2. 青海省盐湖资源化学重点实验室,青海 西宁 810008
2. Key Laboratory of Salt Lake Resources Chemistry of Qinghai Province, Xining 810008, China
锂及其化合物在锂离子电池[1-2]、航空航天[3]、核电站[4-5]、石油化工[6]、玻璃陶瓷[7]等众多领域得到成功应用,被誉为“推动世界进步的能源金属”,是国民经济和国防建设中具有重要意义的战略资源。全球蕴含较为丰富的锂资源,主要分布于澳洲、北美洲、南美洲、亚洲以及非洲,主要分为花岗伟晶岩型和盐湖型2种。中国是锂资源的第2大国,锂资源主要集中于西北地区(西藏、青海和新疆),盐湖锂资源占总储量80%左右,主要分布在青藏高原[9]。固体锂矿因成分和杂质的不同,提锂工艺不同,主要包括:硫酸法、石灰石烧结法、硫酸盐法和纯碱压煮法[9]。以盐湖卤水为原料提锂的方法众多,主要有5种:沉淀法、锻烧浸取法、选择性半透膜法、吸附法和溶剂萃取法。以锂矿石和盐湖卤水为原料提锂均需得到富含锂离子的溶液,要进一步加入纯碱碳化沉淀出初级碳酸锂产品。因此,碳化沉锂是锂产业链中承前启后的一个关键步骤,但是针对碳化沉锂体系缺乏系统研究。孙玉柱等[10-13]研究了碳酸锂反应结晶动力学以及在纯水中的溶解过程。宋昌斌等[14]研究了Li2CO3在水中的溶解度和超溶解度,并对溶解过程进行热力学分析。王怀有等[15]研究了Li2CO3在混合LiCl-NaCl-KCl-Na2SO4溶液中的溶解度和超溶解度,并讨论了不同盐对Li2CO3介稳区的影响。碳化沉锂体系将形成碳酸锂和氯化钠溶液体系,因此,针对碳酸锂在NaCl-H2O体系中溶解度的研究对锂收率极其重要,尚未发现对碳酸锂在不同浓度的氯化钠溶液中溶解度的系统研究。
本文研究了在温度278.15~358.15 K内Li2CO3在不同浓度的NaCl溶液中的溶解度,并利用Debye-Hückel延展式和Apelblat方程关联实验数据;采用热力学模型对溶解度数据进行计算得到热力学参数,以期从实验和理论上系统考察Li2CO3在NaCl溶液中的溶解行为,为碳化沉锂工艺提供基础数据。
2 实验材料和方法 2.1 实验试剂和仪器 2.1.1 主要仪器HXC-500-8A型磁力搅拌恒温槽(控温精度±0.05 K,北京惠城佳仪);恒温水浴槽(控温精度±0.03 K VIVO RT4,德国优莱博公司);自动电子分析天平(BT224S,赛多利斯科学仪器有限公司);超纯水机(UPT,四川优普仪器设备有限公司)。
2.1.2 主要药品试剂Li2CO3(麦克林)和NaCl(国药集团化学试剂公司)均为分析纯,Li2CO3 140 ℃烘干,NaCl重结晶备用。实验过程中所用水均为二次去离子水(DDW),去离子水电导率小于1×104 S·m-1,pH=6.60。
2.2 实验方法实验采用等温溶解平衡法。配制了不同质量摩尔浓度的NaCl溶液,加入过量的Li2CO3(5 g),将所配溶液置入硬质塑料瓶中,再置于磁力搅拌恒温槽中,不断搅拌以达到平衡。5 d后连续2 d取瓶内上层清液,对其进行化学分析,若液相组成无变化,则视为溶解反应达到平衡状态。
3 实验结果与讨论 3.1 溶解度数据实验测定温度在278.15~358.15 K时,Li2CO3在质量摩尔浓度0~4 mol·kg-1 NaCl溶液中的溶解度以及液相密度数据,列于表 1中。表中m(NaCl)为质量摩尔浓度, m(Li2CO3)为溶解度,ρ为液相密度。
|
|
表 1 278.15-358.15 K内Li2CO3在NaCl溶液中溶解度以及密度 Table 1 Solubility and density of lithium carbonate in sodium chloride solution at 278.15-358.15 K |
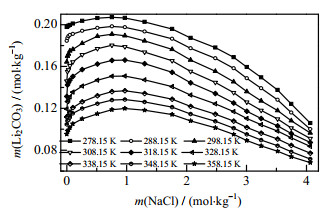
为了解Li2CO3在不同浓度NaCl溶液中的溶解度,绘制Li2CO3溶解度与NaCl浓度的关系图,如图 1所示为不同温度下碳酸锂在氯化钠溶液中的溶解度,从图 1中可以看出,Li2CO3溶解度随NaCl浓度增大先增大后减小,Li2CO3在NaCl溶液中的溶解度在m(NaCl)=1 mol·kg-1时出现最大值,在m(NaCl) < 1 mol·kg-1时,NaCl对Li2CO3盐效应主要表现为盐溶作用,特别是在极稀溶液中(小于0.1 mol·kg-1);而当m(NaCl)>1 mol·kg-1时,Li2CO3溶解度随着NaCl的浓度增加缓慢降低,NaCl对Li2CO3溶解表现为盐析作用,这说明在实际沉锂反应中产生的NaCl能够影响Li2CO3收率。在同浓度NaCl溶液中,Li2CO3溶解度随温度升高明显降低,这与Li2CO3在纯水溶解度一致。
|
图 1 不同温度下碳酸锂在氯化钠溶液中的溶解度 Fig.1 Solubility of lithium carbonate in sodium chloride solution at different temperatures |
在同一温度下,Li2CO3在NaCl溶液中溶解受到盐效应的影响,溶解度可以用溶度积常数表示,而盐效应作用的本质是溶液离子强度会对Li2CO3中Li+和CO32-的活度系数产生影响。根据溶度积规则,当Li2CO3溶解平衡时,用溶度积常数表示即
| $ {K_{\rm sp}}(T) = {m^2}({\rm{L}}{{\rm{i}}^ + })m{\rm{(CO}}_{\rm{3}}^{{\rm{2}} - }{\rm{)}} $ | (1) |
式中:Ksp(T)为Li2CO3溶解平衡的浓度积,(mol·kg-1)3;m(Li+)和m(CO32-)分别为溶液中Li+和CO32-质量摩尔浓度。为了考察Li2CO3溶解度随着NaCl溶液浓度的影响,假定同温度Li2CO3在纯水中溶度积为标准态
| ${\lg _{}} \ \ \beta = {\lg _{}}(\frac{{{K_{\rm sp}}(T)}}{{K_{\rm sp}^0(T)}}) = - \frac{{8A\sqrt I }}{{(1 + B\alpha \sqrt I )}} - CI - D{I^2}$ | (2) |
| $I = 0.5(\sum\limits_i {{m_i}Z_i^2} + \sum\limits_j {{m_j}Z_j^2} )$ | (3) |
| $A = \frac{1}{{2.303}}{(\frac{{2\pi {N_A}}}{{{1_{}}000}})^{0.5}}{(\frac{{{e^2}}}{{dkT}})^{1.5}}$ | (4) |
| $\sigma = \sqrt {\frac{1}{{n - 1}}\sum\limits_n {{{(m{{({\rm{L}}{{\rm{i}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}})}^{{\rm{cal}}}} - m{{({\rm{L}}{{\rm{i}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}})}^{{\rm{exp}}}})}^2}} } $ | (5) |
| $\varepsilon = (m{({\rm{L}}{{\rm{i}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}})^{{\rm{cal}}}} - m{({\rm{L}}{{\rm{i}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}})^{{\rm{exp}}}})/m{({\rm{L}}{{\rm{i}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}})^{{\rm{exp}}}}$ | (6) |
式中:β为不同温度溶度积系数;Ksp0(T)为Li2CO3在纯水中的浓度积,(mol·kg-1)3;I 为溶解平衡时溶液的离子强度,mol·kg-1;A为Debye-Hückel极限斜率,将A在不同温度下列于表 2中计算;NA为阿伏伽德罗常数;e为电子电荷量,C;d为介质的相对介电常数;k为Boltzmann常数;Bα作为理论项(长程力作用项)模型参数;C、D为短程力修正项模型参数;m(Li2CO3)cal为Li2CO3质量摩尔浓度计算值,mol·kg-1;m(Li2CO3)exp为Li2CO3质量摩尔浓度实验值,mol·kg-1。
|
|
表 2 不同温度下的Debye-Hückel延展模型参数和标准偏差 Table 2 Model parameters and standard deviation values of extended Debye-Hückel model at different temperatures |
根据溶解度模型方程(式(2)),分别针对不同温度溶度积系数β值进行多元拟合计算,获得Li2CO3在NaCl溶液中的不同温度下的参数,将计算得到的参数列于表 2中。采用标准偏差σ(式(5))衡量溶解度模型参数拟合的准确度,计算标准偏差也列于表 2中。
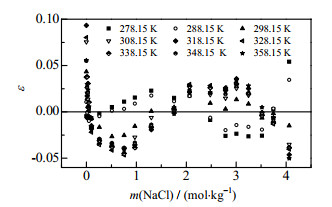
采用相对偏差ε(式(6))考察溶解度E-DH模型计算的准确度,将不同浓度的NaCl溶液中Li2CO3溶解度计算的相对偏差绘制于图 2,绝大部分Li2CO3溶解度实验值与计算值的相对偏差在±0.05之内,表明E-DH模型可准确地表达Li2CO3再不同浓度NaCl溶液中溶解行为。
|
图 2 E-DH模型计算值与实验值的相对偏差 Fig.2 Relative deviation between calculated data from E-DH equation and experimental results |
Li2CO3在水中的溶解度用摩尔分数x 表示,如式(7)
| $x = \frac{{m{\rm{(L}}{{\rm{i}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}{\rm{)}}/M{\rm{(L}}{{\rm{i}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}{\rm{)}}}}{{\sum\limits_i {{{{m_i}} / {{M_i}}}} }}$ | (7) |
式中:mi分别为Li2CO3、NaCl和H2O的质量,g;Mi分别为Li2CO3、NaCl和H2O的摩尔质量,g·mol-1。
Apelblat方程[18]假定溶液的焓变为温度的线性函数,并依据Clausius-Clapeyron方程导出表述固液平衡状态的简化方程(式8):
| $\ln x = a + b/T + c\ln T$ | (8) |
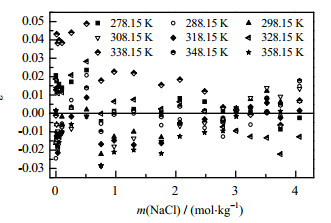
根据Apelblat方程,分别针对不同NaCl浓度Li2CO3饱和摩尔分数进行多元拟合,并将得到的参数和计算标准偏差σ列于表 3中。采用相对偏差ε(式(6))考察Apelblat方程溶解度模型计算的准确度,将不同浓度的NaCl溶液中Li2CO3溶解度计算相对偏差绘制于如图 3所示,由图 3可知,所有Li2CO3溶解度实验值与计算值的相对偏差在±0.05,表明Apelblat方程可准确地表达Li2CO3在不同浓度NaCl溶液中溶解行为。
|
|
表 3 不同NaCl浓度下的Apelblat方程参数 Table 3 Apelblat equation parameters under different NaCl concentrations |
|
图 3 Apelblat方程计算值与实验值的相对偏差 Fig.3 Relative deviation between calculated data from Apelblat equation and experimental results |
Van’t Hoff方程是活度系数方程的简化形式,在溶液中溶质摩尔分数的对数值和绝对温度的倒数呈现线性相关的关系[19],方程如式(9)。
| $\ln x = - \frac{{\Delta {H_{\rm d}}}}{{RT}} + \frac{{\Delta {S_{\rm d}}}}{R}$ | (9) |
| $\Delta {G_{\rm d}} = \Delta {H_{\rm d}} - \Delta {S_{\rm d}}\overline T $ | (10) |
式中:R为通用气体状态常数,8.314 J·mol-1·K-1;ΔHd为溶解焓,J·mol-1;ΔSd为溶解熵,J·mol-1·K-1;ΔGd为溶解吉布斯自由能变,J·mol-1;T为体系的平均温度,K。
根据热力学原理,在实验温度范围内,认为溶液的ΔSd和ΔHd是不随温度变化的常数,根据式(9)和(10)计算出在不同NaCl溶液中Li2CO3溶解反应ΔSd和ΔHd,根据实验平均温度计算溶解过程中的吉布斯自由能的变化值ΔGd。
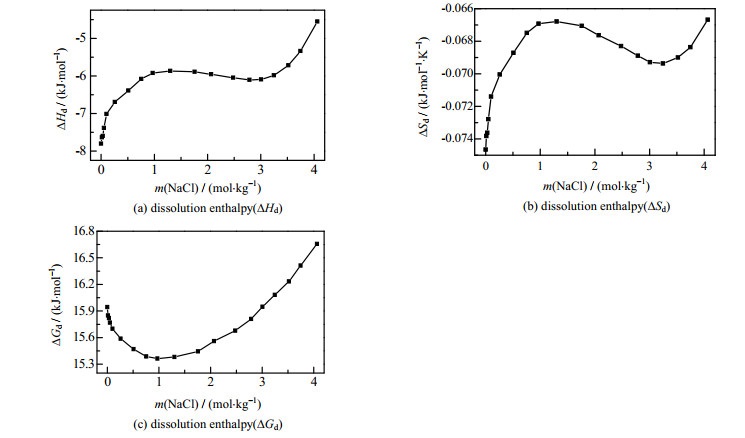
如图 4(a)所示为在不同浓度的NaCl溶液中,Li2CO3溶解过程的摩尔焓变,从图 4(a)中可以得出,ΔHd<0,说明溶解过程为放热过程,升高温度可以显著降低Li2CO3的溶解度。在浓度小于1 mol·kg-1NaCl溶液中几乎不存在离子缔合情况,Na+和Cl-均以自由水合离子形式存在,当浓度大于1 mol·kg-1NaCl溶液中开始出现溶剂分割离子对(SIP)和接触离子对(CIP),随着浓度增加,溶剂分割离子对比例降低接触离子对增加,而当NaCl浓度大于3 mol·kg-1时溶液中几乎只存在接触离子对[20]。Li2CO3在不同浓度的NaCl溶液中溶解过程,当NaCl浓度小于1 mol·kg-1和大于3 mol·kg-1时Li2CO3溶解焓随着NaCl浓度增加而增加,Li+和CO32-离子水化需要与Na+和Cl-水合离子争夺水分子。在低浓度的NaCl溶液中,由于存在大量的自由水,Li+离子和CO32-离子的水化只需要破坏溶液中水分子之间的氢键,形成离子水合结构。随着NaCl溶液浓度增加,溶液中存在Na+和Cl-离子水合结构以及CIP,在形成新的Li+和CO32-离子水合结构过程中需要破坏离子水合结构或Na+-Cl-接触离子对水合结构,因此NaCl浓度的增加将降低Li2CO3溶解的放热量。当1 mol·kg-1 < m(NaCl) < 3 mol·kg-1时,Li+和CO32-离子水化过程,溶液中存在SIP和CIP动态平衡,表现为Li2CO3溶解焓不随NaCl溶液浓度变化。
|
图 4 Li2CO3溶解热力学参数与NaCl质量摩尔浓度关系图 Fig.4 Profiles of thermodynamic parameters of Li2CO3 as a function of NaCl concentrations |
图 4(b)为Li2CO3溶解过程的摩尔熵变随着NaCl溶液浓度变化。离子晶体升华熵变(ΔsubSmθ)是正值。但是气态正、负离子形成水合离子的过程中,由于水化作用,极性水分子在正、负离子的周围有规则地取向,其有序程度增加,混乱程度减小,即水化熵变(ΔhSmθ)为负值,溶解过程熵变取决于两项之和ΔsSmθ=ΔsubSmθ+ΔhSmθ。由图 4(b)可知,ΔSd < 0,由于Li+具有强烈的水合作用,在Li2CO3溶解过程离子水化作用占据主要的作用。Li2CO3溶解熵变随着NaCl浓度增加整体升高,在高浓度区NaCl溶液水分子水合离子和离子对;在1 mol·kg-1 < m(NaCl)l < 3 mol·kg-1时Li2CO3溶解熵出现降低,Li2CO3溶解使得溶液中SIP向规则度更高的CIP转化。
根据吉布斯-亥姆霍兹公式(式(10))计算出Li2CO3溶解过程中的ΔsGmθ随NaCl浓度变化,见图 4(c)。从图 4(c)可知,Li2CO3溶解过程ΔsGmθ>0,表明溶解过程是非自发过程;ΔsGmθ随NaCl浓度增加先降低后又增大,在1 mol·kg-1达到最小值。根据公式[19-20]:
溶解平衡体系密度测定结果见表 1。采用适用于多种盐卤溶液经验密度方程Connaughton[21]方程对密度数据进行拟合关联:
| $(\rho - {\rho _0}) = {a_1}m{\rm{(L}}{{\rm{i}}_{\rm{2}}}{\rm{CO}}{}_{\rm{3}}{\rm{)}} + {b_1}m{{\rm{(L}}{{\rm{i}}_{\rm{2}}}{\rm{CO}}{}_{\rm{3}}{\rm{)}}^2} + {a_2}m{\rm{(NaCl)}} + {b_2}m{{\rm{(NaCl)}}^2}$ | (11) |
式中:a1、b1、a2和b2为经验系数,ρ0为同温度下溶剂水的密度[22]。将Connaughton方程不同温度下Li2CO3-NaCl-H2O体系拟合参数列于表 4。根据式(5)计算拟合的标准偏差偏差σ列于表 3,计算标准偏差σ < 7×10-4,因此Connaughton方程在实验浓度范围内能够准确表达Li2CO3在NaCl溶液中溶解体系密度。
|
|
表 4 不同温度下的Connaughton方程参数和标准偏差 Table 4 Model parameters and standard deviation values of Connaughton equation at different temperatures |
采用等温溶解平衡法开展Li2CO3在NaCl溶液中(278.15~358.15 K)的溶解平衡实验研究,测定平衡体系中Li2CO3溶解度和溶液密度,得到以下结论:
(1) Li2CO3溶解度随NaCl浓度增大先增大后减小,Li2CO3在NaCl溶液中的溶解度在m(NaCl)=1 mol·kg-1出现最大值,在m(NaCl) < 1 mol·kg-1时,NaCl对Li2CO3盐效应主要表现为盐溶作用;而当m(NaCl)> 1 mol·kg-1时,Li2CO3溶解度随着NaCl的浓度增加缓慢降低,NaCl对Li2CO3溶解表现为盐析效应;
利用E-DH方程和Apelblat方程分别对Li2CO3溶解度实验数据进行关联,计算Li2CO3溶解度相对偏差均在±0.05,表明E-DH和Apelblat溶解度模型方程均可较好地表述Li2CO3在NaCl溶液中的溶解度性质。
(2) 通过溶解热力学计算,得到Li2CO3在NaCl中的溶解焓ΔHd、熵ΔSd和吉布斯自由能变ΔGd,结果表明溶解过程为放热、熵减的非自发过程,溶解焓ΔHd、熵ΔSd随着NaCl浓度增大而增大,吉布斯自由能变ΔGd在NaCl浓度1 mol·kg-1出现最小值,且溶解过程为熵控制过程。
(3) 利用Connaughton方程对液相密度数据进行关联,标准偏差小于7×10-4,Connaughton方程能够准确表达NaCl溶液中Li2CO3饱和溶液密度。
| [1] |
OGATA A, KOMABA S, BADDOUR-HADJEAN R, et al. Doping effects on structure and electrode performance of K-birnessite-type manganese dioxides for rechargeable lithium battery[J]. Electrochimica Acta, 2008, 53(7): 3084-3093. DOI:10.1016/j.electacta.2007.11.038 |
| [2] |
AMMUNDSEN B, PAULSEN J. Novel lithium-ion cathode materials based on layered manganese oxides[J]. Advanced Materials, 2001, 13(12/13): 943-956. |
| [3] |
刘滨, 张密林, 胡耀宇, 等. 富镧混合稀土对Mg-10Li-4Al合金组织和力学性能的影响[J]. 航空材料学报, 2007, 27(5): 17-21. LIU B, ZHANG M L, HU Y Y, et al. Influences of La-Rich RE on the microstructure and mechanical properties of Mg-10Li-4Al Alloy[J]. Journal of Aeronautical Materials, 2007, 27(5): 17-21. |
| [4] |
PUMA A L, BERTON J L, BRANAS B, et al. Breeding blanket design and systems integration for a helium-cooled lithium-lead fusion power plant[J]. Fusion Engineering and Design, 2006, 81(1/7): 469-476. |
| [5] |
CHIOVARO P, DI MAIO P A, OLIVERI E, et al. On the influence of the supporting frame on the nuclear response of the Helium-Cooled Lithium Lead Test Blanket Module for ITER[J]. Fusion engineering and design, 2006, 81(1/2/3/4/5/6/7): 677-686. |
| [6] |
刘磊, 孙洪伟. 锂基润滑脂的制备及热力学估算[J]. 轴承, 2009, 11: 30-31. LIU L, SUN H W. Preparation and thermodynamic calculation of lithium grease[J]. Bearing, 2009, 11: 30-31. |
| [7] |
RIELLO P, CANTON P, COMELATO N, et al. Nucleation and crystallization behavior of glass-ceramic materials in the Li2O-Al2O3-SiO2 system of interest for their transparency properties[J]. Journal of non-crystalline solids, 2001, 288(1/2/3): 127-139. |
| [8] |
郑绵平, 王向东, 彭齐鸣, 等.中国盐湖锂资源开发趋势[C]//中国有色金属学会学术年会, 北京: 2000: 17-20. ZHENG M P, WANG X D, PENG Q M, et al. Development trend of salt lake lithium resources in China[C]//Nonferrous Metals Society Academic Annual Meeting, Beijing, 2000: 17-20. |
| [9] |
申军, 戴斌联. 盐湖卤水锂矿资源开发利用及其展望[J]. 化工矿物与加工, 2009, 38(4): 1-4. SHEN J, DAI B L. Status quo of salt lake brine lithium resources and prospect of its exploitation and application[J]. Industrial Minerals & Processing, 2009, 38(4): 1-4. |
| [10] |
SUN Y, SONG X, WANG J, et al. Unseeded supersolubility of lithium carbonate:experimental measurement and simulation with mathematical models[J]. Journal of Crystal Growth, 2009, 311(23/24): 4714-4719. |
| [11] |
SUN Y, SONG X, WANG J, et al. Determination of seeded supersolubility of lithium carbonate using FBRM[J]. Journal of Crystal Growth, 2010, 312(2): 294-300. |
| [12] |
SUN Y, SONG X, WANG J, et al. On-line monitoring of lithium carbonate dissolution[J]. Crystal Research and Technology, 2009, 44(11): 1223-1229. DOI:10.1002/crat.200900402 |
| [13] |
SUN Y, SONG X, WANG J, et al. Preparation of lithium carbonate hollow spheres by spray pyrolysis[J]. Crystal Research and Technology, 2011, 46(2): 173-177. DOI:10.1002/crat.201000532 |
| [14] |
宋昌斌, 李润超. 碳酸锂在水中的溶解度和超溶解度的测定及热力学分析[J]. 化工进展, 2016, 35(8): 2350-2354. SONG C B, LI R C. Measurement and thermodynamic analysis of the solubility and supersolubility of lithium carbonate in water[J]. chemical Industry and Engineering Progress, 2016, 35(8): 2350-2354. |
| [15] |
WANG H, DU B, WANG M. Study of the solubility, supersolubility and metastable zone width of Li2CO3 in the LiCl-NaCl-KCl-Na2SO4 system from 293.15 to 353.15 K[J]. Journal of Chemical and Engineering Data, 2018, 63(5): 1429-1434. DOI:10.1021/acs.jced.7b01012 |
| [16] |
WILLIAM L M, RUTH S, ERNEST V J. Aqueous systems at high temperatures, XIV. solubility and thermodynamic relationships for CaSO4 in NaCl-H2O solutions from 40 to 200℃. 0 to 4 mole NaCl[J]. Journal of Chemical and Engineering Data, 1964, 9(2): 1467-1468. |
| [17] |
WILLIAM L M, RUTH S. Thermodynamics of calcium sulfate dihydrate in aqueous sodium chloride solutions, 0-110°1, 2[J]. Journal of Physical Chemistry, 1966, 70(12): 4015-4027. DOI:10.1021/j100884a044 |
| [18] |
LI J, ZHANG X W, LIU Q J, et al. Measurement and correlation of solubility of 1, 3, 5-trioxane in binary solvents from (288.15 to 328.15) K[J]. Journal of Molecular Liquids, 2017, 234: 469-480. DOI:10.1016/j.molliq.2017.03.108 |
| [19] |
SOUSA JMMV, FONSECA IMA. Solubility of hydrofluorocarbons in halobenzene solvents[J]. Journal of Chemical and Engineering Data, 2014, 59(11): 3605-3609. DOI:10.1021/je500525q |
| [20] |
UCHIDA H, MATSUOKA M. Molecular dynamics simulation of solution structure and dynamics of aqueous sodium chloride solutions from dilute to supersaturated concentration[J]. Fluid Phase Equilibria, 2004, 219(1): 49-54. DOI:10.1016/j.fluid.2004.01.013 |
| [21] |
CONNAUGHTON L M, HERSHEY J P, MILLERO F J. PVT properties of concentrated aqueous electrolytes:Ⅴ. Densities and apparent molal volumes of the four major sea salts from dilute solution to saturation and from 0 to 100℃[J]. Journal of Solution Chemistry, 1986, 15(12): 989-1002. DOI:10.1007/BF00645194 |
| [22] |
BORIS S. K, RITA P, ALEX S, et al. Volumetric ion interaction parameters for single-solute aqueous electrolyte solutions at various temperatures[J]. Journal of Physical and Chemical Reference Data, 2000, 29(5): 1123-1140. DOI:10.1063/1.1321053 |




