2. 东台市 东靖医化科技有限公司,江苏 盐城 224200
2. Dongtai Dongjing Medical and Technology Co., Ltd., Yancheng 224200, China
N-羟基丁二酰亚胺,英文名N-Hydroxysuccinimide,别名N-羟基琥珀酰亚胺,简称HOSU或NHS,分子式C4H5NO3,是一种含氮杂环类化合物,在医药方面有着广泛的用途[1, 2],常用于制备活性酯,如苄基-N-琥珀酰亚胺碳酸酯和9-芴甲酰基-N-琥珀酰亚胺碳酸酯等,它们用于多肽的合成可以防止氨基酸或多肽发生外消旋[3, 4]。但是,在多肽的合成中使用的这些活性酯,在反应以后又返回到HOSU而存在于水相反应废液中[5],含量为1.5~3 kg·(100 L)-1。目前这些废水中含有的HOSU均没有回收,导致大量的HOSU浪费,也给废水处理增加了负担。
HOSU在废水中没有回收的原因是因为缺少合适的回收方法,虽然HOSU的用量每年在上升,但并没有文献报道HOSU在这些多肽合成废水中的回收。考虑到HOSU具有弱酸的性质,参考有关从水溶液中提取有机酸的文献[6~9],针对HOSU水溶液的特点,本文研究以三辛胺(TOA)为络合剂萃取分离的方法,考察几种稀释剂,两相相比、萃取温度、盐析剂等工艺条件对萃取过程的影响以及多级错流萃取下的萃取率,讨论相应的萃取机理,根据络合萃取过程的数学模型,对25℃下HOSU在油水两相中的萃取相平衡实验数据进行模拟,研究结果可为工业萃取分离提取HOSU的装置和操作提供理论基础和设计数据。
2 实验部分 2.1 实验原料与仪器HOSU由江苏省东台市东靖医化科技有限公司提供(含量99%以上)。TOA(95%)和磺化煤油(AR)购于麦克林试剂公司,磷酸三丁酯、氯化钠、硝酸钠、正辛醇、正丁醇、均为AR级,购于国药集团化学试剂有限公司。
2.2 实验装置及操作萃取实验在带夹套保温的500 mL烧杯和250 mL分液漏斗中进行,采用超级恒温槽(河南豫华仪器)控制温度,温度变化范围为±0.1℃。
实验中,根据研究内容配制一定浓度的含有HOSU的水相和含有萃取剂TOA的有机相,通常取20 mL水相和相应体积的有机相于100 mL烧杯中,将此100 mL小烧杯置于夹套保温的500 mL大烧杯中控制温度,为保证传热速度,大烧杯中预先放置少量水作为水浴。在100 mL小烧杯中预先置有一磁力搅拌子,磁力搅拌0.5 h,保证两相充分接触,搅拌完毕,将小烧杯中的两相转移到250 mL的夹套分液漏斗中,静置15 min以上,待两相完全分离。分别量取两相体积,取水相样品5 mL,并用电位滴定法滴定水相中的HOSU浓度,通过物料衡算求得有机相中HOSU的浓度。
对负载HOSU的萃取相及稀释剂(正丁醇)萃取相与空白萃取相,采用Nicolet 6700红外光谱分析法,根据红外谱图特征峰的情况,分析三辛胺络合萃取HOSU的萃取机理。
3 络合萃取过程的数学模型施云海等曾研究了TOA对羟基乙酸的络合萃取分离[10],以TOA为萃取剂的HOSU的络合萃取机理应该与TOA对羟基乙酸的萃取机理类似。在TOA络合萃取HOSU的过程中,考虑到稀释剂正丁醇对HOSU的物理萃取作用,络合萃取作用与物理萃取作用符合简单的加和性,作如下假设:(1) HOSU与TOA通过氢键与离子成盐形成缔合体,结构体以2:1、1:1为主;(2) HOSU与其缔合体的活度正比于其浓度;(3) HOSU与TOA的络合反应发生在两相界面上。
HOSU在水相中的解离平衡:
| $\text{HOSU}\overset{{{K}_{\text{a}}}}{\longleftrightarrow}{{\text{H}}^{+}}+\text{OS}{{\text{U}}^{-}}$ | (1) |
水溶液中游离的[HOSU]与实验测定的浓度Ca符合的关系:
| $[\text{HOSU}]=\frac{{{C}_{\text{a}}}}{1+{{10}^{(\text{pH}-\text{p}{{K}_{\text{a}}})}}}$ | (2) |
式中当25℃时,pKa= 5.806。
HOSU在正丁醇中的物理萃取平衡:
| $\text{HOSU}\overset{{{K}_{\text{d}}}}{\longleftrightarrow}\overline{\text{HOSU}}$ | (3) |
其中Kd为HOSU的物理萃取常数,可由HOSU在正丁醇中的萃取平衡实验测得。
HOSU与TOA之间的络合反应:
| $\text{HOSU}+\overline{\text{TOA}}\overset{{{K}_{1}}}{\longleftrightarrow}\overline{\text{TOA}\cdot \text{HOSU}}$ | (4) |
| $\text{HOSU}+\overline{\text{TOA}\cdot \text{HOSU}}\overset{{{K}_{2}}}{\longleftrightarrow}{{\overline{\text{TOA}\cdot \left( \text{HOSU} \right)}}_{_{2}}}$ | (5) |
则其分配系数为:
| $\begin{align} & D=\frac{\overline{[\text{TOA}\cdot \text{HOSU}]}+\overline{[\text{TOA}\cdot \text{HOSU}{{}_{\text{2}}}\text{ }\!\!]\!\!\text{ }}+\overline{[\text{HOSU }\!\!]\!\!\text{ }}}{{{C}_{\text{a}}}} \\ & =\frac{{{K}_{1}}[\text{HOSU}]\overline{[\text{TOA}]}+2{{K}_{1}}{{K}_{2}}{{[\text{HOSU}]}^{2}}\overline{[\text{TOA}]}+\overline{[\text{HOSU}]}}{[\text{HOSU}](1+{{10}^{(\text{pH}-\text{p}{{K}_{\text{a}}})}}} \\ & =\frac{({{K}_{1}}+2{{K}_{1}}{{K}_{2}}[\text{HOSU}])\overline{[\text{TOA}]}}{1+{{10}^{(\text{pH}-\text{p}{{K}_{\text{a}}})}}}+{{D}_{\text{d}}} \end{align}$ | (6) |
式中Dd为物理萃取的分配系数,K1与K2为表观络合萃取常数,[HOSU]为平衡时水相中HOSU的浓度,
| $\begin{align} & \overline{{{[\text{TOA}]}_{\text{o}}}}=\overline{[\text{TOA}]}+\overline{[\text{TOA}\cdot \text{HOSU}]}+\overline{[\text{TOA}\cdot \text{HOSU}{{}_{2}}]} \\ & =\overline{[\text{TOA}]}+{{K}_{\text{1}}}[\text{HOSU}]\overline{[\text{TOA}]}+{{K}_{\text{1}}}{{K}_{\text{2}}}{{[\text{HOSU}]}^{2}}\overline{[\text{TOA}]} \end{align}$ | (7) |
式(7) 整理得:
| $\overline{[\text{TOA}]}=\frac{\overline{{{[\text{TOA}]}_{\text{o}}}}}{1+{{K}_{1}}[\text{HOSU}]+{{K}_{1}}{{K}_{2}}{{[\text{HOSU}]}^{2}}}$ | (8) |
由式(6) 和式(8) 以及实验测得的Dd、Ca及pH值,以K1、K2为参数值,采用最小二乘法拟合可得到K1、K2的关联值。
4 结果与讨论 4.1 TOA络合萃取HOSU形成的红外光谱图为研究TOA对HOSU的络合萃取机理,利用Nicolet 6700红外光谱仪测定三种不同组成的萃取有机相的红外光谱数据,结果如图 1所示,其中a为负载HOSU的正丁醇萃取相,b为负载HOSU的22.5% TOA-77.5%正丁醇萃取相,c为未负载HOSU的22.5% TOA-77.5%正丁醇萃取相。曲线a在波数为1714.43与1218.81 cm-1处出现了特征峰,在曲线b中对应的波数出现在1675.86和1238.10cm-1处。前者为酰胺中C=O特征峰,对比a、b谱图发现,相比较正丁醇,加入TOA后C=O往低波数的方向偏移,说明萃取过程中存在氢键缔合作用,后者为离子缔合所形成的特征峰=N-O-。这些结果表明:三辛胺与HOSU络合萃取的过程中同时存在离子缔合成盐与氢键缔合两种过程。
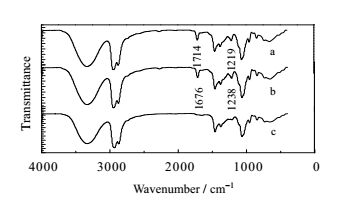
|
图 1 三种组成有机相的红外光谱图 Fig.1 FI-IR spectra of three organic phases a: Cw= 0.120 mol·L-1 b: Cw= 0.120 mol·L-1 c: Cw= 0 |
King提出络合萃取体系应具有高效性、低成本、高选择性等特性[11]。有机羧酸的络合萃取,通常可选用中性或碱性络合萃取剂,如磷酸三丁酯(TBP)、三烷基氧磷(TRPO)、三辛胺(TOA)等,它们一方面能够与有机酸形成络合物,另一方面在水相中几乎不溶,在萃取过程中几乎不会损失。考虑到TRPO的价格,实验分别选取了TBP、TOA为萃取剂,以正辛醇、磺化煤油、正丁醇为稀释剂,研究它们不同组合组成的萃取体系对HOSU水溶液的萃取分配系数的影响。结果如表 1所示,实验条件见表注。
| 表 1 不同萃取剂和稀释剂对HOSU溶液萃取的影响 Table 1 Effects of extractants and diluents on N-Hydroxysuccinimide extraction |
从表 1可以看出, TBP作为萃取剂的萃取效果明显不如TOA,原因应该在于TOA的氮原子更容易和HOSU作用形成络合物。同时,以TOA为萃取剂,辛醇、磺化煤油和正丁醇为稀释剂时,无论何种配比(3:17;6:14;9:11),以正丁醇作为稀释剂的效果最好,原因可能是三种稀释剂中,正丁醇的极性最大,有利于HOSU进入有机相与萃取剂TOA作用。
考察TOA与正丁醇的体积比的变化对HOSU萃取的影响,结果如图 2所示。从图 2可以看出,当TOA在萃取有机相中的体积分数在0.225时,分配系数达到了最大值。产生这种现象的原因在于当有机相中TOA含量较低时,随着有机相中TOA含量升高,形成的TOA与HOSU的萃取络合物也越多,故分配系数相应地随之增大;而当TOA在有机相中的体积分数达到22.5%以后,继续增加TOA在有机相中的含量并不能形成更多的TOA与HOSU的络合物,相反,降低了有机相的极性,从而降低了HOSU的分配系数。综上所述,优选的萃取剂为TOA,稀释剂为正丁醇,TOA与正丁醇在萃取体系中的体积比为22.5:77.5。
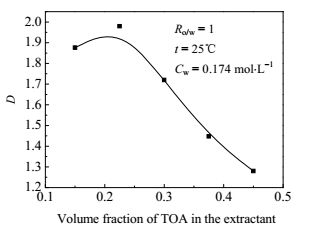
|
图 2 TOA体积分数对HOSU分配系数D的影响 Fig.2 Effects of TOA volume fraction on the distribution coefficient of HOSU |
选用22.5% TOA-77.5%正丁醇的萃取体系,在25℃下,考察有机相与水相的体积比对HOSU分配系数的影响,结果如图 3所示。由图 3可知:当HOSU稀溶液的浓度为0.174 mol·L-1,随着相比的增加,分配系数先增加后减少,出现了极值,极值点Ro/w位于1.5处。
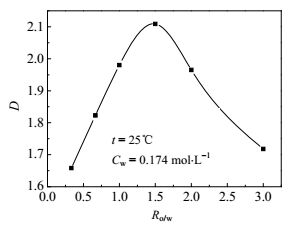
|
图 3 相比Ro/w对分配系数的影响 Fig.3 Effects of phase ratio Ro/w on the distribution coefficient of HOSU |
选用22.5% TOA-77.5%正丁醇萃取体系,根据4.3的实验结果,选择两相相比为1.5时,对HOSU浓度为0.174 mol·L-1的水溶液在25~45℃进行络合萃取实验,考察萃取温度对分配系数的影响,结果如图 4所示。从图 4可以看出,分配系数的自然对数值lnD与温度的倒数1/T存在线性关系,两者的线性相关系数R2= 0.9946,且随着温度的升高,分配系数递减。利用该直线,根据式(9) 可计算该萃取过程的焓变为ΔHm= -23.289 kJ·mol-1。因为ΔHm<0,与文献[10]类似,该络合萃取为放热效应的过程,低温有利于萃取操作。
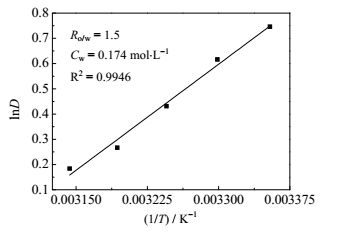
|
图 4 lnD与1/T关系图 Fig.4 Relationship between lnD and 1/T |
| $\left[ \frac{\partial \ln D}{\partial ({}^{1}\!\!\diagup\!\!{}_{T}\;)} \right]=-\frac{\Delta {{H}_{\rm{m}}}}{R}$ | (9) |
25℃下,上述浓度为0.174 mol·L-1的HOSU水溶液经过22.5% TOA~77.5%正丁醇萃取体系一次萃取后,水溶液中的HOSU萃取率达到76.3%,水相中仍然残留了23.7%的HOSU。为提高HOSU的萃取收率,本文研究了HOSU浓度为0.174 mol·L-1的水溶液在25℃下多级错流萃取,有机相同样为22.5% TOA-77.5%正丁醇组成的萃取体系,两相相比为1.5,结果表明经过第二次和第三次错流萃取后,HOSU的萃取收率由76.3%分别提高到94.5%和97.1%,回收得到了大部分HOSU。考虑到萃取剂的成本,因而实际应用时宜选择两次错流萃取。
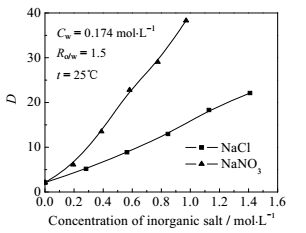
4.6 盐析剂对分配系数的影响在合成多肽过程中产生的含有HOSU的废水中,由于反应的需要,不可避免地含有一定数量的NaCl等无机盐。在萃取过程中,这些水相中包含的无机盐类对萃取过程存在各种影响,同时也可大大降低正丁醇在水中的溶解度,进而降低正丁醇的损耗[12]。本文进而考察了在25℃下,当HOSU水溶液中含有无机盐时的萃取情况。研究中同样以22.5% TOA-77.5%正丁醇为萃取体系,两相相比为1.5,水相中HOSU浓度为0.174 mol·L-1,无机盐为氯化钠、硝酸钠。测定无机盐在水相中含量变化时萃取HOSU的平衡分配系数D的变化情况,结果如图 5所示。从图 5可见,HOSU的分配系数D随着无机盐在水相中含量的增加而增加,盐析效应的强弱为硝酸钠>氯化钠,原因为盐析剂的离子水化作用[13]。
|
图 5 盐析剂对HOSU萃取分配系数的影响 Fig.5 Effects of salting-out agents on the distribution coefficient of HOSU |
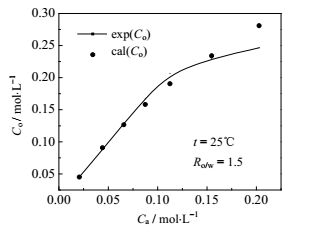
图 6为25℃、Ro/w= 1.5条件下,以22.5% TOA-77.5%正丁醇组成的萃取剂,对含不同浓度HOSU的水溶液进行平衡数据的测定,得到的HOSU在有机相和水相的平衡数据关系。根据节3所建立的HOSU的络合萃取模型,关联计算得络合平衡常数为:K1= 4.755,K2= 0.2243,图 6显示了由模型计算得到的值和实验值的比较,在Ca小于等于0.155 mol·L-1时,两者十分吻合,但当Ca等于0.203 mol·L-1时,两者偏差较大,推测可能的原因是当水相HOSU浓度较高时,存在其它形式的HOSU与TOA的缔合作用。
|
图 6 25℃油相与水相中HOSU浓度与计算值的关系图 Fig.6 Comparison of experimental and simulation results of HOSU concentration in oil and water phases at 25℃ |
针对含低浓度HOSU废水的特点,通过对不同萃取体系的考察,选择以TOA为萃取剂,正丁醇为稀释剂的萃取体系络合萃取分离HOSU,且萃取体系中TOA的体积百分数以22.5%为宜。测得最优相比为1.5;发现低温有利于萃取,通常选择室温25℃进行萃取操作;加入盐析剂能够极大地提高分配系数;合适的错流萃取级数是二级。测定了25℃下,不同浓度HOSU在油水两相中的分配。通过对比不同萃取相的红外光谱图,阐明了TOA与HOSU缔合作用机理,采用质量作用定律的方法,建立了HOSU与TOA界面反应的络合萃取模型,并用最小二乘法得到了模型参数,发现分配系数的实验值与计算值基本吻合,该模型适用于工业实际HOSU废水处理指导。
符号说明:
| Ca | —实验测得的萃余相中HOSU浓度,mol·L-1 | Ka | —HOSU在水中的离解平衡常数,mol·L-1 |
| Co | —实验测得的萃取相中HOSU浓度,mol·L-1 | Kd | —丁醇对HOSU的物理萃取常数 |
| CW | —HOSU在水相中的初始浓度,mol·L-1 | K1 | —酸铵比为1:1时的萃取平衡常数,L·mol-1 |
| D | —HOSU在有机相和水相中的分配系数 | K2 | —酸铵比为2:1时的萃取平衡常数,L·mol-1 |
| Dd | —HOSU物理萃取的分配系数 | Ro/w | —有机相与水相相比 |
| [HOSU] | —水相中游离的HOSU浓度,mol·L-1 | —萃取相中游离TOA浓度,mol·L-1 | |
| —有机相中游离的HOSU浓度,mol·L-1 |
| [1] | WU Yong-ping(吴永平), WANG Qi(王琦), SHEN Yang(沈杨), et al. A new method of synthesizing paclitaxel-octreotide conjugate(合成紫杉醇-奥曲肽偶联物的新方法)[J]. Chinese Journal of Synthetic Chemistry(合成化学) , 2014, 22(6): 840-842. |
| [2] | Zhang C, Tao F R, Cui Y Z. Properties of gelatin films cross-linked by N-hydroxysuccinimide-activated furandicarboxylic acid[J]. Polymer Bulletin , 2016, 73(6): 1565-1580. DOI:10.1007/s00289-015-1563-5. |
| [3] | Kortenaar P, Dijk B G, Peeters J M, et al. Rapid and efficient method for the preparation of Fmoc-amino acids starting from 9-fluorenylmethanol[J]. International Journal of Peptide and Protein Research , 1986, 27(4): 398-400. |
| [4] | Milton R C D, Becker E, Milton S C F, et al. Improved purities for Fmoc-amino acids from Fmoc-ONSU[J]. International Journal of Peptide and Protein Research , 1987, 30(3): 431-432. |
| [5] | XIE Ji-zhong (谢继忠). Synthesis of Fmoc-linker and study on the protection of amino acid (Fmoc-链接剂的合成与保护氨基酸的合成研究)[D]. Shanghai (上海):East China University of Science and Technology (华东理工大学), 2013. http://d.wanfangdata.com.cn/Thesis/Y2271776 |
| [6] | BAI Jie(白洁), ZHU Jie(祝杰), YE Shi-chao(叶世超), et al. Research on micro-dispersion and mass transfer coeffient of phosphoric acid extraction with n-butanol(正丁醇萃取磷酸的微分散过程与传质系数研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(2): 292-297. |
| [7] | SHU Cheng-liang(舒成亮), CAI Jin(蔡谨), WANG Jin(王金), et al. Conditions of separation butyric acid from fermentation broth by complexation extraction(发酵液中丁酸络合萃取分离条件的研究)[J]. Chemical Engineering (China)(化学工程) , 2011, 39(8): 11-15. |
| [8] | DAI You-yuan(戴猷元), YANG Yi-yan(杨义燕), YANG Tian-xue(杨天雪). Treatment of phenolic wastewater by complexation extraction(络合萃取法处理含酚废水技术)[J]. Chemical Industry and Engineering Progress(化工进展) , 1991, 10(6): 40-46. |
| [9] | HUANG Ying-yi(黄颖怡), ZHANG Jin(张瑾), DAI You-yuan(戴猷元). Study on extraction of aromatic acid based on chemical complexation(芳香酸稀溶液的络合萃取研究)[J]. Environmental Chemistry(环境化学) , 2000, 19(2): 136-141. |
| [10] | SUN Hou-yong(孙后勇), SHI Yun-hai(施云海), CAO Hai-yong(曹海甬), et al. Reactive extraction of glycolic acid in high content solution with tri-n-octylamine(含高浓度羟基乙酸溶液的络合萃取分离)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2007, 21(1): 26-30. |
| [11] | King C J. Separation process based upon reversible chemical complexation//rousseau R W. Handbook of separation process technology[M]. New York:John Wiley & Sons, 1987. |
| [12] | JIANG Yun-liang(江运良), CAI Xin-xing(蔡新兴), WU Hao(吴昊), et al. Determination of liquid-liquid phase equilibrium data in N-butanol and water system and research on salting-out effect(正丁醇-水体系液液相平衡数据测定及盐析效应研究)[J]. Chemical Production and Technology(化工生产与技术) , 2015, 22(4): 32-34. |
| [13] | WANG Kai-yi(王开毅), CHENG Ben-cheng(成本诚), SHU Wan-yin(舒万银). Solvent extraction chemistry(溶剂萃取化学)[M].Changsha(长沙): Central South University of Technology Press(中南工业大学出版社), 1991. |




