2. 浙江省能源与核技术应用研究所,浙江 杭州 310012;
3. Department of Chemical Engineering,McMaster University,Hamilton L8S 4L7,Canada
2. Zhejiang Province Institute of Energy and Nuclear Technology, Hangzhou 310012, China;
3. Department of Chemical Engineering, McMaster University, Hamilton L8S 4L7, Canada
能量密度低是目前锂离子电池应用中面临的主要问题之一。相对于负极石墨放电比容量347mAh·g−1,常用的正极三元材料及磷酸铁锂的实际放电比容量均小于200 mAh·g−1。因此,高能量密度的正极材料开发是解决当前锂离子电池能量密度低的关键问题。目前,在所有有应用前景的正极材料中,硫是仅次于氧的高能量密度正极材料,其比容量可达1675 mAh·g−1,所得锂硫电池的理论能量密度可达2600 Wh·kg-1[1]。此外,活性物质硫在自然界中储存量丰富、价格低廉、对环境友好,使硫正极材料引起了广泛关注。但是,由于其仍存在一些问题尚未解决,硫材料迟迟得不到实际应用。例如,硫和放电产物Li2S、Li2S2是电子绝缘体(25℃时S的电导率为5×10-30S⋅cm−1,Li2S的电导率约为10−30S·cm−1)[2];硫和硫化锂的密度差异(S密度为2.03g·cm−3,Li2S密度为1.66g·cm−3)导致电极在充放电过程中体积发生膨胀和收缩而引起的体积变化率达76%,致使电极材料易从集流体上脱落,引起电池性能恶化如硫利用率低、库伦效率低、容量衰退快等问题;以及目前尚未解决的硫穿梭问题[2]。
为改善硫电极性能,现今应用最广泛的是使用导电碳材料制备分散均匀的硫碳复合物以增加电极的导电性能,同时纳米尺寸的复合结构可限制放电中间产物溶于电解质中从而缓解硫穿梭问题。此外,目前改善硫电极性能的其他方法包括使用新型电极粘结剂[1, 3~6],制备功能性隔膜[7],调整电解质包括调整液态电解质的组成、使用凝胶电解质[8]、固态电解质[9]和离子液体[10]等。
电极粘结剂作为构成电极的重要组分显著影响电池性能。性能优异的粘结剂不仅需要具备良好的粘附性能抵抗体积变化来维持电极良好的电子导电网络,而且在充放电过程中应尽量阻止可溶的硫化物扩散到电解质中。传统粘结剂聚偏二氟乙烯(PVDF)因具备较高的粘附强度及电化学稳定性而广泛使用。此外,PVDF溶胀电解液的性能利于锂离子在活性物质表面和电解质间传输[11]。但是,PVDF易溶胀电解液的性质使PVDF凝胶化形成黏性液体[12~14],可使电极颗粒脱落、导电网络坍塌、产生高界面阻抗。同时,PVDF粘结剂在电极制备过程中需使用溶剂N-甲基吡咯烷酮(NMP),NMP沸点高(203℃)、价格昂贵、具有毒性。其中,高沸点性决定电极干燥需要较长的时间和更高的温度(80℃),这会引起电极结构的破坏[15]。
目前,许多研究工作已经证明选用恰当的水溶性粘结剂可以提高电池的电化学性能,如丁苯橡胶-羧甲基纤维素钠(SBR-CMC)、聚环氧乙烯(PEO)[16]、聚乙烯基吡咯烷酮(PVP)[17, 18]、聚四氟乙烯(PTFE)[19]、聚乙烯醇(PVA)[20]、聚丙烯酸(PAA)[21]、聚酰胺-胺型树枝状聚合物(PAMAM)[6]、β-环糊精[3, 19]、LA132、海藻酸钠[19]、明胶[4]、淀粉[22]、阿拉伯树胶[5]等。粘结剂通常含有羧基、羟基、氨基、酯基、酰胺基、醚基、卤素原子等极性官能团,羧基可与聚硫阴离子形成氢键[23],酯基、羟基、醚基、卤素原子等官能团因存在孤对电子而具有Lewis碱的性质,可与多硫化锂、硫化锂Li2S中的Lewis酸Li+形成配位氢键,且键能作用大小依次为酯基、酰胺基、醚基、卤素原子。较强的键能可使浆料中的活性物质和导电碳黑更均匀分散,减少团聚,提供更大的比表面积和载硫量,缓解硫穿梭问题,从而改善电池性能[24]。
此外,当粘结剂兼具极性官能团和特殊的空间结构时,其作为粘结剂具有更大的优势。如粘结剂β-环糊精分子结构呈中空囊状,几何结构为两端开口的圆台,亲水性的羟基均分布在囊状结构侧壁外部,因此表现出囊状结构内侧疏水,外侧亲水的特性,这可使疏水物质形成水溶性的包含络合物,且能增加被包含物质的稳定性,使其具有比链状粘结剂更好的电化学性能[19]。Priyanka Bhattacharya等采用一种新型结构的聚酰胺-胺型树枝状的超支化的大分子作为锂硫电池粘结剂,利用大分子结构高度的表面功能性、内部孔隙率和极性,通过简易的电极制作过程可实现电极的高硫负载量(>4 mg⋅cm-2,极片中硫含量大于68%(wt)、良好的倍率性能和循环稳定性。与传统线性聚合物CMC+SBR相比,树枝状结构的粘结剂分子具有的高密度表面极性官能团,增强了粘结剂分子与硫碳复合材料的界面相互作用使硫负载量增大,同时树枝状粘结剂分子的球状结构和高孔隙率提高了电解液的吸收量。此外,微孔结构的物理吸附性和极性官能团的化学键合性协同作用增强了对多硫化物的固着,增加循环稳定性。当电池以0.05C循环两次后,以0.2C充放电100次时,可逆比容量为640 mAh·g−1,与以0.2C充放电时的初始放电比容量相比,容量保留率高达98%[6]。
参考上述的研究结果,本研究通过可逆加成-断裂转移(RAFT)聚合首次设计合成了三嵌段共聚物作为硫电极粘结剂。RAFT聚合是在传统自由基聚合体系中引入一种双硫代酯类高效可逆链转移剂,通过快速的自由基活化-失活使大部分聚合物链快速引发、持续增长,表现出活性聚合的特征。在RAFT乳液聚合过程中,采用双亲性的大分子RAFT试剂,其具有两亲性,可以溶解在水中形成胶束。引发剂分解产生的单体自由基被大分子RAFT试剂形成的胶束捕捉,变成乳胶粒,聚合反应在乳胶粒内进行。由于乳液聚合的自由基隔离效应,乳液体系表观的终止速率大大降低,因此提高了聚合反应速率和分子量,更利于实现RAFT的“活性”,减少死聚物的含量[25]。本文中采用了聚(苯乙烯-b-丙烯酸正丁酯-b-苯乙烯)(SnBAS)嵌段结构。其中,两端聚苯乙烯(PS)嵌段内聚能密度较大且不溶胀电解液,因此,两端的PS嵌段分别与其它链上的PS嵌段聚集在一起,形成纳米尺寸的微相区,作为物理交联点分散在聚丙烯酸正丁酯(PnBA)的连续相中,从而起到固定弹性链段的物理交联作用,形成具有一定强度的粘连网络结构,稳定电极结构。分子结构中间段的PnBA嵌段含有大量酯基,起到溶胀电解液,提供锂离子传输通道的作用。酯基与聚硫阴离子有较强作用力,使浆料中的硫和导电碳黑分散更均匀,减少团聚作用,提供更大的比表面积和载硫量。嵌段结构设计使PS与PnBA形成独立两相,分别起到物理交联支撑网络和锂离子传输及弹性相功能。聚苯乙烯相不溶胀电解液,避免力学强度的降低;聚丙烯酸正丁酯相可根据需要溶胀尽可能多的电解液,满足大电流充放电需求,从而很好避免了PVDF、改性SBR等粘结剂保持粘结强度与提高锂离子传输能力之间的矛盾。另外,较长的丙烯酸正丁酯的侧链作为树枝状的形态,可以在极片浆料干燥过程中增加孔隙结构,提高对电解液的吸收量,并提供自由体积缓冲电极体积变化[26]。另外,每个高分子分子链含有20个羧酸基团(经部分中和后含7个羧酸基团,13个羧酸根钠盐基团),羧酸根钠盐强的Lewis碱性可与多硫化锂、硫化锂间形成配位键[27]。此外,羧酸因其弱酸性而电离性差,且羧酸基团的酸度系数pKa高于聚硫阴离子,因此羧酸基团可与聚硫阴离子形成氢键[23]。形成的配位键、氢键有助于缓解硫穿梭问题,提高硫正极的循环寿命。本文研究了该粘结剂的可控制备,其作为硫正极粘结剂时的电极性能,以及聚合物分子链结构对电极性能的影响。
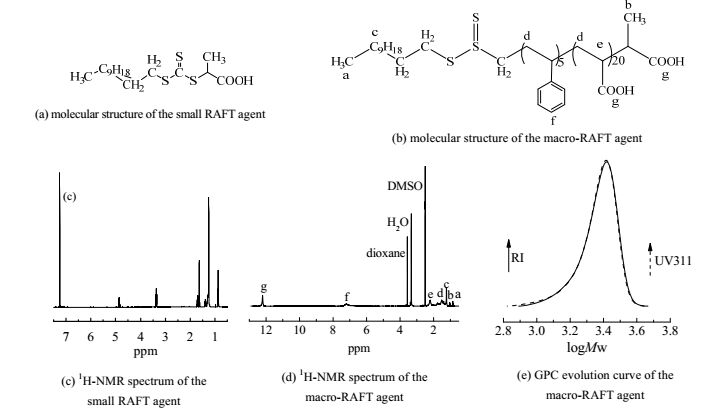
2 实验部分 2.1 实验原料苯乙烯(St),分析纯,使用前减压蒸馏;丙烯酸正丁酯(nBA),分析纯,使用前用10%(wt)氢氧化钠水溶液洗涤及大量去离子水洗涤至中性;四氢呋喃(THF),分析纯;过硫酸钾(KPS),>99%(wt);氢氧化钠(NaOH),>96%(wt);盐酸(HCl),37%(wt);羧甲基纤维素钠(CMC),化学纯;去离子水,杭州娃哈哈饮用纯净水;升华硫,分析纯,≥99.5%(wt),上海阿拉丁生化科技股份有限公司;特密高super p li导电剂,密度为160 kg·m-3,比表面积(BET)为62 m2·g-1,中值粒径(D50) 为40 nm,山西力之源电池销售部;SBR胶乳,黏度为80~400 mPa·s,平均粒径为150nm,山西力之源电池销售部;锂硫电池电解液,1mol L–1的LiTFSI溶于乙二醇二甲醚(DME)和1, 3-二氧戊环(DOL)的混合溶液(DOL与DME的体积比为1:1,含1%(wt)的LiNO3添加剂),苏州乾民化学试剂有限公司;S-RAFT试剂合成参照文献[28],分子结构如图 1(a)所示,以氘代CDCl3为核磁试剂,检测其组成和结构,如图 1(c)所示;M-RAFT试剂合成参照文献[29],分子结构如图 1(b)所示,以氘代DMSO为核磁试剂,检测其组成和结构,如图 1(d)所示,由凝胶渗透色谱仪(GPC)测定分子量和分子量分布,如图 1(e)所示。其它均购自国药集团化学试剂有限公司。
|
图 1 S-RAFT和M-RAFT的结构表征 Fig.1 Structural characterization of S-RAFT and M-RAFT |
以合成固含量30%(wt)的三嵌段共聚物SnBAS75(25K-25K-25K)为例,其中75代表聚合物分子理论摩尔质量为75 000 g⋅mol-1。按实验配方,将0.7400 g(3.23×10-4mol)M-RAFT溶于33 g去离子水中,与8.08 g(7.76×10-2mol)St单体混合均匀,将混合液转移到100 mL四口烧瓶中,然后将四口烧瓶浸于恒温水浴槽中,设置转速300 r⋅min-1,通氮除氧30 min后,设置恒温水浴槽温度至反应温度70℃,烧瓶温度升温70℃时,向烧瓶中加入引发剂KPS水溶液(0.0174g KPS,6.46×10-5mol,4g H2O),引发聚合,反应40 min时,向烧瓶中加入NaOH水溶液(0.0875 g NaOH,3g H2O),中和M-RAFT中部分羧基抑制乳液粒子聚并,第一嵌段反应时间为100 min。使用注射器以3 mL⋅min-1逐滴将nBA单体(8.08 g,6.30×10-2mol)加入到反应烧瓶中,第二嵌段反应时间为100 min。补加18 g H2O,加入St单体(8.08g,7.76×10-2mol),第三嵌段反应时间为100 min。各嵌段聚合反应结束后用取样针取样,采用称重法计算转化率。反应结束,将部分聚合物乳液慢慢滴入9 %(wt)的HCl水溶液中,使聚合物乳胶聚并破乳,过滤,使用去离子水冲洗至中性,真空干燥。其它乳液冷藏保存。
2.3 粘结剂对电解液溶胀率测试将得到的聚合物固体配制成质量浓度为5%(wt)的四氢呋喃溶液,转移到聚四氟乙烯表面皿中挥发成膜,室温下放置24 h,然后转移至真空烘箱,60℃干燥12 h,获得聚合物薄膜。将聚合物薄膜裁成直径为14 mm的圆片,称重,将其浸泡在电解液中,分别在12 h、20 h时滤纸擦拭薄膜除去表面电解液,称重,计算对电解液的溶胀率,浸泡电解液及称重过程在手套箱中进行。其中商用SBR乳液的成膜可直接将一定量的乳液置于聚四氟乙烯表面皿中挥发成膜,其它操作相同。
2.4 硫基正极材料的制备硫碳复合物S/C的制备:由于导电剂super p li具有较大比表面积,吸附能力较强,为减少其对粘结剂粘合力影响,制备浆料时,使用行星式球磨机将super p li导电剂预先球磨2 h,转速为500 r⋅min-1,再将球磨后的super p li导电剂与升华硫按质量比3.5:5.5混合均匀,球磨6h,转速为500 r⋅min-1,使活性材料与导电剂充分混合[30],球磨完毕,用研钵将混合物研磨至粉末状。
粘结剂混合液的制备:以SnBAS75-CMC-H2O为例,将适量CMC溶于去离子水中,搅拌至透明后加入适量SnBAS75乳液搅拌混合均匀,其中CMC与SnBAS75质量比为1:1。
硫正极的制备:将制备的硫碳复合物S/C、SnBAS75-CMC-H2O粘结剂混合液混合,真空搅拌3h,其中硫碳复合物S/C与SnBAS-CMC质量比为9:1。将制备的浆料用刮刀涂敷在铝箔上,置于60℃真空烘箱内干燥12 h,冲片,极片直径14 mm,每个极片上物质质量约2.0 mg⋅cm-2。
2.5 电池装配和电化学性能测试在充满氩气的手套箱中(手套箱内水、氧含量均低于0.1 ppm)将电池组装成CR2025型扣式电池。采用金属锂片为电池负极,电解液为1 mol·L-1的LiTFSI溶于DOL/DME的混合溶液(DOL与DME的体积比为1:1,含1%(wt)的LiNO3添加剂),每个电池加入约120 μL电解液,电池隔膜为Celgard 2400。
电池组装完毕,搁置12h后,在新威电池性能测试系统上进行恒流充放电性能测试,电池的倍率测试:0.1C、0.2C、0.5C、1C、2C、0.1C,0.2C电池寿命测试,测试电压范围为1.6~2.8 V,电化学测试温度为27℃。
2.6 材料表征SnBAS乳液表征:S-RAFT与M-RAFT分子结构通过进行1H NMR 500MHz表征,使用四甲基硅氧烷为内标,采用的设备为瑞士BRUKER Avance DMX 500 MHz spectrometer;单体转化率通过称重法表征;分子量和分子量分布PDIs(Mw/Mn)通过凝胶渗透色谱(Waters 1525,Waters 2414示差检测器,Waters 2487双波长检测器,Waters 717自动进样器)。THF作为洗脱液,流速为1.0 mL⋅min-1,测试采用窄分布聚苯乙烯作为标样,来自Waters公司,测试温度恒定在27℃。
3 结果与讨论 3.1 RAFT乳液聚合合成PS-b-PnBA-b-PS嵌段共聚物本文采用如图 1(b)所示双亲性大分子RAFT试剂作为链转移剂和表面活性剂,实现聚合反应的可控性,合成分子量高且分子量分布较窄的嵌段聚合物。双亲性M-RAFT试剂AA20-b-St5-RAFT是通过两步溶液聚合合成的含有聚丙烯酸和聚苯乙烯嵌段的嵌段型聚合物。选取5个苯乙烯嵌段,20个丙烯酸嵌段的结构可使RAFT试剂在具有较短链结构的同时具有合适的亲水亲油平衡(HLB)值,确保乳液聚合过程可控性好,合成分子量高且分子量分布较窄的嵌段聚合物。增加PAA链长,HLB值高,RAFT试剂亲水性强,部分RAFT试剂被KPS氧化,导致聚合物分子量明显高于理论设计值且最终产物的PDI较高。缩短PAA链段长度,HLB值低,RAFT试剂疏水性强,使得部分大分子RAFT在水相中没有通过自组装形成胶束,而是聚集形成粒子,最终体系存在一定的聚合物聚集体且最终产物PDI较高[31]。分子结构为如图 1(b)所示。通过核磁谱图 1(d)确定分子结构组成与设计结构一致。化学位移分析如下:0.86(3H,a,-CH3),1.04(3H,b,-CH3),1.23(18H,c,-(CH2)9-),1.50(d,-CH2-),2.20(e,-CH-),6.9(f,-Ph-H),12.2(g,-COOH),2.49(DMSO),3.33(H2O),3.57(H of dioxane)。根据a峰3H作为计算基准,通过苯乙烯苯环上的f峰5H计算M-RAFT中苯乙烯的个数,通过g峰1H计算M-RAFT中羧基的个数,其中丙烯酸的个数为全部羧基数减去初始S-RAFT中的一个羧基获得。
M-RAFT的凝胶渗透色谱流出曲线如图 1(e)所示,通过窄分布聚苯乙烯校准曲线分析确定其分子量为2300 g⋅mol-1,分子量分布指数PDI为1.06。基于溶液质量浓度的RI信号曲线峰与基于RAFT分子结构中三硫酯键的311信号曲线峰几乎完全重合,见图 1(e),表明此RAFT中每条分子链均含引发乳液聚合的三硫酯键。
采用乳液聚合合成三嵌段聚合物SnBAS,分别选取不溶胀电解液从而提供力学强度维持电极结构稳定的苯乙烯(St),能溶胀电解液提高电池比容量的丙烯酸正丁酯(nBA)为聚合单体。对于嵌段热塑性弹性体,共聚物的组成是决定此热塑性弹性体机械强度的主要链结构参数[32],“硬段”的分子量一般需高于其链缠结分子量。聚苯乙烯的链缠结分子量约为16600 g⋅mol-1 [33],因此本工作选取了聚苯乙烯嵌段的分子量为25000 g⋅mol-1。选取不同分子量的聚丙烯酸正丁酯嵌段为“软段”,聚丙烯酸丁酯的含量决定电解液的吸收量,进而影响电池充放电性能。同时作为对比,合成了均聚物聚苯乙烯(PS)和聚丙烯酸正丁酯(PnBA)。
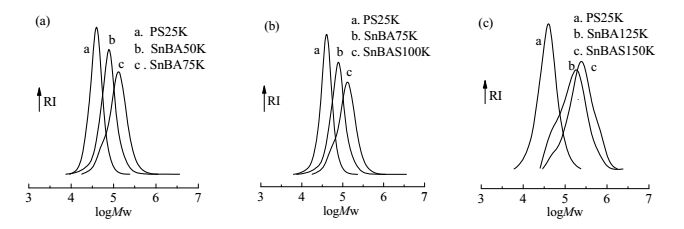
RAFT乳液聚合合成PS-b-PnBA-b-PS三嵌段的结果如表 1所示。PDI随嵌段聚合物中PnBA含量增大而增大,这是因为粒子内部微相分离降低了RAFT试剂的链转移常数[34]以及聚丙烯酸丁酯的聚合反应易发生分子间链转移聚合导致生成长链分支[35]。PS-b-PnBA-b-PS三嵌段聚合物链增长过程中的凝胶渗透色谱流出曲线如图 2所示。
| 表 1 RAFT乳液聚合合成PS-b-PnBA-b-PS三嵌段的结果分析 Table 1 Properties of PS, PnBA and PS-b-PnBA-b-PS triblock copolymers synthesized via RAFT emulsion polymerization |
|
图 2 PS-b-PnBA-b-PS三嵌段聚合物链增长过程中的凝胶渗透色谱流出曲线 Fig.2 GPC curve evolution during the synthesis of PS-b-PnBA-b-PS triblock copolymers (a)25K-25K-25K (b) 25K-50K-25K (c) 25K-100K-25K |
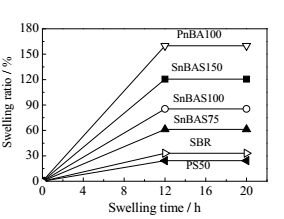
提高粘结剂对电解液的溶胀率可提高电极中电解液含量,利于锂离子在电极中的扩散,降低电阻,改善充放电性能。图 3反应了不同组成的聚合物粘结剂对电解液的溶胀情况,从图中可以看出,聚合物对电解液的溶胀率为PnBA100>SnBAS150>SnBAS100>SnBAS75>SBR>PS50,即随聚合物中聚丙烯酸正丁酯含量增高,聚合物对电解液的溶胀率增高。表 2列出了文献中使用的聚苯乙烯、聚丙烯酸酯、乙二醇二甲醚(DME)、1, 3-二氧戊环(DOL)的介电常数及相应的极性。可见,聚丙烯酸丁酯含有极性的酯基与醚类电解液溶剂的极性更接近[22],从而能溶胀更多电解液。其中商用SBR为苯乙烯与丙烯酸丁酯共聚物。
|
图 3 不同结构的聚合物薄膜对电解液的溶胀率随时间变化 Fig.3 Swelling ratio of different binder sheets as a function of time in electrolyte |
| 表 2 粘结剂聚合物与电解液溶剂的介电常数与极性 Table 2 Dielectric constants and polarity of the binder polymers and electrolyte |
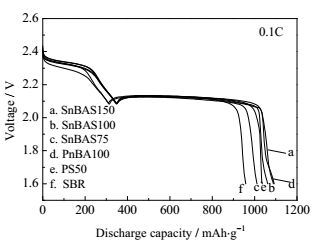
图 4为使用不同粘结剂的硫正极组装的电池在0.1C充放电时的初始放电曲线,各放电曲线均含两个典型的放电电压平台,对应硫在放电过程中的多步还原反应。2.3V左右的高电压平台是由单质硫或多硫化物中的硫-硫键断裂还原为较高价态的多硫化锂(Li2Sn,4≤n≤8) 引起的,2.1V左右的低电压平台是由较高价态多硫化锂进一步还原为较低价态的多硫化锂(Li2S2,Li2S)引起的[21],其中低电压平台对应的反应是锂硫电池放电反应的限速步骤。图 4中低电压平台较为平整,表明电池初始放电过程没有明显的极化现象,电极中电子、离子传导性好,能达到电化学平衡。
|
图 4 含各粘结剂的硫正极组装的电池在27℃、0.1C倍率下的初始放电曲线图 Fig.4 Initial discharge curves of Li-S cells with different binders at 27℃, 0.1C |
粘结剂包覆在硫颗粒表面会阻碍锂离子向硫扩散。虽然粘结剂中的极性官能团也可通过溶剂化锂离子,使锂离子在粘结剂中迁移运动[36, 37],但是锂离子迁移速率慢,离子电导率低。本文所用粘结剂结构中,聚丙烯酸正丁酯(PnBA)嵌段含有大量酯基,起到溶胀电解液、提供锂离子传输通道的作用,因此利于锂离子穿过粘结剂扩散到硫表面,提高硫的利用率,从而增大电池初始放电比容量[38]。因此,如表 3所示SnBAS结构粘结剂中,PnBA含量高时,电池的初始放电容量高,即SnBAS150>SnBAS100>SnBAS75。PnBA作粘结剂组装的电池能溶胀较高的电解液,因此放电比容量也较高为1073 mAh·g−1。PS对电解液的溶胀能力最低,所以初始放电比容量最低。
| 表 3 含各粘结剂的硫正极在27℃、0.1C倍率下的初始放电容量 Table 3 Initial discharge capacities of Li-S cells with different binders at 27℃, 0.1C |
图 5反映了各粘结剂在多倍率充放电时的放电比容量。在0.1C、0.2C、0.5C较低倍率下充放电时,各电池性能变化趋势相同且容量衰退率低,高PnBA含量的粘结剂组装的电池因能溶胀更多的电解液从而使电池放电比容量增大。同时,粘结剂中极性的酯基与聚硫离子较强的相互作用,增强了电极的稳定性,并且每个高分子分子链含有20个羧基基团,有助于缓解硫穿梭,降低电池容量衰退。
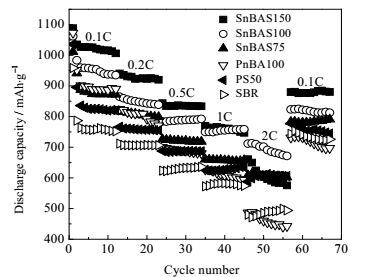
|
图 5 各粘结剂在27℃、不同倍率下的循环性能 Fig.5 Rate discharge capacities of Li-S cells with different binders at 27℃ |
当在1C、2C较高倍率下充放电时,各电池性能变化趋势发生变化。其中,使用SnBAS150与PnBA100粘结剂的电池容量衰退较其它电池快,这是因为电池在高倍率大电流充放电时,SnBAS150与PnBA100结构中因PS含量低或不含PS,粘结剂可溶胀较多的电解液而使其机械强度大大降低。当硫电极初次放电后,硫电池中存在硫化锂,硫电极因充放电产物的密度变化而使电极体积在充放电过程中不断发生增大-减小变化,此变化使电极结构坍塌,导致部分活性物质失去与导电网络的接触。当PnBA含量高时,电极因溶胀较多的电解液没有足够的力学强度,导致在不断的充放电过程中硫颗粒和导电剂颗粒的分离[26]。裸露存在的硫粒子因不能与导电剂粒子接触,而不再参与电极氧化还原反应过程而造成电池容量不可逆的损失。因此,SnBAS150的电池性能在较高倍率时衰退快,且低于SnBAS100的电池容量。PnBA100在所有的粘结剂结构中强度最低,大电流充放电时,包覆在硫颗粒和导电剂颗粒表面的低强度的粘连网络结构破坏程度大,因此电池容量下降幅度最快。
当电池再次以小倍率0.1C充放电时,由于硫电极体积变化使硫与其接触的导电碳分离,使部分硫不能参与电化学反应而使容量大大衰退,此容量衰退为不可逆过程。因此,力学强度较低的PnBA100、SnBAS150容量衰退较高。PnBA100因力学性能最低因此容量衰退最大,且电池放电比容量随聚丙烯酸正丁酯的含量的增大而增大。而PS、SBR、SnBAS75和SnBAS100容量衰退率低。
图 6为各粘结剂在图 5倍率循环后以0.2C充放电时的循环性能。粘结剂SnBAS100所制备的电池放电比容量最佳,这与其结构既兼具优良的力学强度和溶胀电解液能力有关,使电池能溶胀较多电解液且在大电流放电时粘结剂网络的破坏性较小,因此放电比容量较高且容量衰退率最低。SnBAS150因为力学强度低高倍率放电时造成部分不可逆的容量损失,从而放电比容量低于SnBAS100。PS强度高,且该文中由RAFT乳液聚合合成的PS链末端含羧基可缓解硫穿梭效应。SBR有一定强度,但不能有限抑制硫穿梭效应而使容量衰退,PnBA100粘结剂强度最低,因此电极结构被破坏程度大,锂离子传输通道破坏,电极容量衰退迅速。
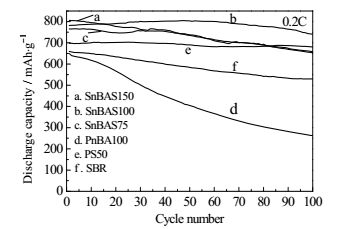
|
图 6 各粘结剂在图 5倍率循环后27℃、0.2C的循环性能 Fig.6 Cycling performance of sulfur cathodes with different binders at 0.2C, 27℃ (current density 335mA·g-1) after rate capacity measurements in Fig.5 |
本文通过RAFT乳液聚合成功设计合成了不同苯乙烯/丙烯酸正丁酯(St/nBA)质量比率的聚(苯乙烯-b-丙烯酸正丁酯-b-苯乙烯)(SnBAS)三嵌段共聚物作为硫电极粘结剂。聚苯乙烯相不溶胀电解液,避免力学强度的降低;聚丙烯酸正丁酯相可根据需要溶胀尽可能多电解液,满足大电流充放电需求,从而很好避免了PVDF、改性SBR等粘结剂保持粘结强度与提高锂离子传输能力之间的矛盾。本文制备了粘结剂薄膜测试了其对醚类电解液的溶胀率,结果提高丙烯酸正丁酯(nBA)的含量可增加粘结剂的电解液溶胀率,有利于锂离子传输。进行多倍率充放电及电池寿命测试后发现,与聚苯乙烯(PS)、聚丙烯酸正丁酯(PnBA)及商用SBR对比,SnBAS100结构的粘结剂兼具高力学强度及高电解液溶胀率,电池在2C充放电时性能最佳。这是因为SnBAS100具有恰当的St/nBA质量比率,使其不仅能够溶胀较多电解液促进锂离子的迁移,同时具有较强的力学强度避免电极体积的快速变化对电极结构的破坏,从而保证活性物质与导电剂的良好接触。电池在0.1C倍率充放电时的首次放电容量为1061 mAh·g−1,在电池分别进行0.1C、0.2C、0.5C、1C、2C、0.1C倍率充放电后,再次以0.2C倍率充放电的初始放电容量为781 mAh·g−1,与首次放电比容量相比容量保留率为73.6%。电极继续100次循环后放电比容量为740 mAh·g−1,容量保留率为94.7%,每次充放电的平均容量衰退率为0.05%。
符号说明:
| BET | -比表面积 | PnBA | -聚丙烯酸正丁酯 |
| CMC | -羧甲基纤维素钠 | PS | -聚苯乙烯 |
| DME | -乙二醇二甲醚 | PVDF | -聚偏二氟乙烯 |
| DOL | -1, 3-二氧戊环 | RAFT | -可逆加成-断裂转移 |
| D50 | -中值粒径,nm | SBR | -丁苯橡胶 |
| KPS | -过硫酸钾 | SnBAS | -聚(苯乙烯-b-丙烯酸正丁酯-b-苯乙烯) |
| NMP | -N-甲基吡咯烷酮 | ε | -介电常数 |
| PDI | -分子量分布指数 |
| [1] | Bao W, Zhang Z, Gan Y, et al. Enhanced cyclability of sulfur cathodes in lithium-sulfur batteries with Na-alginate as a binder[J]. Journal of Energy Chemistry, 2013, 22(5): 790-794.DOI:10.1016/S2095-4956(13)60105-9. |
| [2] | Xu R, Lu J, Amine K. Progress in mechanistic understanding and characterization techniques of Li-S batteries[J]. Advanced Energy Materials, 2015, 5(16): 1500408-1500429.DOI:10.1002/aenm.201500408. |
| [3] | Wang J, Yao Z, Monroe C W, et al. Carbonyl-β-cyclodextrin as a novel binder for sulfur composite cathodes in rechargeable lithium batteries[J]. Advanced Functional Materials, 2013, 23(9): 1194-1201.DOI:10.1002/adfm.v23.9. |
| [4] | Sun J, Huang Y, Wang W, et al. Application of gelatin as a binder for the sulfur cathode in lithium-sulfur batteries[J]. Electrochimica acta, 2008, 53(24): 7084-7088.DOI:10.1016/j.electacta.2008.05.022. |
| [5] | Li G, Ling M, Ye Y, et al. Acacia senegal-inspired bifunctional binder for longevity of lithium-sulfur batteries[J]. Advanced Energy Materials, 2015, 5(21): 1500878-1500885.DOI:10.1002/aenm.201500878. |
| [6] | Bhattacharya P, Nandasiri M I, Lv D, et al. Polyamidoamine dendrimer-based binders for high-loading lithium-sulfur battery cathodes[J]. Nano Energy, 2016, 19: 176-186.DOI:10.1016/j.nanoen.2015.11.012. |
| [7] | Cai W, Li G, He F, et al. A novel laminated separator with multi functions for high-rate dischargeable lithium-sulfur batteries[J]. Journal of Power Sources, 2015, 283: 524-529.DOI:10.1016/j.jpowsour.2015.03.085. |
| [8] | Rao M, Li X, Liao Y, et al. Preparation and performance of a composite polyimide/poly (vinylidene fluoride-co-hexafluoropropylene)/nano-Al2O3 polymer electrolyte for lithium-sulfur cell[J]. Ionics, 2015, 21(7): 1937-1943.DOI:10.1007/s11581-014-1360-4. |
| [9] | Zhang Y, Zhao Y, Gosselink D, et al. Synthesis of poly (ethylene-oxide)/nanoclay solid polymer electrolyte for all solid-state lithium/sulfur battery[J]. Ionics, 2015, 21(2): 381-385.DOI:10.1007/s11581-014-1176-2. |
| [10] | Lu H, Yuan Y, Hou Z, et al. Solvate ionic liquid electrolyte with 1, 1, 2, 2-tetrafluoroethyl 2, 2, 2-trifluoroethyl ether as a support solvent for advanced lithium-sulfur batteries[J]. RSC Advances, 2016, 6(22): 18186-18190.DOI:10.1039/C5RA24182K. |
| [11] | Chou S L, Pan Y, Wang J Z, et al. Small things make a big difference: binder effects on the performance of Li and Na batteries[J]. Physical Chemistry Chemical Physics, 2014, 16(38): 20347-20359.DOI:10.1039/C4CP02475C. |
| [12] | Sekhon S S, Singh H P. Ionic conductivity of PVdF-based polymer gel electrolytes[J]. Solid State Ionics, 2002, 152: 169-174. |
| [13] | Magistris A, Mustarelli P, Parazzoli F, et al. Structure, porosity and conductivity of PVdF films for polymer electrolytes[J]. Journal of power sources, 2001, 97: 657-660. |
| [14] | Magistris A, Quartarone E, Mustarelli P, et al. PVDF-based porous polymer electrolytes for lithium batteries[J]. Solid State Ionics, 2002, 152: 347-354. |
| [15] | Pan J, Xu G, Ding B, et al. Enhanced electrochemical performance of sulfur cathodes with a water-soluble binder[J]. RSC Advances, 2015, 5(18): 13709-13714.DOI:10.1039/C4RA15303K. |
| [16] | Rao M, Song X, Liao H, et al. Carbon nanofiber-sulfur composite cathode materials with different binders for secondary Li/S cells[J]. Electrochimica Acta, 2012, 65: 228-233.DOI:10.1016/j.electacta.2012.01.051. |
| [17] | Kim C S, Guerfi A, Hovington P, et al. Importance of open pore structures with mechanical integrity in designing the cathode electrode for lithium-sulfur batteries[J]. Journal of Power Sources, 2013, 241: 554-559.DOI:10.1016/j.jpowsour.2013.05.026. |
| [18] | Lacey M J, Jeschull F, Edstr M K, et al. Functional, water-soluble binders for improved capacity and stability of lithium-sulfur batteries[J]. Journal of Power Sources, 2014, 264: 8-14.DOI:10.1016/j.jpowsour.2014.04.090. |
| [19] | WU Ying-lei(伍英蕾), YANG Jun(杨军), WANG Jiu-lin(王久林), et al. Composite cathode structure and binder for high performance lithium-sulfur battery(高性能锂-硫电池用复合正极的构造与粘结剂)[J]. Acta Physico-Chimica Sinica(物理化学学报), 2010, 26(2): 283-290. |
| [20] | Nakazawa T, Ikoma A, Kido R, et al. Effects of compatibility of polymer binders with solvate ionic liquid electrolytes on discharge and charge reactions of lithium-sulfur batteries[J]. Journal of Power Sources, 2016, 307: 746-752.DOI:10.1016/j.jpowsour.2016.01.045. |
| [21] | Zhang Z, Bao W, Lu H, et al. Water-soluble polyacrylic acid as a binder for sulfur cathode in lithium-sulfur battery[J]. ECS Electrochemistry Letters, 2012, 1(2): A34-A37.DOI:10.1149/2.009202eel. |
| [22] | Duan X, Han Y, Li Y, et al. Improved capacity retention of low cost sulfur cathodes enabled by a novel starch binder derived from food[J]. RSC Advances, 2014, 4(105): 60995-61000.DOI:10.1039/C4RA10953H. |
| [23] | Zhang S S, Tran D T, Zhang Z. Poly(acrylic acid) gel as a polysulphide blocking layer for high-performance lithium/sulphur battery[J]. J Mater Chem A, 2014, 2(43): 18288-18292.DOI:10.1039/C4TA04417G. |
| [24] | Seh Z W, Zhang Q, Li W, et al. Stable cycling of lithium sulfide cathodes through strong affinity with a bifunctional binder[J]. Chemical Science, 2013, 4(9): 3673-3677.DOI:10.1039/c3sc51476e. |
| [25] | WANG Xiao-guang (王晓光). Mechanism of RAFT emulsion polymerization and synthesis ofpoly(styrene-b-n-butylacrylate-b-styrene) RAFT乳液聚合机理及聚(苯乙烯-b-丙烯酸丁酯-b-苯乙烯)的制备)[D]. Hangzhou (杭州): Zhejiang University (浙江大学), 2011. |
| [26] | Han Z J, Yabuuchi N, Shimomura K, et al. High-capacity Si-graphite composite electrodes with a self-formed porous structure by a partially neutralized polyacrylate for Li-ion batteries[J]. Energy & Environmental Science, 2012, 5(10): 9014-9020. |
| [27] | Olsher U, Izatt R M, Bradshaw J S, et al. Coordination chemistry of lithium ion: a crystal and molecular structure review[J]. Chemical Reviews, 1991, 91(2): 137-164.DOI:10.1021/cr00002a003. |
| [28] | Ferguson C J, Hughes R J, Nguyen D, et al. Ab initio emulsion polymerization by RAFT-controlled self-assembly[J]. Macromolecules, 2005, 38(6): 2191-2204.DOI:10.1021/ma048787r. |
| [29] | Wang X, Luo Y, Li B, et al. Ab initio batch emulsion RAFT polymerization of styrene mediated by poly (acrylic acid-b-styrene) trithiocarbonate[J]. Macromolecules, 2009, 42(17): 6414-6421.DOI:10.1021/ma9010999. |
| [30] | ZHAN Jin-hua(詹晋华), XIAN Qiao-yan(冼巧妍), DAI Yan-shan(戴燕珊). Application of the water-soluable binder for electrodes of Li-ion batteries(水溶性粘合剂在锂离子电池电极中的应用)[J]. Battery Bimonthly(电池), 2001, 31(3): 123-125. |
| [31] | Huang J, Zhao S, Gao X, et al. RAFT Ab initio emulsion polymerization of styrene using poly (acrylic acid)-b-polystyrene trithiocarbonate of various structures as mediator and surfactant[J]. Macromolecular Reaction Engineering, 2014, 8(10): 696-705.DOI:10.1002/mren.v8.10. |
| [32] | Moineau C, Minet M, Teyssié P, et al. Synthesis and characterization of poly (methyl methacrylate)-block-poly (n-butyl acrylate)-block-poly (methyl methacrylate) copolymers by two-step controlled radical polymerization (ATRP) catalyzed by NiBr2(PPh3)2, 1[J]. Macromolecules, 1999, 32(25): 8277-8282.DOI:10.1021/ma990783c. |
| [33] | Mark J E. Physical properties of polymers handbook[M].New York: Springer, 2007. |
| [34] | Luo Y, Wang X, Zhu Y, et al. Polystyrene-block-poly (n-butyl acrylate)-block-polystyrene triblock copolymer thermoplastic elastomer synthesized via RAFT emulsion polymerization[J]. Macromolecules, 2010, 43(18): 7472-7481.DOI:10.1021/ma101348k. |
| [35] | Ahmad N M, Heatley F, Lovell P A. Chain transfer to polymer in free-radical solution polymerization of n-butyl acrylate studied by NMR spectroscopy[J]. Macromolecules, 1998, 31(9): 2822-2827.DOI:10.1021/ma971283r. |
| [36] | Marsella M J, Swager T M. Designing conducting polymer-based sensors: selective ionochromic response in crown ether-containing polythiophenes[J]. Journal of the American Chemical Society, 1993, 115(25): 12214-12215.DOI:10.1021/ja00078a090. |
| [37] | Pei Q, Yang Y. Efficient photoluminescence and electroluminescence from a soluble polyfluorene[J]. Journal of the American Chemical Society, 1996, 118(31): 7416-7417.DOI:10.1021/ja9615233. |
| [38] | Wu M, Xiao X, Vukmirovic N, et al. Toward an ideal polymer binder design for high-capacity battery anodes[J]. Journal of the American Chemical Society, 2013, 135(32): 12048-12056.DOI:10.1021/ja4054465. |




