2. 浙江安诺芳胺化学品有限公司,浙江 绍兴 312369
2. Zhejiang Amino-Chem Co., Ltd., Shaoxing 312369, China
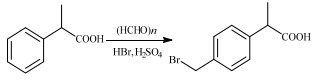
洛索洛芬钠[1-4],即2-[4-(2-氧代环戊烷-1-基甲基)苯基]丙酸钠(sodium 2-[4-(2-oxocyclopentyl- 1-methyl)phenyl]propionate dihydrate),是一种苯丙酸类非甾体消炎药,具有消炎效果好、副作用小的优点[5-10],市场需求较大。2-(4-溴甲基苯基)丙酸[2-(4-bromomethylphenyl)propionic acid,BMPPA][11-15]是合成洛索洛芬钠的关键中间体。目前工业上主要以夏晨东等[16]报道的工艺生产,该工艺中,采用氢溴酸和多聚甲醛作为溴甲基化试剂,硫酸为催化剂,合成路线如图 1,该工艺中,酸相套用困难,导致废酸量较大,有悖于当前绿色化工的理念。
|
图 1 2-苯基丙酸溴甲基化制备2-(4-溴甲基苯基)丙酸 Fig.1 Preparation of BMPPA by bromomethylation of PPA |
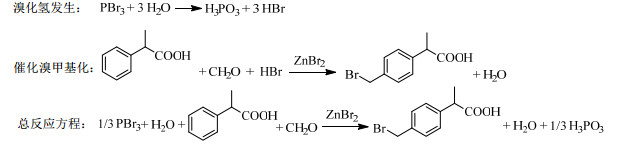
本文基于气相循环和反应-萃取工艺,实现了2-苯基丙酸(2-Phenylpropionic acid, PPA)的高效溴甲基化,优化了2-(4-溴甲基苯基)丙酸的合成工艺。通过三溴化磷(Phosphorus tribromide, PBr3)和水反应生成的溴化氢(Hydrogen bromide, HBr)作为溴源,补充了反应体系中消耗的溴化氢,维持了水相溴化氢处于较高浓度状态,推动反应进行,并实现了水相的套用,解决了当前工艺中废酸量大的问题。在此基础上,通过气体循环泵,对溴化氢进行循环利用,减少了溴化氢的消耗;通过质子酸氢溴酸与路易斯酸溴化锌协同催化,提高了溴甲基化的反应效率;通过加入萃取剂正庚烷,在反应温度下较好的溶解产物,冷却结晶后产物析出,实现有机相套用。反应方程式如图 2所示。
|
图 2 2-苯基丙酸制备2-(4-溴甲基苯基)丙酸新工艺 Fig.2 A new process for BMPPA acid synthesis from PPA |
实验所需的氢溴酸、2-苯基丙酸(PPA)、正庚烷、正辛烷、环己烷、三溴化磷、多聚甲醛、溴化锌、1, 2-二氯乙烷等均为国产分析纯。
实验仪器主要为安捷伦1100 Series高效液相色谱仪(色谱柱:Nova-Pak C18 3.9 mm×150 mm;流动相为水:甲醇:醋酸=7:3:0.1(体积比);流速为1 mL·min-1;检测波长为UV220 nm,进样量为3 μL);Avarice DMX400核磁共振仪(Bruker公司);TRACE GC 2000/TRACE MS气相色谱-质谱联用仪(Thermo Quest公司);WRR-Ⅱ熔点仪;上海蓬普流体科技有限公司气体循环泵。
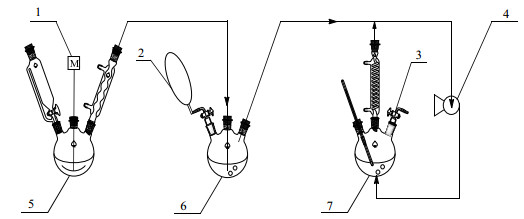
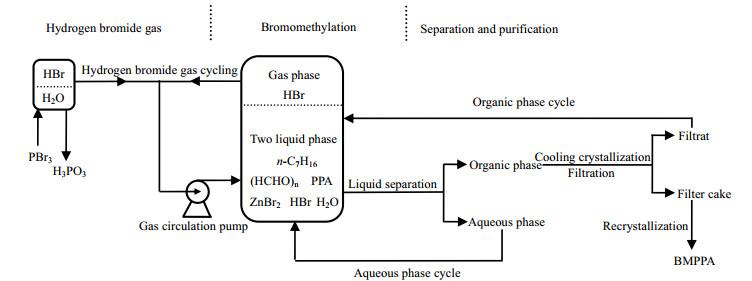
2.2 实验过程图 3为实验装置图,图 4为采用了气相循环和反应-萃取技术的工艺流程图,实验操作步骤如下:
|
图 3 实验装置图 Fig.3 Schematic diagram of the experimental setup 1. mechanical agitator 2. buffer balloon 3. vent valve 4. gas circulation pump 5. hydrogen bromide gas generator 6. buffer device 7. bromomethylation reactor |
|
图 4 工艺流程图 Fig.4 Flow chart of the preparation process |
(1) 反应器中投入w(HBr) = 48 %的氢溴酸168 g(1 mol HBr)、18 g多聚甲醛(0.6 mol)、2-苯基丙酸60 g (0.4 mol)、萃取剂正庚烷150 mL,催化剂溴化锌112 g(0.5 mol),控制温度进行溴甲基化。
(2) 在溴化氢气体发生器中,加入水18 g(1 mol),缓慢滴加43.4 g (0.16 mol,15 mL)三溴化磷。水解产生的溴化氢进入缓冲装置中。至不再产生气体后,取出反应所得液。
(3) 溴甲基化反应起始前,由于反应器内含有空气(不凝气),空气从放空阀3中排出,用溴化氢气体置换3次后,关闭放空阀3。随后溴甲基化反应器升温至80 ℃。缓冲装置中排出的溴化氢气体进入溴甲基化反应器后,经气体循环泵4,将反应体系的气相经反应器顶部的冷凝器出口,以40 mL·min-1的流速输入到溴甲基化反应器底部,鼓泡,从而进行气相循环,维持水相的溴化氢浓度饱和,溴甲基化反应的时间为8 h。
(4) 反应结束后,将溴甲基化反应器中的反应液趁热分层,分出下层水相后,上层有机相经冷却结晶(冷却结晶的温度为0 ℃,时间为6 h)、抽滤,得到滤饼和滤液。滤饼加入30 mL 1, 2-二氯乙烷重结晶后,得到产品2-(4-溴甲基苯基)丙酸,计算收率。
(5) 将步骤(4)抽滤得到的滤液,补充30 mL正庚烷后,与步骤4)所得的下层水相一起转移至溴甲基化反应器中,并在反应器中投入18 g多聚甲醛、60 g 2-苯基丙酸,重复步骤(2)、(3)、(4)的操作,实现水相和有机相的套用,共计套用7次。
每一轮步骤(2)的反应所得液合并,加入100 mL水后,在120 ℃,20 mmHg下减压蒸馏,至不再有水蒸出后,得到亚磷酸浓缩液,将亚磷酸浓缩液在-5 ℃下冷却结晶0.5 h,得到亚磷酸固体76.5 g,收率72.9%。
2.3 结构表征2-(4-溴甲基苯基)丙酸的表征参数如下:
熔点124.2~128.3 ℃,与文献报道[17]相符合。
MS(EI,70 eV),m/z(rel abundance): 242(M+, 6), 197(6), 163(100), 117(32), 107(25), 91(20), 77(6), 63(6), 51(6), 39(6).
|
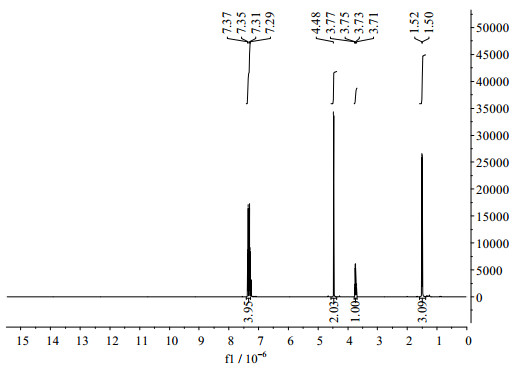
图 5 2-(4-溴甲基苯基)丙酸的1H NMR谱图 Fig.5 NMR spectrum of 2-(4-bromomethylphenyl)propionic acid |
氢谱数据如图 5所示:1H NMR (400 MHz, CDCl3) δ(10-6): 7.33 (dd, J = 25.2, 8.2 Hz, 4H), 4.48 (s, 2H), 3.74 (q, J = 7.2 Hz, 1H), 1.51 (d, J = 7.2 Hz, 3H).
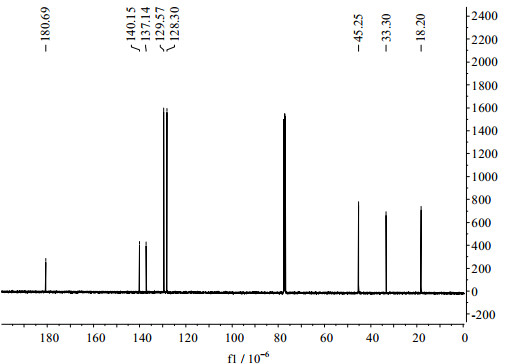
碳谱数据如图 6所示:13C NMR (101 MHz, CDCl3) δ(10-6): 180.69, 140.15, 137.14, 129.57, 128.30, 45.25, 33.30, 18.20.
|
图 6 2-(4-溴甲基苯基)丙酸的13C NMR谱图 Fig.6 13C NMR spectrum of 2-(4-bromomethylphenyl)propionic acid |
一般地,提高温度可以加快化学反应速率,但也会增加能耗。过短或过长的反应时间都不利于反应,因此需要确定合适的反应温度和时间。
通过改变温度和时间,对其进行了考察,得到如表 1的反应结果。
|
|
表 1 温度和时间对反应的影响 Table 1 Effects of temperature and time on the reaction |
由表 1结果可知,随着反应温度升高,原料转化率和收率也逐渐升高,温度达到回流时,收率开始下降,原因是加剧了副反应,随着反应时间提高,收率升高,但到10 h后开始下降,因此,本实验选择反应温度为80 ℃,反应时间为8 h。
3.2 催化剂溴甲基化反应实际上与傅克烷基化反应机理类似,质子酸将甲醛质子化,形成的碳正离子中间体对苯环进行亲电取代。加入路易斯酸催化剂,与质子酸协同催化,可以有效提高反应效率。因此,需要对催化剂进行选择。对催化剂的种类和用量进行了考察,得到如表 2的反应结果。
|
|
表 2 催化剂对反应的影响 Table 2 Effects of catalysts on the reaction |
由表 2结果可知,三氯化铝和三溴化铝的催化性能较好,但三氯化铝催化会有氯甲基化的副产物,后续分离困难,影响产品质量。而三溴化铝价格昂贵,因此选择溴化锌作为路易斯酸催化剂。催化剂用量增加可以减少反应时间,综合考虑,选择催化剂为溴化锌,用量为2-苯基丙酸摩尔量的50%。
3.3 原料配比原料的配比,即投入的氢溴酸、多聚甲醛与原料2-苯基丙酸的比例。原料投入过少则反应不完全,投入过多增加回收成本,因此需要对原料配比进行优化。通过改变原料配比,得到如表 3的反应结果,表中摩尔比为氢溴酸、多聚甲醛、2-苯基丙酸的摩尔比。
|
|
表 3 原料配比对反应的影响 Table 3 Effects of raw material ratios on the reaction |
由表 3结果可知,随着氢溴酸用量增加,原料的转化率和产物的收率逐渐增加至稳定;随着多聚甲醛用量增加,原料的转化率逐渐增加至稳定,产物的收率先增加后减小。这是由于多聚甲醛用量过多,造成了多溴甲基化的副反应。因此,本实验选择氢溴酸、多聚甲醛、2-苯基丙酸的摩尔比为2.5:1.5:1的反应条件。
3.4 萃取剂本文的反应-萃取工艺,要求萃取剂在较高的温度下可以较好地溶解产物,而在低温下可以将产品析出。同时,萃取剂自身不能与反应物作用,水溶性应尽可能差。考察了萃取剂对反应的影响,得到如表 4的反应结果,收率为套用5次后的平均收率。
|
|
表 4 萃取剂对反应的影响 Table 4 Effects of extracting agents on the reaction |
由表 4结果可知,脂肪烃中,正庚烷的效果较好,而1, 2-二氯乙烷能溶解较多的产物,使得收率偏低,因此,选择正庚烷作为萃取剂。
3.5 优化条件下的平行试验上述的单因素实验得到在溴化锌:氢溴酸:多聚甲醛:2-苯基丙酸的摩尔比为0.5:2.5:1.5:1,反应温度为80 ℃,反应时间为8 h,萃取剂为正庚烷的优化条件下,BMPPA的收率为86.7%,为了进一步确定此反应条件下的可行性,进行3次平行实验,得到如表 5所示的反应结果。由表 5可看到,3次平行实验平均收率为86.8%,重复性良好。
|
|
表 5 优化条件下的重复性实验 Table 5 Results of repeatitive experimental runs under optimized conditions |
由于溴甲基化反应消耗了溴化氢,使得水相中溴化氢浓度降低,因此需要向水相中补充溴化氢,维持溴化氢处于较高浓度状态,推动反应进行。在实际反应中,往往通入过量的溴化氢保证水相溴化氢浓度,若不进行循环利用,则会造成大量溴化氢的浪费,增加了废物污染,同时降低了溴原子的利用率。因此需要对其循环利用,以提高溴原子的利用率,表 6对比了气相循环前后的实验结果,其中溴原子利用率为理论所需的溴化氢量/实际消耗的溴化氢量。
|
|
表 6 气相循环对反应的影响 Table 6 Effects of gas phase circulation on the reaction |
由表 6结果可知,通过气体循环泵对溴化氢气体循环,溴原子利用率提高了32%,有效地减少了溴化氢气体的单耗,即三溴化磷的单耗。
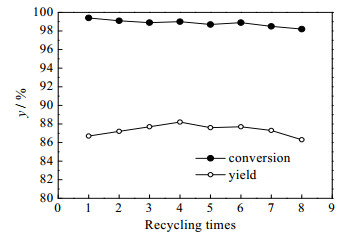
3.7 水相和有机相套用通过三溴化磷与水反应产生溴化氢气体作为溴源,通入溴甲基化反应器中,补充了水相因反应消耗的溴化氢,推动反应的进行。反应结束后,水相中的溴化氢浓度仍然处于较高浓度状态,可以继续套用至下一次反应。而有机相经过冷却结晶析出产物后,得到的结晶母液主要成分为萃取剂正庚烷,同样可对其进行套用。对有机相和水相进行套用,得到如图 7所示的反应结果。从图 7可知,水相和有机相套用7次,产品的收率可维持稳定。累计得到产品679.5 g,收率为87.4%。第7轮套用结束后得到的水相,约428 g,作废酸处理,即平均生产1 kg产品产生0.63 kg废酸,相比于文献报道的工艺[16],废酸量降低了80%。
|
图 7 水相和有机相套用对反应的影响 Fig.7 Effects of aqueous phase circulation on the reaction |
针对现有工艺存在的废酸量过大的问题,本文基于气相循环与反应-萃取技术,优化了2-苯基丙酸的2-(4-溴甲基苯基)丙酸的合成工艺,实现了2-苯基丙酸的高效溴甲基化。通过三溴化磷和水反应生成的溴化氢作为溴源,补充了反应体系中消耗的溴化氢,维持了水相溴化氢处于较高浓度状态,推动反应进行,实现了水相的套用,解决了当前工艺中废酸量大的问题。在此基础上,通过气体循环泵进行气相循环,减少了溴化氢的消耗;通过质子酸氢溴酸与路易斯酸溴化锌协同催化,提高了溴甲基化的反应效率;通过加入萃取剂正庚烷,在反应温度下较好的溶解产物,冷却结晶后产物析出,实现有机相套用。优化后的工艺条件为:反应体系中溴化锌:氢溴酸:多聚甲醛:2-苯基丙酸的摩尔比为0.5:2.5:1.5:1,反应温度为80 ℃,反应时间为8 h,纯化后2-(4-溴甲基苯基)丙酸的收率为86.7%,纯度为98%,水相和有机相套用7次,产品收率稳定,相比于现有工艺,废酸量排放减少80%。本文开发的工艺,成本低、污染小、适合工业化生产。
| [1] |
LANZA F L, CODISPOTI J R, NELSON E B. An endoscopic comparison of gastroduodenal injury with over-the-counter doses of ketoprofen and acetaminophen[J]. American Journal of Gastroenterology, 1998, 93(7): 1051-1054. DOI:10.1111/ajg.1998.93.issue-7 |
| [2] |
PIRKLE W H, LIU Y. Design, synthesis, resolution, determination of absolute configuration, and evaluation of a chiral naproxen selector[J]. Journal of Organic Chemistry, 1994, 59(23): 6911-6916. DOI:10.1021/jo00102a013 |
| [3] |
WILLY Z, THURNEN S. Process of making 6-chloro-α-methyl-carbazole-2-acetic acid: US, 4264500[P]. 1981-04-28.
|
| [4] |
TERADA A, WACHI K, MISAKA E. Substituted phenylacetic acid derivatives and process for the preparation thereof: US, 4161538[P]. 1979-7-17.
|
| [5] |
马秀玲. 2-(4-溴甲基苯基)丙酸合成工艺研究[D].青岛: 青岛科技大学, 2015. MA X L. Study on synthesis of 2-(4-bromomethyl) phenylpropionic acid[D]. Qingdao: Qingdao University of Science and Technology, 2015. |
| [6] |
BRENNA E, CROTTI M, GATTI F G, et al. Enantioselective synthesis of (R)-2-arylpropanenitriles catalysed by ene-reductases in aqueous media and in biphasic ionic liquid-water systems[J]. Chemcatchem, 2014, 6(8): 2425-2431. DOI:10.1002/cctc.201402205 |
| [7] |
THIYAGARAJAN S, GUNANATHAN C, THIYAGA R S, et al. Facile ruthenium(Ⅱ)-catalyzed α-alkylation of arylmethyl nitriles using alcohols enabled by metal-ligand cooperation[J]. Acs Catalysis, 2017, 7(8): 5483-5490. DOI:10.1021/acscatal.7b01427 |
| [8] |
DANG T T, SEAYAD A M. A convenient ruthenium-catalysed α-methylation of carbonyl compounds using methanol[J]. Advanced Synthesis & Catalysis, 2016, 358(21): 3373-3380. |
| [9] |
徐新良, 何昆仑, 卢鑫, 等. 非甾体抗炎药洛索洛芬钠的合成研究[J]. 中国药物化学杂志, 2014, 24(5): 380-383. XU X L, HE K L, LU X, et al. Study on the synthesis of nonsteroidal anti-inflammatory drug loxoprofen sodium[J]. Chinese Journal of Medicinal Chemistry, 2014, 24(5): 380-383. |
| [10] |
冯姣, 潘鹤林, 禹艳坤, 等. 洛索洛芬钠的合成新工艺研究[J]. 化学试剂, 2016, 38(1): 88-90. FENG J, PAN H L, YU Y K, et al. Study on the new synthetic process of loxoprofen sodium[J]. Chemical Reagent, 2016, 38(1): 88-90. |
| [11] |
OGAWA S, OBORA Y. Iridium-catalyzed selective α-methylation of ketones with methanol[J]. Chemical Communications:cambridge, 2014, 50(19): 2491-2493. DOI:10.1039/C3CC49626K |
| [12] |
THIYAGARAJAN S, GUNANATHAN C, THIYAGA R S, et al. Facile ruthenium(Ⅱ)-catalyzed α-alkylation of arylmethyl nitriles using alcohols enabled by metal-ligand cooperation[J]. Acs Catalysis, 2017, 7(8): 5483-5490. DOI:10.1021/acscatal.7b01427 |
| [13] |
LIU Z, YANG Z, YU X, et al. Methylation of C(sp3)-H/C(sp2)-H bonds with methanol catalyzed by cobalt system[J]. Organic Letters, 2017, 19(19): 5228-5231. DOI:10.1021/acs.orglett.7b02462 |
| [14] |
HARTMANN R W, BATZL C. Aromatase I. Synthesis and evaluation of mammary tumor inhibiting activity of 3-alkylated 3-(4-aminophenyl)piperidine-2, 6-diones[J]. Cheminform, 1987, 18(3): 1362-1369. |
| [15] |
FUJIHARA H, IMAOKA K, FURUKAWA N, et al. Tetrakis-sulphoxides:A new type of phase-transfer catalyst for nucleophilic displacements and alkylations[J]. Chemischer Informationsdienst, 1986, 17(24): 333-336. |
| [16] |
夏晨东, 傅华伟, 陈国全.一种洛索洛芬中间体的制备方法, CN, 105753685 A[P]. 2016-07-13. XIA C D, FU H W, CHEN G Q. Preparation method of loxoprofen intermediate: CN, 105753685 A[P]. 2016-07-13. |
| [17] |
HSI R S, STELZER L S, STOLLE W T. Synthesis of carbon-13 labeled ibuprofen[J]. Journal of Labelled Compounds and Radiopharmaceuticals, 1989, 27(10): 1115-1125. DOI:10.1002/jlcr.v27:10 |




