单克隆抗体(简称单抗)药物具有靶向性强、疗效好、副作用小等特点,在治疗癌症、自身免疫性疾病等方面具有显著优势[1-2]。1985年首个鼠源单抗药物被美国食品药品监督管理局(Food and Drug Administration, FDA)批准上市,2002年首个全人源单抗药物上市,此后单抗类药物所占市场份额迅速增加[3-5]。2019年,全球药品销售额前十名中,7个为单抗药物。近年来,多个重磅单抗药物专利到期,各大药企纷纷开展相关产品研发[6-7]。国家通过“4+7”带量采购、医保药品谈判等措施,极大压低了药品价格。因此,制药企业面临着新的挑战,提高过程效率和产能、降低生产成本,是必须面对的迫切问题。
连续生物制造(continuous biomanufacturing)是目前业界普遍关注的热点。连续生产已广泛应用于石油化工、冶金精炼、汽车制造等众多行业[8-11]。近年来生物制药行业也开始加大对连续生产的探索,美国FDA公开表示支持连续生产工艺,组建了专门的团队以推进连续生产工艺的研发和实施[12]。2019年FDA发布官方声明推动生物制药的连续制造,并颁布了质量控制指南[13]。目前连续灌流细胞培养技术已经得到突破,并逐渐普及,在上游培养实现连续化的情况下,下游分离纯化就成为整个生产过程的关键限速步骤[14-17]。麻省理工学院、瑞士联邦理工学院等一些研究机构积极探索下一代抗体连续制备新技术,各生物制药公司也纷纷建立连续制造研发中心,尝试全流程的连续生产工艺[18]。相关研究表明,连续制造可提高过程产率和产品质量,促进设备小型化和流程自动化,拓展过程的灵活性和可靠性,显著降低制备成本。但是连续生产过程复杂、难度较大,至今尚未有抗体药物的连续生产工艺被批准,仍有许多方面有待进一步改善。
单抗药物分离通常采用蛋白A亲和层析捕获和两步层析精制的平台工艺。层析是典型的批次处理过程,针对不同分离阶段的需要,实现高效的连续流层析,是过程开发的关键。本文将综述国内外连续流层析的研究进展,着重介绍不同环节中连续流层析技术的原理、应用和存在的问题,以及连续流层析在单抗药物生产过程中面临的挑战。
2 捕获阶段的连续流层析 2.1 基本原理抗体下游过程的层析分离主要分为捕获与精制2个环节,捕获阶段多采用蛋白A亲和层析,去除大量杂质,普遍认为该阶段是抗体药物生产下游过程的关键步骤[19]。层析过程一般采取批次运行模式,即平衡、上样、冲洗、洗脱、再生等各个步骤依次进行,产能和过程效率比较有限。
目前连续流层析主要应用于抗体捕获阶段,一般采用多柱操作,通过顺序切换层析柱,实现连续上样分离,又称为周期性逆流层析(periodic counter-current chromatography,PCC)。图 1(a)是典型的蛋白穿透曲线,为了避免损失,常规的批次层析通常采取较低的穿透点上样,此时介质的利用率较低(一般为50%~60%),相当于图 1(a)中仅A部分的介质容量被利用,造成了蛋白A层析介质的浪费。为提高介质利用率,可以将常规的单柱批次处理方式(图 1(b))转变为多柱串联的连续上样模式(图 1(c)):柱1穿透的蛋白进入后续柱2继续吸附,持续上样至时间t2,此时柱1的介质吸附容量为(A+B),介质利用率显著提高,经优化后可达90% 以上;柱1吸附完成后,将串联的2根层析柱断开,料液切换至柱2持续上样,而柱1则进行冲洗、洗脱、再生和平衡等操作,然后柱1再次与柱2串联,上述步骤依次进行,循环操作,可以实现料液的持续上样。该方式能够在避免蛋白损失的前提下显著提高介质利用率,同时提高过程产率,减少缓冲液消耗,降低生产成本。
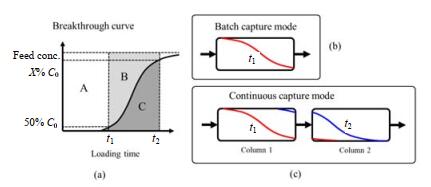
|
图 1 连续捕获层析原理图 Fig.1 Scheme of continuous chromatography for protein capture |
基于上述原理,已开发出不同模式的连续流层析过程,主要有GE Healthcare公司PCC、Pall公司BioSMB、Novasep公司BioSC和ChromaCon公司CaptureSMB。
(1) 双柱连续流层析和CaptureSMB
ChromaCon公司推出双柱连续流层析系统Contichrom® CUBE,使用2根层析柱,是最精简的连续流层析系统,其蛋白捕获模式称为CaptureSMB,YMC Process Technologies公司推出了相应的制备生产级EcoPrime® Twin系统。具体操作包括6个步骤,如图 2所示。首先,2根层析柱以串联方式上样,1#柱流穿的蛋白被2#柱捕获;1#柱达到设定的穿透点后,将未吸附的蛋白冲洗到2#柱;然后将两柱断开,1#柱进行淋洗、洗脱、再生、再平衡等步骤(Recovery-Regeneration,R-R),与此同时2#柱继续上样。待1#柱完成所有洗脱和再生步骤,将1#柱串联至2#柱后,2#柱持续上样,与前面过程类似,只是两柱调换了位置。因此,通过双柱交替上样,便可以实现连续层析分离。为使系统快速达到稳定状态,通常会在最前面添加一个启动环节,还会在结束前添加一个终止环节。
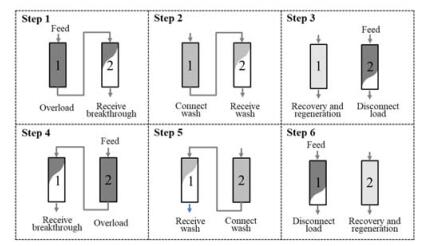
|
图 2 双柱连续流层析(CaptureSMB)捕获蛋白示意图[20] Fig.2 Scheme of twin-column continuous chromatography (CaptureSMB) for protein capture[20] |
CaptureSMB模式只使用2根层析柱,最大程度上简化了设备及操作,但具有一定的局限性。由于存在双柱串联的冲洗阶段(Step 2和5),因此上样过程存在中断,一种改进方式是在Step 2和5中对后柱持续上样,以保持上样过程的连续性。此外,在单柱上样阶段(Step 3和6),为了平衡另一柱的洗脱和再生过程,通常会减慢上样流速,因此CaptureSMB模式为变流速上样。
(2) 3~4柱连续流层析和PCC
GE Healthcare公司推出PCC连续流层析系统,包括实验室规模的ÄKTA pcc和制备生产规模的BioProcess pcc,采取3C-PCC和4C-PCC两种模式,分别使用3和4根层析柱。
3C-PCC系统的具体步骤见图 3,与CaptureSMB类似,也是采用2根层析柱串联上样。首先,1#和2#柱串联进行上样,3#层析柱进行R-R等步骤;当3#柱再生完毕,1#柱也达到预设的穿透比例,将1#柱与3#柱串联,1#柱中未吸附的蛋白冲洗到3#柱,与此同时料液切换到2#柱,以恒定速度上样;待1#柱冲洗完毕,断开1#柱与3#柱,连接2#柱与3#柱,持续上样,1#柱进行R-R步骤。重复以上步骤,从Step 1到Step 6,每根层析柱都完成了层析操作的所有步骤,恢复到初始状态,即完成了一个分离循环。需要注意的是,上样过程和洗脱再生过程需要合理设计,互相匹配。
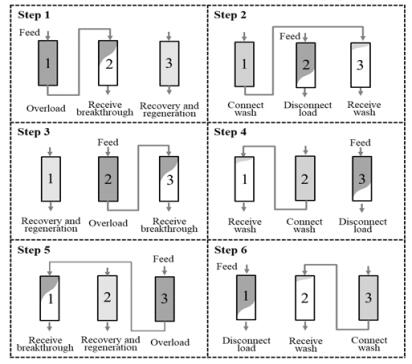
|
图 3 3柱连续流层析(3C-PCC)捕获蛋白示意图 Fig.3 Scheme of three-column continuous chromatography (3C-PCC) for protein capture |
如果蛋白浓度较高,上样时间较短,而洗脱再生时间较长,使得再生过程中蛋白可能从前面2根层析柱中穿透出来,造成蛋白的损失。针对这一状况,可以使用4根层析柱的4C-PCC系统,具体见图 4,仍采用双柱串联的方式进行上样,但将洗脱和再生分为2个阶段,分别在2根层析柱内进行。

|
图 4 4柱连续流层析(4C-PCC)捕获蛋白示意图 Fig.4 Scheme of four-column continuous chromatography (4C-PCC) for protein capture |
不同于双柱CaptureSMB模式,3C-PCC和4C-PCC采用恒定流速上样,即在整个层析过程中,无论是2柱串联上样还是单柱上样,上样流速均保持不变。不过,对于PCC模式,需要合理匹配上样过程和洗脱再生过程。若洗脱再生时间较长时,则通过增加层析柱数来分摊洗脱再生的时间,保证上样过程中不会有蛋白损失;若上样时间较长,洗脱再生完毕后,层析柱需要等待,直至上样完成。对于双柱CaptureSMB模式,则一般通过计算上样量,利用降低单柱上样的流速来匹配洗脱再生步骤,从而实现过程优化。
(3) 3~16柱连续流层析和BioSMB
Pall公司开发了Cadence BioSMB连续流层析系统,使用独特的一次性阀系统,可以实现复杂的流路设计,满足3~16根层析柱的连续流层析。BioSMB系统最简单的3柱连续流层析与3C-PCC技术类似,差异主要在冲洗阶段,如Step 2步骤,BioSMB系统将1#柱和2#柱的出口并联,共同接入3#柱,这样可以保证2#柱中蛋白不会出现穿透的风险。待1#柱冲洗完毕,断开1#柱与3#柱,2#柱与3#柱继续串联上样,1#柱则进行R-R步骤。对于BioSMB系统,当再生时间较长、上样时间较短的情况下,可以通过增加层析柱,将洗脱再生步骤时间分摊到几根层析柱上,可以避免因再生时间较长而导致蛋白从层析柱中穿透而损失。
(4) 多柱序列层析和SMCC技术
Novasep公司开发BioSC系统,也称作多柱序列层析(sequential multicolumn chromatography,SMCC),适用于4~8根层析柱。以4根层析柱为例介绍SMCC操作方式。将前3根层析柱(1#、2#和3#)串联,进行上样,4#柱进行R-R步骤;当4#柱再生完毕,接到3#柱后,此时1#柱已饱和吸附,将未吸附的蛋白冲洗到后续层析柱后,1#柱与后续层析柱断开;1#柱进行R-R步骤;2#、3#和4#柱串联进行上样。每根层析柱交替完成层析过程的所有步骤,恢复到初始状态,完成一个循环。BioSC系统采用3根层析柱串联进行上样,能充分保证蛋白不会从层析柱中穿透。若蛋白浓度较高,且R-R步骤的时间较长,3柱串联仍可能导致蛋白从层析柱中穿透,此时可以添加层析柱。但是,随串联层析柱增加,会造成床层压力升高,容易引起介质坍塌,可以使用较小的线性流速或者较短的层析柱。
与传统批次层析相比,连续流层析利用多柱串联上样,提高了介质的利用率和过程产率,减少介质消耗,同时降低缓冲液等物料消耗,减少了废液排放。但是,需要注意的是,连续流层析过程较为复杂,以上几种模式各有优缺点,还需进一步优化设计。此外,连续流层析的影响因素较多,包括系统本身、工艺条件以及层析介质等,利用层析模型进行预测分析,系统评价关键参数对连续捕获的影响,将有助于连续流层析过程的理性设计。
2.3 抗体连续捕获的应用和发展蛋白A亲和层析介质价格昂贵[21-22],采用连续流层析进行抗体捕获,可显著提高介质和设备利用率,增大过程产率,降低生产成本。近年来,多个研究机构和公司都在研发连续捕获工艺,既有实验室小试,又有中试尝试。
Angarita等[23]对动物细胞表达的单抗进行CaptureSMB双柱连续流亲和捕获,相较于常规批次层析过程,产率提高38%,介质用量减少28%。高宗晔等[24]以两款蛋白A亲和层析介质为对象,比较CaptureSMB与常规批次过程的差异,结果表明在低保留时间下动态载量高的介质具有优势,过程效果显著提升,产率提高约40%,介质利用率提高约25%,缓冲液消耗下降约40%。Godawat等[25]采用ÄKTA pcc 75系统,对动物细胞表达的单抗进行3C-PCC 3柱连续流亲和捕获,与常规批次层析相比,连续流过程的介质利用率增加30%,缓冲液消耗减少80%,同时柱体积减小26倍。Gjoka等[26]采用Cadence BioSMB系统,建立了多柱连续流亲和捕获工艺,相较于常规批次过程,根据上样步骤所连接的柱数量不同,产率提高40%~50%。
Angelo等[27]将实验室规模的CaptureSMB双柱连续流亲和层析放大100倍,采用EcoPrime Twin 100系统进行中试验证,结果表明连续分离的宿主细胞蛋白去除、DNA残留、蛋白A配基泄漏和抗体纯度等均与批次过程相当,产率可提高1.8~2.5倍,介质利用率从67% 提高到92%,缓冲溶液消耗节省一半。Otes等[28]将实验室规模的Cadence™ BioSMB PD系统(5.65 mL层析柱)放大至Cadence™ BioSMB Process 80 system系统(200 mL层析柱),中试实验结果与小试规模相同,相比于批次过程,产率提高400%~500%。Pollock等[29]从成本和操作可行性出发,对早期临床、后期临床及商业化生产3个阶段的PCC多柱连续流亲和层析进行预测分析,结果表明早期临床阶段的成本构成对连续流技术最为敏感,应用连续流亲和捕获可以节省约30% 成本。
3 精制阶段的连续流层析抗体精制的目标在于去除微量杂质,包括宿主细胞蛋白、DNA、抗体片段、聚体、异质体等,一般采用离子交换层析、疏水相互作用层析和混合模式层析。精制阶段连续流层析的相关研究相对较少,原理和模式差别较大,以下分别介绍。
3.1 MCSGP模式在蛋白梯度洗脱分离中,常会遇到目标主峰P和相似组分无法完全分离的情况,包括交叠的前峰杂质W和后峰杂质S。通过分离条件优化,如减小流速、放缓梯度和减小介质粒径等,可以一定程度上提高分离度,但常常难以达到完全分离[30-34]。因此,常规的单柱层析分离必然存在纯度和收率之间的矛盾:若要保证产品纯度,就必须减小产品收集区间,导致收率较低;若想得到较高的收率,需要增大收集区间,纯度就必然下降。为此,Steinebach等[35]提出了一个连续流层析的解决方案:通过收集主峰和杂质峰的交叠区间,实现循环上样,称为多柱逆流溶剂梯度纯化(multicolumn counter-current solvent gradient purification, MCSGP)。双柱MCSGP的具体操作步骤见图 5,根据峰形分布,柱1适时收集高纯度的目标蛋白区间P,前峰交叠区W和后峰交叠区S经在线稀释后相继进入后续柱2,与新鲜料液一起通过柱2进一步实现分离,柱1经清洗和再生,两柱交替换位,从而实现连续性分离。双柱连续流层析系统Contichrom® CUBE combined整合了MCSGP分离模式,相应推出制备生产级的MCSGP连续流层析系统,可以自动实现多柱切换和在线稀释。
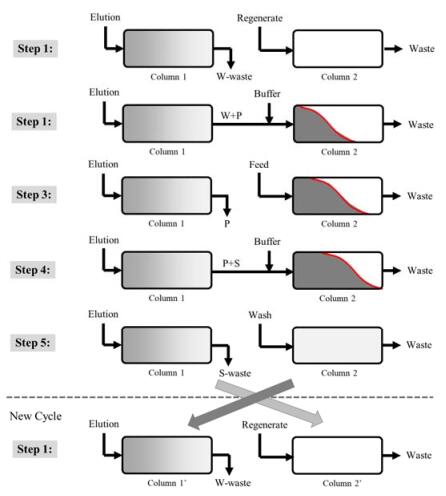
|
图 5 双柱MCSGP连续流层析分离示意图 Fig.5 Scheme of twin-column MCSGP continuous chromatography for protein polishing |
MCSGP连续分离模式,在保证目标物纯度的同时,显著提高收率,特别适合于性质相似组分的分离,已应用于抗体电荷异质体、抗体聚集体、双特异性单抗、多肽等分离纯化[36-38]。Müller-Späth等[39]利用MCSGP分离单抗异质体,结果表明MCSGP的分离效果明显优于单柱批次过程,目标单抗的纯度及收率均达到93%。Steinebach等[35]简化了MCSGP操作,用于单抗电荷异质体分离,经优化后单抗主体蛋白纯度和收率均大于90%。Vogg等[40]以目标蛋白的纯度和收率作为评价指标,对MCSGP过程参数进行评价,结果表明收集区段的选取对目标蛋白纯度有决定性作用。
3.2 双柱批次循环模式Persson等[41]提出双柱批次循环模式(two-column batch-to-batch recirculation)。与MCSGP的“交叠组分循环上样”思路相似,该模式也使用2根层析柱,柱1适时收集高纯度的目标蛋白区间P,前峰交叠区W和后峰交叠区S经在线稀释后相继进入后续柱2,与新鲜料液一起通过柱2进一步实现分离。不同于MCSGP模式的1套设备运转2根层析柱,该模式采用2台单柱层析设备(ÄKTA explore 100),每台设备运转1根层析柱,借助三通阀将2台设备进行耦合。Persson等[41]采用该模式对核糖核酸酶A、细胞色素C和溶菌酶的混合物进行分离,建立层析模型对参数进行优化,结果表明可减少产物损失并提高产物纯度,经20个周期的循环分离后,在保证细胞色素C纯度大于90% 前提下,收率由单柱批次层析的45.4% 提高至93.6%,产率提高3.4倍。该模式使用常规层析设备进行改造,但切换阀等部件较多,控制单元比较复杂,具有一定的局限性。
3.3 多柱置换层析模式Khanal等[42]将置换层析与连续流层析相结合,提出了多柱置换层析(multi-column displacement chromatography),构建了一套由3根层析柱构成的连续流层析系统,用于分离单抗电荷异质体。
单抗电荷异质体分为碱性异质体和酸性异质体,其中前者的等电点比主体蛋白(P)高,与阳离子交换介质的结合能力强,即为强吸附组分(S);后者的等电点比主体蛋白低,与阳离子交换介质的结合能力弱,即为弱吸附组分(W)。首先将3根层析柱串联,对1#柱上样,在上样量大于介质载量的情况下,料液中的强吸附组分会把主体蛋白及弱吸附组分置换出来,根据结合能力强弱,强吸附组分、主体蛋白和弱吸附组分分别主要分布于1#、2#和3#柱中,每根柱中均存在交叠组分;用平衡缓冲液进行冲洗,使1#和2#柱中未结合的残留蛋白进入3#柱,以减少蛋白损失;然后将3根层析柱断开,分别对1#和2#柱进行洗脱,此时3#柱中主要为弱吸附组分和主体蛋白;接着将3根层析柱重新连接,反向从3#柱开始上样,通过这种方式,将第1个循环中未洗脱的3#柱内的弱吸附组分和主体蛋白循环上样,提高主体蛋白的收率。结果表明,将碱性异质体和主体蛋白作为自置换剂,实现了主体蛋白的富集,在满足主体蛋白90%纯度的基础上,收率从65%提高到90%。
3.4 不同层析过程组合的连续精制纯化将精制纯化阶段的不同层析单元进行整合,建立连续精制层析工艺,不仅提高分离效率,还可以减少中间储罐的使用,节省工艺时间与费用。
Kateja等[43]利用一台ÄKTA层析设备对2根层析柱进行串联上样,单抗样品经阳离子交换层析柱分离后,通过三通阀加入缓冲液实现在线调节离子强度,之后进入混合模式层析柱进行分离,去除电荷异质体和聚集体,纯化时间从12缩短至6 h。对纯化后的单抗进行检测,结果表明聚体含量少于1%,宿主细胞蛋白小于10×10-6,DNA含量小于5×10-9。
Löfgren等[44]将阴离子交换层析、病毒灭活和疏水相互作用层析3步纯化单元整合并实现连续化操作,采用1台ÄKTA层析系统装配2根层析柱分别用于阴离子交换层析和疏水相互作用层析,使用Superloop上样器进行病毒灭活。通过连续精制纯化,整个纯化工艺由7步减少为2步,缩减了生产时间与费用。
4 抗体制备的整合连续流层析过程将捕获阶段与精制阶段进行整合,构建全流程的整合连续流层析,可以显著提高过程效率。
Girard等[45]通过3柱SMCC系统,将蛋白A亲和层析和离子交换层析2个单元进行整合,结果表明捕获阶段蛋白A亲和层析的产率从0.39提高至1.77 kg·(L·d)-1,精制阶段离子交换层析的产率从1.0提高至6.1 kg·(L·d)-1,分别提高了4.5和6.1倍。
Gjoka等[46]通过2台Cadence BioSMB PD系统,实现了蛋白A亲和层析、病毒灭活、阴离子交换层析(流穿模式)和混合模式阳离子交换层析4个单元的整合,将传统批次过程转换为连续化生产,可减少95% 的蛋白A及混合模式介质的使用,缓冲液消耗减少44%。对于捕获阶段,产率从13提高至50 g·(L·h)-1;对于混合模式层析阶段,产率从10提高至60 g·(L·h)-1。
将下游连续流层析系统与上游灌流细胞培养相耦合,可以实现抗体的全流程连续生产,从而提高单抗质量的稳定性和生产效率,降低生产成本[47-48]。Warikoo等[49]对上下游整合进行了尝试,利用PCC连续流层析系统,构建了与灌流生物反应器组合的连续捕获,不间断地运行30 d,结果表明产品质量稳定。在此基础上,Godawat等[50]进一步扩展为端到端的全流程整合连续系统,细胞培养液经过滤后泵入一次性缓冲罐中,然后进行连续捕获层析、病毒灭活,过滤、连续精制层析、膜层析,最后得到单抗原液。该工艺采用封闭系统以减少污染的风险,自动化操作保证产品质量的稳定性,提高生产效率和灵活性,降低成本。
5 抗体连续生产的难点及展望作为一项新兴技术,抗体连续生产具有显著优势,是生物制药发展的必然趋势[51]。但是,实现抗体连续生产,除了法规部门的监管因素外,在过程设计、过程分析和过程控制等方面仍存在严峻的挑战。
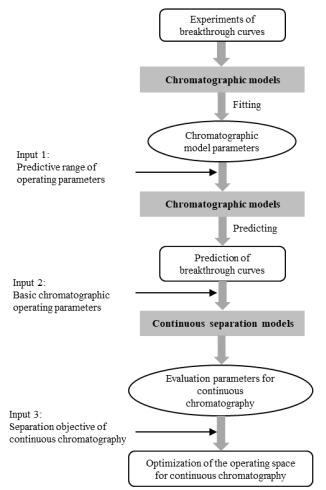
5.1 过程设计连续流层析模式较多,操作复杂,过程参数多,优化设计较为困难。对连续流层析建立数学模型,优化过程参数,可辅助过程设计与放大。Ng等[52]分别建立了单柱及多柱SMCC连续流亲和捕获模型,借助模型进行过程优化,将最优产率从传统批次层析的2.9提高到4.0 kg·d-1。Shi等[20]建立了连续捕获的数学模型与设计方法,对CaptureSMB过程进行综合分析,针对过程产率和介质利用率双指标进行优化,确定合适的保留时间和穿透点比例。为了更好地比较不同模式的连续流层析,林东强等[53]提出基于层析模型的连续流层析设计及优化策略,见图 6,系统分析连续流层析操作参数和设计参数对分离性能的影响,得到过程产率和介质利用率分布图,合理设计连续流层析的操作空间,显著提高连续流层析过程开发效率,并进一步研发了集成软件包,辅助不同模式连续捕获的过程设计[54-55]。在此基础上,为了提高数据处理和复杂优化的能力,林东强等[56]引入人工神经网络(artificial neural network, ANN),采用ANN替代机理模型进行穿透曲线的拟合和预测,在保证计算精度的情况下,加快了运算速度,有利于多维的参数分析和优化,实现连续流层析的综合优化,同时也研发了相应的集成软件包[57]。Sellberg等[58]针对MCSGP过程建立了单柱模拟,以实现对连续分离过程的动态优化,结果表明借助模型对操作条件进行优化,目标蛋白纯度可以提高到95%,收率达99%。鉴于连续流层析的复杂性,采用合适的模型,引入先进的数据处理方法,将有助于过程的合理设计和优化。
|
图 6 基于层析模型的连续流层析设计及优化[53] Fig.6 Model-based process design and optimization of continuous chromatography [53] |
连续生产过程中,料液连续输入,产品连续输出,其中任一环节出现异常,均会对整批产品的质量产生重要影响。因此,连续生产的关键在于确保每一环节中间产品的关键质量属性合格且均一稳定,即需要对各环节进行实时监测[59-62]。
为了便于药物生产的质量控制,2004年FDA开始倡导过程分析技术(process analytical technology, PAT),即通过及时测量样品、中间产品的关键质量属性,对药物生产过程进行评估和控制,以确保终产品的质量[63]。对于连续分离过程,目前仍主要依赖于紫外检测器进行监控,缺乏实时、高效的PAT技术。紫外检测过于单一,无法全面反映蛋白的关键质量属性,若中间产品存在偏差将极有可能导致整批产品的浪费,而取样离线检测耗时过长,无法实现快速分析,难以满足连续分离的监测需求[64]。因此,研发新型过程分析技术十分重要,如拉曼光谱、近红外光谱等,一方面发展小型化、快速化、可靠的过程分析设备,另一方面需要考虑复杂组分的分析,以及取样策略等对连续过程的影响[65-67]。
5.3 过程控制技术高效的过程控制是维护连续过程稳定运行的保障[68-69],其中关键点包括下游捕获与上游细胞培养的衔接、连续层析的预测控制、全流程的集成控制。
下游亲和层析捕获与上游细胞培养(如灌流培养)的衔接是整合连续过程中至关重要的环节。主要问题在于灌流培养输出的蛋白料液浓度是变化的[70-72],料液浓度的波动将会直接影响蛋白穿透曲线,从而影响蛋白A亲和捕获的过程控制。ÄKTA pcc系统在层析柱之前和之后分别设置紫外检测器,在线监测单抗UV值的叠加响应,以控制合适的穿透比例设定值,称为ΔUV控制;Contichrom® CUBE combined系统则只在柱后检测单抗UV值的叠加响应,通过计算单抗穿透曲线的积分面积,以控制合适的上样量,称为AutomAb控制。这2种控制策略,一定程度上可以适应料液蛋白浓度的小幅波动,但归根结底是通过监测UV的被动控制。如果采用层析模型对当前时刻的穿透曲线进行拟合,并对后续柱的穿透曲线进行预测评估,提前进行过程参数调整,就可以提高控制的精准性和可靠性。预测控制的关键在于建立合适的模型,对监测数据进行快速处理分析,并对后续数据进行预测评估和比对,模型质量将直接影响控制决策,进一步影响工艺流程的适用性与稳健性。
对于连续过程,各单元之间没有等待和缓冲,各步骤操作的精准性和时效性要求很高。以MCSGP模式为例,对于相似组分的分离纯化,分离条件的微小改变均有可能对层析柱内的分离性能产生影响,进而导致实际循环再分离的组分发生变化,从而影响产品纯度与收率。此外,每个循环中切割的交叠组分,随循环次数的增加而发生细微改变,若采取恒定的控制模式将产生偏差,难以实现对目标组分的准确分离。因此,需要加强对连续层析过程的认识,建立高预测性、高稳健性、高响应性的模型以实现预测控制,通过实时调整关键操作参数,实现稳定的过程控制。近年来,越来越多的研究集中于建立层析模型以实现不同条件下分离效果的预测,提高控制效率[73-76]。针对传统批次层析的模型已较为成熟,能够较好地对分离效果进行预测,快速优化合适的操作参数,对过程中出现的各种波动及时进行自动调整,从而增强层析系统的稳健性[77-79]。但是,连续过程更加复杂,关键参数众多,建立合适模型的难度较大,有待进一步研发。
对于整合的单抗全流程连续生产,Feidl等[80]研发了数据采集及监控系统(supervisory control and data acquisition system, SCADA),组合了在线和离线检测,收集并集中存储所有过程数据,对整个过程进行监测和控制,实现各个单元的优化协调和集成控制,包括灌流细胞培养、CaptureSMB连续流亲和捕获、病毒灭活和两步精制层析分离,实现了连续10 d的稳定运行。结果表明,全流程的集成控制有助于应对连续生产过程的干扰和漂移,实现稳健的工艺控制,保障稳定的产品质量。
6 结语对于单抗等生物医药行业,连续化生产是自动化、智能化升级的必由之路,也是发展的必然趋势。连续流层析是下游连续化生产的重要环节,能够提高过程效率、增强产品质量的稳定性、提高工艺的灵活性,还可以减少人为操作的失误风险,降低设备及试剂费用和人工成本。对于抗体亲和捕获,多种连续流层析模式已经成功研发,并应用于单抗产品的连续捕获,但仍需加强过程的理性设计和优化。对于抗体精制阶段,研究主要集中于2个方面,利用交叠组分循环上样以提高收率,或者将几步层析整合以简化流程,但相关研究还有待进一步完善。对于全流程的整合连续过程,目前仍处于发展阶段。
作为一项新兴技术,抗体连续生产具有显著优势,但真正实现抗体连续生产还有不少方面需要深入研究,包括更加理性的过程设计、更加高效的过程分析技术、更加精准的过程控制,特别是基于模型的预测分析和控制方法。
| [1] |
KLEIN B, CORRINGHAM R, TRIKHA M, et al. Targeted anti-interleukin-6 monoclonal antibody therapy for cancer: A review of the rationale and clinical evidence[J]. Clinical Cancer Research, 2003, 9(13): 4653-4665. |
| [2] |
MEHREN M, ADAMS G P, WEINER L M. Monoclonal antibody therapy for cancer[J]. Annual Review of Medicine, 2003, 54(1): 343-369. DOI:10.1146/annurev.med.54.101601.152442 |
| [3] |
SMITH S L. Ten years of Orthoclone OKT3(muromonab-CD3): A review[J]. Journal of Transplant Coordination, 1996, 6(3): 109-121. DOI:10.7182/prtr.1.6.3.8145l3u185493182 |
| [4] |
SCHIFF M H, BURMESTER G R, KENT J D, et al. Safety analyses of adalimumab (HUMIRA) in global clinical trials and US postmarketing surveillance of patients with rheumatoid arthritis[J]. Annals of the Rheumatic Diseases, 2006, 65(7): 889-894. |
| [5] |
ECKER D M, JONES S D, LEVINE H L. The therapeutic monoclonal antibody market[J]. mAbs, 2015, 7(1): 9-14. DOI:10.4161/19420862.2015.989042 |
| [6] |
HOLZMANN J, BALSER S, WINDISCH J. Totality of the evidence at work: The first U.S. biosimilar[J]. Expert Opinion on Biological Therapy, 2016, 16(2): 137-142. DOI:10.1517/14712598.2016.1128410 |
| [7] |
FDA. FDA approves first biosimilar for the treatment of cancer[EB/OL]. (2017)[2020-03-20]. https://www.fda.gov/news-events/press-announcements/fda-approves-first-biosimilar-treatment-cancer.
|
| [8] |
RATHORE A S, AGARWAL H, SHARMA A K, et al. Continuous processing for production of biopharmaceuticals[J]. Preparative Biochemistry and Biotechnology, 2015, 45(8): 836-849. DOI:10.1080/10826068.2014.985834 |
| [9] |
严生虎, 张稳, 沈卫, 等. 微通道中由二氯丙醇连续合成环氧氯丙烷的工艺研究[J]. 高校化学工程学报, 2014, 28(2): 352-357. YAN S H, ZHANG W, SHEN W, et al. Research on continuous synthesis of epichlorohydrin from dichloropropanol in micro-channel reactor[J]. Journal of Chemical Engineering of Chinese Universities, 2014, 28(2): 352-357. DOI:10.3969/j.issn.1003-9015.2014.02.025 |
| [10] |
陈春燕, 张俊青, 崔海娣, 等. PDMS膜生物反应器封闭循环连续发酵生产ABE[J]. 高校化学工程学报, 2013, 27(3): 469-475. CHEN C Y, ZHANG J Q, CUI H D, et al. ABE Fermentation in a continuous and closed-circulating fermentation system with PDMS membrane bioreactor[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(3): 469-475. DOI:10.3969/j.issn.1003-9015.2013.03.017 |
| [11] |
石尔, 肖泽仪, 黄卫星, 等. 硅橡胶膜生物反应器封闭循环连续发酵制造乙醇放大实验及该发酵系统的基本性能[J]. 高校化学工程学报, 2007, 21(2): 280-285. SHI E, XIAO Z Y, HUANG W X, et al. Scale-up of continuous ethanol fermentation in a silicone rubber membrane bioreactor and study on its fermentation system performance[J]. Journal of Chemical Engineering of Chinese Universities, 2007, 21(2): 280-285. DOI:10.3321/j.issn:1003-9015.2007.02.018 |
| [12] |
FDA. Modernizing the way drugs are made: A transition to continuous manufacturing[EB/OL]. (2017)[2020-03-20]. https://www.fda.gov/drugs/news-events-human-drugs/modernizing-way-drugs-are-made-transition-continuous-manufacturing.
|
| [13] |
FDA. Quality considerations for continuous manufacturing-Guidance for industry[EB/OL]. (2019)[2020-03-20]. https://www.fda.gov/media/121314/download.
|
| [14] |
SOMASUNDARAM B, PLEITT K, SHAVE E, et al. Progression of continuous downstream processing of monoclonal antibodies: Current trends and challenges[J]. Biotechnology and Bioengineering, 2018, 115(12): 2893-2907. DOI:10.1002/bit.26812 |
| [15] |
KLUTZ S, HOLTMANN L, LOBEDANN M, et al. Cost evaluation of antibody production processes in different operation modes[J]. Chemical Engineering Science, 2016, 141: 63-74. DOI:10.1016/j.ces.2015.10.029 |
| [16] |
XU S, GAVIN J, JIANG R, et al. Bioreactor productivity and media cost comparison for different intensified cell culture processes[J]. Biotechnology Progress, 2017, 33(4): 867-878. DOI:10.1002/btpr.2415 |
| [17] |
VERMASVUORI R, HURME M. Economic comparison of diagnostic antibody production in perfusion stirred tank and in hollow fiber bioreactor processes[J]. Biotechnology Progress, 2011, 27(6): 1588-1598. |
| [18] |
BiosanaPharma gets approval to start phase I clinical trial for a biosimilar version of Omalizumab[EB/OL]. (2019)[2020-03-20]. https://www.biosimilardevelopment.com/doc/biosanapharma-gets-approval-to-start-phase-i-clinical-trial-for-a-biosimilar-version-of-omalizumab-0001.
|
| [19] |
SHUKLA A A, THÖMMES J. Recent advances in large-scale production of monoclonal antibodies and related proteins[J]. Trends in Biotechnology, 2010, 28(5): 253-261. DOI:10.1016/j.tibtech.2010.02.001 |
| [20] |
SHI C, GAO Z Y, ZHANG Q L, et al. Model-based process development of continuous chromatography for antibody capture: A case study with twin-column system[J]. Journal of Chromatography A, 2020, 460936. |
| [21] |
LEE H W, CHRISTIE A, LIU J J, et al. Estimation of raw material performance in mammalian cell culture using near infrared spectra combined with chemometrics approaches[J]. Biotechnology Progress, 2012, 28(3): 824-832. DOI:10.1002/btpr.1536 |
| [22] |
卢慧丽, 林东强, 姚善泾. 抗体药物分离纯化中的层析技术及进展[J]. 化工学报, 2018, 69(1): 341-351. LU H L, LIN D Q, YAO S J. Chromatographic technology in antibody purification and its progress[J]. CIESC Journal, 2018, 69(1): 341-351. |
| [23] |
ANGARITA M, MÜLLER-SPÄTH T, BAUR D, et al. Twin-column CaptureSMB: A novel cyclic process for protein a affinity chromatography[J]. Journal of Chromatography A, 2015, 1389: 85-95. DOI:10.1016/j.chroma.2015.02.046 |
| [24] |
高宗晔, 史策, 姚善泾, 等. 双柱连续流层析亲和分离抗体的过程设计与应用[J]. 高校化学工程学报, 2019, 33(1): 123-133. GAO Z Y, SHI C, YAO S J, et al. Process design and application of twin-column continuous chromatography for antibody affinity separation[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(1): 123-133. |
| [25] |
GODAWAT R, BROWER K, JAIN S, et al. Periodic counter-current chromatography-design and operational considerations for integrated and continuous purification of proteins[J]. Biotechnology Journal, 2012, 7(12): 1496-1508. DOI:10.1002/biot.201200068 |
| [26] |
GJOKA X, ROGLER K, MARTINO R A, et al. A straightforward methodology for designing continuous monoclonal antibody capture multi-column chromatography processes[J]. Journal of Chromatography A, 2015, 1416: 38-46. DOI:10.1016/j.chroma.2015.09.005 |
| [27] |
ANGELO J, PAGANO J, MÜLLER-SPÄTH T, et al. Scale-up of twin-column periodic countercurrent chromatography for mAb purification[J]. BioProcess International, 2018, 16(4): 28-37. |
| [28] |
ÖTES O, FLATO H, RAMIREZ D V, 等. Scale-up of continuous multicolumn chromatography for the protein a capture step: From bench to clinical manufacturing[J]. Journal of Biotechnology, 2018, 281: 168-174. |
| [29] |
POLLOCK J, BOLTON G, COFFMAN J, et al. Optimising the design and operation of semi-continuous affinity chromatography for clinical and commercial manufacture[J]. Journal of Chromatography A, 2013, 1284: 17-27. DOI:10.1016/j.chroma.2013.01.082 |
| [30] |
GUIOCHON G. Fundamentals of preparative and nonlinear chromatography[M]. 2nd ed. Amsterdam: Elsevier, 2006.
|
| [31] |
FARNAN D, MORENO G T. Multiproduct high-resolution monoclonal antibody charge variant separations by pH gradient ion-exchange chromatography[J]. Analytical Chemistry, 2009, 81(21): 8846-8857. DOI:10.1021/ac901408j |
| [32] |
FEKETE S, BECK A, FEKETE J, et al. Method development for the separation of monoclonal antibody charge variants in cation exchange chromatography, Part Ⅱ: pH gradient approach[J]. Journal of Pharmaceutical and Biomedical Analysis, 2015, 102: 282-289. DOI:10.1016/j.jpba.2014.09.032 |
| [33] |
LEE Y F, JÖHNCK M, FRECH C. Evaluation of differences between dual salt-pH gradient elution and mono gradient elution using a thermodynamic model: Simultaneous separation of six monoclonal antibody charge and size variants on preparative-scale ion exchange chromatographic resin[J]. Biotechnology Progress, 2018, 34(4): 973-986. DOI:10.1002/btpr.2626 |
| [34] |
JING S Y, GOU J X, GAO D, et al. Separation of monoclonal antibody charge variants using cation exchange chromatography: Resins and separation conditions optimization[J]. Separation and Purification Technology, 2020, 235: 116136. DOI:10.1016/j.seppur.2019.116136 |
| [35] |
STEINEBACH F, ULMER N, DECKER L, et al. Experimental design of a twin-column countercurrent gradient purification process[J]. Journal of Chromatography A, 2017, 1492: 19-26. DOI:10.1016/j.chroma.2017.02.049 |
| [36] |
AUMANN L, MORBIDELLI M. A semicontinuous 3-column countercurrent solvent gradient purification (MCSGP) process[J]. Biotechnology and Bioengineering, 2008, 99(3): 728-733. DOI:10.1002/bit.21585 |
| [37] |
AUMANN L, STROEHLEIN G, MORBIDELLI M. Parametric study of a 6-column countercurrent solvent gradient purification (MCSGP) unit[J]. Biotechnology and Bioengineering, 2007, 98(5): 1029-1042. DOI:10.1002/bit.21529 |
| [38] |
AUMANN L, MORBIDELLI M. A continuous multicolumn countercurrent solvent gradient purification (MCSGP) process[J]. Biotechnology and Bioengineering, 2007, 98(5): 1043-1055. DOI:10.1002/bit.21527 |
| [39] |
MÜLLER-SPÄTH T, KRÄTTLI M, AUMANN L, et al. Increasing the activity of monoclonal antibody therapeutics by continuous chromatography (MCSGP)[J]. Biotechnology and Bioengineering, 2010, 107(4): 652-662. DOI:10.1002/bit.22843 |
| [40] |
VOGG S, ULMER N, SOUQUET J, et al. Experimental evaluation of the impact of intrinsic process parameters on the performance of a continuous chromatographic polishing unit (MCSGP)[J]. Biotechnology Journal, 2019, 14(7): 1800732. DOI:10.1002/biot.201800732 |
| [41] |
PERSSON O, ANDERSSON N, NILSSON B. Design of two-column batch-to-batch recirculation to enhance performance in ion-exchange chromatography[J]. Journal of Chromatography A, 2018, 1531: 112-121. DOI:10.1016/j.chroma.2017.11.035 |
| [42] |
KHANAL O, KUMAR V, WESTERBERG K, et al. Multi-column displacement chromatography for separation of charge variants of monoclonal antibodies[J]. Journal of Chromatography A, 2019, 1586: 40-51. DOI:10.1016/j.chroma.2018.11.074 |
| [43] |
KATEJA N, KUMAR D, GODARA A, et al. Integrated chromatographic platform for simultaneous separation of charge variants and aggregates from monoclonal antibody therapeutic products[J]. Biotechnology Journal, 2017, 12(11): 1700133. DOI:10.1002/biot.201700133 |
| [44] |
LÖFGREN A, ANDERSSON N, SELLBERG A, et al. Designing an autonomous integrated downstream sequence from a batch separation process-an industrial case study[J]. Biotechnology Journal, 2017, 13(4): 1700691. |
| [45] |
GIRARD V, HILBOLD N, NG C K, et al. Large-scale monoclonal antibody purification by continuous chromatography, from process design to scale-up[J]. Journal of Biotechnology, 2015, 213: 65-73. DOI:10.1016/j.jbiotec.2015.04.026 |
| [46] |
GJOKA X, GANTIER R, SCHOFIELD M. Transfer of a three step mAb chromatography process from batch to continuous: Optimizing productivity to minimize consumable requirements[J]. Journal of Biotechnology, 2017, 242: 11-18. DOI:10.1016/j.jbiotec.2016.12.005 |
| [47] |
ZYDNEY A L. Continuous downstream processing for high value biological products: A review[J]. Biotechnology and Bioengineering, 2016, 113(3): 465-475. DOI:10.1002/bit.25695 |
| [48] |
ICHIHARA T, ITO T, KURISU Y, et al. Integrated flow-through purification for therapeutic monoclonal antibodies processing[J]. MAbs, 2018, 10(2): 325-334. DOI:10.1080/19420862.2017.1417717 |
| [49] |
WARIKOO V, GOADWAT R, BROWER K, et al. Integrated continuous production of recombinant therapeutic proteins[J]. Biotechnology and Bioengineering, 2015, 109(12): 3018-3029. |
| [50] |
GODAWAT R, KONSTANTINOV K, ROHANI M, et al. End-to-end integrated fully continuous production of recombinant monoclonal antibodies[J]. Journal of Biotechnology, 2015, 213: 13-19. DOI:10.1016/j.jbiotec.2015.06.393 |
| [51] |
LANGER E S, RADER R A. Introduction to continuous manufacturing: Technology landscape and trends[EB/OL]. (2013)[2020-03-20]. http://www.biopharma.com/continuous.pdf
|
| [52] |
NG C K, ROUSSET F, VALERY E, et al. Design of high productivity sequential multi-column chromatography for antibody capture[J]. Food Bioproducts Process, 2014, 92(C2-0): 233-241. |
| [53] |
林东强, 史策, 姚善泾. 基于层析模型实现多柱连续流层析设计及分析的方法: CN, 110348089A[P]. 2019-10-18. LIN D Q, SHI C, YAO S J. Model-based design and analysis of multicolumn continuous chromatography: CN, 110348089A[P]. 2019-10-18. |
| [54] |
林东强, 史策, 姚善泾. 连续流层析过程模拟软件(PSCC V1.0). 计算机软件著作权登记号: 2018SR885402[CP]. 2018-11-06. LIN D Q, SHI C, YAO S J. Process simulation of continuous chromatography (PSCC V1.0): 2018SR885402[CP]. 2018-11-06. |
| [55] |
林东强, 史策, 姚善泾. 连续流层析过程模拟软件(PSCC V2.0). 计算机软件著作权登记号: 2019SR1445792[CP]. 2019-12-27. LIN D Q, SHI C, YAO S J. Process simulation of continuous chromatography (PSCC V2.0): 2019SR1445792[CP]. 2019-12-27. |
| [56] |
林东强, 史策, 姚善泾. 基于人工神经网络实现多柱连续流层析设计及分析的方法: CN, 110348090A[P]. 2019-10-18. LIN D Q, SHI C, YAO S J. AI-based design and analysis of multicolumn continuous chromatography: CN, 110348090A[P]. 2019-10-18. |
| [57] |
林东强, 史策, 姚善泾. 人工智能辅助连续流层析过程分析软件(AI-PECC V1.0). 计算机软件著作权登记号: 2019SR1402682[CP]. 2019-12-19. LIN D Q, SHI C, YAO S J. Process evaluation of continuous chromatography by artificial intelligence (AI-PECC V1.0): 2019SR1402682[CP]. 2019-12-19. |
| [58] |
SELLBERG A, ANDERSSON N, HOLMQVIST A, et al. Development and optimization of a single column analog model for a multi-column counter-current solvent gradient purification process[J]. Computer-aided Chemical Engineering, 2017, 40A: 187-192. |
| [59] |
GOTTSCHALK U, BRORSON K, SHUKLA A A. The need for innovation in biomanufacturing[J]. Nature Biotechnology, 2012, 30(6): 489-492. DOI:10.1038/nbt.2263 |
| [60] |
FONTEYNE M, VERCRUYSSE J, LEERSNYDER F D, et al. Process analytical technology for continuous manufacturing of solid-dosage forms[J]. TrAC Trends in Analytical Chemistry, 2015, 67: 159-166. DOI:10.1016/j.trac.2015.01.011 |
| [61] |
RATHORE A S, KAPOOR G. Application of process analytical technology for downstream purification of biotherapeutics[J]. Journal of Chemical Technology & Biotechnology, 2015, 90(2): 228-236. |
| [62] |
UNDEY C, LOW D, MENEZES J C, et al. PAT applied in biopharmaceutical process development and manufacturing: an enabling tool for quality-by-design[M]. Boca Raton: CRC Press, 2011.
|
| [63] |
FDA. Guidance for industry: PAT-a framework for innovative pharmaceutical development, manufacturing and quality assurance U.S.[EB/OL]. (2004)[2020-03-20]. https://www.fda.gov/media/71012/download.
|
| [64] |
RATHORE A S, PARR L, DERMAWAN S, et al. Large scale demonstration of a process analytical technology application in bioprocessing: Use of on-line high performance liquid chromatography for making real time pooling decisions for process chromatography[J]. Biotechnology Progress, 2010, 26(2): 448-457. |
| [65] |
YILMAZ D, MEHDIZADEH H, NAVARO D, et al. Application of Raman spectroscopy in monoclonal antibody producing continuous systems for downstream process intensification[J]. Biotechnology Progress, 2020, e2947. |
| [66] |
FEIDL F, GARBELLINI S, LUNA F M, et al. Combining mechanistic modeling and Raman spectroscopy for monitoring antibody chromatographic purification[J]. Processes, 2019, 7(10): 683. DOI:10.3390/pr7100683 |
| [67] |
FEIDL F, GARBELLINI S, VOGG S, et al. A new flow cell and chemometric protocol for implementing in-line Raman spectroscopy in chromatography[J]. Biotechnology Progress, 2019, 35(5): e2847. |
| [68] |
BHATIA H, READ E, AGARABI C, et al. A design space exploration for control of critical quality attributes of mAb[J]. International Journal of Pharmaceutics, 2016, 512(1): 242-252. DOI:10.1016/j.ijpharm.2016.08.046 |
| [69] |
RATHORE A S, WINKLE H. Quality by design for biopharmaceuticals[J]. Nature Biotechnology, 2009, 27(1): 26-34. DOI:10.1038/nbt0109-26 |
| [70] |
RATHORE A S, KUMAR D, KATEJA N. Recent developments in chromatographic purification of biopharmaceuticals[J]. Biotechnology Letters, 2018, 40(6): 895-905. DOI:10.1007/s10529-018-2552-1 |
| [71] |
KARST D J, STEINEBACH F, SOOS M, et al. Process performance and product quality in an integrated continuous antibody production process[J]. Biotechnology and Bioengineering, 2017, 114(2): 298-307. DOI:10.1002/bit.26069 |
| [72] |
VOGEL J H, NGUYEN H, GIOVANNINI R, et al. A new large-scale manufacturing platform for complex biopharmaceuticals[J]. Biotechnology and Bioengineering, 2012, 109(12): 3049-3058. DOI:10.1002/bit.24578 |
| [73] |
RECK J, PABST T, HUNTER A, et al. Systematic interpolation method predicts antibody monomer-dimer separation by gradient elution chromatography at high protein loads[J]. Biotechnology Journal, 2019, 14(3): 1800132. DOI:10.1002/biot.201800132 |
| [74] |
史策, 虞骥, 高栋, 等. 单抗制备的过程模拟和经济性分析[J]. 化工学报, 2018, 69(7): 3198-3207. SHI C, YU J, GAO D, et al. Process simulation and economic evaluation of monoclonal antibody production[J]. CIESC Journal, 2018, 69(7): 3198-3207. |
| [75] |
KUMAR V, RATHORE A S. Mechanistic modeling based PAT implementation for ion-exchange process chromatography of charge variants of monoclonal antibody products[J]. Biotechnology Journal, 2017, 12(9): 1700286. DOI:10.1002/biot.201700286 |
| [76] |
GUÉLAT B, STRÖHLEIN G, LATTUADA M, et al. Simulation model for overloaded monoclonal antibody variants separations in ion-exchange chromatography[J]. Journal of Chromatography A, 2012, 1253: 32-43. DOI:10.1016/j.chroma.2012.06.081 |
| [77] |
STEINEBACH F, KRÄTTLI M, STORTI G, et al. Equilibrium theory based design space for the multicolumn countercurrent solvent gradient purification process[J]. Industrial & Engineering Chemistry Research, 2017, 56(45): 13482-13489. |
| [78] |
LEE Y F, KLUTERS S, HILLMANN M, et al. Modeling of bispecific antibody elution in mixed-mode cation-exchange chromatography[J]. Journal of Separation Science, 2017, 40(18): 3632-3645. DOI:10.1002/jssc.201700313 |
| [79] |
SHEKHAWAT L K, CHANDAK M, RATHORE A S. Mechanistic modeling of hydrophobic interaction chromatography for monoclonal antibody purification: process optimization in the quality by design paradigm[J]. Journal of Chemical Technology & Biotechnology, 2017, 92(10): 2527-2537. |
| [80] |
FEIDL F, VOGG S, WOLF M, et al. Process-wide control and automation of an integrated continuous manufacturing platform for antibodies[J]. Biotechnology and Bioengineering, 2020, 117(5): 1367-1380. DOI:10.1002/bit.27296 |




