2. 华南理工大学 制浆造纸工程国家重点实验室,广东 广州 510640
2. State Key Laboratory of Pulp and Paper Engineering, South China University of Technology, Guangzhou 510640, China
半纤维素广泛存在于高等植物的细胞壁中[1],在自然界中的储量丰富。作为一种非均一性多糖,半纤维素的功能衍生物可广泛用于造纸、食品、洗涤剂和制药等工业领域[2]。化学工业中作为表面活性剂;造纸工业中作为纸张添加剂,以增加纸张强度并改善漂白效果;食品工业中作为食品胶、增稠剂和黏合剂;生物制药业中用来生产新型药物,这些药物具有增强免疫能力、抑制恶性肿瘤或抗凝血能力[3]。
在硫酸盐法溶解浆的生产过程中,半纤维素在预处理工段被大量脱除,工业预水解液中的半纤维素衍生糖含量为2%~3 %[4],对其进行有效的分离再利用,既可减轻对环境的污染,也可为企业带来额外的经济效益。
半纤维素不溶于乙醇,乙醇沉淀分离预水解液中的半纤维素研究应用较多。乙醇法沉淀半纤维素时,高分子量的半纤维素会析出,而大部分低分子量的半纤维素会保留在乙醇溶液中[5-9],陈晓倩等人对乙醇加入量、反应温度和pH值对沉淀量的影响进行了优化[10]。预水解液中除了溶解性半纤维素外,还有一定量的木质素,它们含有较多的游离酚羟基,容易和半纤维素形成氢键连接,在乙醇法沉淀半纤维素时和半纤维素一同沉淀出来,存在于半纤维素产品中[10]。木质素的存在不利于半纤维素产品的加工和利用,利用酸析木质素的方法可去除部分溶解性木质素,目前酸析木质素的方法被广泛用于制浆造纸工业[11]。除酸析法去除木质素之外,离子交换柱层析法[12]、凝胶层析法[13]、膜纯化法[14]、活性炭吸附法[15-17]、树脂吸附法[18]、生石灰吸附法[19]、聚合氯化铝絮凝法[20-21]和聚氧化乙烯絮凝法[22-23]也被用来去除预水解液中木质素。其中离子交换柱层析法、凝胶层析法、膜纯化法、活性炭吸附法和树脂吸附法成本较高不适合工业化应用;生石灰吸附法在去除木质素的同时会伴随大量半纤维素的损失;聚合氯化铝絮凝法和聚氧化乙烯絮凝法成本较低且聚糖的损失率较低,具有较高的工业应用前景。
预水解液中存在的木质素与碱法制浆黒液中木质素含量和性质差别较大,酸析的方法对于脱除预水解液中的木质素作用有限,而酸化/聚氧化乙烯絮凝处理结合的方法可显著提高预水解液中木质素的脱除[24],且相对于离子交换柱层析等方法相比,具有成本低、流程简单、条件温和等特点,便于工业化应用。本研究进行不同P因子强度下的预水解处理,确定最佳乙醇沉淀半纤维素的预水解P因子,采用酸化/聚氧化乙烯絮凝处理结合的方法来脱除预水解液中的木质素,再进行碱化处理,研究其对回收半纤维素得率、纯度及分子量的影响,以此为工业预水解液的利用提供实验室数据参考。
2 实验 2.1 实验原料实验所用木片越南相思木木片(未经预抽提),产地越南,储存期1年,木片主要化学成分为:葡萄糖,41.30%;木糖,20.12%;甘露糖,3.21%;半乳糖,0.95%;阿拉伯糖,0.72%;总糖含量,66.30%;Klason木质素,17.88 %;酸溶木质素,2.41%;苯醇抽提物,13.08%;灰分,0.41%。
2.2 主要试剂无水乙醇(分析纯,天津科密欧公司)、98%浓硫酸、聚氧化乙烯(PEO,分子量200 k,购自上海攻碧克公司)。木糖、葡萄糖、阿拉伯糖、半乳糖以及甘露糖为色谱级标准品,购自Sigma-Aldrich。
2.3 主要仪器电热鼓风干燥箱(101-2AB,天津市泰斯特仪器有限公司)、马弗炉(SX-4-10,天津市泰斯特仪器有限公司)、电磁搅拌器(KMS-181E,上海精凿科技有限公司)、电子天平(ME104E,梅特勒-托利多仪器有限公司)、离子色谱仪(ICS-5000+,美国戴安公司)、紫外-可见光谱仪(V1500-PC,美国戴安公司)、凝胶渗透色谱仪(2414-2515,waters公司)、真空旋转蒸发器(RV10,德国IKA公司)、高温蒸煮锅(ZQS-15,陕西科技大学仪器制造厂)、冷冻干燥机(LGJ-15D,宁波新芝生物科技股份有限公司)、实验室pH计(FE20,梅特勒-托利多仪器有限公司)、低速离心机(DT5-1,北京时代北利离心机有限公司)。
2.4 试验方法 2.4.1 半纤维素沉淀分离(1) 预水解液制备
取绝干木片100 g,装入1 L蒸煮罐内,液比1:4,加盖旋紧后,放入高温蒸煮锅内,保持腔体内液位,密封蒸煮锅后,设置温度170 ℃。
P因子是上世纪六七十年代由BRASH等人提出,用来表征预水解强度,类似于蒸煮H因子的概念,从而将预水解温度和时间两个因素综合为一个变量,SIXTA等进一步阐述了P因子的概念,并在基于碳水化合物糖苷键断裂活化能的基础上给出了P因子的计算公式,用于指导预水解工艺条件的制订[25]。
若升温速率恒定,则可根据辛普森展开式计算,且总的P因子为升温阶段和保温阶段的P因子之和。P因子的计算如式(1):
| $ P = \int_0^t {\exp (4\;048 - \frac{{15\;106}}{T}} )dT \\ \approx \frac{t}{6}[\exp (4\;048 - \frac{{15\;106}}{{{T_0}}} + 4 \times \\ (40.48 - 2 \times \frac{{15\;106}}{{{T_0} + T}}) + \exp (40.48 - \frac{{15\;106}}{T})] \\ $ | (1) |
式中:T0为初始温度,K;T为任意时刻的温度,K;t为由T0升温至T的所需时间,h。
通过控制保温时间,获得不同P因子的预水解液,共设置10个P因子,即90、120、160、200、235、300、500、700、900、1 100。
(2) 不同P因子预水解液分离沉淀半纤维素
取10组不同P因子的预水解液各100 mL,按体积比1:8加入800 mL乙醇,静置1 h。使用低速离心机(4 000 str·min-1,10 min)分离半纤维素。使用冷冻干燥机将样品干燥1 d,称重。在完成对半纤维素样品的分析后,确定最佳的预水解强度即最佳的P因子,记为A。
(3) 不同ET-PHL体积比条件下沉淀分离半纤维素
取P因子为200的预水解液600 mL,分为6组,每组100 mL。分别按体积比2、4、6、8、10、12向6组预水解液中加入200、400、600、800、1 000、1 200 mL的乙醇,静置1 h。使用低速离心机(4 000 str·min-1,10 min)分离半纤维素。使用冷冻干燥机将样品干燥1 d,称重。在完成对半纤维素样品的分析后,确定最佳的ET-PHL体积比,记为B。
(4) 不同浓缩比条件下沉淀分离半纤维素
取P因子为200的预水解液500 mL,分为5组,每组100 mL。使用真空旋转蒸发器分别对预水解液样品进行浓缩(预水解液减少的体积按百分比计算,记为浓缩比),分别浓缩10%、30%、50%、70%、90%。向浓缩后的预水解液按体积比B加入乙醇,静置1 h。使用低速离心机(4 000 str·min-1,10 min)分离半纤维素。使用冷冻干燥机将样品干燥1 d,称重。在完成对半纤维素样品的分析后,确定最佳的浓缩比记为C。
(5) 不同酸化条件下沉淀分离半纤维素
取P因子为200的预水解液500 mL,按浓缩比C进行浓缩,按体积平均分为5组。其中1组不进行处理,剩余4组使用浓硫酸分别酸化至pH值为3.0、2.5、2.0、1.5,使用离心机(4 000 str·min-1,10 min)离心分离析出的木质素。向5组预水解液中按体积比B加入乙醇,静置1 h。使用低速离心机(4 000 str·min-1,10 min)分离半纤维素。使用冷冻干燥机将样品干燥1 d,称重。在完成对半纤维素样品的分析后,确定最佳的pH值,记为D。
(6) 不同PEO浓度下沉淀分离半纤维素
取P因子为200的预水解液500 mL,按浓缩比C进行浓缩.使用浓硫酸酸化至pH值为D。使用低速离心机(4 000 str·min-1,10 min)离心分离析出的木质素。将经酸化处理后的预水解液按体积平均分为5组,分别向其中加入质量分数为10%的PEO溶液,使其中的PEO质量浓度分别为100、200、300、400、500 mg·L-1,之后使用电磁搅拌器在转速350 str·min-1下搅拌10 min。搅拌完成后,使用低速离心机(4 000 str·min-1,10 min)离心分离析出的不溶物。向5组预水解液中按体积比B加入乙醇,静置1 h。使用低速离心机(4000 str·min-1,10 min)分离半纤维素。使用冷冻干燥机将样品干燥1 d,称重。在完成对半纤维素样品的分析后,确定最佳的PEO浓度,记为E。
(7) 不同碱化pH值下沉淀分离半纤维素
取P因子为200的预水解液600 mL,按浓缩比C进行浓缩,使用浓硫酸酸化至pH值为D,再向其中加入质量分数为10%的PEO溶液,使其中的PEO质量浓度为E,之后使用电磁搅拌器在转速350 str·min-1下搅拌10 min。使用低速离心机(4 000 str·min-1,10 min)离心分离析出的不溶物。将经PEO絮凝处理后的预水解液按体积平均分为6份,其中一组不进行碱化处理,然后使用3 mol·L-1的NaOH溶液对剩余的5份预水解液进行碱化处理,分别碱化至pH值为4.0、6.0、8.0、10.0、12.0,再向5组预水解液中按体积比B加入乙醇,静置1 h。使用低速离心机(4 000 str·min-1,10 min)分离半纤维素。使用冷冻干燥机将样品干燥1 d,称重。在完成对半纤维素样品的分析后,确定最佳的pH值,记为F。
2.4.2 实验样品组分检测及计量方法pH值:实验过程中预水解液样品pH值是使用实验室pH计在室温下测定。
固含量及灰分:固含量及灰分均使用瓷坩埚,配合使用电子天平、电热鼓风干燥箱和马弗炉测定,烘箱温度105 ℃,马弗炉灼烧温度为575 ℃、时间为8 h。
木质素:根据TAPPI UM250标准,使用紫外-可见光谱仪,在205 nm处测定吸光度,然后按照标准中方法计算得出。
半纤维素:预水解液以及半纤维素产品中半纤维素含量以阿拉伯糖、半乳糖、葡糖糖、木糖和甘露糖之和,即总中性糖含量来表征,使用离子色谱进行检测。离子色谱仪检测条件:ED5000电化学检测器,分析柱为CarboPacTMPA20(150 mm×3 mm),保护柱为CarboPacTM PA20(30 mm×3 mm),柱温30 ℃;洗脱液为0.2 mol·L-1 NaOH溶液,流速1 mL·min-1[26]。
分子量:半纤维素产品的分子量使用水系凝胶渗透色谱进行检测,用重均分子量来表征。凝胶渗透色谱仪检测条件:流动相为0.1 mol·L-1的NaNO3溶液,流速1.0 mL·min-1,色谱柱为UltraStyragel™120与UltraStyragel™250(串联),柱温50 ℃。
半纤维素产品得率及纯度计量方法:得率以每升预水解液乙醇沉淀得到的半纤维素的质量表示,单位g·L-1;纯度以半纤维素产品中中中性糖含量表示,单位%。
3 结果与讨论 3.1 预水解液成分分析在预水解过程中,随着水解的进行植物原料中的木质素、半纤维素以及其他少量组分溶出,并且在高温热水体系中,乙酰化的半纤维素会发生脱乙酰反应,生成乙酸从而使预水解液呈现酸性,并且在酸的催化下,部分半纤维素还会转化为糠醛[27]。表 1中的数据显示,P因子从90增大到1 100时,预水解液的pH值从3.57逐渐减小到了3.03,总聚糖和总中性糖含量先增加后减小并在P因子500和700时达到最大值16.81和22.17 g·L-1。
|
|
表 1 预水解液中主要成分含量及pH值 Table 1 Contents of main components in the pre-hydrolysis liquor and related pH values |
P因子从90到1 100,木质素的含量从2.55 g·L-1逐渐增大到了8.49 g·L-1,但是在这个过程中木质素增加呈现出一种逐渐减缓的趋势,产生这一现象的主要原因可能是在高温预水解的过程中,部分溶出的脂类物质和缩合的木质素粘附在木片的表面,导致后续细胞壁组分溶出困难[27]。
3.2 预水解强度对半纤维素沉淀分离的影响图 1(a)和图 1(b)结果显示,随着P因子的增大,半纤维素得率先上升后下降,在P因子为200时达到最大值3.43 g·L-1,但是在P因子200前后,呈现急剧上升然后急剧下降的趋势。产生这种现象的原因可能是在预水解初期预水解液中半纤维素含量较小,随着预水解的进行半纤维素含量迅速增大,得率呈现迅速上升的趋势,但与此同时半纤维逐渐降解,导致分子量降低,在P因子大于200之后,尤其是大于300之后,半纤维素分子量下降至3 000以下,难以从乙醇-水体系中分离出来。P因子在120~500时半纤维素产品里中性糖的含量65.57%~73.04%波动,但在P因子大于500后从73.04%逐渐下降到了47.11%,而木质素的含量在整个范围内基本没有变化。因此,预水解条件控制在P因子为200时,最有利于乙醇分离预水解液中的半纤维素。
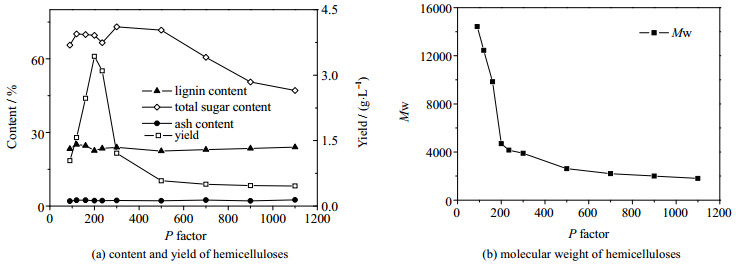
|
图 1 不同P因子条件下分离沉淀的半纤维素组分含量、得率及分子量 Fig.1 Component contents, yields and molecular weights of hemicelluloses precipitated under different P factors |
图 2(a)数据显示,体积比从2增大到10时,半纤维素的得率从0.21增大到了3.61 g·L-1,而体积比从10增大到12时,半纤维素的得率仅从3.61增大到了3.66 g·L-1。半纤维素产品的总中性糖和木质素的含量变化很小,总中性糖含量在69.57%~74.66%,木质素含量在20.4%~24.0%。从图 2(b)凝胶色谱结果可以看出随着体积比的增大,半纤维素产品的分子量呈下降的趋势。图 2数据说明随着体积比的增大,乙醇和预水解液的混合溶液体系更加偏向于乙醇溶液,因而有更小分子量的半纤维素溶出,半纤维素的得率增加。因此,综合经济的角度考虑,体积比10作为乙醇沉淀半纤维素最优条件。
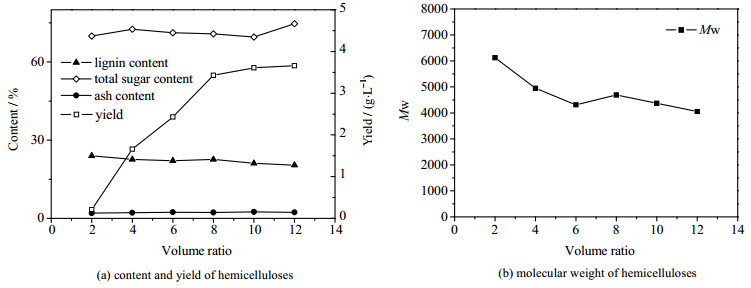
|
图 2 不同体积比下分离沉淀的半纤维素组分含量、得率及分子量 Fig.2 Component contents, yields and molecular weights of hemicelluloses precipitated under different volume ratios |
图 3显示,浓缩比从10%增大到90%,半纤维素产品中的总糖含量在69.13%~72.82%波动,木质素的含量在20.6%~25.0%波动,但半纤维素产品的得率从3.7增到到了6.1 g·L-1,提高了64.9%,这说明增大半纤维素的浓度,可以在使用较少乙醇溶剂的情况下提高得率,且不会造成半纤维素产品纯度的明显变化。从图 3(b)中还可以看出随着浓缩比的增大,半纤维素产品的分子量呈下降的趋势,这可能是分子量更小的低聚糖沉淀出来,从而使半纤维素产品得率提高,重均分子量下降。在浓缩比达到90%以上时,水分的蒸发变得较为困难,需要更长的时间来提高浓缩分数,且预水解液变得黏稠,蒸发能耗变高,流动性变差,不利于输送,因此本研究将90%作为最优的浓缩比。
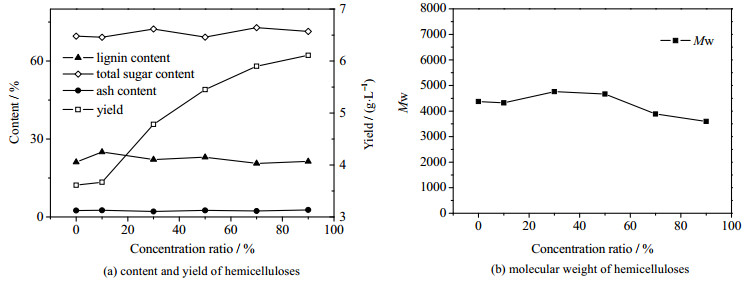
|
图 3 不同浓缩下分离沉淀的半纤维素组分含量、得率及分子量 Fig.3 Component contents, yields and molecular weights of hemicelluloses precipitated under different concentrating percentages |
在乙醇法沉淀半纤维素时,部分木质素会伴随着半纤维素共同沉淀下来降低半纤维素的纯度,影响半纤维素的利用。这是由于含有酚羟基的游离的木质素会和半纤维素形成氢键作用,在氢键的作用下,木质素伴随着半纤维素共同沉淀出来[1]。酸化的方法脱除预水解液中部分木质素后,半纤维素产品中的木质素含量有所减少。从图 4(a)可以看出,pH值从3.47下降到2.0后,半纤维素产品中的木质素含量从21.4%下降到了14.1%,但是pH值从2.0下降到1.5后,木质素含量下降到了13.7%,仅下降了0.4%。pH值从3.0下降到2.0时,半纤维素产品的得率从6.06下降到了5.43 g·L-1,pH值从2.0下降到了1.5后,得率从5.43下降到了5.37 g·L-1,与此同时在整个过程中,总糖的含量从71.38%平缓上升到了79.38%,但灰分含量也从2.72%上升到了10.77%。图 4(b)数据还说明,酸化对于半纤维素分子量的影响很小,这从另一个角度说明了酸化主要作用是去除木质素,而对单位预水解液沉淀的半纤维素中总糖的绝对质量并无明显影响。考虑到在酸化至pH值2.0后进一步酸化的酸的用量陡增,且对于木质素并无明显的去除作用,对于纯度也并无明显提升,同时考虑到后续PEO絮凝处理时,pH值低于2.0会影响絮凝效果[24],因此以pH值2.0作为酸化的最优值。
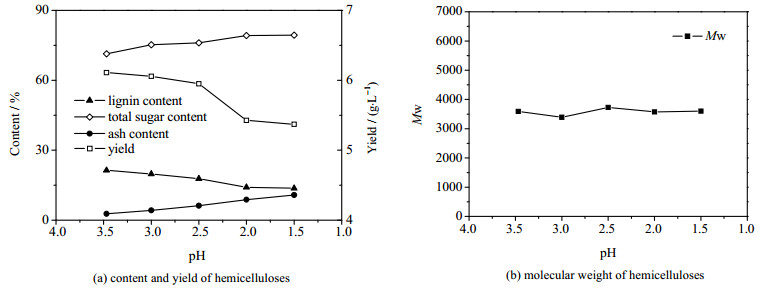
|
图 4 酸化步骤不同pH值下分离沉淀的半纤维素组分含量、得率及分子量 Fig.4 Component contents, yields and molecular weights of hemicelluloses precipitated under different acidification pH values |
酸化/PEO絮凝处理脱除木质素的机理和效果已在课题组前期研究中得到证实[24]。从图 5(a)可以看出,酸化结合PEO絮凝处理后,PHL中的木质素含量从22.63下降到了18.01 g·L-1,半纤维素的得率从5.35下降到了4.98 g·L-1,但半纤维素产品中木质素含量下降到了7.11%,同时半纤维素产品纯度上升到了85.5%。从图 5(a)还可以看出,PEO浓度大于400 mg·L-1后,半纤维素产品的得率、纯度灰分以及木质素含量变化很小。图 5(b)的结果显示PEO絮凝处理对半纤维素产品的分子量并无明显影响,说明PEO絮凝处理主要作用是木质素,对聚糖的沉淀无影响。因此以400 mg·L-1作为最佳的PEO浓度。
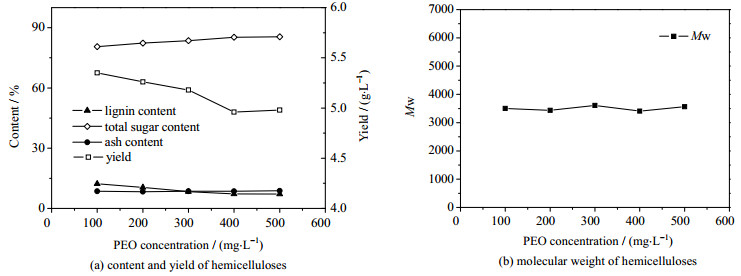
|
图 5 不同浓度PEO絮凝处理后分离沉淀的半纤维素组分含量、得率及分子量 Fig.5 Component contents, yields and molecular weights of hemicelluloses precipitated under different PEO concentrations |
经酸化/PEO絮凝处理后的PHL再碱化,半纤维素的得率得到了极大的提升,pH值从2增大到12时,半纤维素的得率从4.98增大到了12.74 g·L-1,但是在半纤维素产品中的木质素含量有所升高,从7.0%升高到了10.7%,灰分含量从8.55%升高到了20.10%。从图 6(a)可以看出,pH值由6增大到10的过程中,灰分仅由11.12%增大到了12.43%,同时得率和纯度变化不大,但是pH值由10增到12时,灰分由12.43%增大到了20.10%。碱化处理在提高半纤维素得率的同时也引入了较多的无机盐,使得灰分的含量增加,不利于半纤维素的利用。同时从图 6(b)中可以看到半纤维素产品的重均分子量呈下降的趋势,这正如前文所述,可能是由于更多的较小分子量的低聚糖沉淀出来,导致重均分子量呈现下降的趋势。综合用碱量及灰分控制的考虑,研究将6作为在酸化/PEO絮凝处理后碱化操作的最优pH值,在提高得率的同时控制灰分的含量,以利于半纤维素产品的利用。
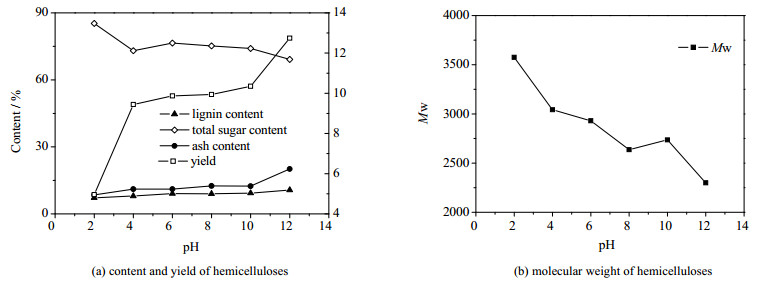
|
图 6 碱化步骤不同pH值下分离沉淀的半纤维素的组分含量、得率及分子量 Fig.6 Component contents, yields and molecular weights of hemicelluloses precipitated under different alkalization pH values |
(1) 乙醇法提取相思木预水解液半纤维素的最佳条件为P因子200、ET-PHL体积比10、浓缩比90%。
(2) 在结论(1)条件下将相思木预水解液酸化至2.0再在400 mg·L-1的PEO浓度下进行絮凝处理可达到85.2%的半纤维素产品纯度,再碱化至pH值为6可达到9.87 g·L-1的半纤维素产品得率。
(3) 酸化/PEO絮凝处理结合的方法可有效去除相思木预水解液中木质素、提高半纤维素产品的纯度。
(4) 碱化可提高相思木预水解液中半纤维素的提取率,但同时存在灰分含量显著增加的问题,为半纤维素产品的利用带来了干扰。
| [1] |
LIU Z, NI Y, FATEHI P, SAEED A. Isolation and cationization of hemicelluloses from pre-hydrolysis liquor of kraft-based dissolving pulp production process[J]. Biomass & Bioenergy, 2011, 35(5): 1789-1796. |
| [2] |
任俊莉, 孙润仓, 刘传富. 半纤维素及其衍生物作为造纸助剂的应用研究进展[J]. 生物质化学工程, 2006, 40(1): 35-39. REN J L, SUN R C, LIU C F. Progress of application of hemicellulose and its derivatives as additives in papermaking[J]. Biomass Chemical Engineering, 2006, 40(1): 35-39. DOI:10.3969/j.issn.1673-5854.2006.01.010 |
| [3] |
孙润仓.木质素及半纤维素利用产业化展望[A].北京: 第176场中国工程科技论坛. 2013. SUN R C. Prospects for the industrialization of lignin and hemicellulose utilization[A]. Beijing: 176th China Engineering Science and Technology Forum. 2013. |
| [4] |
段超, 冯文英, 张艳玲, 等. 热水预水解对杨木半纤维素提取及后续硫酸盐法制浆的影响[J]. 中国造纸学报, 2013, 28(2): 1-7. DUAN C, FENG W Y, ZHANG Y L, et al. Effect of autohydrolysis on pre-extraction of hemicelluloses and subsequent kraft pulping of triploid poplar[J]. Transactions of china pulp and paper, 2013, 28(2): 1-7. DOI:10.3969/j.issn.1000-6842.2013.02.001 |
| [5] |
BIAN J, PENG F, PENG P, et al. Isolation and fractionation of hemicelluloses by graded ethanol precipitation from Caragana korshinskii[J]. Carbohydrate Research, 2010, 345(6): 802-809. DOI:10.1016/j.carres.2010.01.014 |
| [6] |
KOIVULA E, KALLIOINEN M, SAINIO T, et al. Enhanced membrane filtration of wood hydrolysates for hemicelluloses recovery by pretreatment with polymeric adsorbents[J]. Bioresource Technology, 2013, 143(17): 275-281. |
| [7] |
邓永红, 王婷, 钱勇, 等. 竹浆黑液高效减水剂与木质素磺酸钠的吸附行为对比[J]. 高校化学工程学报, 2016, 30(2): 477-483. DENG Y H, WANG T, QIAN Y, et al. Comparison of absorption performance between GCL1-JB and SL[J]. Journal of Chemical Engineering of Chinese Universities, 2016, 30(2): 477-483. DOI:10.3969/j.issn.1003-9015.2016.02.033 |
| [8] |
KOIVULA E, KALLIOINEN M, PREIS S, et al. Evaluation of various pre-treatment methods to manage fouling in ultrafiltration of wood hydrolysates[J]. Separation and Purification Technology, 2011, 83(1): 50-56. |
| [9] |
SHEN J, KAUR I, BAKTASH M M, et al. A combined process of activated carbon adsorption, ion exchange resin treatment and membrane concentration for recovery of dissolved organics in pre-hydrolysis liquor of the kraft based dissolving pulp production process[J]. Bioresource Technology, 2013, 127(1): 59-65. |
| [10] |
CHEN X Q, WANG Z J, FU Y J, et al. Specific lignin precipitation for oligosaccharides recovery from hot water wood extract[J]. Bioresource Technology, 2014, 152(1): 31-37. |
| [11] |
TANG X. Extraction of lignin in paper-mill black liquor by acidification[J]. Research of Environmental Sciences, 1996, 9(4): 60-62. |
| [12] |
WANG Z J, JIANG J G, WANG X J, et al. Selective removal of phenolic lignin derivatives enables sugars recovery from wood prehydrolysis liquor with remarkable yield[J]. Bioresource Technology, 2014, 174(7): 198-203. |
| [13] |
KRAWCZYK H, ARKELL A, JONSSON A S. Impact of prefiltration on membrane performance during isolation of hemicelluloses extracted from wheat bran[J]. Separation and Purification Technology, 2013, 116: 192-198. DOI:10.1016/j.seppur.2013.05.039 |
| [14] |
KIM J, AKEPRATHUMCHAI S, WICKRAMASINGHE S R. Flocculation to enhance microfiltration[J]. Journal of Membrane Science, 2001, 182(1/2): 161-172. |
| [15] |
LIU X, FATEHI P, NI Y H. Removal of inhibitors from pre-hydrolysis liquor of kraft based dissolving pulp production process using adsorption and flocculation processes[J]. Bioresource Technology, 2012, 116(7): 492-496. |
| [16] |
LIU X, FATEHI P, NI Y H. Adsorption of lignocelluloses dissolved in pre-hydrolysis liquor of kraft based dissolving pulp process on oxidized activated carbons[J]. Industrial and Engineering Chemistry Research, 2011, 50(20): 11706-11711. DOI:10.1021/ie201036q |
| [17] |
FATEHI P, RYAN J, NI Y H. Adsorption of lignocelluloses of model pre-hydrolysis liquor on activated carbon[J]. Bioresource Technology, 2013, 131(11): 308-314. |
| [18] |
SCHWARTZ T, LAWOKO M. Removal of acid soluble lignin from biomass extracts using Amberlite XAD-4 resin[J]. Bioresources, 2010, 5(4): 2337-2347. |
| [19] |
SHI H Q, FATEHI P, XIAO H N, et al. A process for isolating lignin of pre-hydrolysis liquor of kraft pulping process based on surfactant and calcium oxide treatments[J]. Biochemical Engineering Journal, 2012, 68(42): 19-24. |
| [20] |
YASARLA L R, RAMARAO B V. Dynamics of flocculation of ligno-cellulosic hydrolyzates by polymers[J]. Industrial and Engineering Chemistry Research, 2012, 51(19): 6847-6861. DOI:10.1021/ie202567c |
| [21] |
DUARTE G V, RAMARAO B V, AMIDON T E. Polymer induced flocculation and separation of particulates from extracts of lignocellulosic materials[J]. Bioresource Technology, 2010, 101(22): 8526-8534. DOI:10.1016/j.biortech.2010.05.079 |
| [22] |
YASARLA L R, RAMARAO B V. Lignin removal from lignocellulosic hydrolyzates by flocculation with polyethylene oxide[J]. Journal of Biobased Materials and Bioenergy, 2013, 7(6): 684-689. DOI:10.1166/jbmb.2013.1398 |
| [23] |
SAEED A, FATEHI P, NI Y H. Chitosan as a flocculant for pre-hydrolysis liquor of kraft based dissolving pulp production process[J]. Carbohydrate polymers, 2011, 86(4): 1630-1636. DOI:10.1016/j.carbpol.2011.06.075 |
| [24] |
SHI H Q, FATEHI P, XIAO H N, et al. A combined acidification/PEO flocculation process to improve the lignin removal from the pre-hydrolysis liquor of kraft-based dissolving pulp production process[J]. Bioresource Technology, 2011, 102(8): 5177-5182. DOI:10.1016/j.biortech.2011.01.073 |
| [25] |
SIXTA H A. Handbook of pulp:Kraft pulping kinetics[M]. Weinheim: WILEY-VCH, 2006: 185.
|
| [26] |
LI H M, Saeed A, Jahan M, et al. Hemicellulose removal from hardwood chips in the pre-hydrolysis step of the kraft-based dissolving pulp production process[J]. Journal of Wood Chemistry and Technology, 2010, 30(1): 48-60. |
| [27] |
MA X J, CAO S L, LIN L, et al. Surface characterizations of bamboo substrates treated by hot water extraction[J]. Bioresource Technology, 2013, 136(12): 757-760. |




