近年来,含铬废水大量排放所致的环境污染问题日渐严重。由于六价铬(Cr(Ⅵ))在水溶液中具有高度可溶性,迁移性,渗透性[1],对细胞具有致畸、致癌的作用,对人类健康造成严重威胁[2-3]。研究发现某些环境微生物能够将有毒的Cr(Ⅵ)还原为低毒的Cr(Ⅲ),并且具有环境友好、成本低等优点而备受关注。铬还原微生物还原Cr(Ⅵ)的效率普遍受到环境因素的影响,列如pH、盐度、Cr(Ⅵ)浓度等。Cr(Ⅵ)对铬还原菌产生毒性,主要与胞内活性氧簇(ROS)的生成密切相关[4]。Cr(Ⅵ)进入到微生物胞内被还原产生中间体Cr(V),Cr(V)并不稳定,易被重新氧化成Cr(Ⅵ),并诱发ROS的生成[5]。过量的ROS会导致细胞蛋白结构的破坏,脂质氧化,以及DNA损伤,并会刺激细胞增强抗氧化酶的表达。Penibacillus胞内超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性随着Cr(Ⅵ)浓度(0~200 mg·L-1)的增加呈现出先增后减的趋势,并显著高于无Cr(Ⅵ)的情况[6]。同样地,菌株Bacillus胞内的SOD酶和CAT酶的活性虽增强,脂质氧化水平却仍然呈现上升的趋势[7]。Mn2+是许多微生物消除ROS的重要物质[8],其主要参与细胞内Mn-SOD酶的组成,并调节SOD酶的转录翻译或稳定酶活性的作用[9],增强SOD酶活性清除超氧阴离子(O2•-),并通过氧化物酶催化分解O2•-歧化产物过氧化氢(H2O2)和水[10],降低丙二醛(MDA)含量,从而缓解氧化胁迫,减小氧化损伤。然而,前人研究关于Cr(Ⅵ)浓度、胞内ROS含量、胞内抗氧化酶活性以及Cr(Ⅵ)还原效率的关系尚未阐述清楚,通过外源添加Mn2+促进铬还原菌的抗氧化能力并提高Cr(Ⅵ)还原效率进行反向验证也鲜有报道。
本研究从自然界中筛选具有还原Cr(Ⅵ)能力的Cr(Ⅵ)还原菌,并探讨该菌株还原Cr(Ⅵ)的特性及其对Cr(Ⅵ)诱导的氧化胁迫响应等特征。研究建立Cr(Ⅵ)浓度、胞内ROS含量、胞内抗氧化酶活性以及Cr(Ⅵ)还原率的关系,探究Cr(Ⅵ)还原菌对Cr(Ⅵ)诱导的氧化胁迫的响应,并考察外源添加Mn2+对Cr(Ⅵ)还原菌抗氧化能力以及Cr(Ⅵ)还原效率的影响。
2 实验(材料与方法) 2.1 实验材料主要实验试剂:Tryptone、Yeast Extract,英国OXOID.LTD;重铬酸钾、四水合氯化锰、30%过氧化氢,分析纯,国药集团化学试剂有限公司;盐酸羟胺、氯化钠、对氨基苯磺酸、山梨醇、七水合硫酸亚铁、氢氧化钠,分析纯,上海泰坦科技股份有限公司;二苯碳酰二肼、硫酸铵、硫酸、盐酸,分析纯,上海凌峰化学试剂有限公司;α-萘胺,分析纯,上海阿拉丁生化科技股份有限公司;二甲酚橙,分析纯,上海麦克林生化科技有限公司。
主要实验仪器:UV-2102C紫外可见分光光度计,上海尤尼柯仪器公司;H2050R湘仪台式高速大容量冷冻离心机,长沙高新技术湘仪离心机仪器有限公司;SC-15数控超级恒温槽,新芝生物科技股份有限公司;ECLIPSE 50i,正置生物显微镜,Nikon;LDZX-75KBS立式压力蒸汽灭菌器,上海申安医疗器械厂。
2.2 菌种的分离与鉴定样品采集自上海植物园河道污泥,将稀释好的污泥加入含Cr(Ⅵ)的LB培养基中,30 ℃培养24 h。初步得到耐Cr(Ⅵ)的细菌,从中吸取富集液加入到新鲜含Cr(Ⅵ)培养基,重复上述操作2次。采用稀释涂布法并挑取单菌落加入到新鲜的含100 mg·L-1 Cr(Ⅵ)的培养基中培养,并置于恒温培养箱中30 ℃培养24 h,分别测定Cr(Ⅵ)还原效率,挑取还原效率较强的菌株做后续研究。
16S rDNA序列分析由上海美吉生物医药科技有限公司完成的。将测序好的序列通过在线的NCBI BLAST与Genebank序列数据库进行同源性序列对比分析。利用MEGA 6.0软件,以邻接法选取不同种属的菌种建立系统发育树。
2.3 Cr(Ⅵ)还原实验实验培养基成分包括(g·L-1):Yeast Extract 10.0;Peptone 10.0;NaCl 5.0,初始pH 8.0。选用重铬酸钾配制初始Cr(Ⅵ)浓度为200 mg·L-1的含Cr(Ⅵ)废水,用于本文的实验研究。为了探究pH对铬还原菌生长及Cr(Ⅵ)还原效率的影响,用NaOH和HCl将实验培养基的初始pH值调整为6.0、7.0、8.0、9.0、10.0。为了探究盐度对该菌生长及Cr(Ⅵ)还原效率的影响,将实验培养基中NaCl浓度设为0、5、10、20、40、60 g·L-1。为了探究初始Cr(Ⅵ)浓度对该菌生长及Cr(Ⅵ)还原效率的影响,将初始Cr(Ⅵ)浓度分别设定为200、300和400 mg·L-1。所有试验均置于摇床30 ℃ 150 r·min-1条件下培养24 h时,取样并测定Cr(Ⅵ)浓度和菌体生长量,所有实验重复3遍。
2.4 Cr(Ⅵ)浓度和菌体干重的测定Cr(Ⅵ)浓度采用二苯碳酰二肼分光光度法[11]。收集菌体分两组,一组采用分光光度计于600 nm处测定OD值,将另一组菌体烘干至干重并称量,并建立两者之间线性关系,其关系式为菌体干重(g·L-1) = 0.368 3×OD600。
2.5 胞内提取液的制备取5 mL细胞培养液,收集的菌体用无菌pH 7.4的10 mmol·L-1 PBS洗涤细胞3次,并加入5 mL PBS重新悬浮,冰浴条件下超声破碎5 min。超声破碎条件设定为:4 s破碎,4 s间隔。待破碎完成后,4 ℃ 12 000 r·min-1离心10 min,收集上清液作为胞内提取液。
2.6 O2•-, H2O2以及MDA含量的测定可溶性蛋白含量采用Bradford法测定[12];O2•-浓度的测定采用盐酸羟胺氧化法[13];H2O2浓度的测定采用二甲酚橙法[14];MDA含量参考采用硫代巴比妥酸法[15]并略微改动,分别在450、532和600 nm分别测定吸光度,浓度计算式为:CMDA (μmol·L-1) = 6.45·(OD532 - OD600) - 0.56·OD450
2.7 SOD酶和CAT酶活测定SOD活性的测定参考邻苯三酚自氧化法[16],以每分钟抑制邻苯三酚自氧化速率达到50%的酶量为一个SOD酶活单位,以U表示。CAT酶活性测定采用紫外分光光度法[17],以每分钟下降0.1吸光值作为一个CAT酶活单位,以U表示。
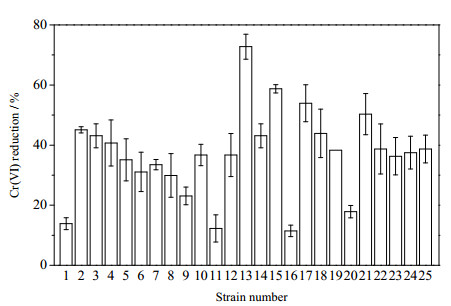
3 结果与讨论 3.1 Cr(Ⅵ)还原菌筛选结果25株菌株还原Cr(Ⅵ)的效率结果如图 1所示,由图可以看出13号菌株具有较强的还原Cr(Ⅵ)的能力,实验选取13号菌用于后续实验研究,并命名为ReCr-13。
|
图 1 25株细菌还原Cr(Ⅵ)效率的对比 Fig.1 Comparison of Cr(Ⅵ) reduction efficiency of 25 bacteria strains |
将菌株ReCr-13重新接种在LB平板培养基上生长,结果发现该菌落呈现乳黄色,圆形、表面光滑、不透明的菌落。显微镜观察该菌呈杆状、具有运动性,革兰氏染色为阳性,有中生或端生芽孢。生理生化实验的结果如表 1所示。通过16SrDNA基因序列的分析,表明该菌与Lysinibacillus sp. Mkj-20 (基因库编号:KU159195.1)相似度为99%,证明筛选菌株为Lysinibacillus sp.,并命名为Lysinibacillus sp. ReCr-13,系统发育树如图 2所示。

|
图 2 基于16S rRNA基因序列的系统发育树 Fig.2 Phylogenetic tree of the strain based on 16S rRNA gene sequences |
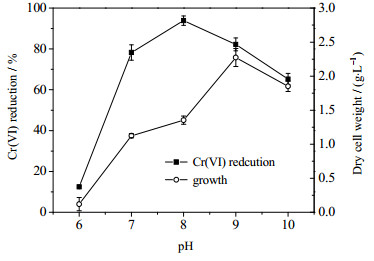
pH值会影响Cr(Ⅵ)在溶液中存在的形式及溶解度,也能改变细胞表面的电荷,影响酶蛋白质亚基的解离和聚合,干扰Cr(Ⅵ)催化还原过程[18]。实验考察在5 g·L-1 NaCl、初始Cr(Ⅵ)浓度为200 mg·L-1条件下,不同pH值对菌株ReCr-13生长及其Cr(Ⅵ)还原效率的影响,结果如图 3所示。由图 3可知,Cr(Ⅵ)还原效率随着初始pH值的增大呈现出先增后减的趋势,其中初始pH 8.0时Cr(Ⅵ)的还原效率最高,在pH 6.0条件下还原率不到20%。菌体生长量随着初始pH值的增加也呈现出先增后将的趋势,其最适生长的pH值为9.0。ZHANG等[19]也发现Serratia sp. Cr-10在pH 5.0时生长最佳,但是Cr(Ⅵ)还原效率最差,这说明pH值对Cr(Ⅵ)还原效率和菌体生长的影响并不一致。当pH为6.0时,菌体生长及Cr(Ⅵ)的还原缓慢;而当pH为10.0时,菌体的生长及Cr(Ⅵ)还原效率也下降。总体而言,菌株ReCr-13在酸性条件不利于生长及Cr(Ⅵ)还原,而中性或弱碱性的环境下具有良好的Cr(Ⅵ)还原能力,因而该菌具备修复较高pH值的Cr(Ⅵ)废渣或废水的潜力。
|
图 3 pH值对菌株ReCr-13还原Cr(Ⅵ)及生长的影响 Fig.3 Effects of pH on growth and Cr(Ⅵ) reduction of strain ReCr-13 |
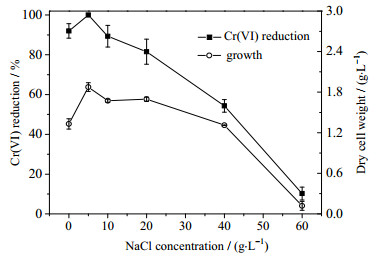
适当的盐度能够保证细胞与外界进行正常的物质交换。实验探究在pH 8.0、初始Cr(Ⅵ)浓度为200 mg·L-1条件下,盐度梯度(以NaCl计)对Lysinibacillus sp.ReCr-13生长及Cr(Ⅵ)还原效率的影响关系,结果如图 4所示,Cr(Ⅵ)还原和菌体生长量呈现先增后减的趋势。在NaCl添加量为零的条件下,菌体生长虽然有所欠佳,但依然能够较好地代谢还原Cr(Ⅵ)。LONG等[20]探讨Pseudochrobactrum saccharolyticum LY10耐盐性发现该菌在初始pH 8.3、130 mg·L-1 Cr(Ⅵ)、0 g·L-1 NaCl条件下菌体生长和Cr(Ⅵ)还原率都很低。这可能是由于本实验初始Cr(Ⅵ)浓度相对较高,Cr(Ⅵ)以及培养基中一些有机物能够调节溶液的渗透压。此外,Na+是可以作为细胞的质子泵和提高酶活必需的重要元素之一,Na+的缺失会延缓细菌的生长[21]。故对菌株ReCr-13而言,NaCl的添加明显地促进该菌生长及Cr(Ⅵ)还原,并在5 g·L-1的NaCl时达到最高值。当NaCl超过5 g·L-1时,随着盐度增加,渗透压的持续增强导致细胞脱水程度加深,细胞与外界的物质交换受阻,而高盐环境下有机物质在水中溶解性的降低进一步影响了细胞的吸收[22],使细胞活性受到严重抑制,最终导致菌体生长量以及Cr(Ⅵ)还原效率出现急速下降。
|
图 4 NaCl对菌株ReCr-13还原Cr(Ⅵ)和生长的影响 Fig.4 Effects of NaCl concentrations on growth and Cr(Ⅵ) reduction of strain ReCr-13 |
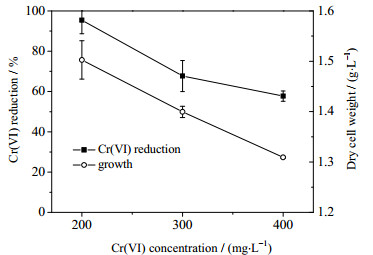
Cr(Ⅵ)还原是微生物的解毒过程,初始Cr(Ⅵ)浓度的增加会加剧菌体的毒害程度,影响Cr(Ⅵ)的还原效率。实验探究在pH 8.0、5 g·L-1 NaCl条件下,初始Cr(Ⅵ)浓度对ReCr-13菌体生长及Cr(Ⅵ)还原效率的影响,结果如图 5所示。菌株ReCr-13还原Cr(Ⅵ)效率及其生长量均于初始Cr(Ⅵ)呈现负相关。由于Cr(Ⅵ)具有毒性,使菌体生长滞后期的延长,抑制菌体生长速率等[23]。微生物在好氧条件下还原Cr(Ⅵ)绝大部分是通过酶促反应进行的,随着初始Cr(Ⅵ)浓度的增加,Cr(Ⅵ)被还原的过程所形成的中间价态也增加,从而加剧胞内蛋白或是核酸发生结合[24],同时被重新氧化在胞内产生更多的ROS,从而破坏胞内环境的稳定性,引起酶活性的下降,最终严重抑制了菌体的生长和铬还原效率。
|
图 5 初始Cr(Ⅵ)浓度对菌株ReCr-13还原Cr(Ⅵ)及生长的影响 Fig.5 Effects of initial Cr(Ⅵ) concentrations on growth and Cr(Ⅵ) reduction of strain ReCr-13 |
重金属诱导细胞产生氧化自由基主要包括两种机制,一种是与胞内具有还原性巯基结合间接减弱或者破坏胞内还原能力,如镉、汞等[25-26],而另一种是具有氧化还原的金属离子参与胞内代谢反应直接产生氧化自由基,如铬、铜等[5, 27],两者均能造成细胞的氧化损伤。上述实验发现Cr(Ⅵ)还原效率与初始Cr(Ⅵ)浓度成负相关,有可能是胞内过量ROS干扰细胞代谢所引起的,故实验测定不同初始Cr(Ⅵ)浓度下的O2•-以及H2O2的含量,结果如图 6A和6B所示。由图 6A可知,菌株ReCr-13胞内的O2•-含量随着初始Cr(Ⅵ)浓度的增加而增加,在初始浓度为200、300和400 mg·L-1 Cr(Ⅵ)条件下所产生的O2•-浓度分别是对照组的1.48、3.41、5.09倍。此外,H2O2的含量变化趋势与O2•-相似,在24 h时,H2O2含量分别为对照组的1.27、1.88、3.14倍。另外,MDA是衡量膜脂氧化程度的主要指标之一,由图 6C可知MDA含量也与Cr(Ⅵ)浓度成正相关的关系,其分别为对照组的2.79、3.24、4.61倍,说明初始Cr(Ⅵ)浓度的增加加剧了细胞膜脂的氧化程度。大部分微生物胞内ROS含量和抗氧化活性保持着动态的平衡,微量的ROS可作为细胞代谢的信号分子,具有调节细胞功能的作用[28],重金属离子浓度过高时会打破胞内ROS平衡,导致胞内ROS含量剧增。上述实验表明菌株ReCr-13暴露在高浓度Cr(Ⅵ)溶液中,确实导致了胞内的O2•-以及H2O2含量的增加,高浓度的Cr(Ⅵ)还原导致ROS过量生成,O2•-和H2O2能够进一步通过芬顿反应生成氧化性最强的羟基自由基(OH·),并不断地攻击细胞膜。随着O2•-、H2O2和OH·在胞内含量的增多,脂质的氧化程度逐渐加剧,破坏生物膜的通透性、流动性,导致膜代谢紊乱,并最终表现为在高浓度Cr(Ⅵ)条件下,ReCr-13还原Cr(Ⅵ)效率降低。
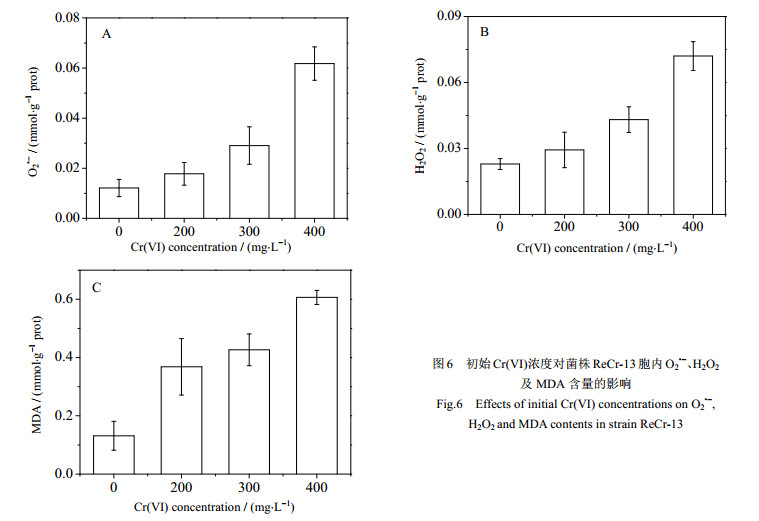
|
图 6 初始Cr(Ⅵ)浓度对菌株ReCr-13胞内O2•-、H2O2及MDA含量的影响 Fig.6 Effects of initial Cr(Ⅵ) concentrations on O2•-, H2O2 and MDA contents in strain ReCr-13 |
为了验证Cr(Ⅵ)诱导的氧化胁迫确实是导致Cr(Ⅵ)生物还原效率低下的因素之一。实验通过添加能促进抗氧化活性的物质以考察其对菌株ReCr-13还原Cr(Ⅵ)效率的影响。许多研究指出,Mn2+本身清除ROS能力十分微弱甚至不存在,但Mn2+主要作为是Mn-SOD催化中心的重要组成部位,对酶的活性起到关键性的作用[29]。此外,Mn2+还可参与细胞的代谢合成具有抗氧化活性的Mn复合物,从而增强细胞清除ROS能力[30-31]。实验选择在反应起始时添加2 mmol·L-1 MnCl2,反应24 h时分别取样测定胞内O2•-、H2O2及MDA含量,结果如图 7A、7B和7C所示。菌株ReCr-13胞内的O2•-、H2O2以及MDA浓度与未添加Mn2+组相比均呈现下降的趋势,这表明外源添加Mn2+确实能够减少O2•-、H2O2在胞内的残留浓度,并降低MDA浓度,减轻自由基对细胞的氧化损伤。通过测定胞内SOD酶和CAT酶活性的变化,结果如图 8所示。由图 8可知,随着初始Cr(Ⅵ)浓度的增加,由于菌株ReCr-13对Cr(Ⅵ)诱导的氧化胁迫做出响应,其胞内SOD酶活CAT酶活都呈现上升的趋势。而添加了相同浓度的Mn2+后,SOD酶和CAT酶的活性均得到显著增强。最终,Mn2+可以使Cr(Ⅵ)还原菌对Cr(Ⅵ)的还原效率均有不同程度的提高(图 9),这表明了Mn2+可以通过提高菌体抗氧化活性,缓解氧化胁迫,并由此增强菌体代谢活性并提高ReCr-13对Cr(Ⅵ)的还原率。细胞抗氧化酶的活性总会处在动态变化之中,并会根据环境条件进行调控,GHOSAL等[8]发现在辐射所诱导的氧化胁迫条件下,Deinococcus radiodurans会在胞内积累大量Mn2+,并作为抗氧化剂增强细胞抗氧化系统保护细胞。因此,当菌体遭受Cr(Ⅵ)胁迫时,胞内ROS的含量会剧增,由于细胞的抗氧化酶之间存在着协同作用,并趋向于维持细胞内氧化还原状态的平衡[32],O2•-歧化产生的H2O2过多积累导致氧化还原电位仍然失衡,并进一步刺激胞内CAT酶的活性的表达,增强H2O2清除效果。O2•-和H2O2浓度的降低间接减少OH·的生成量,膜脂的氧化损伤亦出现缓解,使得细胞还原活性得到一定程度的恢复,从而增强了Cr(Ⅵ)的还原效率。因此,当铬还原菌在遭受Cr(Ⅵ)诱导的氧化胁迫时,适当调控胞内抗氧化酶的活性可以更加有效地维持胞内ROS的动态平衡,增强Cr(Ⅵ)还原菌还原Cr(Ⅵ)的效率,这表明高浓度Cr(Ⅵ)的诱导的氧化胁迫是影响微生物还原废渣废水中Cr(Ⅵ)效率的关键因素之一,通过调控细胞的抗氧化活性是提高Cr(Ⅵ)还原效率一种有效手段。

|
图 7 不同Cr(Ⅵ)浓度下Mn2+对菌株ReCr-13胞内O2•-、H2O2及MDA含量的影响 Fig.7 Effects of Mn2+ on O2•-, H2O2 and MDA contents in strain ReCr-13 under different initial Cr(Ⅵ) concentrations |
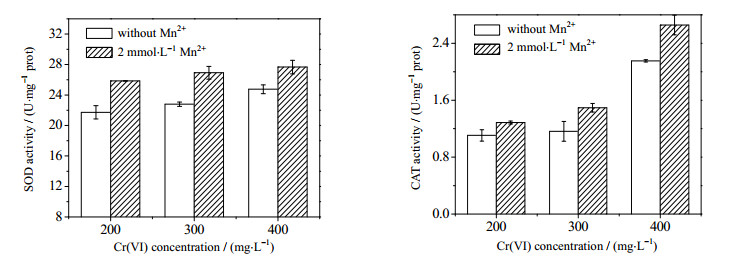
|
图 8 不同初始Cr(Ⅵ)浓度下Mn2+对菌株ReCr-13胞内SOD酶和CAT酶活性的影响 Fig.8 Effects of Mn2+ on SOD and CAT activity in strain ReCr-13 under different initial Cr(Ⅵ) concentrations |
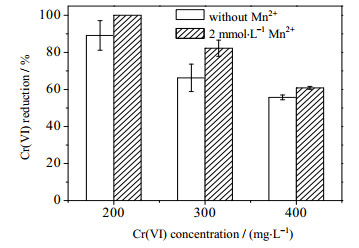
|
图 9 不同初始Cr(Ⅵ)浓度下Mn2+对菌株ReCr-13还原Cr(Ⅵ)的影响 Fig.9 Effects of Mn2+ on Cr(Ⅵ) reduction of strain ReCr-13 under different initial Cr(Ⅵ) concentrations |
(1) 从河道污泥中筛选出一种Cr(Ⅵ)还原菌,并鉴定为Lysinibacillus sp.ReCr-13,其在pH 8.0、5 g·L-1 NaCl、200 mg·L-1 Cr(Ⅵ)条件下具有最佳还原效率。
(2) 菌体暴露在Cr(Ⅵ)溶液中诱发ReCr-13胞内O2•-、H2O2及MDA的积累,其浓度与初始Cr(Ⅵ)浓度成正相关,而ReCr-13的生长量及Cr(Ⅵ)的还原效率随着初始Cr(Ⅵ)浓度的增加而减小。
(3) 外加Mn2+能够参与微生物抗氧化调节,通过增强ReCr-13胞内SOD酶和CAT酶的活性,促进胞内O2•-、H2O2的清除,降低膜脂氧化程度,缓解由Cr(Ⅵ)诱导的氧化胁迫,最终提高了ReCr-13还原Cr(Ⅵ)的效率。
| [1] |
MA S, SONG C S, CHEN Y, et al. Hematite enhances the removal of Cr(Ⅵ) by Bacillus subtilis BSn5 from aquatic environment[J]. Chemosphere, 2018, 208: 579-585. DOI:10.1016/j.chemosphere.2018.06.037 |
| [2] |
周小瑞, 于凤文, 韦一, 等. 汽爆铜藻对模拟废水中Cr(Ⅵ)的吸附特性研究[J]. 高校化学工程学报, 2018, 32(2): 464-471. ZHOU X R, YU F W, WEI Y, et al. Adsorption characteristic of chromium from imitated wastewater by steam-exploded Sargassum Horneri[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(2): 464-471. DOI:10.3969/j.issn.1003-9015.2018.02.028 |
| [3] |
张娜, 夏宏彩, 李宁, 等. 有机阴离子和溶解氧对稳定纳米铁去除水中铬(Ⅵ)的影响[J]. 高校化学工程学报, 2011, 25(5): 882-887. ZHANG N, XIA H C, LI N, et al. Effects of organic anion and dissolved oxygen on removal Cr(Ⅵ) by stabilized nanoscale zero-valent iron in water[J]. Journal of Chemical Engineering of Chinese Universities, 2011, 25(5): 882-887. DOI:10.3969/j.issn.1003-9015.2011.05.027 |
| [4] |
Barak Y, Ackerley D F, Dodge C J, et al. Analysis of novel soluble chromate and uranyl reductases and generation of an improved enzyme by directed evolution[J]. Applied & Environmental Microbiology, 2006, 72(11): 7074-7082. |
| [5] |
Wani P A, Wani J A, Wahid S. Recent advances in the mechanism of detoxification of genotoxic and cytotoxic Cr (Ⅵ) by microbes[J]. Journal of Environmental Chemical Engineering, 2018, 6(4): 3798-3807. DOI:10.1016/j.jece.2018.05.042 |
| [6] |
WANI P A, SUNDAY O O, KEHINDE A M, et al. Antioxidants and chromium reductases by Penibacillus species enhance the growth of soybean under chromium stress[J]. International Journal of Environmental Science & Technology, 2017, 15(2): 1-12. |
| [7] |
WANI P A, WAHID S, SINGH R, et al. Antioxidant and chromium reductase assisted chromium (Ⅵ) reduction and Cr (Ⅲ) immobilization by the rhizospheric Bacillus helps in the remediation of Cr(Ⅵ) and growth promotion of soybean crop[J]. Rhizosphere, 2018, 6: 23-30. DOI:10.1016/j.rhisph.2018.01.004 |
| [8] |
GHOSAL D, OMELCHENKO M V, GAIDAMAKOVA E K, et al. How radiation kills cells: Survival of Deinococcus radiodurans and Shewanella oneidensis under oxidative stress[J]. Fems Microbiology Reviews, 2005, 29(2): 361-375. |
| [9] |
DAVIES B W, WALKER G C. Disruption of sitA compromises Sinorhizobium meliloti for manganese uptake required for protection against oxidative stress[J]. Journal of Bacteriology, 2007, 189(5): 2101-2109. DOI:10.1128/JB.01377-06 |
| [10] |
JENKINSON H F, JAKUBOVICS N S. Out of the iron age: New insights into the critical role of manganese homeostasis in bacteria[J]. Microbiology, 2001, 147(7): 1709-1718. DOI:10.1099/00221287-147-7-1709 |
| [11] |
PATTANAPIPITPAISAL P, BROWN N, MACASKIE L. Chromate reduction and 16S rRNA identification of bacteria isolated from a Cr(Ⅵ)-contaminated site[J]. Applied Microbiology and Biotechnology, 2001, 57(1/2): 257-261. |
| [12] |
SEDMAK J J, GROSSBERG S E. A rapid, sensitive, and versatile assay for protein using Coomassie brilliant blue G250[J]. Analytical Biochemistry, 1977, 79(1-2): 544-552. DOI:10.1016/0003-2697(77)90428-6 |
| [13] |
JIANG M, ZHANG J. Effect of abscisic acid on active oxygen species, antioxidative defence system and oxidative damage in leaves of maize seedlings[J]. Plant & Cell Physiology, 2001, 42(11): 1265-1273. |
| [14] |
李忠光, 宋玉泉, 龚明. 二甲酚橙法用于测定植物组织中的过氧化氢[J]. 云南师范大学学报, 2007, 27(3): 50-54. LI Z G, SONG Y Q, GONG M. Xylenol orange method used for the measurement of hydrogen peroxide in plant tissue[J]. Journal of Yunnan Normal University, 2007, 27(3): 50-54. DOI:10.3969/j.issn.1007-9793.2007.03.012 |
| [15] |
ARAVIND P, PRASAD M N V. Zinc alleviates cadmium-induced oxidative stress in Ceratophyllum demersum L[J]. Plant Physiology & Biochemistry, 2003, 41(4): 391-397. |
| [16] |
MARKLUND S, MARKLUND G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase[J]. European Journal of Biochemistry, 1974, 47(3): 469-474. DOI:10.1111/j.1432-1033.1974.tb03714.x |
| [17] |
KAUR P, SHARMA N, KUMAR M, et al. Changes in growth and antioxidative enzyme activities in Vicia faba L. seedlings under chromium stress[J]. Indian Journal of Plant Physiology, 2014, 19(2): 101-106. DOI:10.1007/s40502-014-0080-0 |
| [18] |
OKEKE B C, LAYMON J, CRENSHAW S, et al. Environmental and kinetic parameters for Cr(Ⅵ) bioreduction by a bacterial monoculture purified from Cr(Ⅵ)-resistant consortium[J]. Biological Trace Element Research, 2008, 123(1): 229-241. |
| [19] |
ZHANG K, LI F. Isolation and characterization of a chromium-resistant bacterium Serratia sp. Cr-10 from a chromate-contaminated site[J]. Applied Microbiology & Biotechnology, 2011, 90(3): 1163-1169. |
| [20] |
LONG D, TANG X, CAI K, et al. Cr(Ⅵ) reduction by a potent novel alkaliphilic halotolerant strain Pseudochrobactrum saccharolyticum LY10[J]. Journal of Hazardous Materials, 2013, 256/257(2): 24-32. |
| [21] |
AMOOZEGAR M A, GHASEMI A, AZAVI M R, et al. Evaluation of hexavalent chromium reduction by chromate-resistant moderately halophile, Nesterenkonia sp. strain MF2[J]. Process Biochemistry, 2007, 42(10): 1475-1479. DOI:10.1016/j.procbio.2007.07.001 |
| [22] |
CASTILLO-CARVAJAL L C, SANZ-MARTÍN J L, BARRAGÁN-HUERTA B E. Biodegradation of organic pollutants in saline wastewater by halophilic microorganisms: A review[J]. Environmental Science and Pollution Research International, 2014, 21(16): 9578-9588. DOI:10.1007/s11356-014-3036-z |
| [23] |
SHI Y, CHAI L, YANG Z, et al. Identification and hexavalent chromium reduction characteristics of Pannonibacter phragmitetus[J]. Bioprocess and Biosystems Engineering, 2012, 35(5): 843-850. DOI:10.1007/s00449-011-0668-y |
| [24] |
LEVINA A, LAY P A. Mechanistic studies of relevance to the biological activities of chromium[J]. Coordination Chemistry Reviews, 2005, 249(3): 281-298. |
| [25] |
YU Q, FEIN J B. The effect of metal loading on Cd adsorption onto Shewanella oneidensis bacterial cell envelopes: The role of sulfhydryl sites[J]. Geochimica et Cosmochimica Acta, 2015, 167: 1-10. DOI:10.1016/j.gca.2015.06.036 |
| [26] |
RISHER J F, TUCKER P. Alkyl Mercury-induced toxicity: Multiple mechanisms of action[J]. Reviews of Environmental Contamination & Toxicology, 2016, 240: 105-149. |
| [27] |
LIU S H, ZENG G M, NIU Q Y, et al. Bioremediation mechanisms of combined pollution of PAHs and heavy metals by bacteria and fungi: A mini review[J]. Bioresource Technology, 2016, 224: 25-33. |
| [28] |
GONZALEZGONZALEZ F J, CHANDEL N, JAIN M, et al. Reactive oxygen species as signaling molecules in the development of lung fibrosis[J]. Translational Research, 2017, 190: 61-68. DOI:10.1016/j.trsl.2017.09.005 |
| [29] |
YESILKAYA H, KADIOGLU A, GINGLES N, et al. Role of manganese-containing superoxide dismutase in oxidative stress and virulence of Streptococcus pneumoniae[J]. Infection & Immunity, 2000, 68(5): 2819-2826. |
| [30] |
ANJEM A, VARGHESE S, IMLAY J A. Manganese import is a key element of the OxyR response to hydrogen peroxide in Escherichia coli[J]. Molecular Microbiology, 2009, 72(4): 844-858. DOI:10.1111/j.1365-2958.2009.06699.x |
| [31] |
AMANDA C G, ELENA K G, VERA Y M, et al. Effects of Mn and Fe levels on Bacillus subtilis spore resistance and effects of Mn2+, other divalent cations, orthophosphate, and dipicolinic acid on protein resistance to ionizing radiation[J]. Applied & Environmental Microbiology, 2011, 77(1): 32-40. |
| [32] |
XU P, ZENG G, HUANG D, et al. Cadmium induced hydrogen peroxide accumulation and responses of enzymatic antioxidants in Phanerochaete chrysosporium[J]. Ecological Engineering, 2015, 75(75): 110-115. |




