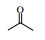
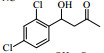
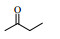
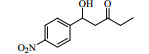
2. 材料化学工程国家重点实验室 南京工业大学, 江苏 南京 210009
2. State Key Laboratory of Materials-Oriented Chemical Engineering, Nanjing Tech University, Nanjing 210009, China
酶在有机与生物合成中是一类重要的催化剂,因其具有高选择性、反应条件温和、环境友好、副产物少等优点,被广泛应用于医药、化工、食品、纺织、洗涤剂及能源等工业领域[1~4]。脂肪酶(lipase, E.C.3.1.1.3)主要是指一类能够催化甘油三酯水解生成脂肪酸、甘油和甘油单酯或二酯的酶,广泛存在于动植物和微生物体中[5],已成功应用于Aldol缩合、Knoevenagel缩合、Michael加成、Henry反应等多种C-C键形成反应[6~8]。
Aldol缩合被认为是有机化学中最重要的C-C键形成反应之一[9],可用于多种天然或非天然有机化合物的合成中。在有机合成中有许多关于用酸[10]、碱[11]、有机小分子[12]催化的Aldol缩合报道,但发现来源更广泛、成本更加低廉、更加绿色高效的新型Aldol缩合反应催化剂仍然具有重要意义。2003年,Branneby等[13]首次发现了脂肪酶具有催化Aldol缩合反应的活性,他们用天然南极假丝酵母脂肪酶(Candida antarctica lipase, CALB)催化此反应,但仅限于丙醛和己醛等简单的脂肪醛且收率只有6%~12%。Li等[14]报道了水相中猪胰脂肪酶(Porcine Paoceneas Lipase, PPL)催化的不对称Aldol反应并提出了反应机理,收率为11.7%~96.4%,ee值为9.6%~43.6%,然而论文仅考察了硝基取代的苯甲醛与丙酮的反应。Guan等[15]发现PPL能催化杂环酮与各种有吸电子取代基的芳醛的不对称Aldol反应,在乙腈溶剂中反应120 h以上,最高收率为56%,此时ee值为46%。Xie[16]等发现了在酸性缓冲溶液中牛胰脂肪酶(bovine pancreatic lipase,BPL)能催化多种芳香醛与环酮类化合物的不对称Aldol反应,但该法不能应用于直链酮底物,如与丙酮反应时,反应没有选择性,收率仅为26%。
研究表明在酶催化反应中加入合适的有机小分子作为添加剂,可以改善酶的催化性能。Itoh等[17]研究了洋葱假单胞脂肪酶(Pseudomonas cepacia lipase,PCL)催化2-氰基-1-甲基-乙酸乙酯的水解反应中,加入冠醚可以显著的改变其反应速率和立体选择性。Liu等[18]报道了在褶皱假丝酵母脂肪酶(Candida rugosa lipase, CRL)催化酮洛芬酯的水解反应时,加入8%(w/v)吐温80可以使酶活性提高13倍,对映体选择率E值从1.2提高到6.7。Chen等[19]研究了N-杂环化合物添加对酶促反应的调控作用,发现咪唑可以促进D-氨基酰化酶(D-aminoacylase, DA)催化的Claisen-Schmidt反应。
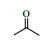
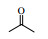
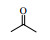
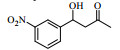
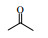
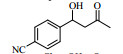
Lipase lipoprotein脂肪酶(LPL)来源于黑曲霉,相比与BPL、CALB等成本要低得多。本文首先以对硝基苯甲醛与丙酮的Aldol缩合反应为模型,考察了添加剂种类和添加量、水含量、时间、温度等因素对反应的影响(Scheme 1),并对反应底物的适用范围进行了研究,希望发展一种成本更低、效率更高、底物适应范围更宽的绿色Aldol缩合反应新方法。

|
图式1 LPL催化4-硝基苯甲醛与丙酮Aldol缩合反应 Scheme1 Aldol condensation of acetone and 4-nitrobenzaldehyde catalyzed by LPL |
Lipase lipoprotein脂肪酶(LPL)购自宁夏夏盛实业集团有限公司,其它药品和试剂均为市售分析纯。熔点测定使用WRS-1B数字熔点仪,温度未经校正;核磁共振用BRUKERAC-P400型仪测定。
2.2 实验方法将2 mmol对硝基苯甲醛和1 mL去离子水、2.3 mL丙酮加入10 mL反应瓶中,然后加入0.2 g LPL、60%(mol)咪唑,35℃下搅拌反应,TLC(石油醚/乙酸乙酯1/1,v/v)监测反应进行情况,反应完毕后过滤除酶,滤纸和滤液分别用CH2Cl2和水洗涤三次[16]。滤液用无水MgSO4干燥后过滤,减压旋蒸,粗产物经柱层析[石油醚/乙酸乙酯,9/1~2/1,v/v]分离即可得到纯化的目标产物。
2.3 部分产物结构表征(3i)1H-NMR (400 MHz, CDCl3) δ 8.23 (d, J=8.5 Hz, 2H), 7.64~7.46 (m, 2H), 5.48 (s, 0.68H), 4.97 (d, J=7.6 Hz, 0.28H), 4.18 (s, 1H), 3.83 (d, J=12.4 Hz, 1H), 3.27 (s, 2H), 2.75 (s, 1H), 2.51 (dd, J=10.1, 5.8 Hz, 2H), 1.38 (t, J=20.0 Hz, 10H)。
(3j)1H-NMR (400 MHz, CDCl3) δ 8.22 (d, J=8.8 Hz, 2H), 7.52 (d, J=8.6 Hz, 2H), 5.54 (s, 0.67H), 5.00 (d, J=8.1 Hz, 0.38H), 4.29~4.16 (m, 1H), 3.85 (dd, J=6.4, 1.3 Hz, 1H), 3.82~3.68 (m, 2H), 3.46 (dd, J=11.4, 9.9 Hz, 0.38H), 3.04 (s, 0.61H), 2.93 (dd, J=5.7, 4.8 Hz, 1H), 2.80~2.63 (m, 1H), 2.58~2.45 (m, 1H)。
3 结果与讨论 3.1 不同添加剂对反应的影响从表 1中可以看出添加剂的选择对于LPL催化Aldol反应有着重要的影响,当加入咪唑类添加剂时对反应有明显的促进作用,如以咪唑为添加剂时(Entry 5),反应48 h后,收率可达71.6%。而18冠醚-6、β-环糊精以及表面活性剂不能辅助LPL催化Aldol反应(Entry1-3)。对比单独以LPL和咪唑为催化剂时反应的收率(Entry6~7),可以看出咪唑添加剂与LPL对此反应具有显著的协同催化作用,这与Chen等[19]报道的结果相似。
| 表 1 不同种类添加剂对LPL催化4-硝基苯甲醛与丙酮Aldol缩合反应的影响 Table 1 Effects of different additives on the Aldol condensation of acetone and 4-nitrobenzaldehyde catalyzed by LPL |
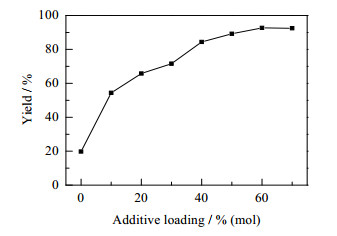
图 1考察了水含量为30%时,添加剂咪唑用量对反应的影响。随着咪唑用量的增加,该反应的产物收率也逐渐增加。当咪唑用量达到60%(mol)时,收率达到最大,此时再增加咪唑用量,产物收率基本不变。在此反应条件下,单独用60%(mol)咪唑催化收率仅为40%,再次证明了咪唑与LPL共同作用催化了Aldol缩合。因此,本文选择咪唑用量为60%(mol)对反应进行后续探讨。
|
图 1 咪唑添加量对Aldol反应收率的影响 Fig.1 Effect of additive loading on the reaction yield of Aldol condensation Reaction conditions: LPL (0.2 g), imidazole (0~70 %(mol)), 4-nitrobenzaldehyde (2 mmol), acetone (2.3 mL), deionized water 1 mL, 35℃, reaction time (48 h). Isolated yield after silica gel chromatography |
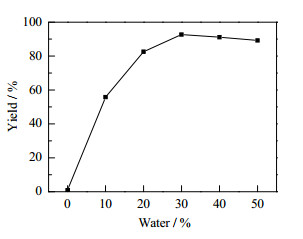
反应中水含量会影响酶的活性中心、稳定性,甚至引起酶分子三维构象发生改变[20, 21],因此体系中水含量是影响反应的重要因素之一。图 2考察了水含量对反应的影响。如图所示水含量对反应的影响较大——不加水时,反应基本不进行,产物收率仅为0.9%;随着反应体系中水含量的增加,产物收率也逐渐的提高,在水含量为30%(v/v)时,收率达到92.7%;继续提高反应体系中的水含量,产物收率会逐渐下降,可能是反应体系中过多的水导致底物的溶解度降低。因此,本文选择最佳水含量为30%(v/v)。
|
图 2 水含量对Aldol反应收率的影响 Fig.2 Effect of water content on the reaction yield of Aldol condensation Reaction conditions: LPL (0.2 g), imidazole (60 %(mol)), 4-nitrobenzaldehyde (2 mmol), acetone(2.3 mL, deionized water(H2O/(H2O+CH3COCH3=0-50%, v/v), 35℃, reaction time (48 h). Isolated yield after silica gel chromatography |
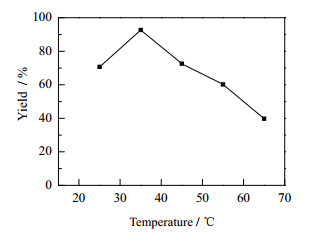
通常,反应温度对酶的活性构象、催化活性和稳定性有较大的影响[22]。由图 3可见,在一定的温度范围内,随着温度的升高,反应收率会增加;当温度高于35℃时,收率会随温度的升高而降低,这是由于在较高温度下使酶发生变性导致。
|
图 3 温度对Aldol反应收率的影响 Fig.3 Effect of temperature on the reaction yield of Aldol condensation Reaction conditions: LPL (0.2 g), imidazole (60 %(mol)), 4-nitrobenzaldehyde (2 mmol), acetone(2.3 mL), deionized water 1 mL, reaction time (48 h). Isolated yield after silica gel chromatography |
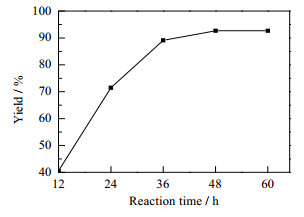
图 4考察了反应时间对反应收率的影响。由图可见产物收率随反应时间的增加而升高;反应进行到48 h时,反应基本达到平衡,收率为92.7%,再延长反应时间,产物收率基本不变。
|
图 4 时间对Aldol反应收率的影响 Fig.4 Effect of reaction time on the yield of Aldol condensation Reaction conditions: LPL (0.2 g), imidazole (60 %(mol)), 4-nitrobenzaldehyde (2 mmol), acetone(2.3 mL), deionized water 1 mL, 35℃. Isolated yield after silica gel chromatography |

|
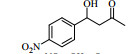
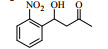
图式2 LPL催化芳醛与酮类化合物Aldol缩合反应 Scheme2 LPL-catalyzed Aldol condensation of ketones and other aromatic aldehydes |
综合以上实验结果,得到优化后的条件:水含量为30%(v/v),添加剂咪唑为60%(mol),催化剂LPL用量为0.2 g,在此条件下在35℃反应48 h,对硝基苯甲醛与丙酮的Aldol缩合反应收率可达92.7%。
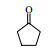
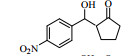
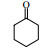
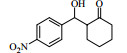
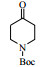
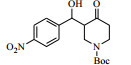
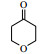
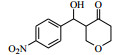
3.6 脂肪酶LPL催化Aldol缩合的底物扩展在优化的反应条件下,对底物进行了扩展,结果见表 2。从实验结果可以看出,对于芳香醛来说,取代基的电子效应对反应有着显著的影响。当取代基为强吸电子的4-硝基苯甲醛、3-硝基苯甲醛及2-硝苯甲醛时,收率分别为92.7%、90.6%、87.2%(表 2, 3a~3c);而具有相对吸电子效应较弱基团的对氰基苯甲醛、2, 4-二氯苯甲醛和丙酮反应时,收率分别为60.1%,68.6%(表 2, 3d、3e)。除此之外,还发现不同结构的直链酮、环酮以及四氢吡喃酮、四氢噻喃-4-酮等杂环酮与4-硝基苯甲醛在此反应条件下也能获得较好的收率(表 2,3f~3k)。
| 表 2 LPL催化芳醛与酮类化合物Aldol缩合反应 Table 2 LPL-catalyzed Aldol condensation of ketones and other aromatic aldehydes |
为了凸显本方法的催化效率,以对硝基苯甲醛与丙酮以及环己酮的反应为代表,与文献报道的方法作对比,反应时间得到大幅度减少,且不需要调控pH或加入乙腈等其他有机溶剂,结果见表 3。
| 表 3 不同种类酶催化的Aldol缩合 Table 3 Aldol condensation catalyzed by different enzymes |
研究首次发现了脂肪酶LPL与咪唑协同作用下,可以高效地催化吸电子取代的芳香醛与脂肪酮、环酮、杂环酮等不同结构酮的Aldol缩合反应。相比文献报道的BPL、CALB等其他种类的脂肪酶,LPL成本更加低廉,且具有环境友好、底物适用范围广、产率高、反应时间短等优点。
| [1] | Hasan F, Shah A A, Hameed A . Industrial applications of microbial lipases[J]. Enzyme Microb Tech , 2006, 39 (2) : 235-251 DOI:10.1016/j.enzmictec.2005.10.016 |
| [2] | Zheng G W, Xu J H . New opportunities for biocatalysis:driving the synthesis of chiral chemicals[J]. Curr opin Biotechnol , 2011, 22 (6) : 784-792 DOI:10.1016/j.copbio.2011.07.002 |
| [3] | Seelig B, Szostak J W . Selection and evolution of enzymes from a partially randomized non-catalytic scaffold[J]. Nature , 2007, 448 (7155) : 828-831 DOI:10.1038/nature06032 |
| [4] | PENG Li-feng(彭立凤), ZHAO Ru-qi(赵汝淇), TAN Tian-wei(谭天伟) . Applications of Microbial Lipase(微生物脂肪酶的应用)[J]. Food Fermn Ind(食品与发酵工业) , 2000, 26 (3) : 68-73 |
| [5] | Kapoor M, Gupta M N . Lipase promiscuity and its biochemical applications[J]. Process Biochem , 2012, 47 (4) : 555-569 DOI:10.1016/j.procbio.2012.01.011 |
| [6] | Busto E, Gotor-Fernández V, Gotor V . Hydrolases:catalytically promiscuous enzymes for non-conventional reactions in organic synthesis[J]. Chem Soc Rev , 2010, 39 (11) : 4504-4523 DOI:10.1039/c003811c |
| [7] | Resch V, Schrittwieser J H, Siirola E, et al Kroutil W . Novel carbon-carbon bond formations for biocatalys is[J]. Curr Opin Biotechnol , 2011, 22 (6) : 793-799 DOI:10.1016/j.copbio.2011.02.002 |
| [8] | DING Yan(丁雁), HUANG He'(黄和), HU Yi'(胡燚) . New Progress on Lipases Catalyzed C-C Bond Formation Reactions'(脂肪酶催化C-C键形成反应研究新进展)[J]. Chinese J Org Chem(有机化学) , 2013, 33 (5) : 905-914 DOI:10.6023/cjoc2012010050 |
| [9] | Machajewski T D, Wong C H . The catalytic asymmetric aldol reaction[J]. Angew Chem Int Ed , 2000, 39 (8) : 1352-1375 DOI:10.1002/(SICI)1521-3773(20000417)39:8<1352::AID-ANIE1352>3.0.CO;2-J |
| [10] | Wang G, Zhao J, Zhou Y, et al Wang B, Qu J . Mild and Highly Enantioselective Vinylogous Aldol Reaction of Brassard's Diene with Aromatic Aldehydes by Combined Lewis Acid Catalyst[J]. J Org Chem , 2010, 75 (15) : 5326-5329 DOI:10.1021/jo100674f |
| [11] | Denmark S E, Fan Y, Eastgate M D . Lewis base catalyzed, enantioselective aldol addition of methyl trichlorosilyl ketene acetal to ketones[J]. J Org Chem , 2005, 70 (13) : 5235-5248 DOI:10.1021/jo0506276 |
| [12] | Tang Z, Jiang F, Yu L T . Novel small organic molecules for a highly enantioselective direct aldol reaction[J]. J Am Chem Soc , 2003, 125 (18) : 5262-5263 DOI:10.1021/ja034528q |
| [13] | Branneby C, Carlqvist P, Magnusson A . Carbon-carbon bonds by hydrolytic enzymes[J]. J Am Chem Soc , 2003, 125 (4) : 874-875 DOI:10.1021/ja028056b |
| [14] | Li C, Feng X W, Wang N . Biocatalytic promiscuity:the first lipase-catalysed asymmetric aldol reaction[J]. Green Chem , 2008, 10 (6) : 616-618 DOI:10.1039/b803406k |
| [15] | Guan Z, Fu J P, He Y H . Biocatalytic promiscuity:lipase-catalyzed asymmetric aldol reaction of heterocyclic ketones with aldehydes[J]. Tetrahedron Lett , 2012, 53 (37) : 4959-4961 DOI:10.1016/j.tetlet.2012.07.007 |
| [16] | Xie Z B, Wang N, Jiang G F . Biocatalytic asymmetric aldol reaction in buffer solution[J]. Tetrahedron Lett , 2013, 54 (8) : 945-948 DOI:10.1016/j.tetlet.2012.12.022 |
| [17] | Itoh T, Takagi Y, Murakami T . Crown ethers as regulators of enzymatic reactions:enhanced reaction rate and enantioselectivity in lipase-catalyzed hydrolysis of 2-cyano-1-methylethyl acetate[J]. J Org Chem , 1996, 61 (6) : 2158-2163 DOI:10.1021/jo951598+ |
| [18] | Liu Y Y, Xu J H, Hu Y . Enhancing effect of Tween-80 on lipase performance in enantioselective hydrolysis of ketoprofen ester[J]. J Mol Catal B:Enzym , 2000, 10 (5) : 523-529 DOI:10.1016/S1381-1177(00)00093-X |
| [19] | Chen X, Liu B K, Kang H . A tandem Aldol condensation/dehydration co-catalyzed by acylase and N-heterocyclic compounds in organic media[J]. J Mol Catal B:Enzym , 2011, 68 (1) : 71-76 DOI:10.1016/j.molcatb.2010.09.014 |
| [20] | Klibanov A M . Enzymatic catalysis in anhydrous organic solvents[J]. Biochem Sci , 1989, 14 (4) : 141-144 DOI:10.1016/0968-0004(89)90146-1 |
| [21] | Halling P J . Thermodynamic predictions for biocatalysis in nonconventional media:theory, tests, and recommendations for experimental design and analysis[J]. Enzyme Microb Technol , 1994, 16 (3) : 178-206 DOI:10.1016/0141-0229(94)90043-4 |
| [22] | LIU You-yan(刘幽燕), XU Jian-he(许建和), LIU Hong-lai(刘洪来) . Effect of reaction parameters on reactivity and enantioselectivity of lipase-catalyzed esterification(反应条件对脂肪酶酯化活性和对映选择性的影响)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 1999, 13 (4) : 372-376 |
| [23] | Peng Y Y, Peng S J, Ding Q P . An environmentally benign system for synthesis of β-hydroxylketones:L-histidine asymmetrically catalyzed direct aldol reactions in aqueous micelle and water-like media[J]. Chin J Chem , 2007, 25 (3) : 356-363 DOI:10.1002/(ISSN)1614-7065 |
| [24] | Grayson D H, Tuite M R . Knoevenagel reactions with β-oxo acids. Regiospecific enol equivalents for syntheses of α, β-unsaturated ketones and of some β-ketols[J]. J Chem Soc Perkin Trans 1 , 1986 : 2137-2142 |
| [25] | Zhou Y, Shan Z . (R)-or(S)-Bi-2-naphthol assisted, l-proline catalyzed direct aldol reaction[J]. Tetrahedron:Asymmetry , 2006, 17 (11) : 1671-1677 DOI:10.1016/j.tetasy.2006.06.022 |
| [26] | Gruttadauria M, Riela S, Aprile C . Supported ionic liquids. New recyclable materials for the L-proline-catalyzed Aldol reaction[J]. Adv Synth Catal , 2006, 348 (1-2) : 82-92 DOI:10.1002/(ISSN)1615-4169 |
| [27] | Stiles M, Wolf D, Hudson G V . Catalyst selectivity in the reactions of unsymmetrical ketones; Reaction of butanone with benzaldehyde and p-nitrobenzaldehyde[J]. J Am Chem Soc , 1959, 81 (3) : 628-632 DOI:10.1021/ja01512a031 |
| [28] | Lei M, Shi L, Li G . Dipeptide-catalyzed direct asymmetric aldol reactions in the presence of water[J]. Tetrahedron , 2007, 63 (33) : 7892-7898 DOI:10.1016/j.tet.2007.05.077 |
| [29] | Billimoria J D . Simple analogues of cortisone. Part IV. Some benzyl-substituted glycolloylcyclohexanols[J]. J Chem Soc , 1955 : 1126-1129 DOI:10.1039/jr9550001126 |
| [30] | Pihko P M, Laurikainen K M, Usano A . Effect of additives on the proline-catalyzed ketone-aldehyde aldol reactions[J]. Tetrahedron , 2006, 62 (2-3) : 317-328 DOI:10.1016/j.tet.2005.09.070 |
| [31] | He Y H, Li H H, Chen Y L . Chymopapain-catalyzed direct asymmetric Aldol reaction[J]. Adv Synth Catal , 2012, 354 (4) : 712-719 DOI:10.1002/adsc.201100555 |
| [32] | Li C, Zhou Y J, Wang N . Promiscuous protease-catalyzed aldol reactions:a facile biocatalytic protocol for carbon-carbon bond formation in aqueous media[J]. J Biotechnol , 2010, 150 (4) : 539-545 DOI:10.1016/j.jbiotec.2010.10.004 |
| [33] | Chen Y L, Li W, Liu Y . Trypsin-catalyzed direct asymmetric aldol reaction[J]. J Mol Catal B:Enzym , 2013, 87 : 83-87 DOI:10.1016/j.molcatb.2012.10.014 |