2. 中国林业科学院南京林产化学工业研究所, 江苏 南京 210042
2. Institute of Chemical Industry of Forest Products, CAF, Nanjing 210042, China
植物纤维素原料是地球上最丰富的可再生资源,其生成与降解构成了生物圈中最大的物质循环[1~3]。有效利用纤维素原料是解决目前人类面临的资源、能源、环境等重大问题的途径之一[4, 5]。
纤维素原料热解时生成的热解液含内醚糖(Levoglucosan,1, 6-脱水-β-D-吡喃葡萄糖,简称LG)、芳烃衍生物、糠醛衍生物等[6, 7]。随着热解工艺的发展,热解液中内醚糖的量大幅度提高[8~10],利用热解产物作为微生物发酵碳源的研究越来越为人们所重视[11~13]。
与葡萄糖等常规碳源相比,自然界中能利用内醚糖的菌株少且存在利用率低的问题[14~16]。余志晟对89种菌株进行了同化内醚糖的实验,发现仅有7株微生物具有较弱的内醚糖同化能力,从土壤中筛选的斯达油脂酵母对内醚糖的利用率低(3 d,64%)[17],因此筛选能高效利用内醚糖的微生物就显得尤为重要[15]。本工作对相关微生物进行了筛选及对内醚糖利用效率进行了研究。
2 材料与方法 2.1 材料 2.1.1 菌株真菌筛选自南京仙林大学城的土壤,红假单孢菌XJ为本实验室保藏菌株。
2.1.2 培养基筛选培养基:2%内醚糖,1%蛋白胨,0.1%KH2PO4,0.04%MgSO4,2%琼脂,pH5.0.
热解液培养基:4%纤维素热解液(内醚糖含量约为1.8%),1%蛋白胨,0.1%KH2PO4,0.04%MgSO4,pH5.0.
2.1.3 试剂内醚糖:河南高的医药科技有限公司(纯度98%)。
纤维素热解液:本课题组成员制备,具体是将秸秆、竹子、木材等农业废料烘干并粉碎,利用管式炉热解反应器(主要由管式炉热解器、电加热器、温控仪、冷凝和真空系统组成)在高温条件下进行热解,收集冷凝得到的组分即为热解液。
2.1.4 仪器与设备GNP-9080隔水式恒温培养箱(上海精宏实验设备公司);ES-315高压蒸汽灭菌锅(TOMY,Japan);FA2004电子分析天平(上海良平仪器仪表公司);高效液相色谱仪(Agilent 1100);HD-930型组合式全温摇床(江苏太仓市博莱特实验仪器厂);LC-MS(Agilent Technologies 6460 Triple Quad LC/MS);高速离心机Sigma 3k30(Sigma公司);高效气相色谱仪(Agilent 7890A)。
2.2 方法 2.2.1 内醚糖同化菌株的筛选取土壤1 g加入盛有99 mL无菌水的锥形瓶中,充分震荡后放置将清液稀释为10-2、10-3、10-4和10-5的稀释度,分别涂布于筛选培养基上,经30℃培养5 d后,挑取菌落用划线分离纯化。纯化后的菌株接种于液体筛选培养基,30℃、180 r·min-1培养,定时取样,经0.45 μm微孔滤膜过滤,分析其同化内醚糖的能力。
2.2.2 内醚糖同化菌株的鉴定 2.2.2.1 形态鉴定将菌株接至不同碳源的培养基中培养,观察菌落形态及生理生化等特征。
2.2.2.2 分子生物学鉴定PCR扩增引物为ITS1:TCCGTAGGTGAACCTGCGG;ITS4:TCCTCCGCTT TTGATATGC。PCR反应体系(20 μL): 10×Ex Taq buffer 2.0 μL;MgCl2(25 mmol·L-1)1.6 μL;dNTP(2.5 mmol·L-1)1.6 μL;引物各1 μL;Template 0.5 μL;5U Ex Taq 0.2 μL;ddH2O12.1 μL。PCR反应条件:95℃预变性5 min,95℃变性30 s,55℃退火30 s,72℃延伸1 min30 s,共24个循环,72℃延伸10 min。所得测序结果用blast与GenBank中的核酸数据进行比对分析,用MEGA 4.0软件构建进化树。
2.2.3 热解液的预处理热解液用5%活性炭+Ca(OH)2常温预处理1 h后,过滤除去活性炭备用。
2.2.4 热解液成分分析将处理前后的热解液用乙酸乙酯萃取3次(1:3体积比),合并乙酸乙酯用无水硫酸钠脱水后过滤进行气相色谱(GC)分析。
2.2.5 HPLC及GC分析HPLC:Aminex HPX-87H Lon Exclusion column分析柱,流动相为0.05 mmol·L-1的硫酸溶液,流速0.5 mL·min-1,柱温35℃。
GC:Agilent DB-5MS(30 m×0.25 mm×0.25 μm)分析柱,载气为高纯氮,升温程序:初始温度40℃维持2 min,3℃·min-1升至120℃,5℃·min-1升至250℃,维持20 min。流量1.6 mL·min-1,分流比10:1,检测器温度240℃。
2.2.6 内醚糖利用率配制11.52 mg·mL-1的内醚糖溶液,梯度稀释为5.76、2.88、1.44、0.72、0.36 mg·min-1,经0.45 μm微孔滤膜,HPLC分析,得内醚糖浓度(x)与峰面积(y)对应的标准曲线。y=379131.1x+7.17(R2=0.99958),内醚糖利用率(%)=(原液中内醚糖量-转化液体中内醚糖量)×100%/原液中内醚糖量。
3 结果与分析 3.1 菌株内醚糖同化能力将筛选到的具有同化内醚糖能力的3株菌分别为命名为ZS2、GT、FX。实验室原保藏的红假单胞菌XJ对内醚糖的利用率为52%(10 d),ZS2和FX对内醚糖利用率为100%(4 d)。GT菌对内醚糖的利用率为100%(7 d),ZS2、GT、FX菌对内醚糖的利用率见图 1所示。与文献中斯达油脂酵母对内醚糖的利用率相比[15],本工作筛选到的ZS2和FX菌转化效率更高。
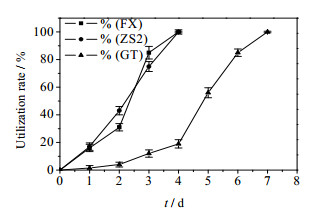
|
图 1 FX/ZS2/GT菌株对内醚糖的转化利用 Fig.1 Utilization rates of levoglucosan by FX/ZS2/GT strains |
菌液呈黄绿色, 在内醚糖培养基平板上2 d可长出菌落,3 d后菌落中间生成黄绿色孢子,菌丝发达多分枝,有膈,孢子球形(图 2)。

|
图 2 ZS菌的孢子与菌丝形态 Fig.2 Spore and hypha morphology of the ZS2 strain(40×10) |
经分析,ZS2的ITS全长为1092 bp,用Blast与Gene Bank中的数据构建进化树比对发现,该微生物与嗜松青霉(Penicillium pinophilum)吻合,结合菌体形态、生理生化分析和分子生物学方法,鉴定该菌为嗜松青霉(Penicillium pinophilum)。
3.2.2 FX菌株鉴定在PDA培养基上的菌落呈灰绿色且有放射状沟纹,菌丝无膈,有帚状分生孢子头,孢子呈灰绿色。孢子和菌丝的形态见图 3所示。
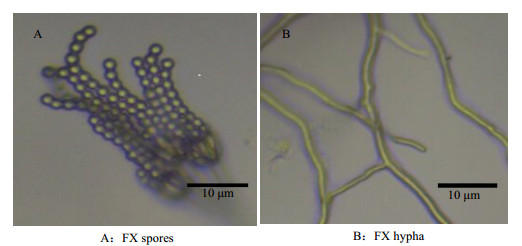
|
图 3 FX菌的孢子与菌丝形态 Fig.3 Spore and hypha morphology of the FX strain(40×10) |
据分析,FX的ITS全长为1040 bp,用Blast与Gene Bank中的数据构建进化树和比对分析,该菌与桔青霉(Penicillium citrinum)最为吻合,结合形态、生理生化和分子生物学方法,鉴定该菌为桔青霉(Penicillium citrinum)。
3.2.3 GT菌的鉴定GT菌在固体PDA培养基上生长初期呈金黄色,生长后期呈褐色,菌丝发达,分生孢子头呈放射状,孢子和菌丝见图 4所示。
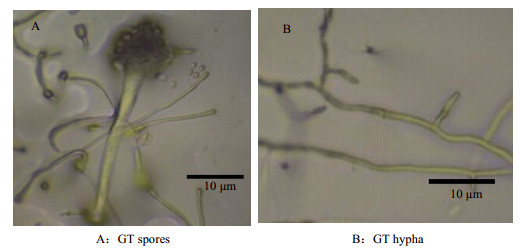
|
图 4 GT菌的孢子与菌丝形态 Fig.4 Spore and hypha morphology of the GT strain(40×10) |
据分析,GT的ITS全长为1534 bp,利用Blast程序将序列与GeneBank数据库中的数据进行比对发现,与冠突散囊菌(Eurotium cristatum)的序列最为吻合,结合菌落与生理生化特征及分子生物学分析,鉴定该菌为冠突散囊菌(Eurotium cristatum)。
3.3 对处理热解液的利用将上述4株菌接入未经处理的热解液中,发现只有红假单胞菌能生长。分析结果表明,经14 d的培养后,红假单孢菌对热解液中内醚糖(15.35 min)利用率为69%,自然界中能利用内醚糖的微生物不多[17],红假单胞菌能利用未经预处理热解液中的内醚糖的结果表明对该菌株进行综合利用有着非常积极的意义。
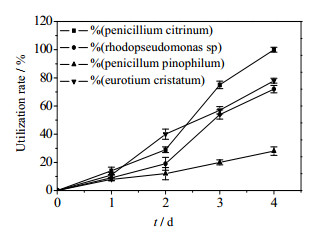
3.4 对预处理热解液的利用对热解液用5%活性炭和Ca(OH)2经1 h的常温吸附后,过滤配成含4%的培养液。分别接入4菌株培养,定时取样分析对内醚糖的利用率,结果见图 6所示。
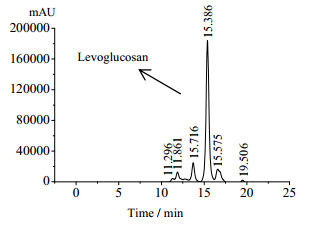
|
图 5 热解液的HPLC分析 Fig.5 HPLC spectrum of the pyrolysis liquidc |
|
图 6 不同菌株对4%脱毒热解液中内醚糖的利用 Fig.6 Utilization rates of levoglucosan by different strains in 4% pretreated pyrolysis liquid |
由图 6可见,所用各菌可在预处理后的热解液培养基中生长(4 d)。桔青霉、红假单胞菌、嗜松青霉和冠突散囊菌对内醚糖的利用率分别为100%,78%,72%和28%。
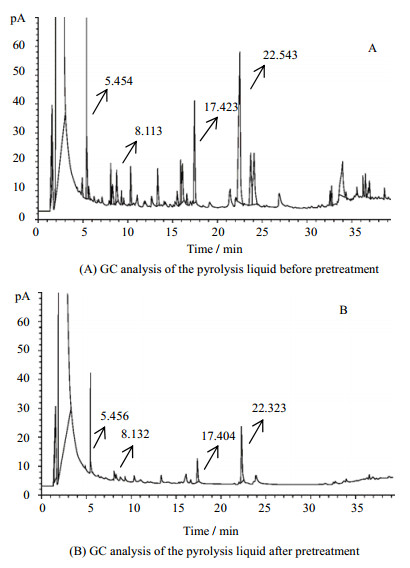
3.5 预处理对热解液成分的影响对预处理前后的热解液进行气相色谱分析,结果见图 7所示。
|
图 7 预处理前后热解液的气相色谱 Fig.7 GC analysis of the pyrolysis liquid before pretreatment(A) and after pretreatment(B) |
对热解液成分的分析结果表明,其醛酮类物质以糠醛(抑菌能力强)含量最高。由图 7和表 1可见,热解液经处理后,六甲基环三氧硅烷、1, 2-环戊二酮、5-甲基糠醛、3-甲基-1, 2-环戊二酮和羟甲基呋喃酮的脱除率达100%,糠醛脱除率77.1%,2-呋喃甲醛、2-乙酰呋喃、左旋葡糖酮烯等物质的量也分别有不同程度的降低(77.1%、83.2%和77.3%)。
| 表 1 预处理后热解液中的成分变化 Table 1 Change of the components in pretreated pyrolysis liquid |
(1) 本工作筛选的嗜松青霉(Penicillium pinophilum)、桔青霉(Penicillium citrinum)、冠突散囊菌(Eurotium cristatum)和红假单胞菌(Rhodopseudomonas sp.)都能高效同化内醚糖,其对内醚糖和热解液的利用是首次发现。
(2) 与文献报道的微生物利用内醚糖的效率相比,本工作筛选的菌株对内醚糖的利用率很高,嗜松青霉、桔青霉在4 d对内醚糖的利用率达100%,冠突散囊菌在7 d对内醚糖的利用率也达100%。
(3) 红假单胞菌可在未经脱毒处理的热解液中生长,在14 d对内醚糖的利用率达69%。
(4) 对热解液的预处理可使三株真菌也能利用热解液中的内醚糖,其中红假单孢菌的利用效率大为提高(从14 d的69%提高至4 d的78%)。
(5) 对可利用内醚糖和热解液菌株的筛选对实现内醚糖与热解液的高效利用提供了更多可选择的菌株与方法。
| [1] | ZHANG Hong-xun(张洪勋), DAI Jiang-hong(代江红), WANG Xiao-yan(王晓燕), et al. A method of promotion the growth of pichia stipitis and production ethanol by levoglucosan(一种促进树干毕赤酵母的生长和发酵产乙醇的方法):CN, 101531989 A[P]. 2009-04-22. |
| [2] | XIE Qing-ruo(谢清若), TONG Zhang-fa(童张法), WEI Teng-you(韦藤幼) . Optimization of bamboo pyrolysis process to prepare bio-oil by response surface methodology(响应曲面法优化竹材热裂解制备生物油的工艺研究)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2012, 26 (3) : 487-492 |
| [3] | FAN Yong-sheng(樊永胜), CAI Yi-xi(蔡忆昔), LI Xiao-hua(李小华) . Bio-oil analysis and optimization of bio-oil yield from vacuum pyrolysis of rape straw using response surface methodology(响应面法优化油菜秸秆真空热解液化工艺及生物油分析)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2015, 29 (3) : 628-633 |
| [4] | Giannoni M, Martellini T, Del Bubba M . The use of levoglucosan for tracing biomass burning in PM2.5 samples in Tuscany[J]. Environmental Pollution , 2012, 167 : 7-15 DOI:10.1016/j.envpol.2012.03.016 |
| [5] | CHANG Dong-dong(常冬冬), YU Zhi-sheng(余志晟), ZHANG Hong-xun(张洪勋) . Progress on pyrolysis of cellulose and its conversion to ethanol(纤维素热解液及其产物转化乙醇的研究进展)[J]. Chinese Agricultural Science Bulletin(中国农学通报) , 2012, 28 (26) : 183-189 |
| [6] | REN Pu-xian(任普鲜), JIANG Jian-chun(蒋剑春), YANG Xiu-shan(杨秀山) . Research progress on production of ethanol as fuel from fast pyrolysis products of lignocellulose(木质纤维素快速热解产物生产燃料乙醇研究进展)[J]. Biomass Chemical Engineering(生物质化学工程) , 2009, 43 (3) : 47-51 |
| [7] | LU Qiang(陆强), ZHU Xi-feng(朱锡峰) . Production of levoglucosenone from pyrolysis of cellulose catalyzed by solid superacids(利用固体超强酸催化热解纤维素制备左旋葡萄糖酮)[J]. Journal of Fuel Chemistry and Technology(燃料化学学报) , 2011, 39 (6) : 425-431 |
| [8] | DSTAG Radlein, A Grinshpun, J Piskorz . On the presence of anhydro-oligosaccharides in the sirups from the fast pyrolysis of cellulose[J]. Journal of Analytical and Applied Pyrolysis , 1987, 12 (1) : 39-49 DOI:10.1016/0165-2370(87)80013-X |
| [9] | Scott D S, Piskorz J, Radlein D . Yield of chemicals from biomass-based fast pyrolysis oils[J]. Energy Biomass Wastes , 1993, 16 : 797-809 |
| [10] | Lede J, Panagopoulos J, Li H Z . Fast pyrolysis of wood:direct measurement and study of ablation rate[J]. Fuel , 1985, 64 (11) : 1514-1520 DOI:10.1016/0016-2361(85)90365-5 |
| [11] | Bridgwater A V, Boocock D G B . Developments in thermochemical biomass conversion[M]. London: Blackie Academic and Professional, 1996 : 611 -621. |
| [12] | Bennett N M, Helle S S, Duff S J B . Extraction and hydrolysis of levoglucosan from pyrolysis oil[J]. Bioresource Technology , 2009, 100 (23) : 6059-6063 DOI:10.1016/j.biortech.2009.06.067 |
| [13] | Mullen C A, Boateng A A, Goldberg N . Bio-oil and bio-char production from corn cobs and stover by fast pyrolysis[J]. Biomass and Bioenergy , 2010, 34 (1) : 67-74 DOI:10.1016/j.biombioe.2009.09.012 |
| [14] | Nakagawa M, Sakai Y, Yasui T . Itaconic acid fermentation of levoglucosan[J]. Journal of Fermentation Technology , 1984, 62 (2) : 201-203 |
| [15] | Prosen E M, Radlein D, Piskorz J . Microbial utilization of levoglucosan in wood pyrolysate as a carbon and energy source[J]. Biotechnology Bioengineering , 1993, 42 (4) : 538-541 DOI:10.1002/(ISSN)1097-0290 |
| [16] | Zhuang X L, Zhang H X, Yang J Z . Preparation of Levoglucosan by pyrolysis of cellulose and its citric acid fermentation[J]. Bioresource Technology , 2001, 79 (1) : 63-66 DOI:10.1016/S0960-8524(01)00023-2 |
| [17] | YU Zhi-sheng(余志晟), NING Bo-ying(宁洎英), ZHANG Ling(张玲) . Microbial investigation on assimilation and ethanol fermentation of levoglucosan from cellulosic pyrolysis products(纤维素热解产物内醚糖的微生物同化与乙醇发酵测试)[J]. Chinese Agricultural Science Bulletin(中国农学通报) , 2011, 27 (6) : 342-349 |
| [18] | WU Meng-yao, HU Xiang . Isolation and identification of a strain of 1-hexyl-3-methylimidazolium hexafluorophosphatedegrading bacterium[J]. J Chem Eng of Chinese Univ , 2014, 28 (6) : 431-437 |




