2. 浙江大学 生物质化工教育部重点实验室,浙江 杭州 310027
2. Key Laboratory of Biomass Chemical Engineering of Ministry of Education, College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, China
从植物油的加工副产物(脱臭馏出物)中,通过提取可以得到一些结构相近的植物甾醇同系物,可广泛应用于医药、食品、饲料及化妆品等领域。例如,豆甾醇具有很高的药用和经济价值,可作为生产甾体药物关键中间体雄甾二烯二酮(4AD)的主要起始原料,也可用作无刺激保湿剂、乳化助剂及调理剂等;β-谷甾醇能明显降低血清胆固醇,可转化成药用维生素D3原料以及多种甾体激素,也可取代胆甾醇作为脂质体膜材。豆甾醇和β-谷甾醇的分子结构见图 1。
|
图 1 豆甾醇和β-谷甾醇的分子结构 Fig.1 Molecular structures of stigmasterol and β-sitosterol |
甾醇同系物分子的结构差异很小,但其生物活性却相差很大,例如β-谷甾醇具有明显的抗炎性,而豆甾醇则具有一定的表面活性作用。由于β-谷甾醇和豆甾醇结构差异仅在于侧链双键,具有较大的分离难度,至今没有一项适于工业化的技术(如溶剂结晶法、固定床吸附法和传统液-液萃取法)能把植物甾醇的分离成本控制在可接受的范围,通过多次结晶或萃取等操作得到的产品仍达不到高纯度要求。例如,万建春等采用结晶法提纯豆甾醇和β-谷甾醇,经4次结晶操作后才使β-谷甾醇的纯度达到90%[1];现有的有机溶剂种类有限,传统液-液萃取法选择性较低,达到分离要求需要多次单级萃取或使用多级逆流萃取工艺,操作费用大;利用碱性阴离子交换树脂吸附分离,具有较高的选择性,但存在溶剂消耗量大而传质慢、处理量小等问题,难以满足工业化大规模生产。近年来的研究结果表明,离子液体具有独特的理化性质,能克服传统溶剂的缺点,萃取效率显著提高[2],对结构相似物的分离表现出优异的分离选择性[3-6]。考虑工业生产的需要,本文选用技术成熟、成本较低的N, N′-二烷基咪唑盐类离子液体,通过真实溶剂似导体屏蔽模型(conductor-like screening model for real solvents, COSMO-RS)预测[7-14],筛选出高选择性的离子液体,构建离子液体液-液两相体系,结合高效液相色谱(HPLC)分析方法测定植物甾醇的分配系数和分离选择性,得到合适的复合萃取剂,实现植物甾醇高选择性分离。
2 COSMO-RS预测首先,使用Gaussian 09程序包对化合物分子的几何构型精确优化,采用密度泛函理论(DFT),在B3LYP/6-31G (d, p)水平下得到最低能量的稳定结构。然后,使用Turbomole 2011程序包[15],采用RI-DFT方法,在Ahlrichs-TZVP水平下得到分子的能量和分子表面屏蔽电荷密度,以及每个分子的σ-profile。最后,通过COSMO therm 2011程序包[16],使用参数文件BP_TZVP_C30_1201.ctd计算离子液体与甾醇同系物的相互作用,从而筛选出高选择性离子液体复合萃取剂。
3 实验 3.1 实验原料和仪器植物甾醇标样和粗品(标样购自百灵威科技有限公司,粗品为实验室自制,经HPLC测定豆甾醇≥36%,β-谷甾醇≥42%);离子液体([bmim]Cl,≥99 %),购自上海艾科股份有限公司,使用前由卡尔费休水分测定仪测得水份含量低于0.3 %;其余试剂如正己烷、甲醇、正丁醇、乙腈等均为分析纯,购自杭州汇普化工仪器有限公司。
Waters液相色谱仪(美国Waters公司),DSHZ-300A振荡水浴槽(苏州培英实验设备有限公司),AS20500A超声波清洗器(天津奥特赛恩斯仪器有限公司),AL204101电子分析天平(梅特勒-托利多仪器有限公司),ZKF-1型卡尔费休水分测定仪(上海市隆拓仪器设备有限公司)。
3.2 实验方法将一定量的甾醇原料溶于正己烷中配成原料液,然后将此正己烷溶液与相同体积的离子液体复合萃取剂加入到10 mL具塞锥形瓶中,密封。将装有液-液两相体系的锥形瓶置于恒温振荡器中,在设定温度(℃)下200 r.min−1振荡数小时(每隔5 min取样分析,确定萃取平衡的时间为10~20 min。因此,本文选取两相的振荡时间为3 h,确保体系达到充分的萃取平衡),然后在相同温度下静置2~3 h。待两相彻底分离后,用预先保温的移液管分别从上下两相取样1 mL至容量瓶中,由甲醇稀释定容至刻度。最后用HPLC对样品进行分析。每组数据重复3次,取平均值。
通过实验确定HPLC的分析条件:色谱柱为C18反相柱(46 mm×250 mm,粒径5 μm),柱温35℃,流速1.2 mL·min−1,纯甲醇为流动相,紫外检测波长210 nm,进样体积为10 μL。配制不同浓度的甾醇标样,得到标准曲线。分配系数D为甾醇在萃取相中的浓度除以萃余相中的浓度得到,见式(1);豆甾醇对β-谷甾醇的分离选择性S由豆甾醇的分配系数除以β-谷甾醇的分配系数得到,见式(2)。
| $ {D_{{\text{stig}}}} = \frac{{C_{_{{\text{stig}}}}^{^{{\text{ext}}}}}}{{C_{_{{\text{stig}}}}^{^{{\text{raff}}}}}}~~~~~~{D_{{\text{beta - stio}}}} = \frac{{C_{_{{\text{beta - stio}}}}^{^{{\text{ext}}}}}}{{C_{_{{\text{beta - stio}}}}^{^{{\text{raff}}}}}} $ | (1) |
| $ {S_{{\text{stig/beta - sito}}}} = \frac{{{D_{{\text{stig}}}}}}{{^{}{D_{{\text{beta - sito}}}}}} $ | (2) |
式中,Dstig和Dbeta-stiO表示的分别是豆甾醇和β-谷甾醇的分配系数,ext表示萃取相,raff表示萃余相。
4 结果与讨论 4.1 COSMO-RS预测298.2 K,COSMO-RS预测豆甾醇在10种有机溶剂和10种具有不同氢键碱性阴离子1-丁基-3-甲基咪唑类离子液体中的溶解度及极性、氢键、范德华等作用力,结果见表 1。
|
|
表 1 298.2 K下COSMO-RS预测豆甾醇在溶剂中的溶解度及极性、氢键、范德华等相互作用 Table 1 COSMO-RS predicted values of solubility and corresponding interaction energies for stigmasterol in solvents at 298.2 K |
从表 1可知,豆甾醇在10种有机溶剂中的溶解度受范德华相互作用(Evan der Waals)的影响较小,主要由Misfit相互作用(EMisfit)和氢键相互作用(EH-bonding)共同决定。在极性溶剂DMSO、1, 4-二氧六环、乙酸乙酯、丁酮中豆甾醇的溶解度相对较大,在正己醇、正丁醇、乙醇中氢键对溶解度的影响也不容忽视,且溶解度随EH-bonding的增强呈整体升高趋势。由表 1数据可见,豆甾醇在10种传统有机溶剂中溶解度都不是很大,尤其在乙腈和正己烷中非常小,限制了萃取的容量。
由表 1知,豆甾醇在10种离子液体中的溶解度受Misfit相互作用(EMisfit)和范德华相互作用(Evan der Waals)的影响较小,而与氢键相互作用(EH-bonding)呈现较大的相关性。究其原因,前者可能是由于咪唑类离子液体的偶极矩(Kamlet-Taft参数,π)差别较小,后者也许是豆甾醇分子中具有弱酸性的酚羟基,易与碱性较强的离子液体形成氢键的缘故。例如,[Bmim]Cl、[Bmim]MeCO2、[Bmim]EtCO2的Kamlet-Taft参数(β)分别为0.84、1.05和1.16,具有较强的氢键碱性,导致豆甾醇在上述离子液体中的溶解度(xcal)较大(依次为2.241、2.788、和3.067)。其它离子液体的氢键碱性(β)均远小于常规溶剂(甲醇、丙酮等),与乙腈(β为0.370)接近,故溶解度很小。由此可以预测,氢键碱性较强的离子液体将增加萃取剂的萃取容量,萃取分离豆甾醇的效果会更好。
表 2列出了二种甾醇的分子量、分子体积及COSMO-RS分子描述符Sig 2,
|
|
表 2 豆甾醇和β-谷甾醇的COSMO-RS分子描述符(Sig 2, HB_acc3和HB_don3) Table 2 COSMO-RS descriptors of Sig 2, HB_acc3 and HB_don3 for stigmasterol and β -sitosterol |
HB_acc3和HB_don3。其中,Sig2表示极性或极化;HB_acc3为氢键受体,表示氢键碱性;HB_don3为氢键供体,表示氢键酸性。从表 2可以看出,β-谷甾醇分子量稍大,与溶剂分子产生相互作用比豆甾醇略大,但豆甾醇的分子极性很明显高于β-谷甾醇,氢键相互作用稍高于β-谷甾醇,其原因可能是豆甾醇分子有一个双键,而后者没有。由此可以预测,使用极性较强的离子液体萃取剂有望取得更好的分离效果,萃取剂极性增大,与豆甾醇的亲和力也会增大,易形成萃取相分离。
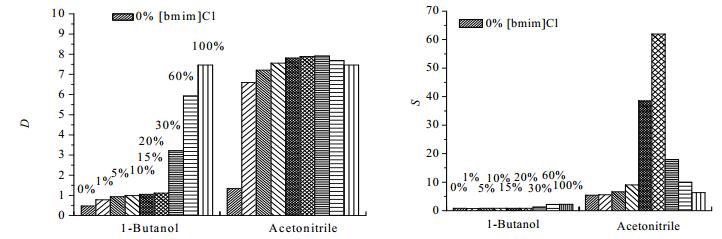
4.2 萃取分离效果根据以上COSMO-RS预测,实验筛选离子液体[bmim]Cl为代表,复配离子液体-分子溶剂混合物。由于甾醇分子极性较弱,因此,选取弱极性溶剂正己烷,构建[bmim]Cl -正丁醇/正己烷和[bmim]Cl -乙腈/正己烷三元两相体系,考察了离子液体复合萃取剂对豆甾醇的萃取效果,图 2画出了稀释剂种类、离子液体浓度对豆甾醇分配系数D、豆甾醇对β-谷甾醇萃取选择性S的影响(30℃)。
|
图 2 稀释剂种类、离子液体浓度对豆甾醇分配系数(D)、豆甾醇对β-谷甾醇萃取选择性(S)的影响 Fig.2 Effects of diluents and ionic liquid concentrations on distribution coefficient (D) and separation selectivity (S) |
由图 2可见,[bmim]Cl -乙腈作萃取剂随离子液体浓度的增加,豆甾醇分配系数增大,仅加入1%摩尔分数的[bmim]Cl,分配系数即从1.34上升到6.6,之后缓慢增加,至20%~30%达到最大,达7.7左右;[bmim]的Cl摩尔分数继续增加,分配系数反而下降。萃取选择性系数与分配系数有相同的变化趋势,但变化更显著,当[bmim]Cl的摩尔分数为20%时,选择性可达65.8,是纯乙腈的54倍。这可能是因为离子液体的摩尔分数增大,其氢键碱性参数β值增大[19],可能使得复合萃取剂的极性增大,从而与豆甾醇的亲和力增大,实验结果与COSMO-RS预测相吻合。当离子液体摩尔分数大于30%,分配系数变化不大,但选择性开始下低,这可能是因为离子液体体系的黏度增大,使传递过程减慢,从而降低了萃取分离效果。
从图 2还获悉,正丁醇与离子液体组成混合萃取剂后,分配系数随离子液体浓度的增加而增加,离子液体的加入,提高了豆甾醇的分配系数,但萃取选择性并没有显著变化,萃取效果并不好,说明正丁醇不适合作该萃取体系的稀释剂。这可能是植物甾醇是弱极性疏水性物质,而离子液体是一种强极性的亲水物质,只有加入像乙腈一类极性相对较小的稀释剂,才可能对植物甾醇的溶解性取到较好调控。因此,虽然离子液体本身有可调性,但只有引入合适的稀释剂才可起到双重调节,才可进一步提高萃取分离效果。
实验结果表明,[bmim]Cl -乙腈/正己烷三元两相体系的互溶程度,明显低于[bmim]Cl -正丁醇/正己烷体系,即使随着[bmim]Cl摩尔分数的增加也是如此。因此,构建不互溶的液-液两相体系有利甾醇同系物的萃取分离。实验还考察了不同温度(30、40、50℃)下, 20% [bmim]Cl -乙腈复合萃取剂对豆甾醇的萃取效果(如表 3所示)。从表 3看出,分配系数和选择性系数都随温度的升高而下降,这可能是随着温度的升高,液-液两相体系的互溶度增大。因此,常温下进行萃取分离实验是可行的。
|
|
表 3 温度对豆甾醇萃取分离的影响 Table 3 Effects of temperature on stigmasterol extraction |
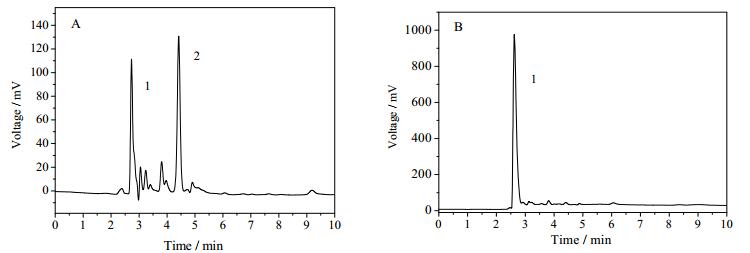
图 3为[bmim]Cl -乙腈复合萃取剂分离前后的豆甾醇HPLC图。图中,A为植物甾醇原料HPLC图(1为豆甾醇吸收峰,2为β-谷甾醇吸收峰);B为摩尔分数为20%的[bmim]Cl -乙腈萃取剂15 min后得到豆甾醇HPLC图。
|
图 3 离子液体复合萃取剂萃取分离前(A)、后(B)的豆甾醇HPLC谱图 Fig.3 HPLC spectra of phytosterols before (A) and after (B) separation by ionic liquid composite extractants (1 for stigmasterol; 2 for β-sitosterol) |
由图 2和图 3所知,用摩尔分数为20%的[bmim]Cl-乙腈作萃取剂分离植物甾醇有较好的萃取性能,从图 3B可见,用20% [bmim]Cl-乙腈萃取15 min后得到的产物几乎是豆甾醇。最后,通过向萃取相中添加正己烷进行反萃取回收,豆甾醇的纯度可达98.3%,经蒸馏,回收离子液体重新利用。
5 结论采用COSMO-RS模型预测了豆甾醇在10种有机溶剂和10种离子液体中的溶解特性及多重相互作用,预测结果表明,豆甾醇在有机溶剂中的溶解度主要由极性和氢键相互作用共同决定,其溶解度都比较小,限制了萃取容量;在离子液体中的溶解度随氢键相互作用的增强而增大,氢键碱性较强的离子液体将增加萃取剂的萃取容量。实验筛选出以[bmim]Cl离子液体为代表,构建了[bmim]Cl -正丁醇/正己烷和[bmim]Cl -乙腈/正己烷两相体系,考察了离子液体复合萃取剂对豆甾醇的萃取效果,实验结果表明:[bmim]Cl -正丁醇/正己烷两相体系并不适用于植物甾醇同系物的萃取分离;[bmim]Cl -乙腈/正己烷两相体系是合适的萃取体系,随[bmim]Cl浓度的增加,分配系数和萃取选择性系数的增加十分显著,当[bmim]Cl的摩尔分数为20 %时,豆甾醇的分配系数可达7.89,豆甾醇对β-谷甾醇的分离选择性可达65.8,是纯乙腈为萃取剂时的54倍。通过反萃回收,得到的豆甾醇纯度可达98.3 %。
| [1] | WAN Jian-chun(万建春), JIANG Bo(姜波). Separation and purification of β-sitosterol and stigmasterol from soybean phytosterol using crystallization(结晶法分离纯化大豆甾醇中β-谷甾醇和豆甾醇单体)[J]. Food science and technology(食品科技), 2008(8): 127-131. DOI:10.3969/j.issn.1005-9989.2008.08.038. |
| [2] | LIU Yan(刘妍), ZHANG Chen(张宸), WU Ke-jun(吴可君). Microchannel extraction of butanone oxime from aqueous ammonium sulfate solution using ionic liquids(微通道内离子液体萃取硫酸铵水溶液中丁酮肟的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2017, 31(3): 530-537. DOI:10.3969/j.issn.1003-9015.2017.03.005. |
| [3] | Cao Y F, Xing H B, Yang Q W, et al. Separation of soybean isoflavone aglycone homologues by ionic liquid-based extraction[J]. Journal of Agricultural and Food Chemistry, 2012(60): 3432-3440. |
| [4] | Yang Q W, Xing H B, Su B G, et al. The essential role of hydrogen-bonding interaction in the extractive separation of phenolic compounds by ionic liquid[J]. AIChE Journal, 2013(59): 1657-1667. |
| [5] | Xu D, Yang Q W, Su B G, et al. Enhancing the basicity of ionic liquids by tuning the cation-anion interaction strength and via the anion-tethered strategy[J]. Journal of Physical Chemistry B, 2014(118): 1071-1079. |
| [6] | JIN Wen-bin(金文彬), LI Xue-nan(李雪楠), ZHANG Yi(张依), et al. Separation of structurally-related compounds with ionic liquids(离子液体在结构相似物分离中的进展)[J]. Scientia Sinica Chimica(中国科学:化学), 2016, 46(12): 1251-1263. |
| [7] | Eckert F, Klamt A. COSMOtherm. Version C3.0, Release 12.01[M]. Leverkusen: COSMOlogic GmbH & Co. KG, 2012. |
| [8] | Klamt A. COSMO-RS: from quantum chemistry to fluid phase thermodynamics and drug design[M]. Amsterdam: Elsevier Science Ltd, 2005. |
| [9] | Klamt A. Conductor-like screening model for real solvents:a new approach to the quantitative calculation of solvation phenomena[J]. Journal of Physical Chemistry, 1995(99): 2224-2235. |
| [10] | Klamt A, Jonas V, Bürger T, et al. Refinement and parametrization of COSMO-RS[J]. Journal of Physical Chemistry A, 1998(102): 5074-5085. |
| [11] | Klamt A, Eckert F. COSMO-RS:a novel and efficient method for the a priori prediction of thermophysical data of liquids[J]. Fluid Phase Equilibria, 2000(172): 43-48. |
| [12] | Klamt A, Eckert F, Hornig M, et al. Prediction of aqueous solubility of drugs and pesticides with COSMO-RS[J]. Journal of Computational Chemistry, 2002, 23(2): 275-281. DOI:10.1002/jcc.v23:2. |
| [13] | XU Qing-qing(许青青), SU Bao-gen(苏宝根), CHEN Wei(陈蔚), et al. Determination, correlation and prediction of solubilities of desmosterol in five organic solvents(链甾醇在五种有机溶剂中溶解度的测定、关联及预测)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2014, 28(3): 443-448. DOI:10.3969/j.issn.1003-9015.2014.03.001. |
| [14] | XU Qing-qing(许青青), SU Bao-gen(苏宝根), CHEN Wei(陈蔚), et al. Solubility prediction for cholesterol and desmosterol in mixed solvents via NRTL-SAC and COSMO-RS(胆甾醇和链甾醇在混合溶剂中溶解度的NRTL-SAC和COSMO-RS预测)[J]. CIESC Journal(化工学报), 2013, 64(10): 3505-3513. |
| [15] | Ahlrichs R, Bär M, Häser M, et al. Electronic structure calculations on workstation computers:the program system turbomole[J]. Chemical Physics Letters, 1989, 162(3): 165-169. DOI:10.1016/0009-2614(89)85118-8. |
| [16] | Eckert F, Klamt A. COSMOthermuser's manual. Version C3.0, Release 12.01[Z]. Leverkusen: COSMOlogic GmbH & Co. KG, 2012. |
| [17] | Wu Y S, Sasaki T, Kazushi K, et al. Interactions between spiropyrans and room-temperature ionic liquids:Photochromism and solvatochromism[J]. Journal of Physical Chemistry B, 2008, 112(25): 7530-7536. DOI:10.1021/jp800957c. |
| [18] | Muldoon M J, Gordon C M, Dunkin I R. Investigations of solvent-solute interactions in room temperature ionic liquids using solvatochromic dyes[J]. Journal of the Chemical Society-Perkin Transactions 2, 2001(4): 433-435. |
| [19] | YANG Qi-wei (杨启炜). Separation of natural bioactive homologues by ionic liquids-mediated extraction (离子液体萃取分离天然活性同系物)[D]. Hangzhou (杭州): Zhejiang University (浙江大学), 2014. http://cdmd.cnki.com.cn/Article/CDMD-10335-1011244859.htm |




