2. 内蒙古自治区生物质能源化利用重点实验室,内蒙古 包头 014010;
3. 内蒙古科技大学 矿业研究院,内蒙古 包头 014010
2. Inner Mongolia Key Laboratory of Biomass-Energy Conversion, Baotou 014010, China;
3. Research Institute of Mining, Inner Mongolia University of Science and Technology, Baotou 014010, China
厌氧发酵产沼气可在处理有机废水及有机固体废弃物的同时实现有机废弃物的能源化利用,是为数不多技术比较完善、经济、且可大规模获取生物能源的生物技术之一,其对能源及有机废弃物环境污染问题都具有十分重要的意义。
沼气是各种有机物质在隔绝空气(还原条件),并在适宜的温度、pH值下,经过微生物的发酵作用产生的一种可燃烧气体(主要成分为甲烷),属于可再生的二次能源。在沼气产生过程中,产甲烷菌不能直接利用丙酸、丁酸、乳酸及醇类(如乙醇、丁醇)等发酵中间产物,而丙酸和丁酸的累积对产甲烷菌具有毒害作用。一直以来,认为丙酸等发酵中间产物只有在产酸菌和产甲烷菌共同作用下才能进一步降解。在产酸菌的作用下,丙酸等发酵中间产物先被转化为乙酸和H2,然后产甲烷菌分别利用乙酸和H2产甲烷。
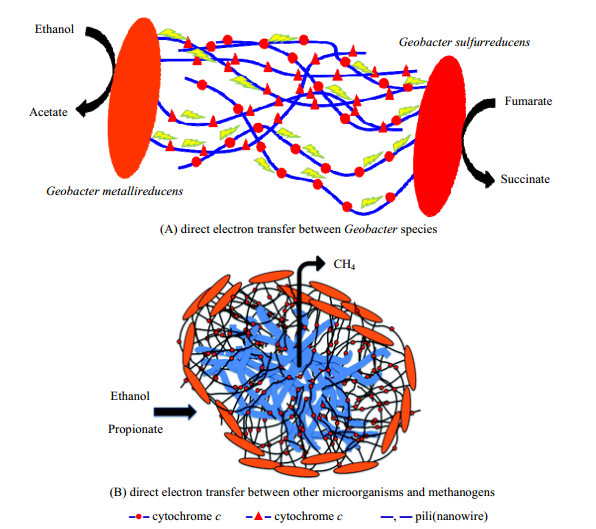
然而,SUMMERS等[1]首次发现并证实Geobacter metallireducens和Geobacter sulfurreducens所形成的共培养微生物(co-culture)能通过种间直接电子传递(direct interspecies electron transfer,DIET)的方式代谢乙酸并还原富马酸(图 1(A))。之后,研究发现某些微生物与产甲烷菌之间形成的co-culture可通过DIET的方式同时实现丙酸或醇类等发酵中间产物进一步降解及CO2还原产甲烷[2-13]。在这一过程中,某些电活性微生物首先将丙酸或醇类等发酵中间产物转化为乙酸、H+及电子,产生的电子直接被传递到产甲烷菌胞内,然后产甲烷菌利用电子及H+还原CO2产甲烷。如在G. metallireducens与Methanosaeta harundinacea 6Ac所形成的co-culture中,G. metallireducens首先将乙醇转化为乙酸、H+及电子,然后M. harundinacea 6Ac直接利用G. metallireducens代谢乙醇产生的电子将CO2还原为甲烷[5]。通过DIET,微生物间可以以一种比以前更直接、更有效的方式共享可用的能量[4, 14]。虽然DIET方式耦合产甲烷研究取得很大进展,但是目前对DIET方式耦合产甲烷还缺乏深入研究。
本文对DIET方式耦合还原CO2产甲烷研究现状进行概述,重点分析DIET方式耦合还原CO2产甲烷研究存在的问题,并讨论其今后的研究方向,以为DIET方式耦合还原CO2产甲烷研究提供参考。
2 以DIET方式传递电子的微生物DIET首次被发现并证实存在于G. metallireducens和G. sulfurreducens共培养微生物,该共培养微生物生长在乙醇作为电子供体和富马酸作为电子受体的培养基中(图 1(A))[1]。
近年来研究表明Geobacter species与产甲烷菌Methanosaeta species[2, 5]和Methanosarcina species[6-7, 9]也能通过DIET方式传递电子(图 1(B))。Geobacter species与Methanosaeta species间直接电子传递在G. metallireducens和Methanosaeta harundinacea共培养微生物耦合代谢乙醇产甲烷中得到了证[5]。在G. metallireducens和M. harundinacea 6Ac所形成的共培养微生物聚集体中,M. harundinacea 6Ac不仅具有表达CO2还原产甲烷时所需酶的完整基因,且这些基因的转录丰度很高。此外,转录组分析、14C同位素示踪及基因分析都表明M. harundinacea 6Ac可通过DIET方式从G. metallireducens接受电子,并利用获得的电子将CO2还原为甲烷,进而从分子水平证实了G. metallireducens和M. harundinacea 6Ac共培养微生物间存在DIET。除M. harundinacea 6Ac外,Methanosarcina barkeri 800也能通过与G. metallireducens所形成的微生物聚集体从G. metallireducens直接接受电子用于还原CO2产甲烷[6]。而在导电材料颗粒活性炭和纳米磁性四氧化三铁的介导下,Geobacter grbiciae与M. barkeri 800也能通过DIET耦合代谢乙醇产甲烷[16]。虽然有报道丙酸/丁酸氧化产酸菌[4, 17]、G. sulfurreducens[18]、Clostridium spp[19]及Anaerolineaceae[20]等能作为电子供体微生物与产甲烷菌通过DIET方式耦合还原CO2产甲烷,但是并没有获得纯的co-culture。此外,产甲烷菌Methanosarcina mazei[7]、Methanospirillum spp[18]、Methanolinea spp[18]及Methanothrix species[21]等也被认为能直接从胞外微生物接受电子还原CO2产甲烷,但是也没有获得纯的co-culture,且未从分子水平证实。PARK等[22]概述了产甲烷菌共培养中使用的微生物和从添加了导电材料的产甲烷反应器中混合菌群中富集的微生物,其电子供体微生物主要为Geobacter spp,而电子受体产甲烷菌主要Methanosarcina spp、Methanosaeta spp及Methanospirillum spp。但是,目前,只对G. metallireducens与G. sulfurreducens的co-culture、G. metallireducens与M. barkeri 800的co-culture、G. metallireducens与M. harundinacea 6Ac的co-culture及G. grbiciae与M. barkeri 800的co-culture有较深入的研究。但对于何种类型的微生物能与产甲烷菌通过DIET方式形成co-culture及哪些类型的产甲烷菌能通过DIET方式形成co-culture都缺乏深入研究。
3 导电材料对微生物间DIET方式耦合产甲烷的影响研究表明导电矿物颗粒(如四氧化三铁和赤铁矿)和导电碳材料(如生物炭、活性炭、碳纳米管及石墨烯)会促进微生物间直接电子传递[3-4, 8-9, 14, 20, 22-34]、缩短产甲烷的滞后时间[3, 20, 23, 35]、提高产甲烷速率[4, 20, 23, 25, 27, 31-33]、提高产甲烷的量[18, 32, 35-36]、影响菌群组成[18, 23, 27]及提高产甲烷系统对不利环境的抵抗能(如高有机负荷[37]、低pH值[20, 38]、高H2分压[20, 38]及高NH3-N[22, 35, 39])。
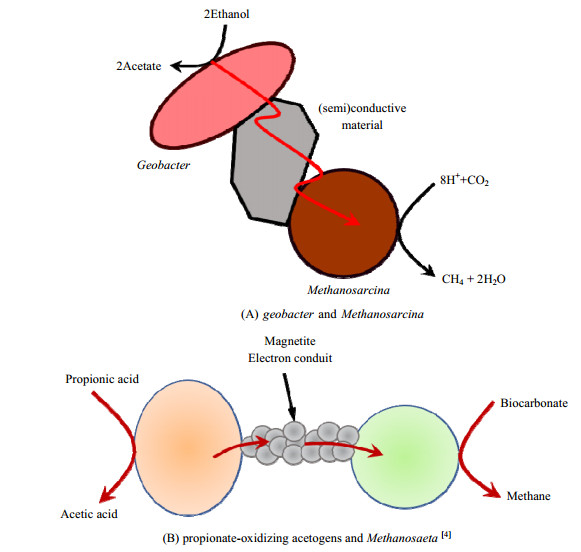
如KATO等[23]发现将四氧化三铁(Fe3O4)或赤铁矿(Fe2O3)加入到以乙醇或乙酸为底物、稻田土壤为接种物的反应器中,产甲烷的滞后时间大为缩短,且产甲烷速率显著提高(图 2A)。利用16S rRNA基因序列分析其菌落组成,结果表明添加Fe3O4或Fe2O3富集到的微生物主要为Geobacter species和Methanosarcina species,说明这些导电材料促进了微生物间的直接电子传递,从而促进了共生微生物的生长及协同产甲烷。在所富集的微生物中加入产甲烷菌特异性抑制剂(2-溴乙烷磺酸盐)不仅抑制了产甲烷菌的生长,而且也抑制了Geobacter species菌的生长,则进一步支持上述假设。WANG等[20]的研究表明,与常规操作相比,在厌氧消化系统中加入生物炭有效地将滞后时间缩短了27.5%~64.4%,并将最大甲烷生成率提高了22.4%~40.3%。LYU等[35]在厌氧消化系统中加入不同粒度的生物炭使产甲烷滞后时间缩短了降低5.9%~23.9%,而最大产气量提高23.5%~47.1%。CRUZ等[4]在产甲烷污泥中加入纳米Fe3O4将丙酸转化为甲烷的速率提高了33%,并认为Fe3O4在丙酸氧化产乙酸型微生物与CO2还原产甲烷菌之间起到电子通道作用(图 2(B))。添加了导电材料的产甲烷反应器其短的产甲烷滞后时间表明,通过DIET方式形成甲烷比通过氢气方式更快。
|
图 2 半导体及导体材料介导的微生物间直接电子传递 Fig.2 Direct interspecies electron transfer mediated by (semi)conductive materials |
此外,在厌氧消化系统中添加导电材料会影响系统的菌群组成。SHRESTHA等[40]研究了厌氧消化反应器中微生物菌群与颗粒炭导电性的相关性,结果发现反应器中Geobacter spp的丰度与颗粒炭导电性具有中度相关性。YANG等[28]在厌氧污泥消化过程中加入颗粒活性炭,结果发现颗粒活性炭的加入明显有利于H2利用产甲烷菌、Geobacter spp及其他能种间直接电子传递产甲烷菌的富集。在厌氧消化体系中,导电材料的加入主要富集到Geobacter spp、Syntrophomonas spp、Methanosaeta spp、Methanosarcina spp、及Methanospirillum spp等特殊的菌群[22]。
导电材料除了通过其导电性可以强化DIET、促进甲烷生成及影响系统的菌群组成外,还可以提高产甲烷系统对不利环境的抵抗能力。在传统的厌氧消化产甲烷系统中,高有机负荷极易造成酸化和较高的氢气分压,而较高的氢气分压又不利于丙酸及丁酸等中间产物进一步降解为产甲烷菌能利用的乙酸和氢气,从而导致丙酸及丁酸等中间产物的积累,丙酸的积累又会抑制产甲烷菌的活性及有机物的进一步降解。因此,在在传统的厌氧消化产甲烷系统中,厌氧消化产甲烷系统的有机负荷往往不高。由于导电材料介导的DIET产甲烷不需要利用氢气,从而使得该系统能耐受更高的有机负荷和更高的氢气分压。如添加了颗粒活炭的产甲烷反应器其耐受有机负荷高达26.5 kg COD (chemical oxygen demand)/(m-3·d-1)[37],而添加了碳布的厌氧反应器其耐受氢气的分压高达17.23 kPa[38]。此外,导电材料也可以提高系统耐低pH值[38]和高NH3-N浓度[22, 35]的能力,并具有缓解体系因挥发性脂肪酸积累导致pH值降低的能力[20, 35, 41]。ZHAO等[38]的研究表明,添加了碳布的厌氧反应器其pH耐受可低至6。可能是由于电活性产甲烷菌还原CO2产甲烷时胞内消耗大量的H+,胞内pH不会很低,进而不会影响胞内酶的活性和产甲烷菌的生长。PARK等[22]认为在导电材料上形成的生物膜可能使质子向生物膜细胞的传递比向悬浮细胞传递的慢。这一推测得到了生物质载体上附着的细胞能抵抗低pH值现象的支持[42]。PARK等[22]发现添加了颗粒活性的反应器,当NH3-N浓度在0.25 g·L-1时其产甲烷过程不受影响。由于炭基材料能吸附NH3[43],且颗粒活性炭或生物炭表面丰富的羧基基团可与NH3结合,因此在厌氧消化系统中颗粒活性炭或生物炭可能降低了本体NH3的浓度和减小了NH3对微生物的毒害。今后需对DIET方式产甲烷体系对低pH值和高氨抗性的机制进行研究。
尽管导电碳材料(如活性炭、碳布)被用于增强和稳定污水厌氧消化产甲烷[3, 44],但是这些导电材料是如何激发产甲烷菌产甲烷的机制还不完全清楚。LIU等[3]认为活性炭能激发产甲烷菌产甲烷很可能是由于这一材料具有一定的导电性,从而能允许产甲烷菌与其共生的微生物之间形成电连接,因为颗粒活性炭的导电性远比pili的导电性高(3 000 vs. 2~20 μS·cm-1)。如在添加了活性炭的G. metallireducens和M. barkeri 800共培养微生物中,发现G. metallireducens和M. barkeri 800分别与活性炭紧密接触,而彼此并不紧密接触,这一结果表明活性炭可以替代生物导电网络连接电子供体微生物和电子受体微生物[3]。根据添加导电材料后co-culture细胞中的细胞色素c表达量减少,而产甲烷效率又没有降低,推测导电材料替代细胞色素c充当细胞色素c传递电子的功能[26, 33, 45]。但是导电材料如何与细胞表面相互作用及胞内电子是如何传递到导电材料的机制还不清楚。
虽然许多研究都表明添加导电材料可以提高产甲烷速率和产甲烷量,但是仅有少量研究提供了添加导电材料后存在DIET的直接证据,而且都是基于已知的co-culture。许多研究只是提供了存在DIET现象的间接证据或仅报道了添加导电材料的影响。生物炭和颗粒活性炭是一个复杂的材料,在复杂的厌氧环境中对DIET以及产甲烷的影响还需要进一步的研究,如进一步探析炭材料等导电物质的类型、导电性、使用量、粒度大小、比表面积、孔径大小及表面特性等强化DIET及厌氧消化的机制。
4 微生物间DIET方式耦合产甲烷研究存在的问题 4.1 影响微生物间通过DIET方式耦合产甲烷的因素目前报道能通过DIET方式耦合产甲烷的co-culture主要是Geobacter species与Methanosaeta species及Geobacter species与Methanosarcina species,而报道的纯微生物中只有G. metallireducens 能分别与M. harundinacia和M. barkeri 800形成co-culture。虽然CRUZ等[4]报道丙酸氧化微生物能与Methanosaeta species形成co-culture,但是并没有获得纯微生物。对于何种类型的微生物能与产甲烷菌通过DIET方式形成co-culture及哪些类型的产甲烷菌能通过DIET方式形成co-culture都缺乏深入了解和研究。此外,对于通过DIET方式形成co-culture的因素(底物类型、底物浓度等)也知之甚少。虽然G.metallireducens 与M. barkeri 800能以短链醇(乙醇、丙醇及丁醇)为底物通过DIET方式形成co-culture,但是却不能以丙酸和丁酸为底物形成co-culture[11],尽管G.metallireducens 能同时代谢丙酸和丁酸还原柠檬酸铁(Ⅲ)。但是G. metallireducens 能以丙酸和丁酸为底物通过DIET方式与G.sulfurreducens形成co-culture[11]。
JUSTE-POINAPEN等[46]研究了溶液的电导率和pH对形成co-culture的影响,在高电导率和低pH下co-culture中丙酸氧化菌以Syntrophobacter和Candidatus Cloacamonas为主,而产甲烷菌以Methanobacteriales为主,但溶液的电导率较低和pH较高时产甲烷菌则以Methanosaeta为主。LI等[10]研究了纳米四氧化三铁介导下co-culture代谢丁酸产甲烷,结果发现丁酸氧化菌以Syntrophomonadaceae和Geobacteraceae为主,而产甲烷菌则主要包括Methanosarcinaceae、Methanocellales和Methanobacteriales。但是上述研究都没有得到纯co-culture,因而无法从分子水平对微生物间通过DIET方式耦合还原CO2产甲烷进行验证。
因此,需要系统研究接种物来源、微生物类型、底物类型及底物浓度等因素对形成co-culture的影响,进而确定不同微生物通过DIET方式与产甲烷菌形成co-culture的条件。获取更多的电子供体微生物和电子受体微生物,寻找共性,构建更为有效的co-culture,尤其是丙酸、丁酸型电子供体微生物。因为在厌氧消化中,主要形成丙酸及丁酸种间产物,而丙酸不易降解且其积累对产甲烷菌的活性具有抑制作用。
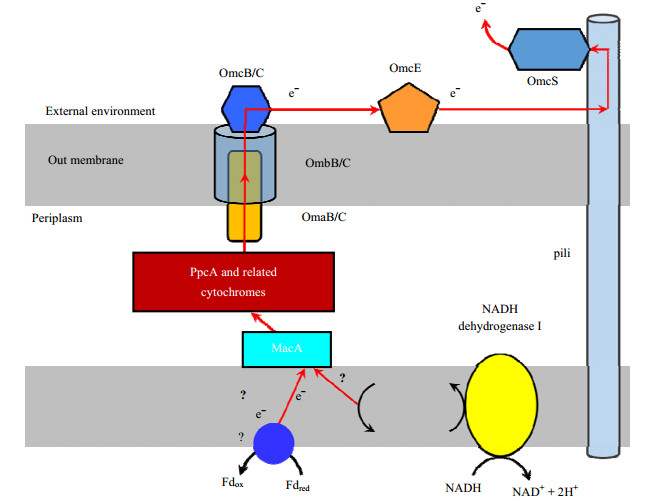
4.2 电子供体微生物胞内电子传递到胞外的机制目前报道能通过DIET方式耦合产甲烷的co-culture主要是Geobacter species与Methanosaeta species及Geobacter species与Methanosarcina species,但是对Geobacter species等电子供体微生物胞内电子载体还原态铁氧蛋白(reduced ferredoxin,Fdred)携带的电子传递到胞外的机制尚不清楚。如Geobacter species中研究最多的为G. sulfurreducens与G. metallireducens,它们代谢有机物时胞内会产生还原态烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide,NADH)和Fdred两种电子载体。NADH在NADH脱氢酶作用下被氧化为氧化态烟酰胺腺嘌呤二核苷酸(oxidized nicotinamide adenine dinucleotide,NAD+),产生的电子通过膜上的电子传递体、外膜细胞色素及纳米导线(pili)等途径传递到胞外(如图 3所示)[47-48]。在G. metallireducens中有NADH脱氢酶、MacA(membrane associated cytochrome A,膜相关的细胞色素A)、OmcB(outer membrane c-type cytochrome B,外膜c型细胞色素B)、pilin、PpcA (periplasmic cytochrome A,细胞周质细胞色素A)及相关cytochromes的表达基因,因此推测G. metallireducens中NADH携带的电子通过类似的途径传递到胞外。但是,MacA 位于细胞周质[49],而menaquinol(MOH2)又位于质膜内。因此,MQH2无法直接将电子传递给MacA。G. sulfurreducens与G. metallireducens胞内的Fdred如何被氧化及氧化后产生的电子通过何种途径传递到MacA的机制还不清楚。然而,G. metallireducens等电子供体微生物胞内Fdred携带的电子是产甲烷菌还原CO2产甲烷所必需的。因此,需对G. metallireducens等电子供体微生物胞内Fdred携带的电子传递到胞外的机制进行深入研究。如先通过转录组分析等方法寻找基因的差异表达,进而探讨电子供体微生物可能的胞外电子传递机制,然后通过基因突变的方式对相关基因的功能进行验证,最终揭示电子供体微生物的胞外电子传递机制。
|
图 3 G. sulfurreducens胞外电子传递模型[47-48]
Fig.3 A proposed model for extracellular electron transfer of G. sulfurreducens[47-48]
MacA (membrane associated cytochrome A), PpcA (periplasmic cytochrome A), OmcB (outer membrane c-type cytochrome B), OmcE (outer membrane c-type cytochrome E), and OmcS (outer membrane c-type cytochrome S) are c-type cytochromes which genetic studies have indicated are required for optimal Fe3+ reduction. MQH2: menaquinol; MQ: menaquinone; pili, nanowire; Fdred: reduced ferredoxin; Fdox: oxidized ferredoxin; NADH: reduced nicotinamide adenine dinucleotide; NAD+: oxidized nicotinamide adenine dinucleotide |
虽然现有研究表明某些产甲烷菌(包括Methanosaeta species和Methanosarcina species)通过细胞接触和导电材料能从它们的互营体(syntrophic partners)中直接接受电子,但是介导这些产甲烷菌接受胞外电子的分子机制仍不清楚。由于Methanosaeta species和Methanosarcina species具有与膜结合的细胞色素[50],而微生物产电和胞外电子传递的研究表明c-type细胞色素和pili结构的纳米导线(nanowires)在胞外电子传递过程中起着重要作用[51-52],因此推测产甲烷菌细胞表面这些导电蛋白(细胞色素)可能参与吸收胞外电子。但是,无细胞色素的Methanococcus maripaludis也能直接从阴极电极接受电子,并将它们用于还原CO2产甲烷,且从基因层面被证实其产甲烷过程与胞内氢酶无关[53]。此外,Methanobacterium palustre[54]和M. barkeri 800[53]也能直接利用阴极电极提供的电子还原CO2产甲烷。这表明胞外电子直接吸收机制可能在产甲烷菌中普遍存在。因此,需进一步对已获得全基因组的产甲烷菌如M. harundinacea 6Ac和M. barkeri 800进行研究以阐明产甲烷菌直接从胞外电子供体(微生物或电极)接受电子的潜在分子机制。通过转录组分析等方法寻找电活性产甲烷菌在不同产甲烷条件下基因的差异性表达,进而探讨电活性产甲烷菌接受胞外电子的可能机制,然后通过基因突变的方式对相关基因的功能进行验证,最终揭示电活性产甲烷菌接受胞外电子的机制。
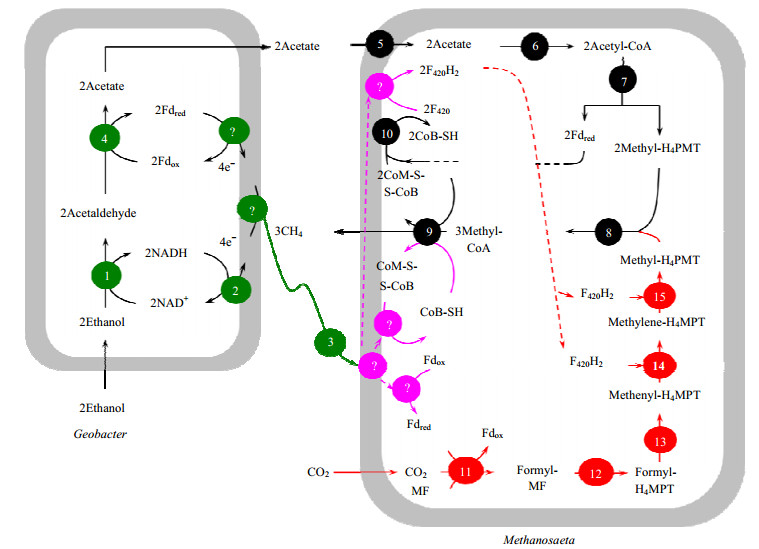
4.4 产甲烷菌直接利用胞外电子还原CO2产甲烷的分子机制现有研究已证实产甲烷菌还原CO2产甲烷时其胞内必须同时有Fdred、还原态辅酶F420(F420H2)、还原态辅酶M(CoM-SH)及还原态辅酶B(CoB-SH)的参与才能实现[50]。产甲烷菌能以CO2、H+及电子合成甲烷,该途径与H2/CO2合成甲烷途径相类似,其主要区别在于两种途径合成甲烷时产甲烷菌胞内Fdred、F420H2、CoM-SH及CoB-SH产生机制不同。产甲烷菌以H2/CO2为原料合成甲烷时,胞外提供的H2分别将胞内氧化态的铁氧还原蛋白(Fdox)、氧化态辅酶F420(F420)及辅酶M与辅酶B的二硫化合物(CoM-S-S-CoB)还原为Fdred、F420H2、CoM-SH及CoB-SH,然后产生的Fdred、F420H2、CoM-SH及CoB-SH为CO2还原为甲烷提供电子和H+[50]。产甲烷菌与其他微生物通过DIET方式耦合还原CO2产甲烷时,产甲烷菌胞外只提供了H+、电子及CO2。目前,DIET耦合还原产甲烷研究仅揭示了co-cultures之间存在DIET及产甲烷菌可直接利用胞外提供的电子和H+还原CO2产甲烷,但没有揭示胞外Geobacter species提供的电子是通过什么途径传递到产甲烷菌胞内,同时也没有解析产甲烷菌如何利用胞外提供的电子生成CO2还原为甲烷时所需的Fdred、F420H2、CoM-SH及CoB-SH(图 4)。
|
图 4 G. metallireducens与M. harundinacea 6Ac耦合代谢乙醇产甲烷模型[5] Fig.4 A proposed model of G. metallireducens and M. harundinacea 6Ac co-culturing for converting ethanol to methane[5] (1) ethanol dehydrogenase; (2) NADH dehydrogenase complex; (3) the structural proteins for conductive pilin used during DIET; (4) aldehyde-ferredoxin oxidoreductase; (5) Na+/solute symporter; (6) acetyl-CoA synthetase; (7) CO dehydrogenase/acetyl-CoA synthase; (8) tetrahydromethanopterin (H4MPT)-S-methyltransferase; (9) methyl-CoM reductase; (10) CoM-S-S-CoB heterodisulfide reductase; (10) formylmethanofuran dehydrogenase; (11) formylmethanofuran-H4MPT formyltransferase; (12) methenyl-H4MPT cyclohydrolase; (13) F420-dependent methylene-H4MPT dehydrogenase; and (14), (15) F420-dependent methylene H4MPT reductase; Fdred: reduced ferredoxin; Fdox: oxidized ferredoxin; CoM-SH: coenzyme M; CoB-SH: coenzyme B; CoM-S-S-CoB: heterodisulfide of CoM-SH and CoB-SH; F420: oxidized coenzyme F420; F420H2: reduced coenzyme F420 |
因此,产甲烷菌与其他微生物通过DIET方式耦合还原CO2产甲烷时胞外提供的H+和电子如何分别将产甲烷菌胞内的Fdox、F420及CoM-S-S-CoB还原为Fdred、F420H2、CoM-SH及CoB-SH是产甲烷菌与其他微生物通过DIET方式耦合还原CO2产甲烷机制研究需解决的一个关键问题。但是,电活性产甲烷菌(能直接利用胞外电子还原CO2产甲烷的产甲烷菌)直接利用胞外提供的电子和H+产生胞内Fdred、F420H2、CoM-SH及CoB-SH的机制尚不清楚。应以M. harundinacea 6Ac和M. barkeri两类不同的电子受体电活性产甲烷菌为模式微生物,通过转录组分析等方法寻找电活性产甲烷菌在不同产甲烷条件下基因的差异性表达,进而探讨电活性产甲烷菌直接利用胞外电子产生胞内的Fdox、F420及CoM-S-S-CoB还原为Fdred、F420H2、CoM-SH及CoB-SH的可能机制,然后通过基因突变的方式对相关基因的功能进行验证,最终揭示电活性产甲烷菌直接利用胞外电子产生胞内的Fdox、F420及CoM-S-S-CoB还原为Fdred、F420H2、CoM-SH及CoB-SH的机制。对于电活性产甲烷菌胞内Fdred、F420H2、CoM-SH及CoB-SH产生机制的研究,不仅有助于解析电活性产甲烷菌直接从胞外接受电子的机制及电活性产甲烷菌胞内Fdred、F420H2、CoM-SH及CoB-SH产生机制,同时也有助于理解产甲烷菌与其他微生物通过DIET方式耦合还原CO2产甲烷的机理。
5 展望虽然近年来DIET的研究已取得了很大的进展,但是主要集中在导电材料对DIET方式耦合产甲烷的影响及证实微生物间存在DIET方式耦合产甲烷,而关于微生物间DIET方式耦合产甲烷的影响因素、DIET方式中电子供体微生物及电子受体微生物的研究并不多。此外,鲜有针对微生物间DIET方式耦合产甲烷的机制研究。如现有研究仅揭示了co-culture之间存在DIET及产甲烷菌可直接利用胞外提供的电子和H+还原CO2产甲烷,但既没有解释电子供体微生物胞内电子载体Fdred与NADH携带的电子是如何传递到胞外,也没有揭示胞外电子供体微生物提供的电子是通过什么途径传递到产甲烷菌胞内,同时也没有解析产甲烷菌如何利用胞外提供的电子生成CO2还原为甲烷时所需的Fdred、F420H2、CoM-SH及CoB-SH。与此同时,对何种产甲烷菌能通过DIET方式接受胞外电子及产甲烷菌接受胞外电子机制的异同都缺乏了解。因此,今后微生物间DIET方式耦合产甲烷研究应主要集中在以下5个方面:
(1) DIET方式耦合产甲烷co-culture中电子供体微生物及电子受体微生物的筛选、富集及鉴定;
(2) 电子供体微生物胞外电子传递的机制;
(3) 电活性产甲烷菌接受胞外电子的机制;
(4) 产甲烷菌直接利用胞外电子生成CO2还原为甲烷时所需的Fdred、F420H2、CoM-SH及CoB-SH的机制;
(5) 导电材料(尤其是炭基导电材料)强化DIET及厌氧消化的机制。
对微生物间通过DIET方式传递电子这一复杂过程作用机制的深入认识,不仅有助于阐明co-culture在能量有限条件下的行为,也为发展更有效的生物能源过程提供新策略。此外,如果DIET是产甲烷过程中电子流的一个重要组成部分,则对DIET方式耦合产甲烷机制的研究将有利于设计更有效和更稳定的产甲烷co-culture及高效生物反应器。
| [1] |
SUMMERS Z M, FOGARTY H E, LEANG C, et al. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria[J]. American Association for the Advancement of Science, 2010, 330(6009): 1413-1415. DOI:10.1126/science.1196526 |
| [2] |
MORITA M, MALVANKAR N S, FRANKS A E, et al. Potential for direct interspecies electron transfer in methanogenic wastewater digester aggregates[J]. mBio, 2011, 2(4): e00159-11. |
| [3] |
LIU F, ROTARU A E, SHRESTHA P M, et al. Promoting direct interspecies electron transfer with activated carbon[J]. Energy & Environmental Science, 2012, 5(10): 8982-8989. |
| [4] |
CRUZ V C, ROSSETTI S, FAZI S, et al. Magnetite particles triggering a faster and more robust syntrophic pathway of methanogenic propionate degradation[J]. Environmental Science & Technology, 2014, 48(13): 7536-7543. |
| [5] |
ROTARU A E, SHRESTHA P M, LIU F, et al. A new model for electron flow during anaerobic digestion: Direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane[J]. Energy & Environmental Science, 2013, 7(1): 408-415. |
| [6] |
ROTARU A E, SHRESTHA P M, LIU F, et al. Direct interspecies electron transfer between Geobacter metallireducens and Methanosarcina barkeri[J]. Applied & Environmental Microbiology, 2014, 80(15): 4599-4605. |
| [7] |
ZHENG S, ZHANG H, LI Y, et al. Co-occurrence of Methanosarcina mazei and Geobacteraceae in an iron(Ⅲ)-reducing enrichment culture[J]. Frontiers in Microbiology, 2015, 6: 00941. |
| [8] |
CHEN S, ROTARU A E, SHRESTHA P M, et al. Promoting interspecies electron transfer with biochar[J]. Scientific Reports, 2014, 4: 5019. |
| [9] |
CHEN S, ROTARU A E, LIU F, et al. Carbon cloth stimulates direct interspecies electron transfer in syntrophic co-cultures[J]. Bioresource Technology, 2014, 173(1): 82-86. |
| [10] |
LI H, CHANG J, LIU P, et al. Direct interspecies electron transfer accelerates syntrophic oxidation of butyrate in paddy soil enrichments[J]. Environmental Microbiology, 2015, 17(5): 1533-1547. DOI:10.1111/1462-2920.12576 |
| [11] |
WANG L Y, NEVIN K P, WOODARD T L, et al. Expanding the diet for DIET: Electron donors supporting direct interspecies electron transfer (DIET) in defined co-cultures[J]. Frontiers in Microbiology, 2016, 7(5019): 236-236. |
| [12] |
WANG O M, ZHENG S L, WANG B C, et al. Necessity of electrically conductive Pili for methanogenesis with magnetite stimulation[J]. PEERJ, 2018, 6(3): e4541. |
| [13] |
FENG Q, SONG Y C, YOO K, et al. Polarized electrode enhances biological direct interspecies electron transfer for methane production in upflow anaerobic bioelectrochemical reactor[J]. Chemosphere, 2018, 204: 186-192. DOI:10.1016/j.chemosphere.2018.03.163 |
| [14] |
KATO S, HASHIMOTO K, WATANABE K. Microbial interspecies electron transfer via electric currents through conductive minerals[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(25): 10042-10046. DOI:10.1073/pnas.1117592109 |
| [15] |
LOVLEY D R. Live wires: Direct extracellular electron exchange for bioenergy and the bioremediation of energy-related contamination[J]. Energy & Environmental Science, 2011, 4(12): 4896-4906. |
| [16] |
COATES J D, BHUPATHIRAJU V K, ACHENBACH L A, et al. Geobacter hydrogenophilus, Geobacter chapellei and Geobacter grbiciae, three new, strictly anaerobic, dissimilatory Fe(Ⅲ)-reducers[J]. International Journal of Systematic & Evolutionary Microbiology, 2001, 51: 581-588. |
| [17] |
ZHAO Z, ZHANG Y, YU Q, et al. Communities stimulated with ethanol to perform direct interspecies electron transfer for syntrophic metabolism of propionate and butyrate[J]. Water Research, 2016, 102: 475-484. DOI:10.1016/j.watres.2016.07.005 |
| [18] |
LEE J Y, LEE S H, PARK H D. Enrichment of specific electro-active microorganisms and enhancement of methane production by adding granular activated carbon in anaerobic reactors[J]. Bioresource Technology, 2016, 205: 205-212. DOI:10.1016/j.biortech.2016.01.054 |
| [19] |
李莹, 郑世玲, 张洪霞, 等. 产甲烷分离物中Clostridium spp.与Methanosarcina barkeri潜在的种间直接电子传递[J]. 微生物学通报, 2017, 44(3): 591-600. LI Y, ZHENG S L, ZHANG H X, et al. Potential direct interspecies electron transfer (DIET) from Clostridium spp. to Methanosarcina barkeri in methanogenic islates[J]. Microbiology China, 2017, 44(3): 591-600. |
| [20] |
WANG G, QIAN L, XIN G, et al. Synergetic promotion of syntrophic methane production from anaerobic digestion of complex organic wastes by biochar: Performance and associated mechanisms[J]. Bioresource Technology, 2018, 250: 812-820. DOI:10.1016/j.biortech.2017.12.004 |
| [21] |
HOLMES D E, SHRESTHA P M, WALKER D J, et al. Metatranscriptomic evidence for direct interspecies electron transfer between Geobacter and Methanothrix species in methanogenic rice paddy soils[J]. Applied & Environmental Microbiology, 2017, 83(9): 00223-17. |
| [22] |
PARK J H, KANG H J, PARK K H, et al. Direct interspecies electron transfer via conductive materials: A perspective for anaerobic digestion applications[J]. Bioresource Technology, 2018, 254: 300-311. DOI:10.1016/j.biortech.2018.01.095 |
| [23] |
KATO S, HASHIMOTO K, WATANABE K. Methanogenesis facilitated by electric syntrophy via (semi)conductive iron-oxide minerals[J]. Environmental Microbiology, 2012, 14(7): 1646-1654. DOI:10.1111/j.1462-2920.2011.02611.x |
| [24] |
ZHAO Z, LI Y, QUAN X, et al. Towards engineering application: Potential mechanism for enhancing anaerobic digestion of complex organic waste with different types of conductive materials[J]. Water Research, 2017, 115: 266-277. DOI:10.1016/j.watres.2017.02.067 |
| [25] |
CHARLES D D, GUIOT S R. Ethanol-to-methane activity of Geobacter deprived anaerobic granules enhanced by conductive microparticles[J]. Process Biochemistry, 2017, 63: 42-48. DOI:10.1016/j.procbio.2017.07.032 |
| [26] |
ZHANG S, CHANG J, LIN C, et al. Enhancement of methanogenesis via direct interspecies electron transfer between Geobacteraceae and Methanosaetaceae conducted by granular activated carbon[J]. Bioresource Technology, 2017, 245(Pt A): 132-137. |
| [27] |
VIGGI C C, SIMONETTI S, PALMA E, et al. Enhancing methane production from food waste fermentate using biochar: The added value of electrochemical testing in pre-selecting the most effective type of biochar[J]. Biotechnology for Biofuels, 2017, 303(10): 1-13. |
| [28] |
YANG Y, ZHANG Y, LI Z, et al. Adding granular activated carbon into anaerobic sludge digestion to promote methane production and sludge decomposition[J]. Journal of Cleaner Production, 2017, 149: 1101-1108. DOI:10.1016/j.jclepro.2017.02.156 |
| [29] |
LI L L, TONG Z H, FANG C Y, et al. Response of anaerobic granular sludge to single-wall carbon nanotube exposure[J]. Water Research, 2015, 70: 1-8. DOI:10.1016/j.watres.2014.11.042 |
| [30] |
LIN R, CHENG J, ZHANG J, et al. Boosting biomethane yield and production rate with graphene: The potential of direct interspecies electron transfer in anaerobic digestion[J]. Bioresource Technology, 2017, 239: 345-352. DOI:10.1016/j.biortech.2017.05.017 |
| [31] |
TIAN T, QIAO S, LI X, et al. Nano-graphene induced positive effects on methanogenesis in anaerobic digestion[J]. Bioresource Technology, 2016, 224: 41-47. |
| [32] |
PARK J H, PARK J H, SEONG H J, et al. Metagenomic insight into methanogenic reactors promoting direct interspecies electron transfer via granular activated carbon[J]. Bioresource Technology, 2018, 259: 414-422. DOI:10.1016/j.biortech.2018.03.050 |
| [33] |
WANG T, ZHANG D, DAI L, et al. Magnetite triggering enhanced direct interspecies electron transfer: A scavenger for the blockage of electron transfer in anaerobic digestion of high-solids sewage sludge[J]. Environmental Science & Technology, 2018, 52(12): 7160-7169. |
| [34] |
ZHAO Z, LI Y, YU Q, et al. Ferroferric oxide triggered possible direct interspecies electron transfer between Syntrophomonas and Methanosaeta to enhance waste activated sludge anaerobic digestion[J]. Bioresource Technology, 2017, 250: 79-85. |
| [35] |
LYU F, LUO C H, SHAO L M, et al. Biochar alleviates combined stress of ammonium and acids by firstly enriching Methanosaeta and then Methanosarcina[J]. Water Research, 2016, 90: 34-43. DOI:10.1016/j.watres.2015.12.029 |
| [36] |
LI Y, ZHANG Y B, YANG Y F, et al. Potentially direct interspecies electron transfer of methanogenesis for syntrophic metabolism under sulfate reducing conditions with stainless steel[J]. Bioresource Technology, 2017, 234: 303-309. DOI:10.1016/j.biortech.2017.03.054 |
| [37] |
ZHAO Z Q, ZHANG Y B, YU Q L, et al. Communities stimulated with ethanol to perform direct interspecies electron transfer for syntrophic metabolism of propionate and butyrate[J]. Water Research, 2016, 102: 475-484. DOI:10.1016/j.watres.2016.07.005 |
| [38] |
ZHAO Z Q, ZHANG Y B, LI Y, et al. Potentially shifting from interspecies hydrogen transfer to direct interspecies electron transfer for syntrophic metabolism to resist acidic impact with conductive carbon cloth[J]. Chemical Engineering Journal, 2017, 313: 10-18. DOI:10.1016/j.cej.2016.11.149 |
| [39] |
SHEN Y W, LINVILLE J L, LEON PAAI-D, et al. Towards a sustainable paradigm of waste-to-energy process: enhanced anaerobic digestion of sludge with woody biochar[J]. Journal of Cleaner Production, 2016, 135: 1054-1064. DOI:10.1016/j.jclepro.2016.06.144 |
| [40] |
SHRESTHA P M, MALVANKAR N S, WERNER J J, et al. Correlation between microbial community and granule conductivity in anaerobic bioreactors for brewery wastewater treatment[J]. Bioresource Technology, 2014, 174: 306-310. DOI:10.1016/j.biortech.2014.10.004 |
| [41] |
LUO C H, Lü F, SHAO L M, et al. Application of eco-compatible biochar in anaerobic digestion to relieve acid stress and promote the selective colonization of functional microbes[J]. Water Research, 2015, 68: 710-718. DOI:10.1016/j.watres.2014.10.052 |
| [42] |
LI Y H, LAU P C Y, TANG N, et al. Novel two-component regulatory system involved in biofilm formation and acid resistance in streptococcus mutans[J]. Journal of Bacteriology, 2002, 184: 6333-6342. DOI:10.1128/JB.184.22.6333-6342.2002 |
| [43] |
NAGARAJAN V, CHANDIRAMOULI R. Investigation of NH3 adsorption behavior on graphdiyne nanosheet and nanotubes: A first-principles study[J]. Journal of Molecular Liquids, 2018, 249: 24-32. DOI:10.1016/j.molliq.2017.11.007 |
| [44] |
SASAKI K, MORITA M, HIRANO S I, et al. Efficient degradation of rice straw in the reactors packed by carbon fiber textiles[J]. Applied Microbiology & Biotechnology, 2010, 87(4): 1579-1586. |
| [45] |
LIU F, ROTARU A, SHRESTHA P M, et al. Magnetite compensates for the lack of a pilin-associated c-type cytochrome in extracellular electron exchange[J]. Environmental Microbiology, 2015, 17(3): 648-655. DOI:10.1111/1462-2920.12485 |
| [46] |
JUSTE-POINAPEN N M S, TURNER M S, RABAEY K, et al. Evaluating the potential impact of proton carriers on syntrophic propionate oxidation[J]. Scientific Reports, 2015, 5: 18364. DOI:10.1038/srep18364 |
| [47] |
LOVLEY D R. Bug juice: Harvesting electricity with microorganisms[J]. Nature Reviews Microbiology, 2006, 4(7): 497-508. DOI:10.1038/nrmicro1442 |
| [48] |
SANTOS T C, SILVA M A, MORGADO L, et al. Diving into the redox properties of Geobacter sulfurreducens cytochromes: A model for extracellular electron transfer[J]. Dalton Transactions, 2015, 44(20): 9335-9344. DOI:10.1039/C5DT00556F |
| [49] |
BUTLER J E, KAUFMANN F, COPPI M V, et al. MacA, a diheme c-type cytochrome involved in Fe(Ⅲ) reduction by Geobacter sulfurreducens[J]. Journal of Bacteriology, 2004, 186(12): 4042-4045. DOI:10.1128/JB.186.12.4042-4045.2004 |
| [50] |
THAUER R K, KASTER A K, SEEDORF H, et al. Methanogenic archaea: Ecologically relevant differences in energy conservation[J]. Nature Reviews Microbiology, 2008, 6(8): 579-591. DOI:10.1038/nrmicro1931 |
| [51] |
LOVLEY D R. Electromicrobiology[J]. Annual Review of Microbiology, 2012, 66: 391-409. DOI:10.1146/annurev-micro-092611-150104 |
| [52] |
UEKI T, NEVIN K P, ROTARU A E, et al. Geobacter strains expressing poorly conductive Pili reveal constraints on direct interspecies electron transfer mechanisms[J]. mBio, 2018, 9(4): e01273-18. |
| [53] |
LOHNER S T, DEUTZMANN J S, LOGAN B E, et al. Hydrogenase-independent uptake and metabolism of electrons by the archaeon Methanococcus maripaludis[J]. The ISME Journal, 2014, 8(8): 1673-1681. DOI:10.1038/ismej.2014.82 |
| [54] |
CHENG S A, XING D F, CALL D F, et al. Direct biological conversion of electrical current into methane by electromethanogenesis[J]. Environmental Science & Technology, 2009, 43(10): 3953-3958. |