2. 杭州奕安济世生物药业有限公司, 浙江 杭州 310018
2. HJB (Hangzhou) Co. Ltd., Hangzhou 310018, China
单克隆抗体(monoclonal antibodies,mAbs)简称单抗,是最重要的生物技术药物之一,具有靶向性好、特异性强、毒副作用小等优点[1]。单克隆抗体应用十分广泛,主要用于治疗癌症、自身免疫性疾病、感染性疾病、微生物疾病、慢性病等[2-4]。近年来,单抗类药物发展迅猛,据报道截至2021年已经有超过100款药物通过了食品及药品管理局(FDA)的上市批准[5-6],预计到2024年单抗的全球市场规模将会接近1 400亿美元[4]。
虽然单抗市场规模十分庞大,但依然面临高昂的生产成本压力。单抗的生产过程主要包括上游细胞培养和下游分离纯化,其中上游的细胞培养基和下游的亲和介质占据了很大的成本比例[7]。随着上游细胞培养滴度上升和连续培养技术的运用,单抗生产瓶颈逐渐向下游转移[8]。下游纯化工艺相对成熟,以蛋白A亲和层析为核心的3步层析、2步过滤和病毒灭活的纯化工艺被广泛使用[9]。但是,由于相同适应症的药物越来越多,专利到期,以及生物仿制药的出现,使得单抗生产过程的经济性越来越受到工业界的关注[10-11]。因此提高产能和降低生产成本变得越来越迫切。
单克隆抗体的连续生产成为一种被持续关注的替代方案。近年来,出现了几种连续和半连续的方法用于缓解下游瓶颈,例如周期性逆流色谱(periodic counter-current chromatography,PCC)[12-13],多柱逆流溶剂梯度纯化(multicolumn counter-current solvent gradient purification,MCSGP)[14-15],连续逆流切向色谱(continuous countercurrent tangential chromatography,CCTC)[14, 16]等。经济分析可以提供基本的成本信息,应用于生产阶段,评价生产效益。比如,Hummel等[17]利用BioSolve软件对比了不锈钢设备生产的批次,一次性批次和连续下游工艺的成本,发现连续下游工艺成本最低;史策等[18]利用Supper Pro Designer软件对整个单抗制备过程进行了模拟和经济性评价,实现全流程分析和优化,改善过程经济性;Klutz等[19]在不使用软件模拟的情况下对比了批次生产和连续技术同批次混合生产的经济性,发现混合工艺模式为最具成本效益的运行模式。运用成本模型的方式是研究生物制药过程成本变化和工艺经济性的常规手段,然而对下游经济性的研究主要集中在整体纯化过程,对蛋白A亲和层析步骤成本的研究显得不足。
本研究首先梳理蛋白A单柱和3柱连续层析工艺过程,搜集所有成本变量,设置符合实际的工艺参数,然后通过成本变量和成本输出之间的数学关系建立成本模型。最后利用模型多维度评估并比较了单柱层析和3柱连续层析捕获抗体的经济性,分析该步骤中各项成本,对各项变量进行确定性分析,同时以实际生产为基础,对工业界关心的参数进行敏感性分析和讨论,丰富了对蛋白A亲和层析步骤的成本研究,为捕获工艺的优化指出方向,为抗体产品的生产提供合理的工艺选择。
2 实验方法 2.1 单柱层析工艺过程单柱层析时工艺过程和缓冲液的使用如表 1所示,表中CV为洗脱体积。由于生物反应器规模的扩大,亲和层析通常需要几个循环来完成一个批次的纯化。每个层析都包含碱洗消毒到低pH洗脱步骤,而填料再生到储存步骤为料液纯化完毕,保存层析柱的过程,每次使用仅需进行一次。此外,本模型中除了考虑层析时操作,也考虑了层析前的装柱、测柱效、缓冲液配制、空跑缓冲液,层析后的洗脱液转移过滤、滤膜完整性测试、样品质量控制(QC)检测以及废物处理等操作。
|
|
表 1 典型亲和层析工艺过程和缓冲液的使用 Table 1 Buffers used in typical affinity chromatography processes |
3柱连续层析包括实验室AKTA PCC和生产规模的Bio Process PCC,拥有3柱和4柱2种不同模式。本研究评价的是生产规模的Bio Process PCC,以下简称PCC。PCC层析前后的操作与普通层析类似,只是需要装3根柱子,需要更多的缓冲液和准备时间。层析具体步骤[12]如图 1所示。启动阶段:每根柱子需要碱洗消毒,缓冲液平衡。循环阶段:首先1#和2#柱进行串联上样,3#柱进行淋洗、洗脱、再生、再平衡等步骤(recovery and regeneration, R-R)。然后当3#柱R-R完毕,1#柱达到一定的穿透值时,将3#柱串联至1#柱后,将1#柱中未吸附的蛋白冲入3#柱。随后切换2#柱上样,1#冲洗完毕后,把3#柱串联到2#柱后,继续上样。重复上述步骤,从Step 1到Step 6,每根层析柱都完成所有层析操作,恢复到初始状态,完成了一个分离循环。结束阶段:每根柱子经碱洗再生,平衡液冲去残留碱,再用0.2mol⋅L−1的醋酸钠-醋酸、质量分数为2% 的苯甲醇储存。
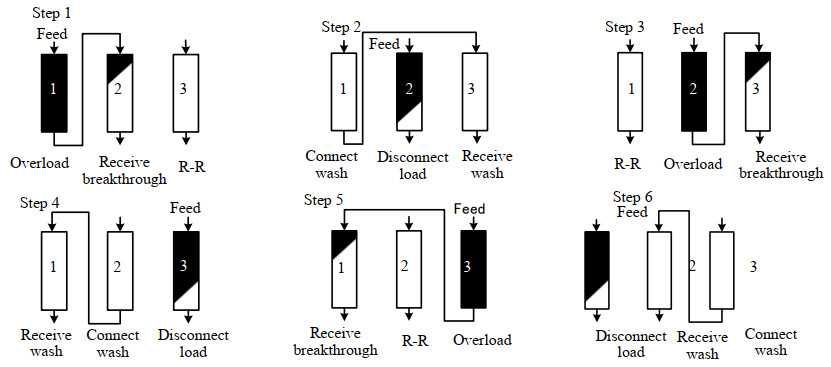
|
图 1 3柱连续流层析捕获蛋白示意图 Fig.1 Scheme of three-column continuous chromatography for protein capture |
本模型中的蛋白A参数以实际生产过程为基础进行设定,亲和填料是GE公司的MabSelect Prism A,单柱纯化的停留时间为4 min,载量为48 g⋅L−1,柱高为20 cm。PCC纯化停留时间为2 min,载量为70 g⋅L−1,柱高为10 cm。结合奕安济世的生产情况,上游抗体培养包含500和2 000 L规模2种典型的细胞培养发酵罐,收获细胞培养液(harvested cell culture fluid,HCCF)滴度为5 g⋅L−1,下文所描述的500和2 000 L的HCCF均以此为基础。从发酵罐得到HCCF后需要先深层过滤,过滤收率为90%,蛋白A工艺收率设定为95%。经过实验验证,0.5 mol⋅L−1氢氧化钠清洗条件下填料寿命为130循环,且每经历10个循环色谱柱重新装填并测试柱效。详细工艺参数见表 2。
|
|
表 2 单抗生产亲和层析步骤的主要假设参数 Table 2 Main hypothesis parameters of affinity chromatography for monoclonal antibody production |
本模型着重关注的是生产过程中亲和层析阶段成本,包括填料、耗材、缓冲液、劳动力、QC、废物处理、一般公用基础事业,设备的折旧维修等[20]。不考虑工厂的设计、启动验证等成本。
(1) 每克商品成本(cost of goods per gram,COG)包含生产过程中的直接成本和间接成本,广泛应用于单步和集成制造过程的成本分析。其计算如式(1)所示[21]:
| $ \text{COG}{\text{ = }}\frac{\text{Batch direct cost + Batch indirect cost}}{\text{Batch product output}} $ | (1) |
亲和层析过程的直接成本包括填料成本、缓冲液成本、一次性消耗品、劳动力成本、QC检测成本、废物处理成本和公共开支成本。间接成本包括设备、土地相关成本。
(2) 在大多数成本模型中,把填料归类于消耗品。本模型是精细考虑亲和层析过程,特意把填料成本独立出来。填料的成本计算如式(2)所示[21]:
| ${{C}^{\text{Resin}}}\text{ = }\frac{A\cdot {{P}_{\text{c}}}^{\text{Resin}}\cdot {{N}^{\text{Batch}}}\cdot {{N}^{\text{Cycle}}}\cdot {{V}^{\text{Resin}}}}{L}\cdot n $ | (2) |
式中:A表示填料压缩因子;
(3) 单批次缓冲液成本计算如式(3)所示:
| $ \text{Buffer}\ \text{cost = 1}\text{.2}\cdot {{C}_{\text{litre}}}\cdot {{N}^{\text{Cycle}}}\cdot {{V}_{\text{Cs}}} $ | (3) |
式中:1.2表示缓冲液的安全因子;每种缓冲液需配制理论值的1.2倍;
(4) 劳动力成本考虑管理人员、工艺研发支持人员和QC检测人员各1名,生产操作人员2名。劳动力成本计算如式(4)所示:
| $ {\text{Labor cost = }}\text{Position average salary }\cdot\text{ Working Hours }\cdot\text{ Headcount }$ | (4) |
职位工资为该类型员工的平均工资,工作时长以每批次生产所需的实际时间考虑,精确到小时。
(5) 整个亲和层析过程中固定资产投资包含仪器设备、厂房和土地。仪器设备每批的折旧费用计算如式(5)所示[22]:
| $ \text{Batch}\ \text{depreciation}\ \text{cost = }\frac{\text{Purchase}\ \text{price}\cdot \left( \text{1-Net}\ \text{residual}\ \text{valuerate} \right)}{\text{Service}\ \text{life}\cdot \text{annual}\ \text{batch}}$ | (5) |
预计净残值率为5%,设备服务年限通常为8年,厂房的使用年限为15年,土地成本按照每年的租金核算,年生产批次按37批计算。
此外,还考虑滤膜,一次性袋子、硅胶管,生产废弃物的处理,以及一般公用事业的使用费用等。其中废水处理成本假定为0.5 ¥⋅kg−1。公用事业费用包括1 ¥⋅(kW⋅h)−1的商业用电,2 ¥⋅L−1的蒸气。
2.5 层析填料的寿命验证工业界一般认为填料寿命为动态结合载量(dynamic binding capacity, DBC)降到初始值的80% 以下所能使用的次数。本研究中为了模拟生产过程,在DBC基础上还考虑了收率指标。因为收率的高低会影响捕获得到的蛋白量,进一步影响成本。因此定义DBC低于初始DBC的80% 或收率低于90% 时为填料的寿命终点。
2.5.1 主要材料与仪器AKAT PURE 150M蛋白纯化系统(GE Healthcare);Nano Drop one紫外检测器(Thermo);MabSelect Prism A,柱直径为0.66 cm、高为(10±2) cm(GE Healthcare);中国仓鼠卵巢细胞(Chinese hamster ovary,CHO)细胞培养上清液,滴度约为1.6 g⋅L−1;IgG1型单抗(由同一批蛋白A捕获得到);氢氧化钠、氯化钠、三羟甲基氨基甲烷(Tris)、醋酸钠购于默克;冰醋酸购于J.T Baker;75% 乙醇溶液购于国药集团;超纯水。
2.5.2 动态结合载量和收率的测定DBC通过UV280紫外穿透曲线测定。用IgGl型单抗上样,当AKTA UV检测器检测到UV280达到最大紫外吸收的10%时,停止上样。流穿液浓度达到10% 进料液浓度时的上样量为该保留时间下的动态结合载量。此时,DBC的计算如式(6)[23]:
| $\text{DB}{{\text{C}}_{10\%}}\text{ = }\frac{\left( {{V}_{\text{BT}}}-{{V}_{0}} \right)\cdot {{\rho }_{\text{Feed}}}}{{{V}_{\text{Resin}}}} $ | (6) |
式中:VBT表示当流穿的蛋白浓度达到进样浓度10% 时的上样体积,L;V0是死体积,L;
Prism A填料寿命测试,每10次层析计算DBC和收率,结果如图 2所示,当使用次数达到160次时,DBC降到初始值的79%,使用次数达到140次时,收率降到初始值的84.5%。所以,根据寿命定义,在0.5 mol⋅L−1的NaOH清洗条件下,Prism A的使用寿命为130次。
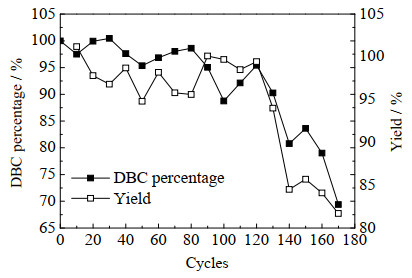
|
图 2 Prism A寿命的测试 Fig.2 Lifetime tests of Prism A |
图 3显示了亲和层析过程中使用Bio Process和Bio Process PCC设备在每批次纯化500 L的HCCF,滴度为5 g⋅L−1,年产37批次,收率为95% 的情况下,各类成本的占比情况。该生产条件下单柱层析填料的成本最高,为31.78%,其次是设备成本和缓冲液成本,分别占16.93% 和15.52%。使用PCC设备后,设备成本变为最高,占25.54% 的生产成本,填料和缓冲液排在2、3位,占24.07% 和14.71%。图 4显示的是纯化2 000 L的HCCF情况,与500 L时不同,填料成本总是最高的,单柱工艺填料成本占到了48.60%,PCC工艺占到了40.98%,其次是缓冲液的成本。
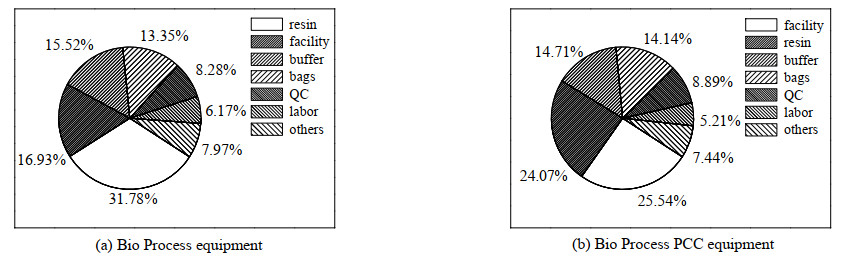
|
图 3 Bio Process和Bio Process PCC纯化500 L的HCCF的各类成本占比 Fig.3 Cost proportions for purification 500 L HCCF using Bio Process and Bio Process PCC |

|
图 4 Bio Process和Bio Process PCC纯化2 000 L的HCCF的各类成本占比 Fig.4 Cost proportions for purification 2 000 L HCCF using Bio Process and Bio Process PCC |
结合图 5,纯化500 L的HCCF时把层析设备从Process转换成Process PCC导致设备成本从15.14 ¥⋅g−1上升到21.24 ¥⋅g−1,上升了40% 的成本。因为PCC技术能有效提升载量,填料利用率提升,所以填料成本降低了30%。此外,PCC技术也使缓冲液的消耗和储液袋的成本降低,因为缓冲液体积的减少会直接影响储液袋的选择。相比于500 L规模,2 000 L时,单批次捕获量增加了,导致设备的COG降低了74%,这直接导致了填料成本占比的上升,成为比例最高的一项。同样在使用PCC技术后,由于载量优势,填料的成本降低了29.4%。
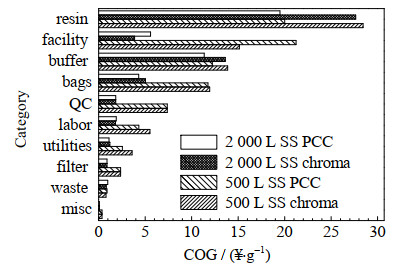
|
图 5 Bio Process和Bio Process PCC层析纯化500 L和2 000 L的HCCF各成本分项的COG Fig.5 COG results of 500 L and 2 000 L of HCCF purification using Bio Process and Bio Process PCC chromatography |
总的来说,无论每批纯化500 L还是2 000 L的HCCF,无论是使用单柱层析还是PCC工艺,在蛋白A亲和层析步骤中成本占比靠前的项目总是填料、缓冲液、设备和一次性袋子等。这为日后工艺优化降低成本提供了思路和理论支撑,从成本排名靠前的动因进行优化。史策等[18]也指出针对下游过程的优化降低生产成本,核心是优化蛋白A介质。针对蛋白A层析,郭静等[24]通过降低柱高、增加循环速度来提高生产效率,结果显示在抗体滴度为15 g⋅L−1时,可使生产效率提高2至3倍。Ghose等[23]采用基于实验设计(design of experiment,DOE)的模型和实验建立了变流速工艺,使填料MabSelect SuRe LX的动态结合能力提升了1.5倍以上。此外,国产蛋白A介质近年来发展迅速,性能指标显著提升,且价格较进口填料有显著优势,因此国产化替代也可能是有效的方式。与上述不同的方法是用其他工艺直接取代蛋白A层析从而降低成本,如双水相萃取[25-26]和混合模式层析[27-28]等。这些方法若能放大到产业化生产,都有可能降低生产成本。
3.3 成本敏感性分析敏感性分析是用来研究参数变化时对最终成本结果的影响。本节重点讨论工业界关心的年批次数变化、上游滴度变化以及一次性层析设备的使用对蛋白A亲和层析成本的影响。
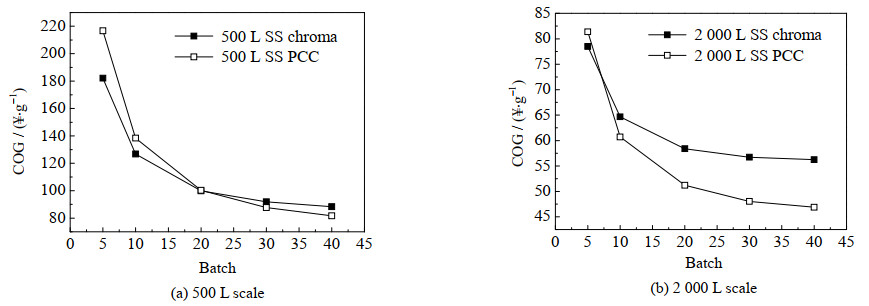
3.3.1 敏感性分析——年纯化批次数滴度5 g⋅L−1、收率95% 保持不变,只改变年纯化批次,从而评估年批次数对不锈钢单柱层析(stainless steel chromatography,SS chroma)和不锈钢3柱连续层析(stainless steel periodic counter-current chromatography,SS PCC)成本的影响,结果如图 6所示。
|
图 6 单抗捕获成本与年纯化批次的相关性 Fig.6 Relationship between annual purification batch and production cost |
年批次数从5批次到40批次变化,2种工艺的COG均显著降低。这主要是由于设备成本和捕获量间有显著的关系。不管每年工作与否设备都会如期折旧,但是年生产批次增多,导致蛋白输出量增多,同时设备停机时间缩短,利用率增加,导致成本显著降低。此外,SS chroma和SS PCC在年生产批次的影响下存在交点。图 6(a)显示,每批纯化500 L的HCCF,交点在20批次左右,意味着年生产批次小于20时,SS PCC工艺的成本比SS chroma成本要高,直到年批次大于20,PCC技术的优势才显现出来。这是因为PCC层析设备要比普通层析设备贵得多,500 L规模下年生产量少,PCC工艺成本较高。然而,随着年批次增加,PCC技术的载量优势逐渐覆盖了设备的成本劣势。在图 6(b)中,每批纯化2 000 L的HCCF,由于单批次产量的增加,交点前移至约7批次,此时PCC工艺的优势会较早展现,且在7批次以后单柱层析工艺和PCC工艺的成本差距逐渐加大。因此,每批纯化2 000 L的HCCF要比500 L时使用SS PCC工艺更具优势。此外,500 L规模下两者的交点为20纯化批次,根据史策等[18]对上游和下游过程的匹配分析以及奕安济世公司的甘特图排班,如果只有一条上游生产线,那么最大年生产批次就是20批次左右。所以,如果是一家初创公司,只有500 L规模的生物反应器,要使用SS PCC作为亲和层析工艺是不推荐的。这类公司至少需要2条上游生产线,PCC技术才能展现优势。
3.3.2 敏感性分析——上游滴度本研究的抗体滴度指从生物反应器中收获的抗体质量浓度。在过去20多年中,由于生物反应器的改进,培养基和细胞系开发水平的提高,单抗表达水平从0.5逐渐提高到了10 g⋅L−1左右[29-31],甚至更高。因此,此节讨论了不同抗体滴度对下游亲和层析工艺的影响。
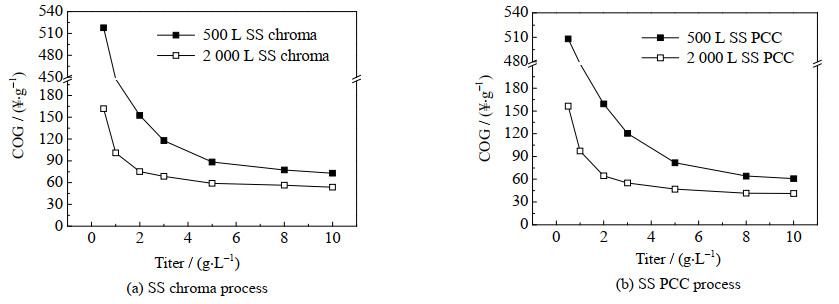
图 7显示,比较每批纯化500和2 000 L的HCCF,生产规模越大成本越低,并且随着上游表达水平的升高,生产规模越小,捕获成本下降越显著。此外,滴度从0.5增加到2 g⋅L−1,生产成本显著下降,从2到8 g⋅L−1时捕获成本下降趋势变缓,SS chroma每批纯化500和2 000 L的HCCF分别降低了49%和24%,SS PCC工艺下则分别降低了25% 和35%。图 7(a)和(b)都显示滴度增长到8 g⋅L−1之后,2种工艺曲线趋于平缓,滴度升高对蛋白A层析成本下降的影响在逐渐减小。对上游而言滴度升高,成本会降低,而蛋白A层析成本会趋于稳定,从而造成该步骤成本在总成本中的占比增加。
|
图 7 单抗捕获成本与细胞表达水平的相关性 Fig.7 Relationship between mAb titer and production cost |
总体而言,上游生产的单克隆抗体滴度增加,对于下游的纯化过程是有利的。滴度提高后,无论是产品的纯度还是提取的收率,都会得到提高,因为原料中单克隆抗体的质量分数增加了。问题是下游使用的层析柱和填料的容量会不足,单克隆抗体在柱上超载会造成产品的损失,或者减少单次层析处理的料液体积,缩短每个循环的时间,增加循环的次数和缓冲液的用量。这时需要增加柱的数量或体积,以捕获更多的单克隆抗体。虽然下游设备和填料的成本增加,但收率也增加,单位产品的成本还是下降的。
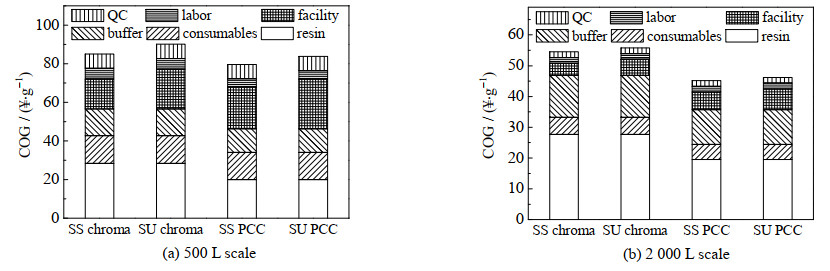
3.3.3 成本敏感性分析——一次性层析系统的使用一次性层析系统的功能与不锈钢层析系统类似,只是在生产过程中运用了更多的一次性组件。作者比较了SS chroma和一次性单柱层析(single-use chromatography,SU chroma),SS PCC和一次性3柱连续层析(single-use periodic counter-current chromatography,SU PCC),每批纯化500和2 000 L的HCCF,年产37批,滴度为5 g⋅L−1,收率为95% 的情况,结果如图 8所示。
|
图 8 单抗捕获成本与使用一次性层析系统的相关性 Fig.8 Relationship between single-use chromatography equipment and production cost |
从图 8观察到,相同条件下,使用一次性层析系统后,2种工艺的单位成本都增加了。(a)、(b)堆积图中明显增加的成本是设备部分,虽然一次性层析系统本身的价格确实比不锈钢设备便宜,但是一次性系统需要使用额外的歧管,而歧管的成本是比较高的。以杭州奕安济世公司为例,实际生产过程并不是每个批次都更换歧管,而是在使用一定次数后进行评估,根据评估结果决定是否更换歧管,可能是3批次、5批次或者10批次,一般不超过10批次。若每10个批次更换一次歧管,这使得500 L规模下将要提升6 ¥⋅g−1的成本。若用不到10批次,意味着成本的提升还要更高。另外由于不是单批次就更换歧管,因此每批次结束后仍然要用缓冲液清洗消毒,缓冲液几乎无法节省。在2 000 L规模时,由于规模效应,单批次抗体捕获量增加,歧管的利用率提高,导致单位成本下降,对总成本的影响减小,若每10批次更换歧管则COG的增加只有1.5 ¥⋅g−1。
总之无论是传统单柱层析还是3柱连续层析,每批纯化500和2 000 L的HCCF,使用一次性层析系统都会令生产成本有一定的提高。500 L时使用一次性层析系统影响更大,会较大地增加捕获过程的设备成本,经济性不高,而2 000 L时使用一次性层析系统对成本的影响较小。
4 结论本研究针对抗体工业生产中蛋白A单柱层析和3柱连续层析2种工艺做了全面的经济评估。首先以实际生产为基础建立工艺过程、收集成本动因、设置合理的工艺参数,然后根据单项成本与每克商品成本之间的关系建立成本模型,最后利用成本模型对单抗工业生产中蛋白A亲和层析步骤进行确定性分析和敏感性分析。需要额外指出的是作为关键工艺参数的填料寿命是用DBC和收率2个指标通过实验确定的,而不是假设,这提高了结果的实际参考价值。确定性分析讨论了每批纯化500和2 000 L的HCCF蛋白A单柱层析和3柱连续层析工艺中各类成本占总成本比例的大小,结果表明成本占比靠前的总是填料、设备、缓冲液和一次性袋子,其中蛋白A填料是核心。敏感性分析讨论了工业界关心的重要参数变化所引起的成本改变。不同工艺参数包括年纯化批次数、上游滴度和一次性层析系统的使用。结果表明,滴度为5 g⋅L−1,95% 的收率条件下,年纯化批次数不同对是否使用PCC工艺有较大影响。若每批纯化500 L的HCCF,年批次数达到20以上PCC才能突显出优势,而每批纯化2 000 L的HCCF,批次数只需要大于7就能显示出优势,且随着批次的增加优势逐渐扩大。年纯化37批次,收率95%,滴度从低到高变化时,捕获工艺成本降低先快后慢。滴度达到8 g⋅L−1时,成本变化变得稳定,蛋白A亲和层析成本在总成本中的占比增加。引入一次性层析系统则会因需要额外的歧管导致设备成本变高,进而提升总成本。由于规模效应,这种影响对500 L纯化规模的敏感性要高于2 000 L规模。本研究分析单抗工业生产中蛋白A亲和层析步骤的成本,为降低抗体亲和层析成本指出了方向,为抗体生产工艺的选择提供了参考。
| [1] |
TRIKHA M, CORRINGHAM R, KLEIN B, et al. Targeted anti-interleukin-6 monoclonal antibody therapy for cancer: A review of the rationale and clinical evidence[J]. Clinical Cancer Research, 2003, 9(13): 4653-4665. |
| [2] |
SHEPARD H M, PHILLIPS G L, C D T, et al. Developments in therapy with monoclonal antibodies and related proteins[J]. Clinical Medicine (London, England), 2017, 17(3): 220-232. DOI:10.7861/clinmedicine.17-3-220 |
| [3] |
DING C. Belimumab, an anti-BLyS human monoclonal antibody for potential treatment of inflammatory autoimmune diseases[J]. Expert Opinion on Biological Therapy, 2008, 8(11): 1805-1814. DOI:10.1517/14712598.8.11.1805 |
| [4] |
YANG O, PRABHU S, IERAPETRITOU M. Comparison between batch and continuous monoclonal antibody production and economic analysis[J]. Industrial & Engineering Chemistry Research, 2019, 58(15): 5851-5863. |
| [5] |
GRILO A L, MANTALARIS A. The increasingly human and profitable monoclonal antibody market[J]. Trends Biotechnol, 2019, 37(1): 9-16. DOI:10.1016/j.tibtech.2018.05.014 |
| [6] |
MULLARD A. FDA approves 100th monoclonal antibody product[J]. Nature Reviews Drug Discovery, 2021, 20(7): 491-495. DOI:10.1038/d41573-021-00079-7 |
| [7] |
BANSODE V, GUPTA P, KATEJA N, et al. Contribution of protein A step towards cost of goods for continuous production of mAb therapeutics [J/OL]. Journal of Chemical Technology & Biotechnology, 2021 [2021-10-25]. http://dx.doi.org/10.1002/jctb.6686.
|
| [8] |
KORNECKI M, SCHMIDT A, LOHMANN L, et al. Accelerating biomanufacturing by modeling of continuous bioprocessing—piloting case study of monoclonal antibody manufacturing[J]. Processes, 2019, 7(8): 495. DOI:10.3390/pr7080495 |
| [9] |
LIU H F, MA J, WINTER C, et al. Recovery and purification process development for monoclonal antibody production[J]. MAbs, 2010, 2(5): 480-499. DOI:10.4161/mabs.2.5.12645 |
| [10] |
HOLZMANN J, BALSER S, WINDISCH J. Totality of the evidence at work: The first U. S. biosimilar[J]. Expert Opinion on Biological Therapy, 2016, 16(2): 137-142. DOI:10.1517/14712598.2016.1128410 |
| [11] |
PADDA I S, BHATT R, REHMAN O, et al. Biosimilars use in medicine for inflammatory diseases[M]. StatPearls. Treasure Island (FL): StatPearls Publishing LLC, 2021.
|
| [12] |
荆淑莹, 史策, 姚善泾, 等. 连续流层析及用于抗体分离的新进展[J]. 高校化学工程学报, 2021, 35(1): 1-12. JING S Y, SHI C, YAO S J, et al. Progress on continuous chromatography and its application in antibody separation[J]. Journal of Chemical Engineering of Chinese Universities, 2021, 35(1): 1-12. DOI:10.3969/j.issn.1003-9015.2021.01.001 |
| [13] |
SHI C, ZHANG Q L, JIAO B, et al. Process development and optimization of continuous capture with three-column periodic counter-current chromatography[J]. Biotechnology and Bioengineering, 2021, 118(9): 3313-3322. DOI:10.1002/bit.27689 |
| [14] |
ZYDNEY A L. Continuous downstream processing for high value biological products: A review[J]. Biotechnology and Bioengineering, 2016, 113(3): 465-475. DOI:10.1002/bit.25695 |
| [15] |
ULMER N, MULLER-SPATH T, NEUNSTOECKLIN B, et al. Affinity capture of F(ab')2 fragments: Using twin-column countercurrent chromatography[J]. Bioprocess International, 2015, 13(2): 22-29. |
| [16] |
DUTTA A K, TRAN T, NAPADENSKY B, et al. Purification of monoclonal antibodies from clarified cell culture fluid using protein A capture continuous countercurrent tangential chromatography[J]. Journal of Biotechnology, 2015, 213: 54-64. DOI:10.1016/j.jbiotec.2015.02.026 |
| [17] |
HUMMEL J, PAGKALIWANGAN M, GJOKA X, et al. Modeling the downstream processing of monoclonal antibodies reveals cost advantages for continuous methods for a broad range of manufacturing scales [J/OL]. Journal of Biotechnology, 2019 [2021-10-25]. https://doi.org/10.1002/biot.201700665.
|
| [18] |
史策, 虞骥, 高栋, 等. 单抗制备的过程模拟和经济性分析[J]. 化工学报, 2018, 69(7): 3198-3207. SHI C, YU J, GAO D, et al. Process simulation and economic evaluation of monoclonal antibody production[J]. CIESC Journal, 2018, 69(7): 3198-3207. |
| [19] |
KLUTZ S, HOLTMANN L, LOBEDANN M, et al. Cost evaluation of antibody production processes in different operation modes[J]. Chemical Engineering Science, 2016, 141: 63-74. DOI:10.1016/j.ces.2015.10.029 |
| [20] |
GUPTA P, KATEJA N, MISHRA S, et al. Economic assessment of continuous processing for manufacturing of biotherapeutics [J/OL]. Biotechnology Progress, 2021 [2021-10-25]. https://doi.org/10.1002/btpr.3108.
|
| [21] |
YANG O, QADAN M, IERAPETRITOU M. Economic analysis of batch and continuous biopharmaceutical antibody production: A review[J]. Journal of Pharmaceutical Innovation, 2020, 15: 182-200. DOI:10.1007/s12247-018-09370-4 |
| [22] |
崔艳. 固定资产折旧两种年限平均法之比较[J]. 财会月刊(会计版), 2011(5): 38-39. CUI Y. Comparison of two annual averaging methods of depreciation of fixed assets[J]. Finance and Accounting Monthly (Accounting version), 2011(5): 38-39. |
| [23] |
GHOSE S, ZHANG J, CONLEY L, et al. Maximizing binding capacity for protein A chromatography[J]. Biotechnology Progress, 2014, 30(6): 1335-1340. DOI:10.1002/btpr.1980 |
| [24] |
GUO J, JIN M, KANANI D. Optimization of single-column batch and multicolumn continuous protein A chromatography and performance comparison based on mechanistic model [J/OL]. Journal of Biotechnology, 2020 [2021-10-25]. https://doi.org/10.1002/biot.202000192.
|
| [25] |
ROSA P A, AZEVEDO A M, SOMMERFELD S, et al. Aqueous two-phase extraction as a platform in the biomanufacturing industry: economical and environmental sustainability[J]. Biotechnology Advances, 2011, 29(6): 559-567. DOI:10.1016/j.biotechadv.2011.03.006 |
| [26] |
武强, 林东强, 翁叶靖, 等. 用于双水相萃取的混合模式配基制备及对IgG分配的影响[J]. 高校化学工程学报, 2013, 27(6): 925-930. WU Q, LIN D Q, WENG Y J, et al. Preparation of mixed-mode ligand for aqueous two-phase extraction and the influences of the ligand on IgG partitioning[J]. Journal of Chemical Engineering of Chinese Universities, 2013, 27(6): 925-930. DOI:10.3969/j.issn.1003-9015.2013.06.002 |
| [27] |
TONG H F, LIN D Q, CHU W N, et al. Multimodal charge-induction chromatography for antibody purification[J]. Journal of Chromatography A, 2016, 1429: 258-264. DOI:10.1016/j.chroma.2015.12.047 |
| [28] |
李菁, 林东强, 童红飞, 等. 疏水性电荷诱导色谱分离抗HER2单克隆抗体[J]. 化工学报, 2014, 65(10): 3931-3937. LI J, LIN D Q, TONG H F, et al. Separation and pu rification of anti-HER2 monoclonal antibody with hydrophobic charge-induction chromatography[J]. CIESC Journal, 2014, 65(10): 3931-3937. DOI:10.3969/j.issn.0438-1157.2014.10.025 |
| [29] |
BIBILA T A, ROBINSON D K. In pursuit of the optimal fed-batch process for monoclonal antibody production[J]. Biotechnology Progress, 1995, 11(1): 1-13. DOI:10.1021/bp00031a001 |
| [30] |
GRONKE R S. The search for process intensification and simplification: Alternative approaches versus current platform processes for monoclonal antibodies[M]. Cambridge, United States: Elsevier, 2018.
|
| [31] |
XU S, GAVIN J, JIANG R, et al. Bioreactor productivity and media cost comparison for different intensified cell culture processes[J]. Biotechnology Progress, 2017, 33(4): 867-878. DOI:10.1002/btpr.2415 |




