目前,我国农作物每年产生的废弃秸秆约7亿吨,农产品加工的废弃物在2亿吨以上,包括稻壳、玉米芯、花生壳、甘蔗渣和棉籽壳等。森林面积1.75亿公顷,各类林木生物质资源量已高达200亿吨。这些农林废弃物的闲置造成巨大的能源浪费和环境污染[1]。秸秆等农林废弃物的高效清洁利用已成为了当代重大的环境问题。
生物质的快速热解技术已经引起了国内外学者的关注,并在其转化和应用方面进行了初步探索。在工业上,朱锡锋等利用快速热解技术,以松木屑、稻壳、玉米秆和棉花秆为原料,用制备出的生物油进行了替代柴油、重油在工业锅炉、窑炉中燃烧供热的实验。但是,从热值比,品质方面来看,生物油并不具备优势[2]。利用生物油替代传统能源的技术路线,也因此受到了制约。相反,其在农业,医学上的应用前景十分广阔,如热解过程中糖类含量最高的小分子物质———内醚糖(Levoglucosan,简称LG),可以合成农业上的植物生长调节剂,杀虫剂,以及在制药中合成寡聚糖或者维生素H等,这都是农业,医学产品合成过程中的必要资源,内醚糖甚至被誉为“一种极其具有发展潜力的合成用的基本物质”[3]。因此,具有较高附加值的这类热解产物,未来有着很大的发展空间[4]。其中,分别利用Aspergillus terreus K26和Aspergillus niger CBX在一定的条件下可将内醚糖转化为衣康酸和柠檬酸[4, 5]。Bennett等利用水相分离的方法将提取所得内醚糖水溶液发酵获得乙醇[6]。实验结果表明,选用适合的微生物,内醚糖可以有效地转化为其他化学品。
有关从生物油中提取内醚糖的研究始于1966年,美国的Crown Zellerbach、Weyerhaeuser公司先后从造纸、木质生物质热解液中提取得到内醚糖。前者采用的方法为三氯甲烷脱色,丙酮溶解,后者为两相(油、水)分离方法,但是两者内醚糖的产率都偏低,且较多的化学试剂对环境造成了污染[7, 8]。1994年,Midwest Research Institute通过沉淀共沸萃取的方法分离生物油中的内醚糖。这种方法不能彻底除去有机胶质,色素以及芳香族化合物,提取出的内醚糖杂质较多[9]。2000年,张洪勋利用离子交换树脂的方法,分离淀粉或纤维素类热解液中的内醚糖,由于多步利用树脂分离,对内醚糖性质有所影响[8]。在分析方面,李林和庄绪亮利用HPLC和TLC对内醚糖进行了分析[10, 11]。由TLC知,内醚糖主要存在于水相,焦油和热解液中,又通过HPLC,进一步确定了内醚糖是热解液中的主要成分。但他们仅利用HPLC和TLC两种方法,对热解液中所得内醚糖和内醚糖标准品进行保留时间的比对,缺少对内醚糖应有的定性定量分析。
从以上学者开展的研究工作来看,内醚糖的分离以及定量定性分析一直是一个未得到妥善解决的难题。采用传统方法在内醚糖提取分离方法中寻找最佳条件时,需经历长时间的实验过程。响应面法(Response Surface Methodology,RSM)是一种较为科学和高效的参数优化方法,可在保证实验精度的基础上,尽可能减少实验次数。目前,使用响应面优化法对生物油中内醚糖的工艺参数进行优化,未见有文献报道。本文采用Box-Behnken优化生物油中分离提取内醚糖的方法,以加入高纯水体积,活性炭质量以及pH作为三个优化因素,通过旋蒸,沉淀,萃取等方法除去生物油中的杂酚、有机酸、胶质等物质。本研究还通过HPLC、FTIR和NMR等方法确定了内醚糖的测试条件与参数,并利用该测试条件与参数对提取分离出来的内醚糖进行了纯度和结构的表征。
2 实验材料与方法 2.1 材料与仪器 2.1.1 仪器索氏提取器:西安试剂公司,萃取容积250 mL。旋转蒸发仪;水浴锅;250 mL分液漏斗;OPTIMA L-100XP离心机(贝克曼);85-2数显恒温磁力搅拌器;傅立叶变换红外光谱仪(德国BRUKER公司),高效液相色谱(waters1525泵+2424蒸发光散射检测器),Bruker AVⅢ核磁共振波谱仪。
2.1.2 材料与试剂生物油是以稻草秸秆为原料,采用中国科技大学朱锡锋教授实验室的快速流化床式生物质热解液化装置制得生物油[2]。前期的热解实验发现,热解仪器装置参数设定为热解温度:500℃,颗粒大小:600 μm,停留时间:1.4 s,酸洗浓度:8%可获得最大产率的内醚糖,所得内醚糖产率为19.86%。
试剂均购买自西安试剂公司,分别为吡啶,乙酸酐,氯仿,乙酸乙酯,以上试剂均为分析纯,Ca(OH)2, NaOH也为分析纯,活性炭(课题组自制,比表面积为716.6 m2·g-1),内醚糖(纯度为99%)购买自Sigma公司。
2.2 方法 2.2.1 生物油中内醚糖的提取如图 1所示向生物油中加入一定量高纯水,用磁力搅拌器搅拌2 h;取上层液体置于离心管中,在5000 r·min-1下离心15 min;取离心液的上层液体加入一定量的活性炭,在恒温振荡仪上振荡2 h后过滤,向滤液中加入无机碱固体调节pH;将所得溶液于60~70℃下保温3 h后过滤,调节滤液pH至7,蒸干水分获得棕黄色固体并研磨至粉末;将其加入到索氏提取器中,用乙酸乙酯和水的混合液(V/V,2:1)作为萃取剂,提取12 h;将萃取液于70℃,真空度为0.08 MPa条件下脱除乙酸乙酯和水以获得固体粉末,向其中加入100 mL热乙酸乙酯,在60~70℃下保温12 h,趁热过滤,并用热乙酸乙酯多次洗涤滤渣;于50℃,真空度0.08 MPa条件下旋蒸滤液,获得内醚糖晶体。
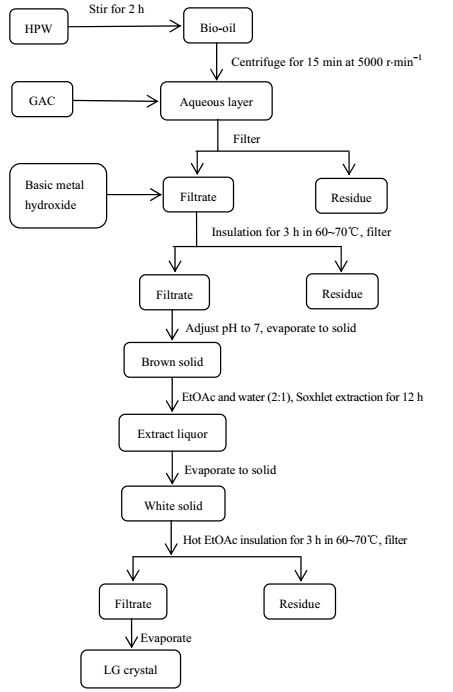
|
图 1 生物油中提取内醚糖流程图 Fig.1 Flow chart of levoglucosan extraction from bio-oil |
分别量取10 mL生物油置于5个50 mL烧杯中,按水/生物油比0.4:1、0.6:1、0.8:1、1:1、1.2:1加入蒸馏水,加入生物油体积5%的活性炭,调节pH至12,放入60~70℃水浴锅中保温3 h,过滤后测定内醚糖的含量。
2.2.2.2 活性炭质量对内醚糖提取含量的影响分别量取10 mL生物油置于5个50 mL烧杯中,水与生物油比为1:1,分别加入生物油体积3%、4%、5%、6%、7%的活性炭并调pH至12,放入60~70℃水浴锅中保温3 h,过滤后测定内醚糖的含量。
2.2.2.3 pH对内醚糖提取含量的影响分别量取10 mL生物油置于5个50 mL烧杯中,水/生物油比为1:1,加入生物油体积5%的活性炭,调节pH至10、11、12、13、14,放入60~70℃水浴锅中保温3 h,过滤后测定内醚糖的含量。
2.2.3 响应面对内醚糖提取条件进行优化根据Box-Behnken的中心组合试验设计原理,综合单因素实验的结果,选取加入高纯水体积、活性炭质量、pH对内醚糖提取产率影响显著的3个因素,采用三因素三水平的响应面分析方法。试验因素与水平设计见表 1。
| 表 1 响应面因素水平表 Table 1 Factors and the levels of experiment in response surface analysis |
分别选取不同体积比的乙酸乙酯和水,0.5:1,1:1,2:1,3:1,4:1作为索氏提取剂,提取12 h后测定内醚糖的含量。
2.2.5 生物油中提纯的内醚糖结构鉴定红外光谱检测:称取提取出的内醚糖样品约2 mg,加入200 mg干燥的KBr晶体,在研钵中轻轻研磨至极细,取一定量置于压片机下压片,然后置于中红外区扫描,扫描16次。
核磁共振检测:所有核磁共振波谱由Bruker AVⅢ型核磁共振仪测定,以TMS(四甲基硅烷)为内标。将提取出的内醚糖样品20 mg,分别置于1H-NMR谱图 50°400 MHz和13C-NMR谱图 30°100 MHz条件下测定。
2.2.6 生物油中提纯的内醚糖纯度测定HPLC检测:色谱柱为XBridge TM Amide C18(4.6 mm×250 mm,3.5 μm),流动相为甲醇:水=9:1(V/V),流速为0.5 mL·min-1;柱温为25℃,进样量为5 μL;漂移管的温度为75℃,气体的流量为40 psi,喷雾器为最大加热程度的60%。
3 实验结果与讨论 3.1 生物油中分离提取内醚糖结果分析向10 mL生物油中加入一定量的高纯水,并向溶液中加入一定量的活性炭以吸附色素,芳香族化合物及其他杂质[6]。加入无机碱调节pH值至12~13,60~70℃下保温3 h,可除去大量胶体杂质[10]。以不同比例的乙酸乙酯和水作为萃取剂进行索氏提取,提取出生物油中大部分内醚糖,再利用内醚糖溶于热乙酸乙酯这一特性进行重结晶[11]。按2.3.1节对生物油进行处理发现,加入高纯水的体积,活性炭的质量,pH的调节范围以及萃取剂的选取为影响内醚糖提取的重要因素。
3.1.1 高纯水体积对内醚糖提取含量的影响由图 2可知,水/生物油比从0.4到1时,内醚糖提取率显著增加,水/生物油比从1到1.2时,内醚糖提取率变化不明显,因此选择水/生物油体积比为1:1。
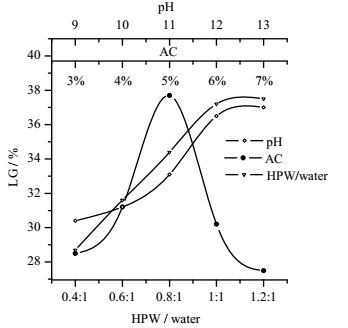
|
图 2 高纯水体积、活性炭质量和pH对内醚糖提取率的影响 Fig.2 Effects of different parameters on levoglucosan yields AC = active carbon, HPW = high purity water |
由图 2可知,活性炭质量从3%到5%时,内醚糖提取率显著增加,活性炭质量从5%到7%时,内醚糖提取率变化不明显,过多的活性炭会造成内醚糖的损失,因此选择活性炭质量为5%。
3.1.3 pH对内醚糖提取含量的影响pH从10到12时,内醚糖提取率显著增加,pH从12到13时,内醚糖提取率变化不明显,因此选择pH为12.
3.2 响应面实验结果在单因素实验结果基础上,根据Box-Behnken的中心组合试验设计原理,通过Design Expert 8.0.6软件进行二次回归响应面分析,建立多元二次响应面回归模型[12, 14]:
| $\begin{array}{l} {\rm{LG}}({\rm{mg}} \cdot {\rm{m}}{{\rm{L}}^{ - 1}}) = 13.99 + 1.88A + 0.0025B + 0.40C - \\ 0.95AB + 0.31AC + 0.37BC - 2.40{A^2} - 2.80{B^2} - 1.67{C^2} \end{array}$ |
通过比较回归方程中各个因素系数,得出单因素以及两两因素交互作用与生物油中内醚糖含量的关系。负系数值表明单因素或两两因素交互作用与生物油中内醚糖含量呈现负相关;正系数值则表明单因素或两两因素交互作用与生物油中内醚糖含量呈现正相关。
模型方差分析结果如表 2所示。方差分析表明,该二次响应面模型F 值为28.99,P值<0.0001,表明拟合得到的二次多项式模型具有极好的显著性(P <0.01)[12]。模型的调整确定系数RAdj2= 0.9403,确定性系数R2= 0.9739,表明该模型能解释94.03%响应面的变化,拟合程度较好,实验方案较为合理。
| 表 2 回归模型方差分析 Table 2 Analysis of the model variances |
由方程系数显著性检验可知,如果模型各项系数的检验项P值小于0.05,则该项是显著的,否则该项不显著。模型的A(图 3所示),加入高纯水的体积对生物油中内醚糖的提取影响最大,随着加入高纯水的体积的增大,生物油中内醚糖的提取率随之增大,研究表明,内醚糖在水中有着较高的分配系数,仅次于丙酮醛和乙醇醛,内醚糖会和水形成一个较弱的氢键,以增加其在水中的溶解度[13]。Vitasari等人研究表明,内醚糖在水中的分配系数随着水/生物油(V/V)的比例增大而增加,在比例为0.9时,可达到内醚糖最大的提取率[13]。水提取后的内醚糖溶液中还有一些其他的水溶性物质,如色素,大分子芳香族化合物等。根据朗格缪尔吸附定律及其他因素,选用活性炭为吸附剂。由响应面优化模型可知,B因素不显著,则选取加入5%的活性炭。除去大分子物质后,仍有一些小分子物质,如酚类,酸类以及包裹在内醚糖周围的胶体存在,采用碱沉法除去这些物质。生物油中加入活性炭的质量与pH值对生物油中内醚糖提取影响较小,通过响应面优化设计可得一组最优值,以获得生物油中内醚糖最大的提取率。在各参数约束范围内对模型方程进行内醚糖提取率最大化分析,得出生物油中提取内醚糖的最佳工艺条件为:0.96:1 (加入水的体积:生物油体积)、0.05:1 (加入活性炭质量:生物油体积)和12.14 (pH)。为验证实验数据的可靠性,并基于实验仪器控制精度,取1:1 (加入水的体积:生物油体积)、0.05:1 (加入活性炭质量:生物油体积)和12.2 (pH)追加3次验证性实验,生物油中内醚糖提取率与预测值基本一致,误差较小,预测数据可靠。利用Design Expert所得最优比例组合,依照1.3.1节所示步骤获得的内醚糖收率58%明显要比Midwest Research Institute所得内醚糖收率高出10%~15%[9]。
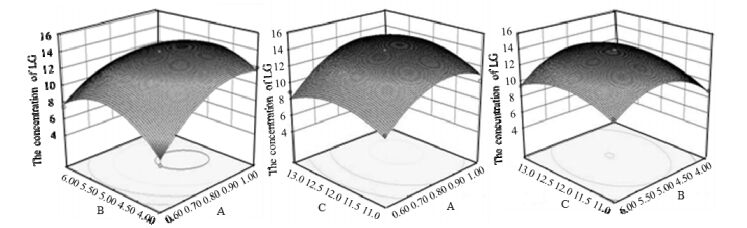
|
图 3 高纯水体积,活性炭质量与pH对生物油中内醚糖含量影响响应面图 Fig.3 Effects of water volume (A), active carbon weight (B) and pH (C) on levoglucosan concentration |
根据前人实验可知,纤维素类物质热解后,所获得生物油成分复杂,除了含有内醚糖外,还含有多种成分,如酸性物质(如甲酸、乙酸、糖质酸等),芳香族化合物,色素高分子,木素等。选取较为常规的方法对于非内醚糖等物质的去除,对后期的大批量工业生产有着较大的意义。木素不溶于水,在生物油中加入高纯水后经过离心,木素自然沉淀可将其除去。而在前期实验中发现影响内醚糖结晶提纯的主要原因为色素和少量胶体物质的存在。对于色素的去除,可采用活性炭吸附的方法。对于胶体的去除,可采用提高pH并保温过滤的原理,基于内醚糖在碱性条件下稳定存在的原理,选择了不同的无机碱对此进行对比,无机碱的选择对于内醚糖的收率有很大影响,两组平行试验数据说明Ca(OH)2优于NaOH,前者内醚糖的收率为57%、58%,后者为38%、42%。采用Ca(OH)2的结果较好,是因为Ca(OH)2中含有Ca2+,较易和其他物质形成沉淀并析出,且Ca(OH)2易于形成CaCO3,CaCO3分散度较好,对色素也会有一定的吸附作用[15]。
3.3 乙酸乙酯和水最优比例的确定前期的实验中发现,内醚糖在热乙酸乙酯中有一定的溶解度,虽然用乙酸乙酯萃取可获得较高纯度的内醚糖晶体,但收率不高,作者又探索了适于制备内醚糖的新分离方法。实验中发现当乙酸乙酯和水以一定比例进行混合后作为萃取剂,所获得内醚糖的含量较高。基于以上实验中的新发现,作者采用了不同乙酸乙酯和水的比例(0.5: 1、1:1、2:1、3:1、4:1)进行实验比较,结果如图 4所示。实验结果表明,当乙酸乙酯和水的比例为0.5:1和1:1时,内醚糖的提取率较低,这是因为乙酸乙酯体积较少,很容易达到饱和,使目标产物内醚糖不能充分溶出,当乙酸乙酯和水的比例从2:1增加到4:1时,随着乙酸乙酯体积的增加,内醚糖含量也随之增加,但从2:1到4:1,内醚糖产量增加不显著,从经济成本和后期浓缩处理等角度考虑,确定乙酸乙酯和水的比例为2:1。而旋转蒸发获得的内醚糖可用热乙酸乙酯重结晶以提高纯度,乙酸乙酯可回收再用。
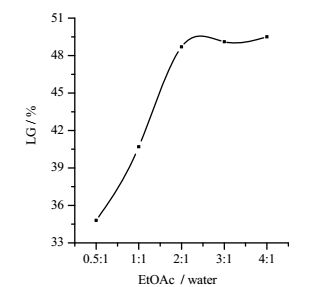
|
图 4 不同体积比的乙酸乙酯和水对内醚糖提取率的影响 Fig.4 Effects of EtOAC/water ratios on levoglucosan yields |
从生物油中分离所得的内醚糖红外吸收谱图如图 5所示,发现具有典型的糖类红外吸收峰(3356,3273,2906,1400,1131,1042 cm-1),通过对该内醚糖红外吸收光谱和已知红外谱进行比对后发现,在3670~3230 cm-1为-OH的伸缩振动,在2975~2845 cm-1为-CH的伸缩振动,1460 cm-1附近为-CH的变形振动,2925 cm-1附近为-CH2的振动,而在1098 cm-1和813 cm-1为饱和六元环醚的伸缩振动,在1150~1050 cm-1为-C-O-C的伸缩振动,这是常见的吡喃糖环内酯和羟基吸收产生的吸收峰,是由于糖环上C-O-C醚键的不对称伸缩振动,构成了糖类的特征吸收峰,为葡聚糖类典型的红外吸收峰。而1250 ~950 cm-1峰则证明该糖为吡喃型糖,与内醚糖结构相符[6, 16]。且由NaOH处理所得内醚糖的在2360 cm-1附近有一杂峰出现,说明利用NaOH处理所得纯度低于利用Ca(OH)2处理,与高效液相色谱所测得纯度一致。
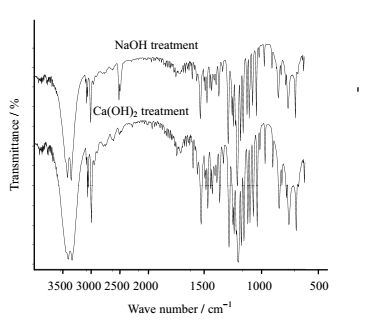
|
图 5 NaOH处理所得内醚糖及Ca(OH)2处理所得内醚糖的红外谱图 Fig.5 FTIR spectra of NaOH and Ca(OH)2 treated samples |
本实验利用HPLC对内醚糖标准品、NaOH和Ca(OH)2处理所得的内醚糖的峰面积(图 6)进行对比后可知,利用Ca(OH)2处理所得内醚糖的纯度要明显高于NaOH,Ca(OH)2处理所得内醚糖的纯度可高达98.17%,而利用NaOH处理所得内醚糖的纯度可达97.63%,利用本实验成功建立了利用蒸发光散射检测器对内醚糖进行定量检测分析的参数指标[17],经实验测定,定量限(LOQ)为9.08 μg·mL-1,检测限(LOD)为3.632 μg·mL-1,回收率为101%~107% (表 3)。蒸发光散射检测器较一般的液相色谱检测器相比,稳定性好,灵敏度高,适宜测定低含量的糖类物质并对其进行分析。以甲醇和水(V/V,9:1)混合作为流动相,甲醇在流动相中比例较大能够有效的改善色谱峰形,有利于各组分基线的分离。漂移管温度和气体流量则是蒸发光检测器的另外两个重要指标。漂移管温度的升高有利于流动相的完全蒸发,但温度过高会导致部分液体汽化,而气体的流量则会影响雾化器中液滴的形成,所以本实验选用漂移管温度为75℃,气体的流量为40 psi,可达到较小的噪声信号,使得色谱图基线趋于平稳。
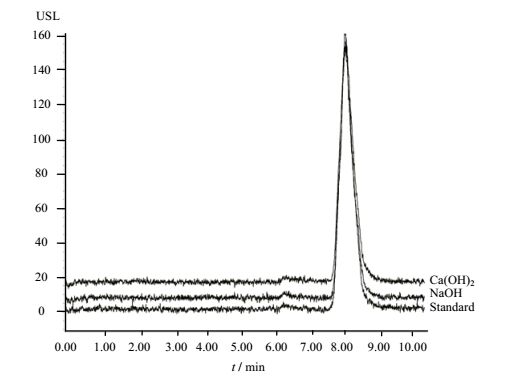
|
图 6 内醚糖标准品、NaOH处理所得内醚糖及Ca(OH)2处理所得内醚糖的液相色谱图 Fig.6 HPLC spectra of levoglucosan, NaOH treated and Ca(OH)2 treated samples |
| 表 3 内醚糖回收率测定结果 Table 3 Recovery of levoglucosan tested by a spiking method |
13C-NMR谱图清楚地显示有6个信号峰,说明共有6种碳,初步推测为单糖。且在δ65.2~ 72.5处皆为糖环碳,根据碳谱信号的δ值,结合红外光谱分析,判断该糖结构为吡喃糖结构,通过2D NMR谱分析后可知,NaOH处理所得内醚糖及Ca(OH)2处理所得内醚糖的13C的归属[18, 19]。内醚糖中主要碳原子的化学位移见图 7,内醚糖标准品a、NaOH处理所得内醚糖b及Ca(OH)2处理所得内醚糖c的100 MHz 13C-NMR谱对照谱图见图 7。
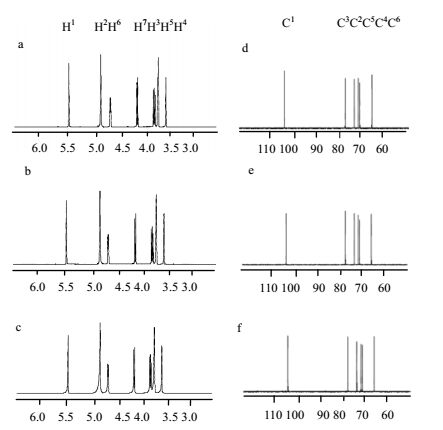
|
图 7 内醚糖标准品、NaOH处理所得内醚糖及Ca(OH)2处理所得内醚糖的400MHz 1H-NMR谱和100MHz 13C-NMR谱 Fig.7 400MHz 1H-NMR and 100MHz 13C-NMR results of levoglucosan (a, d), NaOH treated (b, e) and Ca(OH)2 treated samples (c, f) |
由图 7可知,b谱图、c谱图与a谱图基本一致,且由图 7可知,b谱图、c谱图的主要碳原子的化学位移与a谱图的主要碳原子化学位移基本一致,即NaOH处理所得内醚糖及Ca(OH)2处理所得内醚糖中的C原子骨架与标准品中的C原子骨架基本相同。
1H-NMR谱显示,质子信号都出现在δ3.50~ 5.45,提示为典型的糖信号。谱图中有明显的7个信号峰,说明共有7种氢原子。通过对NaOH处理所得内醚糖及Ca(OH)2处理所得内醚糖的2D NMR谱进行分析可得其1H的归属[18, 19]。内醚糖主要氢原子的化学位移见图 7,内醚糖标准品d、NaOH处理所得内醚糖e及Ca(OH)2处理所得内醚糖f的400 MHz 1H-NMR谱对照谱图见图 7。
由图 7可知,e谱图、f谱图与d谱图基本一致,且由图 7可知,e谱图、f谱图的主要氢原子的化学位移与d谱图的主要氢原子化学位移基本一致。即NaOH处理所得内醚糖与Ca(OH)2处理所得内醚糖中的H原子位置与标准品中的H原子位置基本相同。
因此通过结合13C-NMR和1H-NMR谱图可知,通过NaOH处理所得内醚糖及Ca(OH)2处理所得内醚糖的结构与标准品一致。说明利用Bruker AVⅢ核磁共振波谱仪来确定内醚糖的结构是可行的,且精准性高,通过该核磁共振仪可以极其详尽的说明有机物分子结构和分子间相互作用的信息,现利用核磁共振对单糖及多糖结构测定的方法已经成熟且有较多报道[19],但利用核磁共振对内醚糖进行结构表征的文献报道却很少。
4 结论本实验采用蒸发光散射器和Waters carbohydrate高效糖柱建立了一种快速、灵敏分析生物油中内醚糖的高效液相色谱法,HPLC分析时间只需9 min。采用4000~400 cm-1范围的红外光谱,并结合以TMS为内标,100 MHz 13C-NMR和400 MHz 1H-NMR建立了一种准确测定内醚糖结构的傅立叶变换红外光谱和核磁共振分析检测方法。经试验验证,在最优参数条件下(高纯水:生物油= 1:1 (V/V)、活性炭:生物油= 0.05:1 (m/V)、pH12.2),以乙酸乙酯和水(V/V,2:1)作为萃取剂,Ca(OH)2作为pH调节剂对生物油中内醚糖进行提取分离,所得内醚糖收率可高达58%,且纯度在98%以上。
| [1] | Vassilev S V, Vassileva C G, Vassilev V S. Advantages and disadvantages of composition and properties of biomass in comparison with coal:an overview[J]. Fuel , 2015, 158(15): 330-350. |
| [2] | ZHU Xi-feng(朱锡锋), LU Qiang(陆强), ZHENG Ji-lu(郑冀鲁), et al. Research on biomass pyrolysis and bio-oil characteristics(生物质热解与生物油的特性研究)[J]. Acta Energiae Solars Sinica(太阳能学报) , 2006(12): 1285-1289. DOI:10.3321/j.issn:0254-0096.2006.12.018. |
| [3] | WANG Shu-rong (王树荣), LUO Zhong-yang (骆仲泱), FANG Meng-xiang (方梦祥), et al. A device converse cellulose to levoglucosan (一种纤维素转化左旋葡聚糖装置)[P]. CN, 1724693. 2005-07-12. |
| [4] | Jarboe L R, Wen Z, Choi D, et al. Hybrid thermochemical processing:fermentation of pyrolysis-derived bio-oil[J]. Applied Microbiology and Biotechnology , 2011, 91(6): 1519-1523. DOI:10.1007/s00253-011-3495-9. |
| [5] | Zhuang X L, Zhang H X. Identification, characterization of levoglucosan kinase, and cloning and expression of levoglucosan kinase cDNA from Aspergillus niger CBX-209 in Escherichia coli[J]. Protein Expression and Purification , 2002, 26(1): 71-81. DOI:10.1016/S1046-5928(02)00501-6. |
| [6] | Bennett N M, Helle S S, Duff S J B, . Extraction and hydrolysis of levoglucosan from pyrolysis oil[J]. Bioresource Technology , 2009, 100(23): 6059-6063. DOI:10.1016/j.biortech.2009.06.067. |
| [7] | Crown Zellerbach Corporation, Process for preparation of levoglucosan[P]. US:3235541, 1966-02-19. |
| [8] | Weyerhaeuser Company. Separating levoglucosan and carbohydrate derived acids from aqueous mixtures containing the same by treatment with metal compounds[P]. US, 3374222:1968-03-19. |
| [9] | Midwest Research Institute, Isolation of levoglucosan from pyrolysis oil derived from cellulose[P], US:5371212, 1994-12-06.. |
| [10] | ZHANG Hong-xun (张洪勋), ZHUANG Xu-liang (庄续亮), YANG Jian-zhou (杨建州). The method of preparation levoglucosan from pyrolysis oil (自热解油中制备1, 6-脱水-β-D-吡喃葡萄糖的方法)[P]. CN, 00107956: 2000-06-01. |
| [11] | ZHUANG Xu-liang (庄绪亮). Study on bioconversion of levoglucosan derived from pyrolysis of cellulose (纤维素热解产物1, 6-脱水-β-D吡喃葡萄糖生物转化研究)[D]. Beijing (北京): Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences (中国科学院生态环境研究中心), 2001. |
| [12] | FAN Yong-sheng(樊永胜), CAI Yi-xi(蔡忆昔), LI Xiao-hua(李小华), et al. Bio-oil analysis and optimization of bio-oil yield from vacuum pyrolysis of rape straw using response surface methodology(响应面法优化油菜秸秆真空热解液化工艺及生物油分析)[J]. Journal of Chemical Engineering of Chinese University(高校化学工程学报) , 2015, 29(6): 628-633. |
| [13] | Vitasari C R, Meindersma G W, de Haan A B. Water extraction of pyrolysis oil:the first step for the recovery of renewable chemicals[J]. Bioresource Technology , 2011, 102(14): 7204-7210. DOI:10.1016/j.biortech.2011.04.079. |
| [14] | Pooja G, S , Indu S T. Enhanced removal of COD and color from landfill leachate in a sequential bioreactor[J]. Bioresource Technology , 2014, 170: 10-19. DOI:10.1016/j.biortech.2014.07.079. |
| [15] | NING Fang-yao(宁方尧), HUANG Yue-gang(黄悦刚). Study on sugar juice clarification using over-fine calcium carbonate(超细碳酸钙用于亚法澄清的探索)[J]. Guang Xi Journal of Light Industry(广西轻工业) , 2004(6): 17-19. |
| [16] | Song S Y, Lee Y K, Kim I J. Sugar and acid content of Citrus prediction modeling using FT-IR fingerprinting in combination with multivariate statistical analysis[J]. Food Chemistry , 2016, 190(1): 1027-1032. |
| [17] | Alsaadi M M, Christine C K, Mullen A B. High performance liquid chromatography with evaporative light scattering detection for the characterisation of a vesicular delivery system during stability studies[J]. Journal of Chromatography A , 2013, 1320(13): 80-85. |
| [18] | RONG Guo-bin(荣国斌). Structure determination of organic compounds——tables of spectral data(有机物结构鉴定)[M].Shanghai(上海): East China University of Science and Technology Press(华东理工大学出版社), 2002: 255. |
| [19] | Kosaka A, Aida M, Katsumoto Y. Reconsidering the activation entropy for anomerization of glucose and mannose in water studied by NMR spectroscopy[J]. Journal of Molecular Structure , 2015, 1093(5): 195-200. |




