2. 大连理工大学 精细化工国家重点实验室, 辽宁 大连 116024
2. State Key Laboratory of Fine Chemicals, Dalian University of Technology, Dalian 116024, China
1,4-丁二醇(BDO)是一种重要的精细化工原料,主要用来生产聚对苯二甲酸丁二醇酯、四氢呋喃、γ-丁内酯、可降解塑料聚对苯二甲酸-己二酸丁二酯/聚丁二酸丁二醇酯等[1-2]。工业化生产BDO主要为炔醛法工艺,即铜基催化剂催化乙炔和甲醛发生炔醛化反应生成1,4-丁炔二醇,1,4-丁炔二醇再被氢化还原为BDO[3]。炔醛化反应过程中,二价或者一价铜化合物与甲醛、乙炔作用,原位生成活性中间体乙炔亚铜[4]。保持高度分散且稳定存在的乙炔亚铜是铜基催化剂体现较好活性及稳定性的关键,而铜基催化剂的制备方法及助剂的种类影响铜化合物的分散性、价态变化及电子协同作用[5]。ZnO作为一种两性氧化物,常被用作助剂添加到催化剂中。共沉淀法制备铜锌催化剂时会获得锌孔雀石沉淀物,焙烧后可得到比表面积较大的铜锌氧化物,因此锌孔雀石被认为是铜锌催化剂最好的前驱体[6]。陈泽鹏等[7]采用共沉淀法制备了Cu-ZnO-ZrO2催化剂,发现以Na2CO3为沉淀剂,焙烧后得到的催化剂中CuO-ZnO间存在较强的相互作用,铜化合物颗粒小且分散度高。Jiang等[8]在制备CuO-ZnO催化剂时发现ZnO能够产生氧空位,有利于增强铜锌之间的电子协同作用。李海涛等[9]通过共沉淀法制备了CuO-ZnO催化剂,生成的固溶体能增加催化剂的稳定性,并且ZnO能够抑制CuO颗粒的生长和团聚,有效提高炔醛化过程中Cu2+转变为Cu+的效率。Ban等[10]通过共沉淀法制备了不同锌含量的CuO-ZnO催化剂,添加适量的ZnO起到分散活性铜化合物的作用,形成的铜锌界面结构有利于电子转移,促进了CuO转化为活性亚铜化合物。铜锌催化剂中氧空位对铜锌催化剂炔醛化反应中的影响尚未见报道。本研究为了获得小颗粒、高分散、活性中心稳定的铜基催化剂,采用共沉淀法,以Na2CO3为沉淀剂,锌化合物为助剂,制备了一系列铜锌催化剂,并通过炔醛化反应合成1,4-丁炔二醇,对催化剂进行了相关结构表征,探讨了催化剂制备条件对催化剂结构及炔醛化性能的影响。
2 实验部分 2.1 催化剂的制备称取9.779 g Cu(NO3)2·3H2O和6.020 g Zn(NO3)2·6H2O,溶解于6×10−2 m3蒸馏水中。另称取10.600 g Na2CO3配制0.1 m3约1×10−3 mol⋅m−3 Na2CO3水溶液。将Na2CO3溶液缓慢滴加到铜锌混合溶液中,均匀搅拌,控制溶液pH值为7~8,然后静置于65 ℃水浴中3 h。最后,将混合液过滤,洗涤滤饼并烘干(110 ℃,3 h),焙烧(450 ℃,4 h),所得催化剂命名为C2Z1-450。将催化剂的前驱体分别于250、350、550 ℃焙烧4 h,所得催化剂命名为C2Z1-250、C2Z1-350、C2Z1-550。
与C2Z1-450催化剂制备过程相同,铜、锌物质的量比为1:1、3:1、4:1时制备的催化剂命名为C1Z1-450、C3Z1-450、C4Z1-450。在相同条件下制备了CuO-450和ZnO-450催化剂,并进行了活性评价。为方便对照,以Cu2(OH)2CO3为组成的商业催化剂也进行了活性评价。与上述沉淀剂正加得到的C2Z1-450催化剂相区分,沉淀剂反加与并流得到的催化剂分别命名为C2Z1-450-reverse、C2Z1-450-parallel。
2.2 催化剂的表征催化剂X射线衍射(XRD)表征采用德国Bruker D8型X射线衍射仪,波长λ=1.540 56×10−8 cm,扫描范围为5°~80°。氢气程序升温还原(H2-TPR)表征分析使用中国先权公司的TP-5080型仪器测试。扫描电镜(SEM)及元素分布表征采用日本日立公司的S-4800场发射扫描电子显微镜。透射电镜(TEM)表征使用日本日立公司的H-7650型电子显微镜。X射线光电子能谱(XPS)表征采用美国Thermo Fisher Scientific公司的ESCALAB 250Xi型X射线光电子能谱仪,利用C1s结合能(284.8 eV)进行电荷校准。
2.3 催化剂催化炔醛化反应合成1,4-丁炔二醇的性能评价称取1.2 g催化剂,量取2×10−2 m−3甲醛溶液(质量分数为20%)放入三颈瓶中,用Na2CO3-NaHCO3缓冲液调节反应液pH值为7.5。将反应瓶中缓慢通入氮气排除体系中的空气,逐渐升温至75 ℃,改通入一定流速的乙炔气体。保持反应体系75 ℃,4 h后,升高温度至90 ℃,进行炔醛化反应。反应7 h后改通入氮气并降低反应温度至室温。将混合液过滤,洗涤滤饼并真空干燥。滤液中甲醛含量采用亚硫酸钠法测定,1,4-丁炔二醇含量通过气相色谱仪(GC-2014C Plus)测定,以BDO为内标物。为考察催化剂的稳定性,将真空干燥保存的反应后催化剂再进行上述评价过程。
3 结果与分析 3.1 XRD表征由图 1可见,催化剂均在32.51°、35.54°、38.73°、48.72°处出现CuO的衍射峰,在31.77°、34.42°、36.25°、47.54°处出现ZnO的衍射峰[11]。焙烧温度为250 ℃时,CuO与ZnO的衍射峰发生重叠,说明有铜锌固溶体产生[12]。随着焙烧温度升高,CuO与ZnO的衍射峰愈加尖锐,固溶体随之消失。与CuO-450相比,C2Z1-450中CuO衍射峰更加尖锐。反应后催化剂C2Z1-450-used中CuO与ZnO的衍射峰消失,在43.30°、50.43°、74.13°处出现Cu0衍射峰,并在31.99°、36.43°处出现Cu2C2微弱衍射峰[13]。反应后催化剂中CuO衍射峰消失是因为Cu2+在反应过程中逐渐转变为活性中心Cu2C2及无活性的Cu0 [14]。ZnO (002)极性平面中存在较多的氧空位,通常利用ZnO晶面强度I002/I100值反映氧空位的数量[15]。经过计算可得C2Z1-350、C2Z1-450、C2Z1-550 3个催化剂I002/I100值分别为0.796、0.770、0.737,随着焙烧温度升高,氧空位含量减少。C2Z1-250生成铜锌固溶体,无法计算I002/I100值。
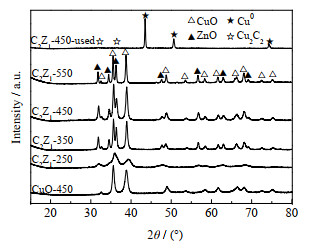
|
图 1 催化剂XRD分析 Fig.1 XRD patterns of catalysts |
对催化剂进行TEM及SEM-mapping表征,观察催化剂形貌、分散情况及颗粒尺寸。如图 2所示,CuO颗粒主要呈球状。CuO的颗粒尺寸约为40 nm,并且团聚现象严重。添加锌助剂后,催化剂中CuO颗粒尺寸明显减小,催化剂中CuO的分散性也有所改善。C2Z1-250催化剂的颗粒尺寸约为10 nm,C2Z1-350、C2Z1-450 2个催化剂颗粒尺寸比较均匀,大小相近,约为20 nm。当焙烧温度达到550 ℃时,催化剂颗粒尺寸增大至50 nm,并且发生明显团聚。从SEM-mapping图中可以看出在C2Z1-450催化剂中,Cu、Zn元素的均匀分布,说明催化剂中CuO与ZnO均匀分散。

|
图 2 催化剂TEM及SEM-mapping图 Fig.2 TEM and SEM-mapping images of catalysts |
图 3为各样品的H2-TPR图。由于ZnO在低于400 ℃很难被还原,因此图中还原峰均归属于CuO还原峰[16]。CuO-450在337 ℃出现CuO还原为Cu0的还原峰,而铜锌催化剂中CuO还原峰均向低温区偏移,说明锌化合物使CuO还原温度降低。这是由于添加锌化合物使CuO颗粒尺寸减小,有利于CuO还原,与TEM分析结果一致[17]。另外,H2在ZnO表面的解离吸附促进CuO还原[18]。C2Z1-250样品出现以305 ℃为中心的宽峰,由TEM分析C2Z1-250颗粒尺寸较小,分散较均匀,通常会有较低的氢气还原峰,但是铜锌固溶体的存在使CuO还原峰较高[9]。C2Z1-350出现以280 ℃为中心的还原峰,峰形较宽。C2Z1-450出现以295 ℃为中心的α峰及310 ℃为中心的较小的β峰,α峰为C2Z1-450中尺寸较小的CuO还原峰,β峰为颗粒较大的CuO还原峰[19]。α峰对称且尖锐,表明450 ℃焙烧的催化剂C2Z1-450中,大部分CuO颗粒尺寸较均匀。C2Z1-550中CuO还原温度明显升高,还原温度区间为300~360 ℃,说明CuO颗粒尺寸较大,这与TEM的分析结果一致。值得注意的是,结合TEM分析,催化剂C2Z1-350、C2Z1-450中CuO颗粒的平均尺寸接近,但是C2Z1-350中CuO还原温度较低,这是由于CuO与ZnO之间形成了较多氧空位,氧空位促进晶格氧迁移至催化剂表面,有利于降低CuO-ZnO中CuO的还原温度[15, 20]。XRD计算的氧空位含量结果表明,C2Z1-350、C2Z1-450、C2Z1-550中的氧空位含量逐渐减少,与其中的CuO还原温度逐渐升高紧密相关。
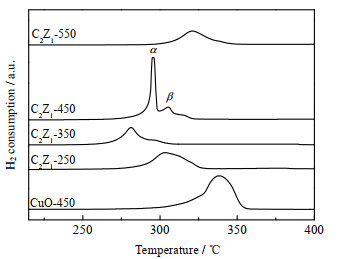
|
图 3 催化剂H2-TPR图 Fig.3 H2-TPR profiles of catalysts |
为了进一步探究催化剂表面物种的价态及相互作用,对C2Z1-350、C2Z1-450以及反应后的催化剂C2Z1-450-used进行了XPS表征。图 4(a)中C2Z1-350和C2Z1-450催化剂均在933及953 eV附近出现Cu 2p3/2和Cu 2p1/2的电子结合能,942 eV出现Cu2+的卫星峰,说明催化剂C2Z1-350、C2Z1-450中有Cu2+ [21]。对C2Z1-350、C2Z1-450的Cu 2p3/2峰进行分峰拟合后发现,在933.7与933.9 eV出现Cu2+的峰及少量932.7与932.9 eV的峰,推测催化剂中存在少量Cu0或Cu+ [22]。C2Z1-350比C2Z1-450的Cu 2p电子结合能低0.2 eV,说明C2Z1-350中铜元素周围电子密度较高。与C2Z1-450相比,C2Z1-450-used电子结合能峰中Cu2+的卫星峰消失,说明反应后催化剂中Cu2+被还原成Cu+或Cu0。另外,C2Z1-450-used中的Cu 2p向低结合能方向偏移,说明反应后铜元素周围电子密度增加。由图 4(b) Cu LMM谱图可进一步确定铜元素价态,C2Z1-350与C2Z1-450催化剂均在917.4和914.3 eV出现归属于Cu2+和Cu+的电子动能峰,Cu2+的质量分数分别为75.81% 与75.96%,而C2Z1-450-used在916.1和918.9 eV出现分别属于Cu+和Cu0的电子动能峰[23-24],其中Cu+的质量分数为97.46%。由上述分析可知,铜锌催化剂中铜元素以Cu2+为主,存在少量由铜锌相互作用产生的Cu+ [25]。反应后的铜锌催化剂中以Cu+为主,存在少量由于Cu2+被过度还原得到的Cu0。
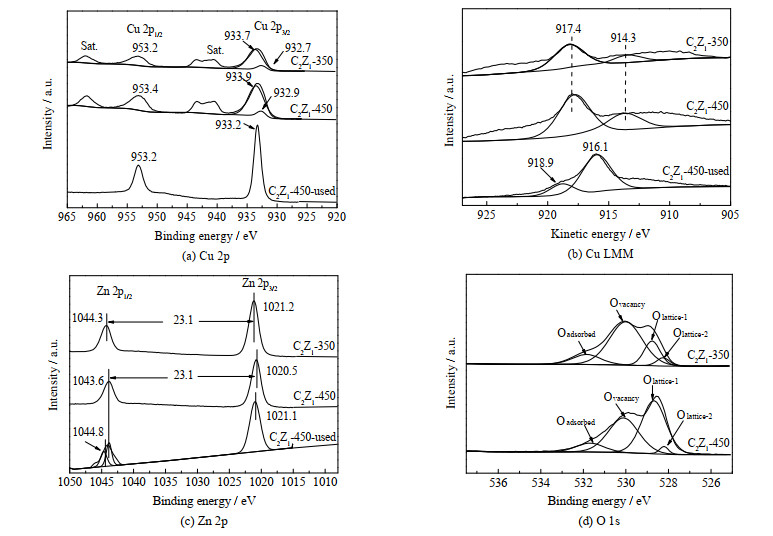
|
图 4 催化剂的XPS谱图 Fig.4 XPS spectra of catalysts |
图 4(c)为Zn 2p轨道的XPS谱图,C2Z1-350、C2Z1-450分别在1 021.2和1 020.5 eV出现Zn 2p3/2电子结合能峰,在1 044.3和1 043.6 eV出现Zn 2p1/2电子结合能峰[26]。C2Z1-350的Zn 2p电子结合能略高于C2Z1-450催化剂,说明C2Z1-350中锌元素周围电子密度较低。与C2Z1-450相比,C2Z1-450-used的电子结合能向高偏移,说明反应后催化剂中锌元素周围电子密度下降。通过图 4(a)、(c)中催化剂反应前后结合能的变化,说明Cu-Zn之间电荷实现了再分布。Cu的电负性高于Zn,促使ZnO上的电子流向CuO,相应的Zn 2p结合能增加,Cu 2p结合能降低[10],这很好地解释了铜锌催化剂反应前出现少量Cu+,反应后出现少量Cu0的原因。图 4(d)显示氧元素主要以吸附氧(Oadsorbed)、氧空位(Ovacancy)、ZnO晶格氧(Olattice-1)、CuO晶格氧(Olattice-2)形式存在[27]。由积分面积计算氧空位含量,C2Z1-350氧空位为65.18%,高于C2Z1-450氧空位42.61%,与XRD分析结论一致。
3.5 铜锌催化剂对炔醛化反应的催化活性图 5为催化剂焙烧温度从250上升至450 ℃时,1,4-丁炔二醇收率从17% 增加到43%。焙烧温度升高到550 ℃时,1,4-丁炔二醇收率下降至20%。甲醛转化率及1,4-丁炔二醇选择性均出现相似的变化趋势。C2Z1-450催化剂表现出最高的1,4-丁炔二醇收率(43%)及选择性(73%)。ZnO对炔醛化反应没有催化活性,但添加锌助剂后有效提高了铜基催化剂催化活性。对商业催化剂进行相同条件活性评价,商业催化剂的催化活性明显低于C2Z1-350和C2Z1-450催化剂。
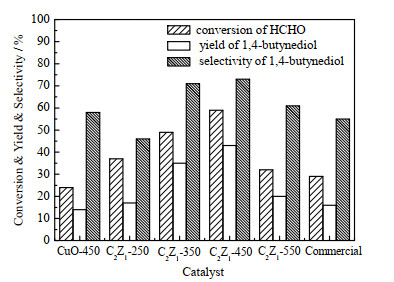
|
图 5 焙烧温度对铜锌催化剂炔醛化反应活性影响评价 Fig.5 Effect of calcination temperature on the performance of Cu -Zn catalysts |
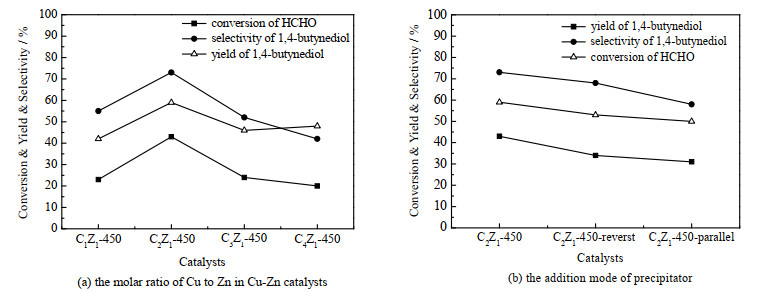
图 6为不同铜锌物质的量比、不同沉淀剂滴加方式对催化剂炔醛化反应活性的影响。图 6(a)显示,当铜锌物质的量比为2:1时,C2Z1-450催化炔醛化反应得到最高的1,4-丁炔二醇收率及选择性。这种非线性关系归因于ZnO和活性Cu+之间的协同效应,适当铜锌物质的量比能够激活一定比例的乙炔、甲醛,形成稳定的活性中间体Cu2C2,有利于生成1,4-丁炔二醇[10]。
|
图 6 催化剂炔醛化反应活性 Fig.6 Performance of catalysts in ethynylation reaction of formaldehyde |
由图 6(b)可见,沉淀剂不同滴加方式对炔醛化性能有较大的影响,沉淀剂正加所制备的催化剂表现出最好的催化活性。研究表明,沉淀剂的滴加方式对催化剂的微观结构有一定影响,因而各催化剂活性差别较大。正加法制备的铜锌催化剂中CuO容易被还原,有利于Cu2+还原为活性Cu+物种,因此催化活性较高[28]。
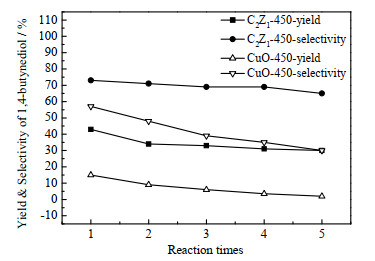
为考察铜锌催化剂炔醛化反应稳定性,对C2Z1-450进行循环实验,并与CuO-450进行对照(图 7)。经过5次循环反应后,C2Z1-450的1,4-丁炔二醇收率由43% 降低到30%,1,4-丁炔二醇选择性维持在70%。而CuO-450的1,4-丁炔二醇收率由15% 降低到1.83%,1,4-丁炔二醇选择性由57% 降低到30%。与CuO-450相比,添加锌助剂后的C2Z1-450催化活性及稳定性均有较大提升。炔醛化反应过程中,甲醛会发生聚合反应、歧化反应,生成多聚甲醛、甲醇、甲酸等副产物,导致1,4-丁炔二醇选择性只有70% 左右。通常反应体系pH小于4导致甲醛聚合生成多聚甲醛,pH大于8会发生甲醛的歧化反应生成甲醇、甲酸。随着反应时间的延长,催化剂中的铜化合物会团聚,流失,活性中心被覆盖等结构变化,以及操作过程中催化剂损失均会导致1,4-丁炔二醇收率有所降低。
|
图 7 CuO-450与C2Z1-450催化剂炔醛化反应稳定性 Fig.7 Stability of CuO-450 and C2Z1-450 catalysts in ethynylation reaction of formaldehyde |
由上述催化剂表征及催化炔醛化反应的结果,可以发现添加锌助剂后铜基催化剂活性及稳定性有所提高。C2Z1-250形成了铜锌固溶体、C2Z1-550颗粒尺寸较大且发生团聚,Cu2+难以还原为活性Cu+,故C2Z1-250、C2Z1-550催化性能较低。C2Z1-350和C2Z1-450体现较好的催化活性是由于C2Z1-350和C2Z1-450中CuO颗粒尺寸较小、分散较均匀、催化剂中具有丰富的氧空位,铜锌之间存在较强的相互作用。根据炔醛化反应机理[10],CuO在甲醛与乙炔的作用下还原为亚铜物种,并形成乙炔亚铜。乙炔亚铜作为亲核试剂进攻甲醛中的羰基,生成1,4-丁炔二醇。铜锌相互作用有利于稳定乙炔亚铜。氧空位增加了铜锌之间的电子流动,进一步增强铜锌电子协同作用。电子协同作用使铜锌催化剂中存在Cu+,一方面,Cu+可以与乙炔分子结合,形成活性Cu2C2;另一方面,不受束缚的Cu+容易被甲醛/乙炔过度还原为Cu0[29]。Cu0使部分活性位点流失,还可能诱发生成聚炔,覆盖活性位点,不利于催化炔醛化反应[30]。
4 结论通过共沉淀法制备了铜锌催化剂,并催化炔醛化反应合成1,4-丁炔二醇。研究表明铜锌物质的量比为2:1、沉淀剂正加方式、焙烧温度为450 ℃时制备的C2Z1-450催化剂具有较好的炔醛化性能。一方面,添加锌助剂后,C2Z1-450催化剂中CuO颗粒尺寸减小,分散性增加,铜锌间电子协同作用增强,有利于生成活性乙炔亚铜。另一方面,铜锌催化剂经过高温焙烧后产生了氧空位,氧空位为电子流动提供平台,有利于增强铜锌之间电子协同作用。
| [1] |
LUO P, LI X D. Application and market of 1,4-butanediol production of Reppe method in China[J]. American Journal of Chemical Engineering, 2021, 9(2): 34-38. DOI:10.11648/j.ajche.20210902.11 |
| [2] |
LEE Y, KIM Y T, KWON E E, et al. Biochar as a catalytic material for the production of 1,4-butanediol and tetrahydrofuran from furan[J]. Environmental Research, 2020, 184: 109325. DOI:10.1016/j.envres.2020.109325 |
| [3] |
高峰, 杨林雪, 王吉德, 等. 甲醛乙炔化反应铜基催化剂研究进展[J]. 天然气化工−C1化学与化工, 2022, 47(5): 17-25. GAO F, YANG L X, WANG J D, et al. Research progress of Cu-based catalysts for ethynylation of formaldehyde[J]. Natural Gas Chemical Industry, 2022, 47(5): 17-25. |
| [4] |
GUPTE S P, JADKAR P B, CHAUDHARI R V. Kinetics of ethynylation of formaldehyde to butynediol[J]. Reaction Kinetics and Catalysis Letters, 1984, 24(1/2): 173-177. |
| [5] |
YANG G H, GAO F, YANG L X, et al. MnOx effect on the performance of Cu-based catalysts in ethynylation of formaldehyde for 1,4-butynediol synthesis[J]. Reaction Kinetics, Mechanisms and Catalysis, 2022, 135(5): 2611-2627. DOI:10.1007/s11144-022-02265-z |
| [6] |
JIANG X, LING C, WANG Z Y, et al. The effect of Cu-Zn distribution in zincian malachite on the formation of individual CuO and ZnO particles[J]. Journal of Thermal Analysis and Calorimetry, 2019, 137(5): 1519-1525. DOI:10.1007/s10973-019-08081-3 |
| [7] |
程鹏泽, 高文桂, 纳薇, 等. 不同沉淀剂对CO2加氢合成甲醇Cu-ZnO-ZrO2催化剂性能的影响[J]. 化工进展, 2017, 36(8): 2955-2961. CHENG P Z, GAO W G, NA W, et al. Influence of different precipitants on the properties of Cu-ZnO-ZrO2 catalyst for methanol synthesis through CO2 hydrogenation[J]. Chemical Industry and Engineering Progress, 2017, 36(8): 2955-2961. |
| [8] |
JIANG X Y, JI Y J, LI J, et al. Impact of oxygen vacancy in CuO-ZnO catalysts on the selectivity of dimethyldichlorosilane monomer in the Rochow reaction[J]. Molecular Catalysis, 2021, 504: 111453. DOI:10.1016/j.mcat.2021.111453 |
| [9] |
李海涛, 郝全爱, 王志鹏, 等. 不同沉淀剂制备CuO-ZnO催化剂甲醛乙炔化反应性能[J]. 分子催化, 2019, 33(2): 124-131. LI H T, HAO Q A, WANG Z P, et al. Study on catalytic performance of CuO-ZnO catalyst prepared by different precipitants[J]. Journal of Molecular Catalysis, 2019, 33(2): 124-131. |
| [10] |
BAN L J, LI H T, ZHANG Y, et al. Importance of zinc oxide in Cu-based catalysts for the ethynylation of formaldehyde to 1,4-butynediol[J]. The Journal of Physical Chemistry C, 2021, 125(30): 16536-16549. DOI:10.1021/acs.jpcc.1c04886 |
| [11] |
El-MOllA S A, IBRAHIM S M, EBRAHIM M M. Influence of ZnO doping and calcination temperature of nanosized CuO/MgO system on the dehydrogenation reactions of methanol[J]. International Journal of Industrial Chemistry, 2016, 7(2): 223-229. DOI:10.1007/s40090-016-0076-x |
| [12] |
李忠, 刘岩, 何忠, 等. Cu/Zn比对微波辐射老化制备CuO/ZnO/Al2O3催化剂结构和活性的影响[J]. 化学学报, 2011, 69(5): 570-576. LI Z, LIU Y, HE Z, et al. Effects of Cu/Zn on the structure and activity of CuO/ZnO/Al2O3 catalysts prepared under microwave irradiation in aging process[J]. Acta Chimica Sinica, 2011, 69(5): 570-576. |
| [13] |
LU C Y, ZENG A N, WANG Y, et al. High-performance catalysts derived from cupric subcarbonate for selective hydrogenation of acetylene in an ethylene stream[J]. European Journal of Inorganic Chemistry, 2021, 2021(10): 997-1004. DOI:10.1002/ejic.202001073 |
| [14] |
WANG Z P, NIU Z Z, HAO Q A, et al. Enhancing the ethynylation performance of CuO-Bi2O3 nanocatalysts by tuning Cu-Bi interactions and phase structures[J]. Catalysts, 2019, 9(1): 35. DOI:10.3390/catal9010035 |
| [15] |
CHEN F, ZHANG P P, XIAO L W, et al. Structure-performance correlations over Cu/ZnO interface for low-temperature methanol synthesis from syngas containing CO2[J]. ACS Applied Materials & Interfaces, 2021, 13(7): 8191-8205. |
| [16] |
JUNG K D, JOO O S, HAN S H. Structural change of Cu/ZnO by reduction of ZnO in Cu/ZnO with methanol[J]. Catalysis Letters, 2000, 68(1/2): 49-54. DOI:10.1023/A:1019027302428 |
| [17] |
陈帅帅, 陈鑫超, 凌晨, 等. 微反应器中超声对Cu-ZnO催化剂制备过程的影响[J]. 高校化学工程学报, 2019, 33(5): 1092-1097. CHEN S S, CHEN X C, LING C, et al. Effects of ultrasound on the preparation of Cu-ZnO catalysts in a microreactor[J]. Journal of Chemical Engineering of Chinese Universities, 2019, 33(5): 1092-1097. DOI:10.3969/j.issn.1003-9015.2019.05.009 |
| [18] |
ANNESINI M C, LAVECCHIA R, MARRELLI L, et al. Reduction kinetics of CuO-ZnO[J]. Solid State Ionics, 1993, 63-65: 281-288. DOI:10.1016/0167-2738(93)90117-L |
| [19] |
TADA S, WATANABE F, KIYOTA K, et al. Ag addition to CuO-ZrO2 catalysts promotes methanol synthesis via CO2 hydrogenation[J]. Journal of Catalysis, 2017, 351: 107-118. DOI:10.1016/j.jcat.2017.04.021 |
| [20] |
CHEN D K, HE D D, LU J C, et al. Investigation of the role of surface lattice oxygen and bulk lattice oxygen migration of cerium-based oxygen carriers: XPS and designed H2-TPR characterization[J]. Applied Catalysis B: Environmental, 2017, 218: 249-259. DOI:10.1016/j.apcatb.2017.06.053 |
| [21] |
IVANOVA T M, MASLAKOV K I, SIDOROV A A, et al. XPS detection of unusual Cu(Ⅱ) to Cu(Ⅰ) transition on the surface of complexes with redox-active ligands[J]. Journal of Electron Spectroscopy and Related Phenomena, 2020, 238: 146878. DOI:10.1016/j.elspec.2019.06.010 |
| [22] |
LEE J H, LEE B J, LEE D W, et al. Synergistic effect of Cu on a Ag-loaded CeO2 catalyst for soot oxidation with improved generation of active oxygen species and reducibility[J]. Fuel, 2020, 275: 117930. DOI:10.1016/j.fuel.2020.117930 |
| [23] |
CHEN H Y, CHEN L, LIN J, et al. Copper sites in copper-exchanged ZSM-5 for CO activation and methanol synthesis: XPS and FTIR studies[J]. Inorganic Chemistry, 1997, 36(7): 1417-1423. DOI:10.1021/ic960122l |
| [24] |
DURANDO M, MORRISH R, MUSCAT A J. Kinetics and mechanism for the reaction of hexafluoroacetylacetone with CuO in supercritical carbon dioxide[J]. Journal of the American Chemical Society, 2008, 130(49): 16659-16668. DOI:10.1021/ja8050662 |
| [25] |
BILKOVA I, SOBCZAK I, DECYK P, et al. The effect of zinc and copper in gold catalysts supported on MCF cellular foams on surface properties and catalytic activity in methanol oxidation[J]. Microporous and Mesoporous Materials, 2016, 232: 97-108. DOI:10.1016/j.micromeso.2016.06.008 |
| [26] |
PETER R, PETRAVIC M. Initial stages of oxide formation on copper surfaces during oxygen bombardment at room temperature[J]. The Journal of Physical Chemistry C, 2021, 125(45): 25290-25297. DOI:10.1021/acs.jpcc.1c07615 |
| [27] |
YE H C, NA W, GAO W G, et al. Carbon-modified CuO/ZnO catalyst with high oxygen vacancy for CO2 hydrogenation to methanol[J]. Energy Technology, 2020, 8(6): 2000194. DOI:10.1002/ente.202000194 |
| [28] |
罗小军, 王榕, 林建新, 等. 沉淀方法对Ru/CeO2氨合成催化剂催化性能的影响[J]. 催化学报, 2009, 30(11): 1125-1130. LUO X J, WANG R, LIN J X, et al. Effect of precipitation methods on catalytic activity of Ru/CeO2 catalyst for ammonia synthesis[J]. Chinese Journal of Catalysis, 2009, 30(11): 1125-1130. |
| [29] |
HUANG X, LI H T, ZHANG Y, et al. Enhancement of Cu+ stability under a reducing atmosphere by the long-range electromagnetic effect of Au[J]. Nanoscale, 2022, 14(36): 13248-13260. DOI:10.1039/D2NR02407A |
| [30] |
TROTUŞ I T, ZIMMERMANN T, SCHÜTH F. Catalytic reactions of acetylene: a feedstock for the chemical industry revisited[J]. Chemical Reviews, 2014, 114(3): 1761-1782. DOI:10.1021/cr400357r |




