芍药苷与芍药内酯苷是传统中药赤芍中的主要活性成分,具有各自独特的药用功效,其中芍药苷具有保护神经[1]、抗伤害性疼痛[2]、抗癌[3]及治疗心脑血管疾病[4]等药理学作用;芍药内酯苷在抗抑郁、糖尿病潜在治疗等方面,表现出显著的药效特点[5]。目前关于从芍药提取物中同时提取芍药苷和芍药内酯苷活性组分的方法主要有大孔吸附树脂法[6, 7]和硅胶柱层析法[8]。但现有的分离工艺中多以芍药苷活性组分的纯度作为考察目标,难以同时得到芍药苷与芍药内酯苷两种活性组分,且工艺繁琐,得到的产品收率低,有的使用大量的有机溶剂造成溶剂残留[9]。
近年来超临界流体色谱(SFC)技术在分离天然药物方面得到了十分广泛的应用[10, 11]。它是一种以超临界流体为流动相的新型色谱分离技术[12],具有分离时间短、分离效率高、分离温度低等优势,对于提纯热敏性的药物具有优良的性能[13]。制备型超临界色谱(Prep-SFC)系统增加了收集装置,在分离的基础上可以同时达到富集产品的目的。本研究应用SFC技术从赤芍粗提物中同时制备芍药苷与芍药内酯苷活性组分。采用半制备的CN色谱柱(9.4 mm×250 mm, 5 μm),考察了夹带剂、CO2流量、柱压、柱温对分离效果的影响,并建立了容量因子模型。为模拟移动床式制备型超临界色谱(SMB-SFC)[14]大规模分离和制备芍药苷和芍药内酯苷产品提供基础数据和技术支持。
2 实验仪器与材料 2.1 实验材料芍药苷标准品(纯度99.3%(wt),南通飞宇生物科技公司),芍药内酯苷标准品(纯度98.0%(wt),南通飞宇生物科技公司),赤芍粗提物(芍药苷47.04%(wt)、芍药内酯苷9.68%(wt)),二氧化碳(纯度99.9%(wt),天津六方气体厂),甲醇(色谱纯,Merck公司),无水乙醇(分析纯,天津江天化工公司),甲醇(分析纯,天津江天化工公司),纯净水(电阻率1.60×107 Ω·cm-1,实验室自备)。
2.2 实验装置及流程实验仪器为美国Thar公司的SFC-200型制备型超临界流体色谱装置,色谱柱采用半制备CN柱(9.4 mm ×250 mm,5 μm),实验流程图已在文献中报道[15]。具体的实验操作如下:首先将流动相温度、柱温、产品收集温度分别设定为273.15、313.15、293.15 K,同时打开启动工作站,设置系统压力和CO2的流量。然后排空夹带剂泵,同时设定夹带剂流量。启动压力调节阀,打开CO2储气瓶,等待装置压力稳定。待水浴温度到达设定值后,开启CO2泵,等待色谱基线稳定。随后开启乙醇进料泵,SFC基线重新稳定后,手动注入样品,样品为经0.45 μm的微孔滤膜过滤后赤芍粗提物的乙醇溶液。
2.3 分析仪器分析仪器为Agilent-1100高效液相色谱,分析柱采用C-18柱(4.6 mm×250 mm,5 μm),分析条件为:流动相:甲醇:水(V:V)=4:6;流动相流量:1.00 mL·min-1;柱箱温度:25℃;进样量:20 μL;检测器:紫外检测器;检测波长:230 nm。
2.4 实验条件实验在夹带剂(乙醇)含6.82%~16.03%(wt),CO2流量16~26 g·min-1,柱压10~17 MPa,柱温308.15~328.15 K的范围内探究SFC分离芍药苷和芍药内酯苷的规律,紫外检测器紫检测波长:230 nm。
3 实验结果与讨论 3.1 夹带剂的影响芍药苷与芍药内酯苷均含有双键,互为同分异构体,因此选用适宜分离含双键异构体的CN柱(9.4 mm×250 mm,5 μm)作为固定相,并在流动相超临界二氧化碳(SC-CO2)中加入一定量的有机溶剂作为夹带剂,以增强流动相的溶剂化能力,进而提高SFC分离效率。一般常在SC-CO2中加入0~20%(wt)甲醇或者乙醇作为夹带剂[16]。芍药苷与芍药内酯苷作为中药活性组分,对其安全性有着较高的要求,因此本实验选用无毒的乙醇作为夹带剂。
实验中选用芍药苷与芍药内酯苷组分在SFC中色谱峰分离度(R)作为评价分离效果的指标。R是用来评价所用色谱分离效能的重要参数,表达式如式(1)所示。研究了夹带剂含量对分离效果的影响,结果如图 1所示。
| $ R=\frac{2\Delta t}{{{W}_{1}}+{{W}_{2}}} $ | (1) |
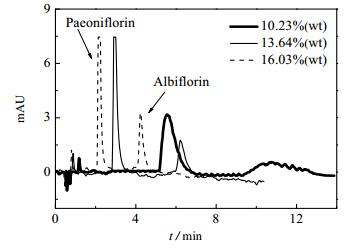
|
图 1 不同乙醇含量下SFC谱图 Fig.1 SFC spectra of samples under different ethanol contents |
式中,W1、W2分别是芍药苷及芍药内酯苷的色谱峰底宽,无因次;∆t是两色谱峰之间的距离,无因次。
从图 1可以看出,当乙醇含量为10.23%(wt)时,芍药苷有较好的洗脱效果,但样品中的芍药内酯苷洗脱效果较差。随着乙醇含量的增加,流动相的极性不断增强,使得样品中芍药苷和芍药内酯苷组分在流动相中的溶解度增加,在流动相和固定相的吸附与脱附行为增强,保留时间逐步缩短,峰形愈加对称且尖锐。当乙醇含量达到13.64%(wt)时,两组分均能够获得较好洗脱效果。而继续增加乙醇含量到16.03%(wt)时,夹带剂对组分的洗脱效果影响不显著。考虑夹带剂的含量过大会增加后续分离难度并且造成溶剂浪费,因此选择流动相中适宜的乙醇含量为13.64%(wt)。
3.2 CO2流量的影响以SC-CO2/C2H5OH二元体系作为流动相,在夹带剂含量13.64%(wt),柱温313.15 K,柱压12 MPa,紫外检测器波长230 nm条件下,CO2流量对R的影响见图 2。

|
图 2 CO2流量对分离度影响 Fig.2 Effects of CO2 flow rate on R |
由图 2可以看出,R随CO2流量的增大呈先增大后减小的趋势。在SFC分离过程中,CO2流量的增大有利于样品中各组分在流动相与固定相之间的分[17],所以流量增大使得R增大;而在CO2流量过大时,溶质分子尚未扩散到CN柱填料内表面就被洗脱带走,与固定相的接触时间的减少直接使得CN柱效率降低,R减小。CO2流量控制在16~26 g·min-1时,R值均大于1.5,说明在该范围内芍药苷与芍药内酯苷组分在色谱柱中均能够完全分离开,R流量变化不大,而实验中流量过大易导致色谱柱压降过大,因此为能够在制备过程中更好的实现分离芍药苷与芍药内酯苷活性组分的目的,选择CO2最佳流量为20 g·min-1。
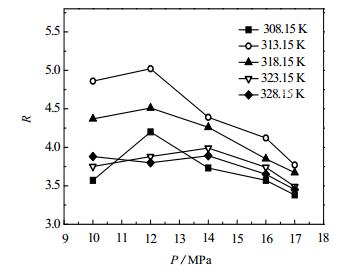
3.3 压力的影响柱压是影响SFC分离效率的重要因素之一[17]。不同的温度下,赤芍活性组分的容量因子(k)和R随压力的变化分别如图 3,图 4所示。其中,k是描述溶质在固定相和流动相中分配特性的参数,定义式如式(2)所示。
| $ k{\rm{ = }}\frac{{{t_{\rm{R}}} - {t_0}}}{{{t_0}}} $ | (2) |

|
图 3 压力对容量因子的影响 Fig.3 Effects of pressure on k (a) paeoniflorin (b)albiflorin |
|
图 4 压力对分离度影响 Fig.4 Effects of pressure on R |
其中,tR是溶质保留时间,min;t0是色谱柱死时间,min。
由图 3可看出,当温度一定时,k1、k2均随着压力的增加而减小。由于压力的增加导致SC-CO2密度的增大,流动相对芍药苷与芍药内酯苷组分的洗脱能力增加,溶质分子在色谱柱中的保留时间减少,因而k1、k2减小。并且压力越小,即密度越小时,k随压力的变化越敏感。
从图 4中可以看出,温度一定时,R随着压力的增高呈先增大后减小的趋势。压力的增加直接导致流动相密度的增加,溶剂化能力增强。但流动相对芍药苷与芍药内酯苷组分溶解能力的影响不同,因此R增加。当压力继续增高,流动相对各组分的溶解能力趋于相同,使得R降低。在柱温313.15 K、柱压12 MPa时R达到最大,为4.86。此外,柱压直接影响到色谱柱的压降与使用寿命,为使芍药苷与芍药内酯苷组分得到更好的分离,同时使色谱柱能够在较低压力下工作,因此确定适宜的柱压为12 MPa。
3.4 温度的影响柱温是影响SFC分离效率的又一重要因素[18]。不同的压力下,k1、k2及R随温度变化趋势分别如图 5,图 6所示。

|
图 5 温度对容量因子的影响 Fig.5 Effects of temperature on k (a) paeoniflorin (b) albiflorin |
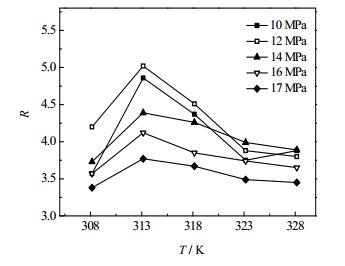
|
图 6 温度对分离度影响 Fig.6 Effects of temperature on R |
由图 5可看出,一定压力下,k1、k2均随着温度升高而增大。一方面,由于在温度的升高会造成SC-CO2密度减小,流动相的溶剂化能力降低,对芍药苷与芍药内酯苷的溶解能力减弱。另一方面,温度的升高会增强流动相的扩散能力,增大溶质在固定相表面和流动相中的扩散系数,降低传质阻力,有助于芍药苷和芍药内酯苷组分从固定相表面脱附进入流动相中。在该压力条件下,流动相对两组分的溶解能力的影响程度大于对其扩散性的影响程度,因而随着温度的升高,芍药苷和芍药内苷组分溶解分配在流动相中的量减小,流动相对两组分的洗脱能力降低,使得k1、k2增大。
从图 6可以看出,在不同的压力下,R随温度的升高呈先增大后减小的趋势。由于温度的升高一方面会改善传质,使峰宽向着减小的方向发展;另一方面温度升高将增强轴向弥散效果,从而使峰宽向着增大的方向发展。这两种结果的共同作用,导致了R随温度的增高出现一个极大值。选择最大分离度对应的温度313.15 K作为分离芍药苷与芍药内酯苷活性组分的最佳柱温。
3.5 产品制备采用Prep-SFC制备芍药苷与芍药内酯苷活性组分,需在满足产品纯度要求下,尽可能提高产品产量,因此对上载量进行探究。具体的实验条件为:夹带剂含量13.64%(wt),CO2流量20 g·min-1,柱温313.15 K,柱压12 MPa,进样量20~ 80 μL,紫外检测器波长230 nm。在该工艺条件下,色谱图如图 7所示。
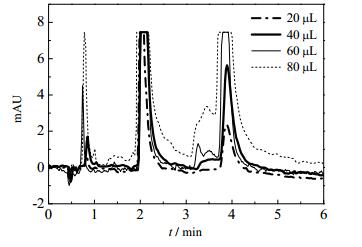
|
图 7 不同进样量下赤芍样品SFC分离图 Fig.7 SFC spectra of samples with different sample volumes |
由图 7可以看出,随着进样量的增加,芍药苷和芍药内酯苷的色谱峰的峰强逐渐增大,当进样量增大到60 μL时,芍药内酯苷特征洗脱峰前有其他物质的洗脱峰出现,继续增加进样量至80 μL时,芍药内酯苷特征峰和杂质峰出现重合现象,不能完全分离。对于Prep-SFC,在保证生产能力的同时亦要求兼顾产品的纯度。为使目标组分与杂质组分能够达到较好的分离效果,又尽可能地提高产品产量,故确定适宜的进样量为60 μL。
在上述实验条件下连续进样100次,在洗脱时间1.98~2.35 min与3.81 ~ 4.16 min分别收集芍药苷与芍药内酯苷产品,得到26.98 mg芍药苷和5.12 mg芍药内酯苷,纯度分别为94.11%(wt)及85.65%(wt),收率分别为95.6%和88.3%。
3.6 SFC保留值规律超临界流体中溶质的保留性质是研究制备色谱分离过程的基础。平均晶格场模型考虑了物质的膨胀和压缩性,能成功的描述溶质在纯流体、流体混合物、聚合物溶液、超临界流体中的保留性质[19]。本研究在柱温308.15~328.15 K,柱压10~17 MPa,采用该模型将芍药苷与芍药内酯苷容量因子与温度和密度进行关联,拟合得到平均晶格场模型的模型参数,具体方程如下:
| $ \ln {{k}_{1}}=18.97-\frac{5375.30}{T}-20.61\rho +6727.7(\frac{\rho }{T})-906.8(\frac{{{\rho }^{2}}}{T}) $ | (3) |
| $ \ln {{k}_{2}}=17.10-\frac{4550.90}{T}-17.53\rho +5911.20(\frac{\rho }{T})-1002.70(\frac{{{\rho }^{2}}}{T}) $ | (4) |
式中,k1、k2分别为芍药苷和芍药内酯苷的容量因子,无因次;ρ为SC-CO2的密度,g·cm-3;T为温度,K。
采用该方程得到的k1、k2的理论计算值与实验值的平均相对偏差分别为1.20%、0.72%;最大偏差分别为3.12%、1.45%;最小偏差分别为0.12%、0.05%,拟合结果较好。
4 结论(1) 采用超临界流体色谱技术制备赤芍活性组分芍药苷和芍药内酯苷的适宜工艺条件为:色谱柱Zorbax SB-CN (9.4 mm×250 mm,5 μm),CO2流量20.00 g·min-1,夹带剂乙醇含量13.64%(wt),柱温313.15 K,柱压12 MPa。
(2) 在适宜的工艺条件下,以含47.04%(wt)芍药苷与9.68%(wt)芍药内酯苷的赤芍粗提物为原料,制备得到纯度为94.11%(wt)的芍药苷产品及纯度为85.65%(wt)的芍药内酯苷产品,收率分别为95.6%和88.3%。提供了一种步骤简单、绿色高效的制备方法,为将来应用SMB-SFC大规模分离制备提供基础数据和技术支持。
(3) 对SFC提纯制备芍药苷和芍药内酯苷过程的保留值规律进行了探究,通过将容量因子与密度和温度进行关联,建立了超临界流体色谱容量因子平均晶格场模型,芍药苷和芍药内酯苷组分容量因子的拟合平均相对偏差分别为1.20%和0.72%,拟合结果良好。
符号说明:
|
|
| [1] | Zhou J, Wang J, Li W, et al. Paeoniflorin attenuates the neuroinflammatory response in a rat model of chronic constriction injury[J]. Molecular Medicine Reports , 2017, 15(5): 3179-3185. DOI:10.3892/mmr.2017.6371. |
| [2] | Wei Y, La L, Wang L, et al. Paeoniflorin and liquiritin, two major constituents in Chinese herbal formulas used to treat hyperprolactinemia-associated disorders, inhibits prolactin secretion in prolactinoma cells by different mechanisms[J]. Journal of Ethnopharmacology , 2017, 204(10): 36-44. |
| [3] | SUN Rong(孙蓉), LÜ Li-li(吕丽莉), GUO Shou-dong(郭守东), et al. Effect of paeoniflorin on focal cerebral ischemia model and blood-brain barrier(芍药苷对局灶性脑缺血模型及血脑屏障的影响)[J]. Journal of Harbin University of Commerce (Natural Sciences Edition)((哈尔滨商业大学学报(自然科学版))) , 2005, 21(4): 405-410. |
| [4] | Li W, Qi Z, Wei Z, et al. Paeoniflorin inhibits proliferation and induces apoptosis of human glioma cells via microRNA-16 upregulation and matrix metalloproteinase-9 downregulation[J]. Molecular Medicine Reports , 2015, 12(2): 2735-2740. DOI:10.3892/mmr.2015.3718. |
| [5] | Wang Y L, Wang J X, Hu X X, et al. Antidepressant-like effects of albiflorin extracted from Radix paeoniae Alba[J]. Journal of Ethnopharmacology , 2016, 179(9): 9-15. |
| [6] | GUO Xian-shuai(郭先帅), LIU Dong-yun(刘冬云), ZHU Wan-ting(朱婉婷), et al. Purification technology of extracts from prunuspersica and paeonialactiflora in compound guizhifuling by AB-8 macroporous absorption resin(AB-8型大孔吸附树脂纯化复方桂枝茯苓丸中桃仁、赤芍提取物工艺)[J]. Journal of Guangdong Pharmaceutical University(广东药学院学报) , 2015, 31(2): 167-170. |
| [7] | LI Qian (李芊). Extraction and separation of paeoniflorin & albiflorin from radix paeoniaerubra (从白芍中提取及分离芍药苷和芍药内酯苷) [D]. Anshan (鞍山): University of Science and Technology Liaoning (辽宁科技大学), 2012. |
| [8] | Li W, Wang J, Zhang J. Extracting albiflorin/paeoniflorin, involves adding alumina to paeony extract, eluting, collecting liquid, purifying liquid in active carbon column, eluting in silica gel column, collecting, filtering solution, and drying filtrate: US, 102304159[P]. 2006-02-01. |
| [9] | Wang R, Peng X, Wang L, et al. Preparative purification of peoniflorin and albiflorin from peony rhizome using macroporous resin and medium-pressure liquid chromatography[J]. Journal of Separation Science , 2012, 35(15): 1985-1992. DOI:10.1002/jssc.v35.15. |
| [10] | Nie L, Dai Z, Ma S. Improved chiral separation of (R, S)-goitrin by SFC: an application in traditional chinese medicine[J]. Journal of Analytical Methods in Chemistry , 2016, 2016(1): 1-5. |
| [11] | Yang H, Ying F, Tang G, et al. Development and validation of a fast SFC method for the analysis of flavonoids in plant extracts[J]. Journal of Pharmaceutical & Biomedical Analysis , 2017, 140(10): 384-391. |
| [12] | DU Jin-bao(杜金宝), DENG Li-kang(邓立康), YAN Li(闫莉), et al. Research progress on supercritical(超临界色谱技术制备功能性产品研究进展)[J]. Cereal & Food Industry(粮食与食品工业) , 2013, 20(4): 26-30. |
| [13] | Miller L. Pharmaceutical purifications using preparative supercritical fluid chromatography[J]. Chimica Oggi-Chemistry Today , 2014, 32(2): 23-26. |
| [14] | LI Jia-xu (李嘉旭). The preparative separation of two kind of drugs by simulated moving bed chromatography (模拟移动床色谱分离福莫特罗对映体过程研究) [D]. Shanghai (上海): East China University of Science and Technology (华东理工大学), 2016. |
| [15] | LÜ Hui-sheng(吕惠生), WANG Zhi(王智), GENG Zhong-feng(耿中峰), et al. Measurements and prediction of infinite diffusion coefficients for paeoniflorin and albiflorin in supercritical carbon dioxide(芍药苷及芍药内酯苷在超临界CO2中无限稀释扩散系数的测定与计算)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2018, 32(1): 16-23. |
| [16] | HE Yan(何岩), ZHANG Min-hua(张敏华), DONG Xiu-qin(董秀芹). Molecular dynamics simulation for calculating the diffusion coefficients of acetone, ethyl acetate and cyclohexane at infinite dilution solution of supercritical CO2(常用夹带剂在超临界CO2中无限稀释扩散系数的MD计算)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2008, 22(1): 152-156. |
| [17] | PANG Fei(庞斐), LÜ Hui-sheng(吕惠生), LIU Yan(刘岩), et al. The study on purification of artemisinin by supercritical fluid chromatography(超临界流体色谱纯化Z-藁本内酯的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2010, 24(4): 569-573. |
| [18] | MO Xu-fei(莫绪飞), LÜ Hui-sheng(吕惠生), ZHANG Min-hua(张敏华), et al. The study on purification of Z-ligustilide by supercritical fluid chromatography(超临界流体色谱纯化青蒿素的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2013, 27(5): 737-742. |
| [19] | Bolten D, Johannsen M. Influence of 2-propanol on adsorption equilibria of α-and δ-tocopherol from supercritical carbon dioxide on silica gel[J]. Journal of Chemical & Engineering Data , 2006, 51(6): 2132-2137. |




