近年来,随着石化燃料枯竭和环境问题的不断升级,燃料乙醇作为替代汽油的清洁能源越来越受到人们的关注[1, 2]。由于受粮食和石化资源的限制,开发以煤为原料制乙醇技术成为了目前的研究热点。其中,由煤化工后续产物羧酸催化加氢制乙醇的路线引起人们的广泛研究[3~6]。由于乙酸对设备的腐蚀性,所以乙酸先通过酯化生成乙酸乙酯,然后将乙酸乙酯加氢制取乙醇的工艺路线得到了众多的关注[7~9]。
羧酸酯类的催化体系已见诸多报道,包括有贵金属、过渡金属氧化物以及铜基催化剂,其中Cr催化剂显示了较好的催化性能[9~11]。但由于经济成本以及环境污染问题,这些贵金属尤其是Cr等的工业应用受到了限制[12, 13]。近年来,铜基催化剂在羧酸酯加氢反应体系中的应用被广泛研究。Brand等[14]系统研究了Cu/SiO2催化剂在乙酸甲酯加氢反应中的应用,发现Y和Mg能够较好地抑制烷烃的生成,但转化率最高只能达到70%。Kaili等[15]研究了乙酸乙酯在Cu/Zn催化剂上的加氢反应,转化率达到了95%,而且不同沉淀剂对催化性能影响较大。
本文采用硅酸钠共沉淀法制备非贵金属含量为26%的CuX/Mg-SiO2催化剂,并探究不同Mg含量的催化剂对乙酸乙酯催化性能的影响。通过XRD、TEM、H2-TPR、ICP-AES、XPS等表征手段对催化剂进行表征,进一步分析26% CuX/Mg-SiO2催化剂的乙酸乙酯加氢反应机理。
2 实验部分 2.1 实验原料Mg(NO3)2·6H2O (AR,≥ 98.5%)、Cu(NO3)2·3H2O (AR,99.0%~102.0%)、Na2SiO3· 9H2O (AR,Na2O含量19.3%~22.8%)、乙酸乙酯(AR,≥ 99.5%)均购自国药集团化学试剂有限公司,原料购买后直接使用。
2.2 催化剂制备催化剂制备方法为:将Na2SiO3·9H2O溶解于去离子水中,置于圆底烧瓶中搅拌均匀。用去离子水溶解Mg(NO3)2·6H2O和Cu(NO3)2·3H2O配制金属前驱体溶液,室温下搅拌1 h。将金属前驱体溶液逐滴缓慢滴加到硅酸钠溶液中,不断搅拌,并伴随沉淀物出现,整个沉淀过程pH由12~13逐渐降至7~8,沉淀完全,然后继续搅拌2 h。将此混合物过滤、洗涤6~8次。滤饼静置过夜,然后在393 K下干燥12 h。干燥后的混合物研磨成粉末后在一定温度下焙烧5 h。催化剂用26% CuX/Mg-SiO2表示,其中26%表示催化剂中Cu含量(X = 0时,26%表示Mg含量),X表示Cu和Mg的摩尔比。
催化剂置于固定床反应器中,在一定温度下于氢气流中原位还原。同时,温度从室温开始以10 K·min-1的升温速率升至指定温度,在氢气流(标准状态下50~60 mL·min-1)中还原3 h。
2.3 催化剂表征XRD通过Rigaku D/MAX-2550/PC型X射线衍射仪测定,采用CuKα射线(λ = 0.15406 nm)。XPS通过VG ESCALAB MARK Ⅱ型X光电子能谱仪测定,采用MgKα射线源,以C1S结合能284.6 eV为标准校正荷电子效应。TEM分析在JEM 2010透射电镜上进行,加速电压为200 kV。催化剂样品碾磨至300目以上,悬浮于无水乙醇后超声分散2 min,吸取悬浮液滴于铜网上,自然干燥后进行电镜分析。H2-TPR在Micromeritics AutoChem Ⅱ 2920上进行。经过250℃干燥2 h预处理后,将50 mg样品在30 mL·min-1的10% H2/Ar气流中由室温开始还原至600℃,加热速率为10℃·min-1。金属实际负载量由Thermo Jarrel-Ash ICAP 612E光谱仪,采用电感耦合离子体-原子发射光谱法测得。采用AUTOSORB-IQ2-MP的全自动比表面和微孔孔径分析仪对催化剂进行比表面积和孔径进行测定。称取0.11~0.12 g催化剂在300℃真空脱气处理4 h,来脱除催化剂表面吸附的杂质、水蒸气等。然后在液氮(77.4 K)温度下,进行N2低温吸附脱附。催化剂的比表面积根据吸附等温曲线由BET公式计算得到,孔容和孔径分布根据脱附曲线由BJH方程计算得到。
2.4 催化剂反应测试乙酸乙酯气相加氢反应催化剂的测评在不锈钢管式固定床反应器中进行。将约2.4 mL催化剂装填在反应管中间,在催化剂两侧装填石英砂。反应管两侧管路均是不锈钢管路,同时加热到443 K,以防止反应物和产物冷凝。乙酸乙酯通过高效液相色谱(HPLC)泵打入汽化混合器,与氢气混合进入反应器。反应器出口压力降为常压,用两台气相色谱检测产物的组成和含量。一台气相色谱(SP-6800A)配有氢焰离子检测器和GDX-103填充柱,用来检测甲烷、乙烷、乙烯、丙烷、丙烯、乙醛、乙醇、丙酮、异丙醇、乙醚和乙酸乙酯。另一台气相色谱(SP-6801)配有热导检测器和GDX-5022填充柱,用来检测CO、CO2、甲烷、乙烷、乙烯、丙烷、丙烯、水、乙醛、乙醇、丙酮、异丙醇、乙醚、乙酸乙酯和乙酸。
选择性(S)和转化率(X)根据碳原子数由以下方程式得到,其中ki和ri分别是产物i分子中所含碳原子数和产物i对乙醇的摩尔比:
| $ {S_i}(\% ) = \frac{{{k_i}{r_i}}}{{\sum {{k_i}{r_i}} }} \times 100\% $ | (1) |
| $ {X_i}(\% ) = \frac{{\sum {{k_i}{r_i}} }}{{\sum {{k_i}{r_i} + 4{r_{EA}}} }} \times 100\% $ | (2) |
分别在不同Mg含量的催化剂上进行乙酸乙酯加氢催化性能的测试,反应条件为280℃、2.0 MPa、乙酸乙酯液时空速1.0 h-1、氢气/乙酸乙酯摩尔比为30。如图 1所示,两单金属催化剂26% Cu/SiO2和26% Mg/SiO2对乙酸乙酯的催化性能相较于双金属催化剂26% Cu/Mg-SiO2较差,其乙酸乙酯的转化率较低,分别为71.57%和34.25%。同时,在两单金属催化剂上的产物分布中,C3(丙酮、异丙醇、丙烯、丙烷)和不凝性气体(CO2、CO、CH4、C2H4、C2H2)具有较大的比重,尤其在26% Mg/SiO2催化剂上,分别为22.81%和32.09%。而双金属催化剂26% Cu/Mg-SiO2具有较高的乙酸乙酯转化率和乙醇选择性,而副产物C3和不凝性气体得到了极大的抑制,显示了更优的催化性能。由图 1可以看出,双金属催化剂26% CuX/Mg-SiO2的乙酸乙酯的转化率和乙醇的选择性呈火山型分布。催化剂活性随着改性金属Mg含量的增加显示出了先升高后降低的趋势。由表 1可知,当Cu/Mg摩尔比达到3时,催化剂显示了最高的活性,乙酸乙酯转化率和乙醇的选择性分别达到了96.28%和94.23%。而乙醛的选择性受Cu/Mg比例的影响不大,维持在较低的水平。以上结果表明,双金属催化剂上Cu与Mg在乙酸乙酯加氢反应中活性不同,负载在SiO2上的Cu活性较高,但是对于目标产物乙醇的选择性较差;Cu与Mg两者存在一种相互协同作用,并且存在最佳摩尔比,当Cu/Mg摩尔比为3时,26% Cu/Mg-SiO2双金属催化剂具有更优的催化性能。
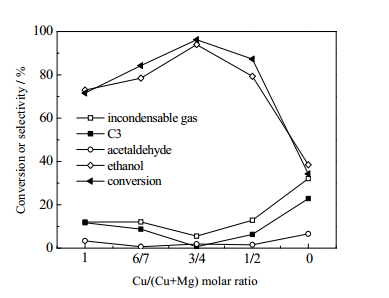
|
图 1 铜镁摩尔比对催化剂性能的影响 Fig.1 Effects of Cu/Mg molar ratios on catalytic performance of the 26% CuX/Mg-SiO2 catalyst |
| 表 1 CuX/Mg-SiO2(X = ∞, 6, 3, 1, 0)催化剂的产物分布和转化率 Table 1 Product distributions and conversion with 26% CuX/Mg-SiO2 catalysts (X = ∞, 6, 3, 1, 0) |
为了探究26% CuX/Mg-SiO2催化剂在乙酸乙酯加氢反应上具有不同催化性能的内在原因,本文对该系列催化剂进行了表征。图 2显示了还原后26% CuX/Mg-SiO2(X = ∞, 6, 3, 1)催化剂的XRD图谱。由图谱可知,经过350℃还原后,26% CuX/Mg-SiO2催化剂中(X = ∞, 6, 3, 1),检测到明显的Cu0特征峰,说明催化剂前驱体中CuO被H2还原为Cu0。同时,也检测到了少量的MgO相以及SiO2相。SiO2特征峰强度较小,说明载体SiO2在催化剂中处于无定性状态或者高度分散状态[8]。图中A、B、C、D图谱可以明显看出,在2θ = 43.3˚、50.4˚、74.1˚处都出现了明显的Cu0特征峰,而这三个不同的Cu0特征峰分别对应了Cu的三个不同的晶面:(1 1 1)、(2 0 0)、(2 2 0),同时由图谱可以看出,这三个不同晶面Cu0特征峰强度相差很大。利用2θ = 43.3˚处的Cu0特征峰,通过谢乐公式进行计算,得到铜晶体颗粒的粒径大小,见表 2。
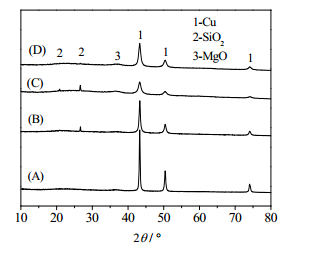
|
图 2 不同Mg含量催化剂还原后的XRD图谱 Fig.2 XRD patterns of the catalysts with different Mg contents:(A)26% Cu-SiO2 (B) 26% Cu6/Mg-SiO2 (C) 26% Cu3/Mg-SiO2 (D) 26% Cu1/Mg-SiO |
| 表 2 催化剂26% CuX/Mg-SiO2的物理性质 Table 2 Physical properties of 26% CuX/Mg-SiO2 |
如图 2显示,不含Mg的单金属26% Cu-SiO2催化剂,其还原后的Cu0特征峰明显要强于含有Mg的其他三种催化剂,根据谢乐公式计算结果显示,其Cu0晶体尺寸达到了25.2 nm,是四种催化剂中尺寸最大的,说明单金属26% Cu-SiO2催化剂活性组分分散性较差。由此表明金属Mg的加入,有效地提高了催化剂活性组分的分散性,而这可能是提高催化剂活性的重要原因。同时,在含有Mg的催化剂中,随着Mg含量的增加,Cu0特征峰先减弱后又增加,当Cu/Mg为3时,Cu0特征峰最弱,其Cu0晶粒尺寸减小到了8.9 nm。这说明适量Mg的加入能够有效地抑制Cu晶粒尺寸的长大,也有效地增加了Cu晶粒在催化剂上的分散性。根据Cu/Mg摩尔比对催化剂催化性能影响的研究结果,Mg金属的加入使催化剂催化性能得到了较大的提升,同时,随着Mg加入量的增加,乙酸乙酯转化率和选择性呈现先上升后下降的趋势,在Cu/Mg摩尔比为3时,达到最优,其变化与XRD表征的Cu晶粒尺寸变化趋势相一致。说明适量Mg金属助剂的加入很好地提高了Cu晶粒在催化剂上的分散度以及控制了晶粒尺寸,这有利于提高催化剂的催化活性。
图 3显示了不同催化剂还原后的透射电镜图。由图中可以看出,有明显的黑色颗粒和浅色颗粒,由EDX分析可知,黑色颗粒可以被认为是铜颗粒,浅色的为MgO或者SiO2颗粒[16]。

|
图 3 原后的催化剂TEM图 Fig.3 TEM images of the catalysts after reduction: (A) 26% Cu-SiO2 (B) 26% Cu6/Mg-SiO2 (C) 26% Cu3/Mg-SiO2 (D) 26% Cu1/Mg-SiO2 |
由图(A)可以看出,铜颗粒分布较为密集,颗粒大致为25~35 nm。这可以看出单金属26% Cu-SiO2催化剂上Cu颗粒分散性不好,颗粒较大,且团聚较为严重。而对于加入Mg的其余三种催化剂,从TEM图中看出,其分散性明显好于催化剂A。其中,图(C)、(D)中26% Cu3/Mg-SiO2、26% Cu1/Mg-SiO2催化剂铜颗粒分布较为均匀,颗粒大小在8~15 nm。这一结果与XRD分析结果也一致。值得注意的是,通过TEM图分析计算的Cu颗粒粒径要普遍大于XRD计算的结果,这可能是由于还原后的催化剂中Cu0为多晶相。
为了探究在还原过程中不同含量Mg对Cu颗粒形态的影响,分别作了焙烧后不同Mg含量催化剂的H2-TPR图。焙烧后的催化剂中铜以CuO形式存在。由图 4可知,单金属催化剂26% Cu-SiO2在303℃开始有一个较宽的还原峰,这是由于CuO在单金属催化剂中晶粒尺寸较大,团聚较为严重,还原后单金属催化剂26% Cu-SiO2表面Cu颗粒分散不均一[17~19]。其余含有Mg的催化剂,26% Cu6/Mg-SiO2、26% Cu3/Mg-SiO2、26% Cu1/Mg-SiO2都显示了相对较为尖锐的峰型,表明Mg的加入促进了CuO在催化剂载体上的分散性[20]。同时,该系列催化剂均为单一的还原峰,表明在催化剂还原过程中,大部分CuO被直接还原为Cu0,这也与XRD检测结果一致。同时没有检测出碱金属MgO的还原峰,因为在该温度下H2无法还原MgO。因此,在该系列催化剂中,助剂其实是MgO而非Mg[21, 22]。结合26% Mg-SiO2催化剂在乙酸乙酯反应上低效催化性能的情况,表明在26% CuX/Mg-SiO2双金属催化剂上MgO并不是活性位,金属铜才是反应活性位。
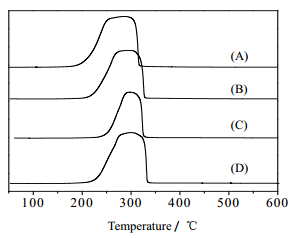
|
图 4 不同Mg含量焙烧后的催化剂H2-TPR图 Fig.4 H2-TPR profiles of the calcined catalysts with different Mg contents: (A) 26% Cu-SiO2 (B) 26% Cu6/Mg-SiO2 (C) 26% Cu3/Mg-SiO2 (D)26% Cu1/Mg-SiO2 |
催化剂还原温度受组分晶粒的颗粒大小、分散度以及各组分之间的相互作用力的影响[23]。组分晶粒小、分散度越高、相互作用力越小,还原温度越低。根据XRD和TEM检测结果显示,MgO的存在有效地增加了Cu在催化剂表面的分散性并减小了Cu晶体的颗粒。而由图 4可以看出,随着Mg含量的增加,催化剂还原温度呈现逐渐升高的趋势。这可以归咎于Cu和MgO以及载体之间的相互作用力增强。当Cu/Mg摩尔比减小时,即MgO含量的增加,MgO与CuO结合比SiO2与CuO结合更紧密,而且MgO的电子亲和性比SiO2更好,导致CuO更难获得电子,因而不易被还原,于是导致还原温度升高。同样,26% Cu-SiO2还原温度低是由于Cu物种与载体SiO2相互作用力较弱。同时,更多Mg负载的26% Cu1/Mg-SiO2催化剂相较于26% Cu6/Mg-SiO2、26% Cu3/Mg-SiO2催化剂还原温度更高,应该归因于有过多的MgO成分包裹在CuO表面,使CuO接触还原气体氢气面积更少,不利于还原。由XRD分析可知,26% Cu1/Mg-SiO2催化剂表面的CuO颗粒更大,分散性较差,这也是导致其还原温度过高的原因[22]。
为了探索催化剂表面铜颗粒在反应中的化学态以及助剂金属Mg对催化剂的影响,本文对还原后的26% Cu-SiO2、26% Cu3/Mg-SiO2催化剂进行了XPS检测,其图谱以及结果如表 3和图 5所示[24, 25]。由图 5可以看出,Cu2p由两部分组成,分别为2p3/2和2p1/2,一般采用2p3/2对Cu化学态进行分析[26]。Cu 2p3/2结合能BE在932.6~932.7 eV。同时在940.2~945.1 eV发现了有Cu2+特征2p→3d卫星峰,表明了还原后催化剂上有Cu2+存在,这可能是由于催化剂在还原后处理时部分氧化造成的[27]。而图中932.6~932.7 eV处的特征峰则表明有Cu0或者Cu+存在,结合文献报道[8, 19, 27],本文认为Cu0/Cu+是该反应的活性组分。在反应过程中,活性成分Cu0/Cu+可能主要为反应物提供活性位并活化氢气的作用[27]。
| 表 3 XPS图谱结果 Table 3 Summary of the XPS spectra results |
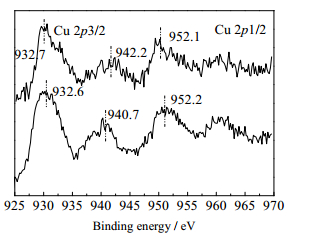
|
图 5 Cu 2p轨道XPS图谱 Fig.5 XPS spectra of Cu 2p:(A) 26%Cu-SiO2 after reduction; (B) 26%Cu3/Mg-SiO2 after reduction |
通过上述分析,研究发现双金属催化剂中Mg的加入有效地增加了还原后催化剂上Cu晶粒的分散性以及减小了Cu晶粒的尺寸。同时在双金属催化剂中,MgO不能被H2还原,MgO的存在促进了CuO的还原,MgO与CuO之间的相互作用力显著强于CuO与SiO2之间的作用力,这一协同作用与反应机理有关。XRD和XPS图谱结果表明,催化剂上主要的活性成分为Cu0/Cu+,而MgO在反应过程中并不具备反应活性,可能主要扮演着协同Cu0/Cu+进行反应的角色。催化剂中活性组分Cu0/Cu+的晶粒尺寸大小以及其在载体上的分散性对乙酸乙酯加氢反应有重要的影响。Brand等[27]研究了Cu/ZnO/SiO2催化剂上的酯氢解反应,发现了反应过程中Cu0为主要活性组分,ZnO并没有催化活性,作为助剂能吸附反应物酯中的C=O键,以减少活性组分Cu0表面上吸附的反应物,促进了反应的进行,并利于Cu0吸附并活化氢气。Mason等[8]研究Rh-GeO2/SiO2催化剂上乙酸乙酯加氢反应中发现,催化剂上的主要活性位是Rh,其作用主要是吸附氢气并将其活化为氢原子,同时,GeO吸附反应物乙酸乙酯并将其氢解为乙酰基和乙氧基,最后加氢生成两分子乙醇。He等[19]研究报道了B-Cu-SiO2催化剂上草酸二甲酯反应,发现导致催化剂具有高活性的主要原因是还原后催化剂上非Cu2+的存在,包括Cu0和Cu+。而助剂B的加入,促进了CuO的还原。
综上所述,在26% Cu/Mg-SiO2双金属催化剂上,催化剂上的主要活性组分为Cu0/Cu+,其作用主要是吸附氢气并将氢气活化为氢原子,并将反应物乙酸乙酯分解为活化的乙酰基和乙氧基。而MgO作为助剂,并非是活性位,其主要作用是催化剂形成过程中利于获得更小的Cu颗粒,并在反应过程中吸附乙酸乙酯反应物,避免活性位Cu0/Cu+上吸附过多的反应物而促进反应高效的进行。
4 总结通过硅酸钠共沉淀法制备了一系列不同Mg含量的26% CuX/Mg-SiO2催化剂,并在乙酸乙酯加氢制乙醇反应上进行测试。结果显示,26% Cu3/Mg-SiO2催化剂显示了最优的催化性能,在280℃、2 MPa的反应条件下,乙酸乙酯转化率和乙醇选择性分别可达到96.25%和94.27%。通过一系列表征,结果显示Mg的加入增加了26% Cu-SiO2催化剂上Cu颗粒的分散性,并获得尺寸更小的Cu颗粒。同时,在催化反应中,Cu0/Cu+作为活性位,活化氢气并将反应物氢解,而MgO作为助剂吸附反应物,避免活性位Cu0/Cu+上吸附过多反应物,从而促进反应的进行。
| [1] | Franco A, Giannini N. Perspectives for the use of biomass as fuel in combined cycle power plants[J]. International Journal of Thermal Sciences , 2005, 44(2): 163-177. DOI:10.1016/j.ijthermalsci.2004.07.005. |
| [2] | Naik S N, Goud V V, Rout P K, et al. Production of first and second generation biofuels:a comprehensive review[J]. Renewable and Sustainable Energy Reviews , 2010, 14(2): 578-597. DOI:10.1016/j.rser.2009.10.003. |
| [3] | HU Ying-tao(胡英韬), DOU Mei(窦梅), NAN Sui-fei(南碎飞). Effects of supporter on Pt-Sn catalytic performance in selective hydrogenation of acetic acid to ethanol(载体对Pt-Sn催化乙酸加氢制乙醇性能的影响)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28(6): 1281-1285. |
| [4] | CHEN Lei(陈磊), DOU Mei(窦梅), DOU Li-jun(窦立军), et al. Gas phase hydrogenation of acetic acid catalyzed by Cu/SiO2, Fe/SiO2 and Cu-Fe/SiO2(Cu/SiO2, Fe/SiO2和Cu-Fe/SiO2催化乙酸气相加氢反应的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2016, 30(1): 91-96. |
| [5] | Zhang S, Duan X, Ye L, et al. Production of ethanol by gas phase hydrogenation of acetic acid over carbon nanotube-supported Pt-Sn nanoparticles[J]. Catalysis Today , 2013, 215(1): 260-266. |
| [6] | Zhang K, Zhang H, Ma H, et al. Effect of Sn addition in gas phase hydrogenation of acetic acid on alumina supported Pt-Sn catalysts[J]. Catalysis Letters , 2014, 144(4): 691-701. DOI:10.1007/s10562-014-1210-z. |
| [7] | Pouilloux Y, Autin F, Guimon C, et al. Hydrogenation of fatty esters over ruthenium-tin catalysts; characterization and identification of active centers[J]. Journal of Catalysis , 1998, 176(1): 215-224. DOI:10.1006/jcat.1998.2044. |
| [8] | Luo M, Das T K, Delibas C, et al. Heterogeneous catalytic hydrogenation of ethyl acetate to produce ethanol[J]. Topics in Catalysis , 2014, 57(6-9): 757-761. DOI:10.1007/s11244-013-0232-x. |
| [9] | Wang Z, Liu Q, Yu J. Surface structure and catalytic behavior of silica-supported copper catalysts prepared by impregnation and sol-gel methods[J]. Applied Catalysis A General , 2003, 239(1-2): 87-94. DOI:10.1016/S0926-860X(02)00421-0. |
| [10] | Yuan P, Liu Z, Zhang W. Cu-Zn/Al2O3 catalyst for the hydrogenation of eaters to alcohols[J]. Chinese Journal of Catalysis , 2010, 31(7): 769-775. DOI:10.1016/S1872-2067(09)60087-5. |
| [11] | Ryashentseva M A, Avaev V I. Hydrogenation of ethyl acetate over supported rhenium catalysts[J]. Russian Chemical Bulletin , 1999, 48(5): 998-1000. DOI:10.1007/BF02494654. |
| [12] | Ross D, Riekea D. Fatty methyl ester hydrogenation to fatty alcohol part Ⅱ:process issues[J]. Journal of the American Oil Chemists Society , 1997, 74(4): 341-345. DOI:10.1007/s11746-997-0089-x. |
| [13] | Ross D, Riekea D. Fatty methyl ester hydrogenation to fatty alcohol part Ⅰ:process issues[J]. Journal of the American Oil Chemists Society , 1997, 74(4): 333-339. DOI:10.1007/s11746-997-0088-y. |
| [14] | Brands D S, Poels E, Bliek A. Ester hydrogenolysis over promoted Cu/SiO2 catalysts[J]. Applied Catalysis A-General , 1999, 184(2): 279-289. DOI:10.1016/S0926-860X(99)00106-4. |
| [15] | Wang J J, Petr A C, Wang Y, et al. Influence of the support and promotion on the structure and catalytic perfoermance of copper-cobalt catalysts for carbon monoxide hydrogenation[J]. Fuel , 2013, 103(1): 1111-1122. |
| [16] | Nagaraja B M, Kumar V S, Shasikala V, et al. A highly efficient Cu/MgO catalyst for vapour phase hydrogenation of furfural to furfuryl alcohol[J]. Catalysis Communications , 2003, 4(6): 287-293. DOI:10.1016/S1566-7367(03)00060-8. |
| [17] | Zhao S, Yue H, Zhao Y, et al. Chemoselective synthesis of ethanol via hydrogenation of dimethyl oxalate on Cu/SiO2:enhanced stability with boron dopant[J]. Journal of Catalysis , 2013, 297(1): 142-150. |
| [18] | Asthana S, Bhaumil C. Direct synthesis of dimethyl ether from syngas over Cu-based catalysts enhanced selectivity in the presence of MgO[J]. Journal of Catalysis , 2016, 334(1): 89-101. |
| [19] | He Z, Lin H, He P. Effect of boric doping on the stability and activity of a Cu-SiO2 catalyst for vapor-phase hydrogenation of dimethyl oxalate to ethylene glycol[J]. Journal of Catalysis , 2011, 277(1): 54-63. DOI:10.1016/j.jcat.2010.10.010. |
| [20] | Zhenle Y, Lina W, Junhua W, et al. Hydrogenolysis of glycerol over homogenously dispersed copper on solid base catalysts[J]. Applied Catalysis B:Environmental , 2011, 101(3-4): 431-440. DOI:10.1016/j.apcatb.2010.10.013. |
| [21] | Chang C, Liaw B, Huang C. Preparation of Au/MgxAlO hydrotalcite catalysts for CO oxidation[J]. Applied Catalysis A-General , 2007, 332(2): 216-224. DOI:10.1016/j.apcata.2007.08.021. |
| [22] | Espinós J P, Morales J, Barranco A, et al. Interface effects for Cu, CuO, and Cu2O deposited on SiO2 and ZrO2. XPS determination of the valence state of copper in Cu/SiO2 and Cu/ZrO2catalysts[J]. The Journal of Physical Chemistry B , 2002, 106(27): 6921-6229. DOI:10.1021/jp014618m. |
| [23] | Emanalzahrani A R. Synthesis of copper nanoparticles with various sizes and shapes:application as a superior non-enzymatic sensor and antibacterial agent[J]. International Journal of Electrochemical Science , 2016, 11(6): 4712-4723. |
| [24] | Agrell J H. Production of hydrogen from methanol over Cu-ZnO catalysts promoted by ZrO2 and Al2O3[J]. Journal of Catalysis , 2003, 219(2): 389-403. DOI:10.1016/S0021-9517(03)00221-5. |
| [25] | Anna M S F. XPS characterization of (copper-based) coloured stains formed on limestone surfaces of outdoor Roman monuments[J]. Chemical Central Journal , 2012, 6(2): 1-13. |
| [26] | Moretti G. Auger parameter and wagner plot in the characterization of chemical states by X-ray photoelectron spectroscopy:a review[J]. Journal of Electron Spectroscopy and Related Phenomena , 1998, 95(2-3): 95-144. DOI:10.1016/S0368-2048(98)00249-7. |
| [27] | Poels E K, Brands D S. Modification of Cu/ZnO/SiO2 catalysts by high temperature reduction[J]. Applied Catalysis A General , 2000, 191(1-2): 83-96. DOI:10.1016/S0926-860X(99)00307-5. |




