有机胺具有优秀的脱硫性能,国内外大量学者对于其合成、化学结构、脱硫性能和脱硫机理等[1~3]进行了研究。20世纪80年代末,加拿大联合碳化公司研究开发的Cansolv法[4]脱硫技术是目前世界上工业化运营最为成熟的有机胺脱硫技术。Sung Yun Hong等[5]合成了三种不同类型的腈胺,和几种羟基胺做了脱硫性能的比较,通过计算说明羟基胺与SO2的反应是-OH和SO2形成了共价键-OSO2-,而腈胺和SO2是物理反应。汤志刚等[6]将乙二胺/磷酸水溶液体系作为脱硫性能的研究对象,体系中磷酸降低了乙二胺的饱和蒸汽压减少了其挥发损失并可调节体系的pH值。邓人攀等[7]人研究了六种水溶性氨基酸脱除SO2的实验,最终得出β-丙氨酸具有优秀的脱硫性能,通过13C-NMR等技术研究得出β-丙氨酸吸收SO2的反应不是形成了共价键而是某种弱的相互作用如色散力和氢键等。孙人杰等[8]设计合成了1, 4-二(2-羟丙基)哌嗪(HPP),崔鹏等研究了其硫酸盐水溶液的密度,黏度和水溶液的表面张力[9],并测定了SO2在其硫酸盐水溶液中的气液平衡数据[10],作为烟气脱硫剂,其半盐溶液具有低挥发性、高脱硫率、易再生等特点。
作为一种二元有机胺脱硫剂,HPP具有对称结构,虽然具有良好的脱硫性能,但其高熔点导致合成过程中须有溶剂的参与,溶剂的存在影响了产品的纯度,而且使产品的分离过程复杂并会造成产品和溶剂的损失。据此,本文拟设计合成一种非对称结构的二元有机胺1-(2-羟乙基)-4-(2-羟丙基)哌嗪(HEHPP),期望其具有低熔点、无溶剂、低挥发等特性,可作为新型有机胺脱硫剂使用。
2 实验部分 2.1 原料与试剂1-(2-羟乙基)哌嗪(HEP):含量≥99%,湖北鑫源顺医药化工有限公司;
环氧丙烷(PO):分析纯,含量≥99.5%,国药集团化学试剂有限公司;
正丙醇(PA):色谱纯,含量≥99.8%,天津市科密欧化学试剂有限公司。
2.2 HEHPP合成工艺将0.4 mol HEP加入100 mL四口烧瓶中,烧瓶上方接蛇形冷凝管保持水冷凝,左侧口接一温度计,右侧口接一恒压滴液漏斗,前口塞一可取样的顶空橡胶塞,整个装置保持密封,烧瓶置于恒温磁力搅拌水浴锅中。将HEP预热后,向HEP液面下慢慢滴加入PO,通过改变水浴温度和调节PO滴加速率保持温度恒定,滴加完成后继续反应一段时间。反应终止后,进行冷却降温,得到反应产物,待测。
2.3 GC-MS检测目标产物HEHPP的分子式为C9H20O2N2,分子量为188.27。
将产物用PA溶解为质量浓度3%左右的溶液,经过GC-MS检测,得出GC图和MS图,对GC图全谱自动积分,采用面积归一法处理数据,得到HEHPP、HEP、PO和副产物在图中的面积占比作为各物质的含量。
GC-MS型号:Trace GC/ISQ MS,Finnigan公司。
GC条件色谱柱:TRACE TR-5 MS (30 m×0.25 mm×0.25 μm);载气:He气(纯度99.999%);柱流量:1 mL·min-1;分流比:50:1;进样量:0.5 μL;进样口温度:250℃;柱箱温度:起始温度40℃,停留3 min,以15℃·min-1升温至260℃,停留5 min。
MS条件离子源:EI源;离子源温度:230℃;电子能量:70 ev;扫描方式:SCAN;扫描范围:33~550 amu;色谱-质谱连接口温度:280℃。
2.4 NMR和DSC表征将产物用DMSO-d6(TMS为内标物)溶解于核磁管中,对产物进行1H-NMR和13C-NMR表征。NMR仪器型号:VNMRS600,Agilent公司。
对产物进行DSC表征;DSC仪器型号:Q2000,TA公司;气氛:N2;温度程序:起始温度20℃,停留2 min,以10℃·min-1降温至-80℃,停留2 min,再以10℃·min-1升温至300℃,停留2 min。
3 结果与讨论 3.1 HEHPP的合成原理、反应热力学参数估算及副反应推测环氧化合物在碱作用下易发生亲核取代反应,不对称的环氧化合物在碱性条件下进行亲核取代时易按双分子亲核取代反应(SN2)机理,优先在取代基少的C原子上进行取代[11]。据此,设计以HEP和PO为原料合成HEHPP,胺呈碱性,PO在碱性条件下优先在无取代基的C原子形成的C-O键上断裂开,同时取代HEP中N原子上的H原子,形成N-C键,合成HEHPP。反应方程式为:
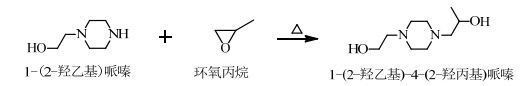
|
(1) |
在298.15 K、101.325 kPa下HEP、HEHPP均为液态。通过Benson法[12]、CSGC-HW法[13]、Joback法[14、15]和Rozicka-Domalski法[16]等基团贡献法计算反应(1)的热力学参数列于表 1中。
| 表 1 反应(1)的热力学参数估算 Table 1 Estimation of thermodynamic parameters for reaction(1) |
式(1)的焓变ΔrHθ<0说明反应为放热反应,反应中需要控制PO的滴加速率,以防大量放热导致实验安全问题。根据熵增原理,反应熵变ΔrSθ<0说明环境熵值增加超过了反应体系熵值的减小。反应吉布斯自由能变ΔrGθ<0,并且反应的平衡常数Kθ很大,说明该反应在298.15 K、101.325 kPa下会自发进行,合成过程中对其加热能提高反应速率。
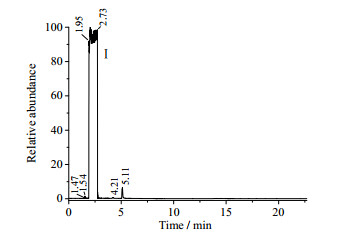
反应过程中会有副反应发生,副反应可能是原料HEP中残有的杂质哌嗪引起的,也可能是HEP和过量PO反应引起的。下面为溶剂PA和原料HEP的PA溶液GC图。
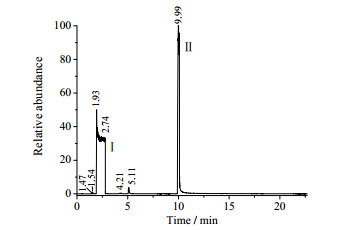
图 1是溶剂PA的GC图,可以看到溶剂中除了PA峰Ⅰ之外,还有保留时间RT为1.47、1.54、4.21、5.11的杂质峰,杂质总含量为2.18%。图 2是HEP的PA溶液GC图。
|
图 1 PA的GC图 Fig.1 GC spectrum of PA |
|
图 2 HEP-PA的GC图 Fig.2 GC spectrum of HEP-PA |
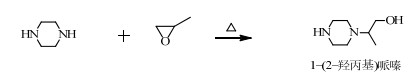
由于原料纯度的影响,HEP原料中可能残留有哌嗪,可能和PO发生副反应(2),生成副产物1-(2-羟丙基)哌嗪。
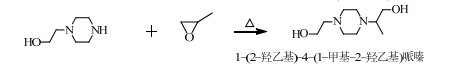
在碱性环境中,PO和HEP主要按SN2机理进行反应,但也可能存在着少量按单分子亲核取代(SN1)机理[11]的反应,促使PO在取代基多的C原子上开环与HEP反应生成1-(2-羟乙基)-4-(1-甲基-2-羟乙基)哌嗪,发生副反应(3)。
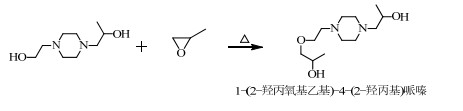
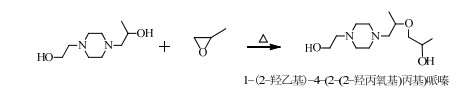
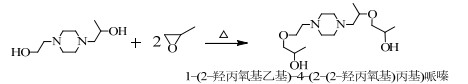
当PO过量时,根据SN2机理,PO还可能和HEHPP继续反应,取代-OH中的H,发生副反应(4)、(5)、(6)。
|
(2) |
|
(3) |
|
(4) |
|
(5) |
|
(6) |
合成产物中除了目标产物HEHPP外,还可能含有未反应的原料HEP、PO和副产物1-(2-羟丙基)哌嗪、1-(2-羟乙基)-4-(1-甲基-2-羟乙基)哌嗪、1-(2-羟丙氧基乙基)-4-(2-羟丙基)哌嗪、1-(2-羟乙基)-4-(2-(2-羟丙氧基)丙基)哌嗪和1-(2-羟丙氧基乙基)-4-(2-(2-羟丙氧基)丙基)哌嗪等。需要对反应参数进行优化,以提高原料转化率和目标产物HEHPP的纯度。
3.2 反应参数的优化 3.2.1 反应时间的优化固定原料HEP与PO的摩尔比n(HEP):n(PO)=1:1、反应温度70℃,滴加完PO后继续反应,定时取样,对产物进行GC-MS分析,得到GC图如图 3所示。
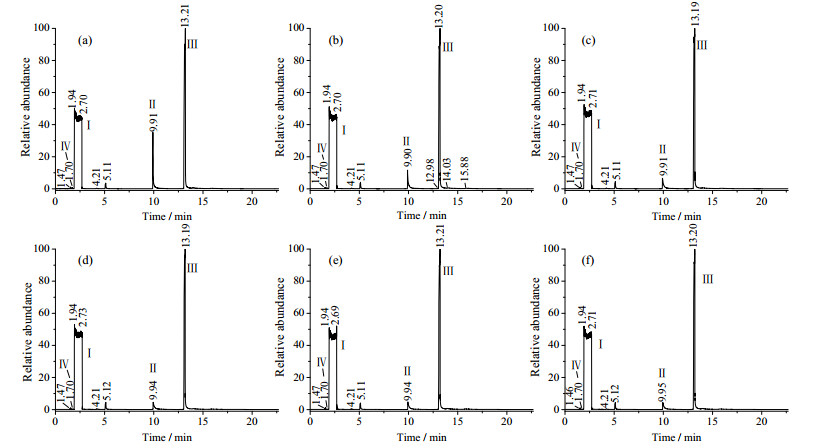
|
图 3 不同反应时间的GC图 Fig.3 GC spectra of products at different reaction times (a) 30 min (b) 60 min (c) 120 min (d) 180 min (e) 240 min (f) 300 min |
图 3中Ⅱ为HEP峰,Ⅲ为HEHPP峰,Ⅳ为PO峰。
从图 3中可以看到,反应时间从30 min增加到180 min时,峰Ⅲ从90.76%逐渐增大到96.79%,峰Ⅱ从8.74%逐渐减小到2.76%,峰Ⅳ从0.11%逐渐减小到0.07%,副产物含量变化不大,说明180 min之前HEP和PO在反应生成HEHPP。180 min以后峰Ⅲ从96.79%稍减小为96.56%,副产物含量从0.38%增大到0.54%,说明180 min之后,主反应基本完成,副反应增多,HEHPP含量减小。可取180 min为优化的反应时间。
3.2.2 反应原料配比的优化固定反应温度70℃、反应时间180 min,改变原料配比,对不同产物进行GC-MS表征,含量如表 2所示:
| 表 2 原料不同配比产物中HEHPP、HEP、PO和副产物的含量 Table 2 Contents of HEHPP, HEP, PO and byproducts in the products with different ratio of raw materials |
从表 2可以看到,随着PO量的增大,HEHPP的含量先增加后微微减少,在1:1时含量最高为98.28%;当PO摩尔量小于HEP时,PO量的增加提高了HEP的转化率和HEHPP的收率。当PO摩尔量大于HEP时,过量PO参与了副反应,导致副产物含量增加,HEHPP含量降低,但均保持在97.47%以上。原料摩尔比为1:1时HEHPP含量最高,为优化的原料配比。
3.2.3 反应温度的优化固定原料配比n(HEP):n(PO)=1:1、反应时间180 min,改变反应温度,对不同产物进行GC-MS表征,含量如表 3所示。
| 表 3 不同温度产物中HEHPP、HEP、PO和副产物含量 Table 3 Contents of HEHPP, HEP, PO and byproducts in product with different temperatures |
由表 3可知,HEHPP含量无明显变化。随着反应温度升高,HEP和PO的含量逐渐降低,说明提高反应温度可以增大HEP和PO的转化速率。反应温度大于50℃时有副产物的生成且含量随温度升高而增大,说明有副反应的发生。无副产物生成、HEHPP含量为98.16%的50℃为优化的反应温度。
根据以上优化结果,选择选择反应条件如下:n(HEP):n(PO)=1:1、反应温度50℃、反应时间180 min为优化的反应条件,此条件下得到了HEHPP含量为98.16%的产物。
3.2.4 反应产物中副产物的分析取反应时间为60 min的产物进行分析,判断反应过程中副反应的发生。图 3(b)显示副产物峰RT分别为12.98、14.03和15.88 min,MS图分别为图 4(a)、(b)、(c)。
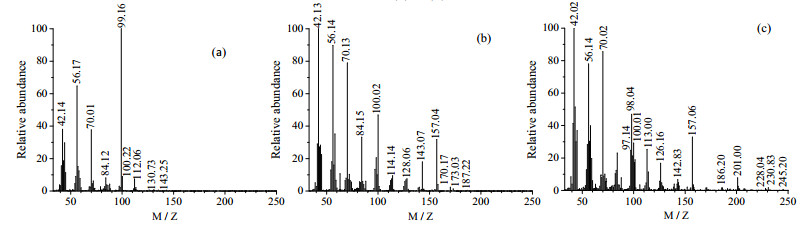
|
图 4 不同副产物的MS图 Fig.4 MS spectra of different byproducts (a) 12.98 min (b) 14.03 min (c) 15.88 min |
图 4(a)中质荷比M/Z为143.25的峰可能为1-(2-羟丙基)哌嗪的分子离子峰,M/Z小于130.73的峰和HEP的MS图重合,说明此副产物和HEP具有相似的结构,综上推断图 4(a)为反应(2)合成的副产物1-(2-羟丙基)哌嗪。
图 4(b)和HEHPP的MS图中各峰基本重合,但RT不同,所以推断是HEHPP的同分异构体,可能是反应(3)合成的副产物1-(2-羟乙基)-4-(1-甲基-2-羟乙基)哌嗪。
分析图 4(c)可知,分子离子峰是M/Z为245.20的峰,分子丢失一个-CH3形成M/Z为230.83的碎片峰,分子离子峰丢失一个-OH形成M/Z为228.04的碎片峰,M/Z为230.83的峰丢失一个-OH和一个-CH=形成M/Z为201.00的碎片峰,M/Z小于186.20的碎片峰和HEHPP峰的MS图基本重合。故可以推测出图 4(c)代表的物质可能为反应(4)或(5)合成的副产物1-(2-羟丙氧基乙基)-4-(2-羟丙基)哌嗪或1-(2-羟乙基)-4-(2-(2-羟丙氧基)丙基)哌嗪。
3.3 MS和NMR表征在n(HEP):n(PO)=1:1、反应温度50℃、反应时间180 min条件下,产物中HEHPP含量为98.18%,产物GC图中峰Ⅲ的MS图为图 5,产物的1H-NMR图为图 6,产物的13C-NMR图为图 7。
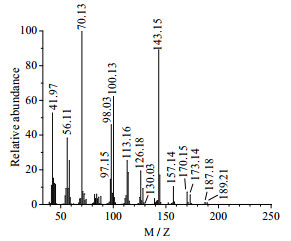
|
图 5 峰Ⅲ的MS图 Fig.5 MS spectrum of peak Ⅲ |
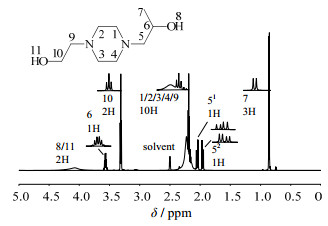
|
图 6 产物的1H-NMR谱图 Fig.6 1H-NMR spectrum of the product 1 H-NMR (600 MHz, dmso) δ 4.08 (s, 2H), 3.60~3.53 (m, 1H), 3.31 (t, J=6.3 Hz, 2H), 2.37~2.11 (m, 10H), 2.05 (dd, J=12.3, 7.2 Hz, 1H), 1.96 (dd, J=12.3, 5.4 Hz, 1H), 0.85 (d, J=7.4 Hz, 3H) |
|
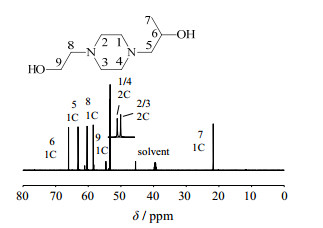
图 7 产物的13C-NMR谱图 Fig.7 13C-NMR spectrum of the product 13 C‐NMR (151 MHz, dmso) δ 66.04 (s, 1C), 63.13 (s, 1 C), 60.38 (s, J=6.5 Hz, 1 C), 58.49 (s, 1 C), 53.52~52.90 (d, 4 C), 21.75 (s, 1 C) |
分析图 5可知,分子离子峰是M/Z为187.18的峰,分子丢失掉一个-CH3形成M/Z为173.14碎片峰,分子离子峰丢失一个-OH形成M/Z为170.15的碎片峰,M/Z为170.15的峰丢失一个-CH=形成M/Z为157.14的碎片峰,M/Z为157.14的峰丢失一个-CH2形成M/Z为143.15碎片峰,M/Z小于130.03的碎片峰和HEP的MS图对比基本重合。
分析1H-NMR谱图可知,H7位移最小且峰型好,作为基准峰来进行积分。遵循1H NMR中的“N+1”规则,H6受相邻的H5和H7的影响,裂分为6重峰。H51受到H1和H6影响,裂分为4重峰,H52受到了H4和H6影响,同样裂分为4重峰,所以表现为位移δ相距较近的两个4重峰。H10受到相邻H9影响,裂分为3重峰。H8和H11为活泼氢,因为位移相近发生了重叠,导致δ8 & 11为4.08的峰面积只有1.56。而H1、H2、H3、H4和H9的δ相近,峰不能很好的分开,但积分得到10个H,符合分子中的H数目。
分析13C-NMR谱图可知,根据碳杂化轨道理论,分子中C5、C6、C7、C8和C9都是sp3杂化,位移δ大小为伯碳 < 仲碳 < 叔碳[17],所以可以判断出δ7最小,δ6最大,δ5、δ8和δ9在中间。由于空间效应,C5的取代基-CH(OH)CH3比C8的取代基-CH2OH分子量大、分支多,所以δ5(63.13)比δ8(58.49)要略大。C1和C4所处化学环境相同,所以δ1=δ4=δ1 & 4,同理δ2=δ3=δ2 & 3。由于空间效应,和C1 & 4相近的-CH2CH(OH)CH3比和C2 & 3相近的-CH2CH2(OH)分子量大、分支多,所以δ1 & 4(53.52)比δ2 & 3(52.90)要略大。
综合图 5、图 6和图 7的谱图分析,可以很肯定得出结论:合成的产物是HEHPP。
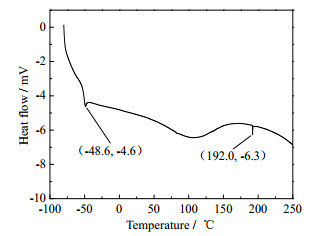
3.4 DSC表征图 8为HEHPP含量为98.18%的产物的DSC图。
|
图 8 产物的DSC曲线 Fig.8 DSC curve of the product |
从图 8中可以看到,HEHPP的凝固点是-48.6℃,沸点是192.0℃。其凝固点很低,合成温度下为液态。
综合分析HEHPP的合成过程可知:合成过程中无需溶剂参与,产物无需分离过程,即可得纯度很高的HEHPP产品。实际应用过程中也不会结晶,导致管道堵塞。
4 结论(1) 本文直接以HEP与PO为原料制得了非对称结构的二元有机胺HEHPP。在HEP与PO的摩尔比为1、反应温度50℃、反应时间180 min的优化条件下,制得了HEHPP含量为98.16%的产物。该制备方法利用HEP常温下为液态,即可作为反应物、又可作为溶剂的特点,不使用其他有机溶剂,具有合成过程简单、无溶剂分离过程、绿色环保、成本低等优点。
(2) 采用NMR、GC-MS和DSC对产物进行了表征,证明了产物即为设计合成的HEHPP,目标产物中的微量杂质主要为原料中所含的哌嗪;HEHPP沸点为192.0℃,凝固点为-48.6℃。HEHPP具有低熔点、无溶剂、低挥发等特性,可作为新型二元有机胺脱硫剂使用。
| [1] | Adelson D E, MacDowell L G, Pollard C B . Derivatives of piperazine. Ⅶ. procaine analogs, part[J]. J Am Chem Soc , 1935, 57 (10) : 1988-1989 DOI:10.1021/ja01313a068 |
| [2] | Kitchen L J, Pollard C B . Derivatives of piperazine. xx. monoalkylation of piperazine with alkene oxides[J]. J Org Chem , 1943, 8 (4) : 338-341 DOI:10.1021/jo01192a006 |
| [3] | SHI Cheng-wu(史成武), LIU Qing-an(刘清安), CUI Peng(崔鹏), et al. Renewable flue gas desulfurization agent and its preparation(可再生的烟气脱硫剂及制备方法):CN, 101584961 B[P]. 2011-07-20. |
| [4] | LIU Yu(刘瑜) . Application of cansolv regenerable amine desulphurization technology(康世富可再生胺法脱硫技术的应用)[J]. Sulfuric Acid Industry(硫酸工业) , 2007 (1) : 39-45 |
| [5] | Hong S Y, Kim H, Kim Y J . Nitrile-functionalized tertiary amines as highly efficient and reversible SO2 absorbents[J]. J Hazard Mater , 2014, 264 : 136-143 DOI:10.1016/j.jhazmat.2013.11.026 |
| [6] | TANG Zhi-gang(汤志刚), ZHOU Chang-cheng(周长城), CHEN Cheng(陈成) . Chemical bsorption of SO2 by using ethylene diamine/phosphoric acid solution(乙二胺/磷酸溶液化学吸收法烟气脱硫的研究)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2005, 19 (3) : 285-291 |
| [7] | Deng R P, Jia L S, Song Q Q . Reversible absorption of SO2 by amino acid aqueous solutions[J]. J Hazard Mater , 2012, 229 : 398-403 |
| [8] | SUN Ren-jie(孙仁杰), LIU Qing-an(刘清安), TAO Li(桃李) . Synthesis of 1, 4-bis(2-hydroxypropyl)piperazine and its application in flue gas desulfurization(N, N'-二(2-羟丙基)哌嗪的合成及其在烟气脱硫工艺中的应用)[J]. Applied Chemical Industry(应用化工) , 2011, 40 (7) : 1145-1147 |
| [9] | CUI Peng, WANG Ting-ting, CHEN Ya-zhong . Density, viscosity, and surface tension of aqueous solution of 1, 4-bis-(2-hydroxypropyl)-piperazine sulfate[J]. J Chem Eng Data , 2013, 58 (12) : 3327-3331 DOI:10.1021/je400405m |
| [10] | CUI Peng(崔鹏), WANG Ting-ting(王婷婷), WANG Qi(王琪) . Measurements of vapor-liquid equilibrium data of sulfur dioxide-1, 4-bis(2-hydroxypropyl) piperazine sulfate aqueous solutions(SO2在N, N-二(2-羟丙基)哌嗪硫酸盐水溶液中气液平衡数据的测定)(在N, N-二(2-羟丙基)哌嗪硫酸盐水溶液中气液平衡数据的测定)[J]. J Chem Eng of Chinese Univ(高校化学工程学报) , 2014, 28 (3) : 454-459 |
| [11] | GAO Hong-bin(高鸿宾) . Organic chemistry(有机化学)[M]. Beijing(北京): Higher Education Press(高等教育出版社), 2005 . |
| [12] | MA Pei-sheng(马沛生) . Chemical data(化工数据)[M]. Beijing(北京): China Petrochemical Press(中国石化出版社), 2003 . |
| [13] | Li Ping, Liang Ying-hua, Ma Pei-sheng . Estimations of enthalpies of vaporization of pure compounds at different temperatures by a corresponding-states group-contribution method[J]. Fluid Phase Equil , 1997, 137 (1) : 63-74 |
| [14] | Joback K G, Reid R C . Estimation of pure-component properties from group-contributions[J]. Chemical Engineering Communications , 1987, 57 (1-6) : 233-243 DOI:10.1080/00986448708960487 |
| [15] | Reid R C, Prausnitz J M, Poling B E . The properties of gases and liquids[M]. New York: Mc Graw-Hill, 1987 . |
| [16] | Rozicka Jr V, Domalski E S . Estimation of the heat capacities of organic liquids as a function of temperature using group additivity. I. hydrocarbon compounds[J]. J Phys Chem Ref Data , 1993, 22 (3) : 597-618 DOI:10.1063/1.555923 |
| [17] | WANG Nai-xing(王乃兴) . Nuclear magnetic resonance spectroscopy(核磁共振谱学)[M]. Beijing(北京): Chemical Industry Press(化学工业出版社), 2006 . |




