2. 江苏(沙钢)钢铁研究院,江苏 张家港 215625;
3. 钢铁研究总院先进钢铁流程及材料国家重点实验室,北京 100081
2. Shagang Iron & Steel Research Institute of Jiangsu Province, Zhangjiagang 215625, China;
3. State Key Laboratory of Advanced Steel Processes and Products, Central Iron and Steel Research Institute, Beijing 100081, China
低共熔溶剂(deep eutectic solvents,DES)具备挥发性低、电导率高、化学性质稳定、溶解能力强等优于传统离子溶剂的特点,在分离纯化、电化学、材料化学等领域受到广泛关注并取得良好的实验效果[1-3]。Abbott等[4]发现摩尔比为1:2的氯化胆碱(ChCl)与尿素(urea)在80 ℃下混合加热至透明溶液,冷却至室温后能形成熔点为12 ℃的液体,展现出了无毒、可生物降解、制备简单、价格低廉等特点。
氯化胆碱-尿素(ChCl-urea)能够很好地溶解金属氧化物,在金属氧化物提取、分离等方面引起人们的极大关注[5-14]。Capper等[15]研究结果表明,ChCl-urea能够选择性溶解金属氧化物,对ZnO、Cu2O和PbO2具有良好的溶解性能,但对Al2O3、SiO2、MgO、CaO、Fe2O3等基本不溶解。因此,ChCl-urea可用于氧化锌提纯,并用作制备纳米级氧化锌的反应源及表面活性剂;也可用于电解沉积锌,ChCl-urea作为溶剂能够避免传统硫酸电解液需要严格除杂等问题,大大简化电解沉积锌的工艺。所有应用的基础是ZnO在ChCl-urea中溶解,而溶解温度制约着氧化锌在氯化胆碱-尿素中的溶解度及溶解速度,所以对ChCl-urea及ChCl-urea-ZnO体系的热稳定性进行研究,对最高运行温度及最长运行时间的确定显得尤为重要,关于ChCl-urea的热稳定性,Chen等[16]系统研究了ChCl-urea的热分解情况,得出氢键对受热后的表现起重要作用,ChCl-urea中的氢键会阻碍分子“逃脱”,使得开始分解温度向高温方向移动;Marcos等[17]提出ChCl-urea最大操作温度明显低于ChCl-urea的起始分解温度。Chemat等[18]在ChCl-urea中加入常见的L-精氨酸形成三元共晶溶剂,增加了共晶溶剂的热稳定性、摩尔热容和玻璃化转变温度,同时降低了热膨胀系数。
针对目前关于ChCl-urea-ZnO体系的热稳定性研究较少,本文对ChCl-urea-ZnO体系的热稳定性进行较为系统的研究,分析升温速率、ρ(ZnO)、温度及保温时间对ChCl-urea及ChCl-urea-ZnO体系短期及长期热稳定性的影响;对热重最终残余物进行焙烧,分析焙烧温度对其物相及形貌的影响。
2 实验(材料与方法) 2.1 实验原料与仪器氯化胆碱(AR,98%)、尿素(AR,99%)、氧化锌(AR,99%)均购自上海阿拉丁生化科技股份有限公司;D-09123型热重差热分析仪,梅特勒-托利多公司;Ulitima IV型X射线衍射仪(XRD),日本理学公司;JSM-6510LA型扫描电子显微镜(SEM),日本电子株式会社。
2.2 溶液的制备取氯化胆碱和尿素在80 ℃下干燥10 h备用,按摩尔比1:2进行混合,在80 ℃下油浴加热并搅拌,直至溶液呈无色澄清,所得溶液即为ChCl-urea低共熔溶剂。取一定量的ZnO加入低共熔溶剂,配制ZnO质量浓度ρ(ZnO)为10、20、40、80、160 g·L-1的ChCl-urea-ZnO溶液,油浴恒温80℃,搅拌至完全溶解。
2.3 ChCl-urea及ChCl-urea-ZnO体系热稳定性的表征采用热重分析对ChCl-urea及ChCl-urea-ZnO体系的热稳定性进行研究。研究不同升温速度对ChCl-urea短期热稳定性的影响;研究不同ρ(ZnO)对ChCl-urea-ZnO体系的短期热稳定性的影响;研究不同温度、不同ρ(ZnO)及不同保温时间对ChCl-urea-ZnO体系长期热稳定性的影响,对失重率、失重速率及最终现象进行对比分析。失重率、氧化锌质量浓度及失重速率如式(1)~(3)所示。
| $w = \frac{{{m_s}}}{{{m_y}}} \times 100\% $ | (1) |
| $\rho ({\rm{ZnO}}) = \frac{{m(\rm{ZnO})}}{V}$ | (2) |
| $v = \frac{w}{t}$ | (3) |
式中:ms为失去的质量,g;my为原来的质量,g;w为失重率,%;m(ZnO)为氧化锌的质量,g;V为溶液的体积,L;v为失重速率,%·min-1;t为时间,min。
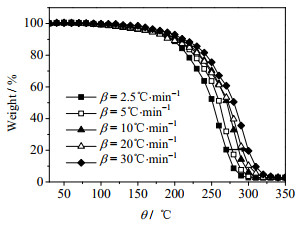
3 结果与讨论 3.1 ChCl-urea及ChCl-urea-ZnO体系短期热稳定性研究 3.1.1 升温速率对ChCl-urea的短期热稳定性的影响如图 1所示为不同升温速率下ChCl-urea低共熔溶剂的热重法(TG)线,图中,θ1为摄氏温度,从图中可以看出,随着升温速率β的增加,有显著的升温滞后现象。不同升温速率对ChCl-urea TG曲线的影响,随着升温速率的增加,TG曲线向着高温方向移动。表明随着升温速率的增加ChCl-urea表现出短暂的热稳定性。在20%处,升温速率2.5 ℃·min-1与30 ℃·min-1温差约为60 ℃左右,每条相邻的不同升温速率的TG曲线之间的温差约为15 ℃。
|
图 1 不同升温速率下ChCl-urea低共熔溶剂的TG曲线 Fig.1 TG curves of ChCl-urea at different heating rates |
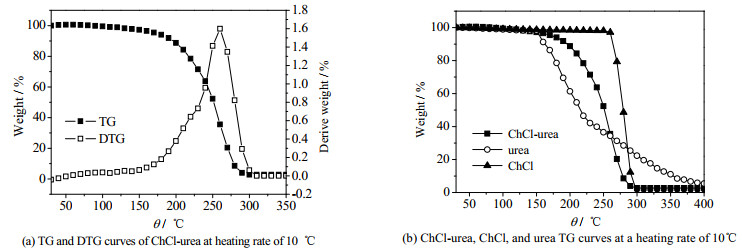
如图 2(a)所示为升温速率为10 ℃·min-1的ChCl-urea的TG及微分热重法(DTG)曲线,从图中可以看出,ChCl-urea低共熔溶剂的分解分为3个阶段,第1阶段是氢键的断裂;第2阶段是尿素的分解;第3阶段是氯化胆碱的分解。氢键是一种弱的分子间作用力,当温度升高到一定的程度,氢键就会断裂,在150 ℃左右分解速率开始快速增加,此时是热稳定性比较差的尿素开始分解,且260 ℃左右结束分解;在270 ℃左右分解速率达到最大值并开始降低,即为热稳定性较好的氯化胆碱开始分解,并在300 ℃左右完全分解。图 2(b)中ChCl-urea、ChCl及urea的失重曲线与上述分解情况相符。ChCl-urea低共熔溶剂热重最终残余物占比为2.69%。
|
图 2 升温速率为10 ℃·min-1的ChCl-urea、ChCl和urea的TG及DTG曲线 Fig.2 TG and DTG curves of ChCl-urea, ChCl and urea under heating rate of 10 ℃·min-1 |
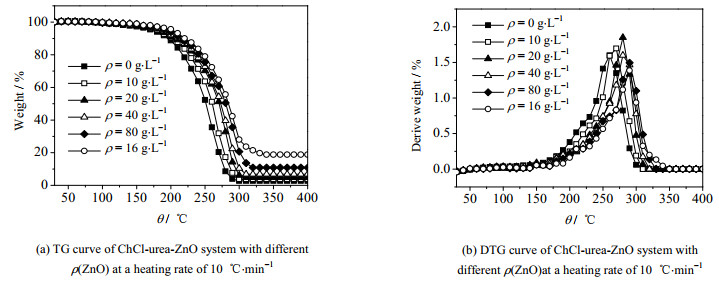
如图 3所示为不同ρ(ZnO)的ChCl-urea-ZnO体系在升温速率为10 ℃·min-1的TG及DTG曲线,从图中可以看出,ChCl-urea-ZnO体系的短期热稳定性与ρ(ZnO)的关系,随着ρ(ZnO)的增加,溶液的TG与DTG曲线向着高温方向移动,表现出更好的短期热稳定性。
|
图 3 不同ρ(ZnO)的ChCl-urea-ZnO体系在升温速率为10 ℃·min-1的TG及DTG曲线 Fig.3 TG and DTG curves of the ChCl-urea-ZnO systems with different ρ(ZnO) under heating rate of 10 ℃·min-1 |
当ZnO加入ChCl-urea DES中,ZnO便与溶液中存在的urea和Cl-配位发生如下反应:
| $ {\rm{ZnO }} + {\rm{ urea }} + {\rm{ C}}{{\rm{l}}^ - } \to {\rm{ }}{\left[ {{\rm{ZnClO}} \cdot {\rm{urea}}} \right]^ - } $ | (4) |
由Abbott等[15]的研究可知,在ChCl-urea DES中存在[ChCl2]-和[(Ch)2Cl3]-,表明在未加ZnO时低共熔溶剂中存在由Ch+和Cl-交替排列形成的低聚体,如式(5)pattern Ⅰ所示。在ChCl-urea中,由于Cl-体积小,Ch+和Cl-间较强的相互作用力有利于形成低聚体。而由于配合物R-的体积远大于Cl-的体积,ChCl-urea-ZnO体系中由R-、Ch+和Cl-交替排列形成的多聚物,如式(5)pattern Ⅱ和pattern Ⅲ所示。
| $ \begin{array}{l} \cdots {\rm{Cl}}\; - \;{\rm{Ch}}\; - \;{\rm{Cl}}\; - \;{\rm{Ch}}\; - \;{\rm{Cl}}\; - \;{\rm{Ch}}\; - \;{\rm{Cl}}\; - \;{\rm{Ch}}\; - \;{\rm{Cl}}\; - \;{\rm{Ch}}\; - \;{\rm{Cl}}\; \cdots {\rm{pattern}}\;Ⅰ\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; \cdots {\rm{R}}\; - \;{\rm{Ch}}\; - \;{\rm{R}}\; - \;{\rm{Ch}}\; - \;{\rm{Cl}}\; - \;{\rm{Ch}}\; - \;{\rm{Cl}}\; \cdots {\rm{pattern}}\;Ⅱ\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; \cdots {\rm{R}}\; - \;{\rm{Ch}}\; - \;{\rm{R}}\; - \;{\rm{Ch}}\; - \;{\rm{Cl}}\; \cdots {\rm{pattern}}\;Ⅲ \end{array} $ | (5) |
式中:R={ [ZnClO·urea]}[19]
多聚物的数量越多,聚合度越高,链越长,多聚物体积相对越大,ChCl-urea-ZnO体系的热稳定性越好。随着ρ(ZnO)的增加[ZnClO·urea]-浓度也不断增加,两者呈正比关系。而体系中的Cl-和尿素的浓度却逐渐减小,随着温度的升高,离子的能量在不断的积累,当能量达到极限离子就能克服相互之间的聚合作用和氢键作用,发生分解。随着ρ(ZnO)的增加溶液的聚合度也不断增加,导致ChCl-urea-ZnO体系需要吸收更多的能量来克服相互之间的聚合作用和氢键作用,所以随着ρ(ZnO)的增加使得TG曲线向着高温方向移动。最终残余占比分别为2.69%、3.81%、4.76%、6.84%、10.88%和18.77%,随着ρ(ZnO)的增大,最终残余占比也随之增大,并且两者呈正比关系。
3.2 ChCl-urea及ChCl-urea-ZnO体系长期热稳定性研究低共溶溶剂的热稳定性是衡量其最高运行温度的主要参数之一,开始分解温度通常被用来衡量离子溶液体系的热稳定性[20-22]。但是,开始分解温度可能导致人们过高地估计离子溶液体系的最高运行温度上限[23]。短期的热稳定性研究是以固定的升温速率进行的,当达到实际分解温度时,因为温度继续升高,导致没有可测量的质量损失。Crosthwaite等[24]研究表明离子溶液会在长时间明显低于开始分解温度的条件下发生分解。所以对于ChCl-urea及ChCl-urea-ZnO体系长期热稳定性研究,是其在工业上广泛应用不可或缺的一部分。
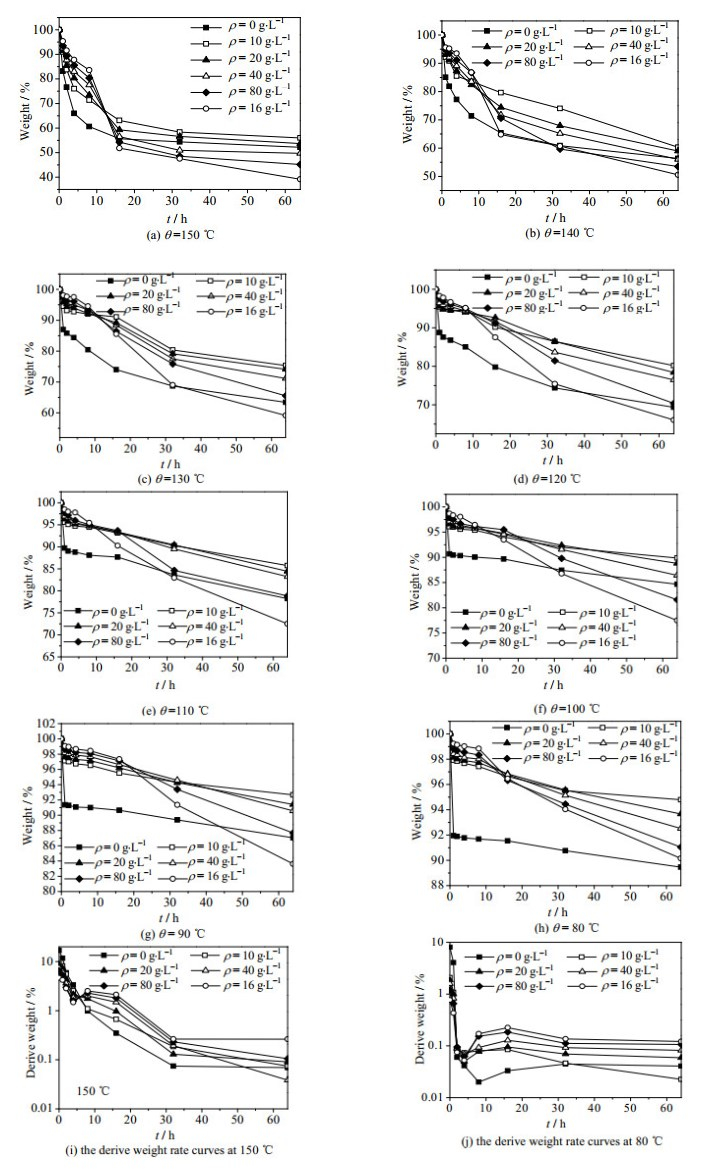
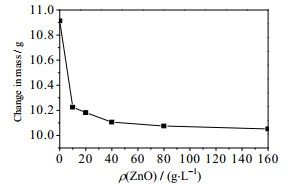
如图 4所示为不同温度、不同ρ(ZnO)及不同保温时间的长期热稳定性失重曲线,在未加ZnO的条件下当0 h < t < 1 h时的失重率明显高于其他的时间段,而其他不同ρ(ZnO)当0 h < t < 1 h时失重率随着ρ(ZnO)的增加而减小。分别取10 g不同ρ(ZnO)的低共熔溶剂在空气中存放24 h后质量变化如图 5所示,从图中可以看出,ChCl-urea相较ChCl-urea-ZnO体系有着较好的吸水性,所以ChCl-urea当0 h < t < 1 h时的失重,水分的蒸发占很大比重,而加入ZnO生成的[ZnClO·urea]-并无很好的吸水性,所以随着ρ(ZnO)的增加,配位体[ZnClO·urea]-的量不断增加,吸收的水分减少,0 h < t < 1 h时的失重率随之减少。
|
图 4 失重曲线及失重速率曲线 Fig.4 Profiles of weight loss and weight loss rate |
|
图 5 不同ρ(ZnO)的溶液在空气中存放24 h之后的质量变化 Fig.5 Mass variation of different ρ(ZnO) solutions after stored in air for 24 h |
ChCl-urea的开始分解温度为172 ℃[17],在图 4(a)中,150 ℃低于开始分解温度,选为长期热稳定性研究的开始温度。当0 h < t < 8 h时,ChCl-urea-ZnO体系的失重率都低于ChCl-urea,并且ρ(ZnO)越高失重率越小,失重率与ρ(ZnO)呈反比,表明当0 h < t < 8 h时ρ(ZnO)越高长期热稳定性越好。当16 h < t < 64 h时,随着ρ(ZnO)增加,失重率增大,表明当16 h < t < 64 h时,ρ(ZnO)越高长期热稳定性越差,长期热稳定性为ρ=10 > 20 > 0 > 40 > 80 > 160 g·L-1。并且当16 h < t < 64 h时,如图 6(a)所示,溶液的颜色随着ρ(ZnO)的增加由原来的无色逐渐变成黄色再到黑色,如图 6(b),ρ= 160 g·L-1条件下会有膨胀现象。当8 h < t < 16 h时,ChCl-urea-ZnO体系的失重速率,为ρ=160 > 80 > 40 > 20 > 10 g·L-1。

|
图 6 最终现象 Fig.6 Profiles of samples at different stages |
如图 4(b)-(h)所示,与4(a)相比随着温度的降低,ChCl-urea及ChCl-urea-ZnO体系的失重率也随之降低,失重率与温度成正比。当0 h < t < 8 h时,随着保温时间增加,ChCl-urea及ChCl-urea-ZnO体系的失重速率随着温度的降低和ρ(ZnO)的增加而减低。当16 h < t < 64 h时,随着ρ(ZnO)增加,失重率增大,在这个阶段ρ(ZnO)越高长期热稳定性越差,长期热稳定性为ρ=10 > 20 > 40 > 0 > 80 > 160 g·L-1;相较于图 4(a)出现“凹”现象是因为随着温度降低ChCl-urea-ZnO体系的失重速率虽然相较ChCl-urea体系要快,但是整体失重比例ChCl-urea体系还是比ChCl-urea-ZnO体系高,随温度降低存在一个渐变过程;如图 4(i)-(j)所示,当0 h < t < 8 h时,ρ(ZnO)越高失重速率越小,失重速率与ρ(ZnO)呈反比;而当8 h < t < 64 h时,ρ(ZnO)越高失重速率越大,失重速率与ρ(ZnO)呈正比,与上述结论一致。
当1 h < t < 8 h时,ρ(ZnO)越高失重率越低,在此阶段只有ChCl-urea发生分解,而[ZnOHCl(urea)n]并没有开始分解,所以失重率的高低与ρ(ZnO)呈反比;当8 h < t < 64 h时,失重率与ρ(ZnO)之间的关系逐渐发生变化,并逐渐与ρ(ZnO)呈正比,发生了式(6)的分解反应,ZnOHCl为褐色,随着ρ(ZnO)的增高,[ZnOHCl(urea)n]的浓度也在不断增高,分解生成的ZnOHCl也越多,相对应的最终现象的颜色也越来越深。在80、90、100、110、120、130 ℃,10 h之前ChCl-urea-ZnO体系的失重率都较小,有着较好的热稳定性,但随着时间的推移失重速率随着[ZnOHCl(urea)n]的分解逐渐失重率逐渐增大。
| $ \left[ {{\rm{ZnOHCl}}{{\left( {{\rm{urea}}} \right)}_n}} \right] \to {\rm{ ZnOHCl }} + {\rm{ N}}{{\rm{H}}_{\rm{3}}} \uparrow {\rm{ }} + {\rm{ C}}{{\rm{O}}_{\rm{2}}} \uparrow $ | (6) |
130、120、110、100、90、80与150 ℃有相同的最终现象,最终现象的颜色随着ρ(ZnO)的增加而逐渐变深,如图 6(c)相较6(b)颜色较浅,随着温度降低,相应的颜色也会变浅,160 g·L-1条件下都会有膨胀现象。
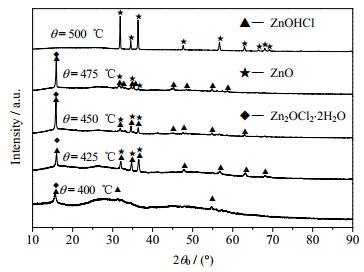
3.3 热重最终残余物分析对ChCl-urea-ZnO体系热重残余物进行焙烧,如图 7所示为不同焙烧温度下的最终残余物X射线衍射仪(XRD),从图中可以看出,400 ℃下最终残余为ZnOHCl和Zn2OCl2·2H2O,随着焙烧温度的升高逐渐有ZnO形成,当焙烧温度为500 ℃,热重最终残余物完全转化为ZnO。
|
图 7 不同焙烧温度下的最终残余物XRD Fig.7 XRD patterns of final residues at different temperatures |
如图 8(a)所示为400 ℃下的最终残余的微观形貌,从图中可以看出,最终残余为胶状物。图 8(a)中(1)处X射线能谱仪(EDS)如表 1所示,表中wB为元素质量分数,与XRD分析的结果相符合。450 ℃的最终残余物的微观形貌如图 8(b)所示,明显看出图中有多种不同形状的结构,呈球状聚合在一起的为ZnO,呈圆柱状及块状聚合在一起的为ZnOHCl和Zn2OCl2·2H2O,(2)(3)处EDS如表 1所示,也与XRD符合。500 ℃下最终残余完全转化为ZnO,微观形貌如图 8(c)所示,呈球状聚合在一起,EDS中Cl元素占很小比重,与XRD分析结果一致。

|
图 8 最终残余物的SEM Fig.8 SEM micrographs of the final residues |
|
|
表 1 (1)(2)(3)(4)处EDS元素分析 Table 1 EDS element analysis at (1)(2)(3)(4) |
运用热重分析研究ρ(ZnO)、温度及保温时间对ChCl-urea-ZnO体系热稳定性的影响,并对热重最终残余物的物相及形貌进行分析。
(1) 随着ρ(ZnO)的增加,溶液的TG及DTG曲线向着高温方向移动,表现出更好的短期热稳定性。
(2) 当0 h < t < 8 h时,ρ(ZnO)越高长期热稳定性越好,当8 h < t < 16 h时,ρ(ZnO)越高长期热稳定性逐渐变差;而当16 h < t < 64 h时,ρ(ZnO)越高长期热稳定性越差;当0 h < t < 8 h时,ρ(ZnO)越高失重速率越小,失重速率与ρ(ZnO)呈反比;而当8 h < t < 64 h时,ρ(ZnO)越高失重速率越大,失重速率与ρ(ZnO)呈正比;并且最终溶液的颜色随着ρ(ZnO)的增加而由原来的无色逐渐变成黄色再到黑色,并且发生膨胀。
(3) 400 ℃下最终残余物为ZnOHCl和Zn2OCl2·2H2O,随着焙烧温度的升高逐渐有ZnO形成,当焙烧温度为500 ℃,热重最终残余物完全转化为ZnO。
| [1] |
韩金玉, 黄鑫, 王华, 等. 绿色溶剂离子液体的性质和应用研究进展[J]. 化学工业与工程, 2005, 22(1): 62-66. HAN J Y, HUANG X, WANG H, et al. Research progress on properties and applications of green solvent ionic liquids[J]. Chemical Industry and Engineering, 2005, 22(1): 62-66. DOI:10.3969/j.issn.1004-9533.2005.01.016 |
| [2] |
MA W, TANG W, ROW K H. Characterization of deep eutectic solvents for dispersive liquid-liquid microextraction for phenolics[J]. AnalLett, 2017, 50(14): 2177-2188. |
| [3] |
CARRIAZO D, GUTIERREZ M C, FERRER M L, et al. Resorcinol-based deep eutectic solvents as both carbonaceous precursors and templating agents in the synthesis of hierarchical porous carbon monoliths[J]. Chemistry of Materials, 2010, 22(22): 6146-6152. DOI:10.1021/cm1019684 |
| [4] |
ABBOTT A P, CAPPER G, DAVIES D L, et al. Novel solvent properties of choline chloride/urea mixtures[J]. Chemical Communications, 2002, 9(1): 70-71. |
| [5] |
胡鹏程, 江伟, 钟丽娟. 低共熔溶剂的应用研究进展[J]. 现代化工, 2018, 38(10): 59-63. HU P C, JIANG W, ZHONG I J. Application and research progress of low eutectic solvent[J]. Modern Chemical Industry, 2018, 38(10): 59-63. |
| [6] |
李汝雄, 王建基. 绿色溶剂-离子液体的制备与应用[J]. 化工进展, 2002, 21(1): 43-47. LI R X, WANG J J. Preparation and application of green solvent-ionic liquid[J]. Progress in Chemical Industry, 2002, 21(1): 43-47. DOI:10.3321/j.issn:1000-6613.2002.01.013 |
| [7] |
GUO W, HOU Y, WU W, et al. Separation of phenol from model oils with quaternary ammonium salts via forming deep eutectic solvents[J]. Green Chemistry, 2013, 15(1): 226-229. DOI:10.1039/C2GC36602A |
| [8] |
ABBOTT A P, CAPPER G, MCKENZIE K J, et al. Electrodeposition of zinc-tin alloys from deep eutectic solvents based on choline chloride[J]. Journal of Electroanalytical Chemistry, 2007, 599(2): 288-294. DOI:10.1016/j.jelechem.2006.04.024 |
| [9] |
TIAN G. Green solvents Ⅱ[M]. Springer: Dordrecht, 2012: 119-153.
|
| [10] |
ABBOTT A P, CAPPER G, DAVIES D L, et al. Processing metal oxides using ionic liquids[J]. Mineral Processing & Extractive Metallurgy IMM Transactions, 2006, 115(1): 15-18. |
| [11] |
REDDY B R, PRIYA D N, RAO S V, et al. Solvent extraction and separation of Cd(Ⅱ), Ni(Ⅱ) and Co(Ⅱ) from chloride leach liquors of spent Ni-Cd batteries using commercial organo-phosphorusextractants[J]. Hydrometallurgy, 2005, 77(3): 253-261. |
| [12] |
张盈盈, 吉晓燕, 陆小华. 氯化胆碱/尿素和氯化胆碱/甘油的性质与应用[J]. 中国科学:化学, 2014, 44(6): 927-941. ZHANG Y Y, JI X Y, LU X H. properties and applications of choline chloride/urea and choline chloride/glycerol[J]. Science in China:Chemistry, 2014, 44(6): 927-941. |
| [13] |
ZHANG Q, DE O V K, ROYER S, et al. Deep eutectic solvents:syntheses, properties and applications[J]. Chemical Society Reviews, 2012, 41(21): 7108-7146. DOI:10.1039/c2cs35178a |
| [14] |
CARRIAZO D, SERRANO M C, GUTIERREZ M C, et al. Deep-eutectic solvents playing multiple roles in the synthesis of polymers and related materials[J]. Chemical Society Reviews, 2012, 41(14): 4996-5014. DOI:10.1039/c2cs15353j |
| [15] |
ABBOTT A P, CAPPER G, DAVIES D L. Solubility of metal oxides in deep eutectic solvents based on choline chloride[J]. Journal of Chemical & Engineering Data, 2006, 51(4): 1280-1282. |
| [16] |
CHEN W J, XUE Z M, WANG J F, et al. Thermal stability of low eutectic solvent[J]. Acta Physico-Chimica Sinica, 2018(8): 904-911. |
| [17] |
DELGADO-MELLAADO N, LARRIBO M, NAVARRO P, et al. Thermal stability of choline chloride deep eutectic solvents by TGA/FTIR-ATR analysis[J]. Journal of Molecular Liquids, 2018, 37-43. |
| [18] |
CHEMAT F, ANJUM H, SHARIFF A M, et al. Thermal and physical properties of (Choline chloride+urea+l-arginine) deep eutecticsolvents[J]. Journal of Molecular Liquids, 2016, 218: 301-308. DOI:10.1016/j.molliq.2016.02.062 |
| [19] |
雷震, 徐存英, 华一新, 等. 低共熔溶剂体系的电化学行为[J]. 化工学报, 2017, 68(8): 3301-3309. LEI Z, XU C Y, HUA YX, et al. Electrochemical behavior of ChCl-urea-ZnO in low eutectic solvent system[J]. CIESC Journal, 2017, 68(8): 3301-3309. |
| [20] |
HEYM F, ETZOLD B J M, KERN C, et al. An improved method to measure the rate of vaporisation and thermal decomposition of high boiling organic and ionic liquids by thermogravimetrical analysis[J]. Physical Chemistry Chemical Physics, 2010, 12(38): 12089-12100. DOI:10.1039/c0cp00097c |
| [21] |
DEL SESTO R E, MCCLESKEY T M, MACOMBER C, et al. Limited thermal stability of imidazolium and pyrrolidinium ionic liquids[J]. Thermochimica Acta, 2009, 491(1): 118-120. |
| [22] |
SEEBERGER A, ANDRESEN A K, JESS A. Prediction of long-term stability of ionic liquids at elevated temperatures by means of non-isothermal thermogravimetrical analysis[J]. Physical Chemistry Chemical Physics, 2009, 11(41): 9375-9381. DOI:10.1039/b909624h |
| [23] |
ZAITSAU D H, POHAKO-ESKO K, ARLT S, et al. Thermodynamics of imidazolium based ionic liquids with cyano containing anions[J]. Journal of Molecular Liquids, 2006, 8: 691-696. |
| [24] |
CROSTHWAITE J M, MULDOON M J, DIXON J N K, et al. Phase transition and decomposition temperatures, heat capacities and viscosities of pyridinium ionic liquids[J]. Journal of Chemical Thermodynamics, 2005, 37(6): 559-568. DOI:10.1016/j.jct.2005.03.013 |




