天然纤维素作为自然界丰富的绿色可再生生物资源,由其转化为新型原料、精细化学品、生物医药材料及功能材料等已成为今后工业发展的趋势[1]。以纤维素上的羟基为接枝点,对纤维素进行接枝改性,可以赋予其新的功能,如光敏感性、pH敏感性、温度敏感性等[2~4],这使得功能性纤维素聚合物在医药领域,特别是在药物负载及药物缓释方面发挥着越来越重要的作用。然而纤维素的分子间和分子内部存在有大量的氢键,结晶度较高使得其在普通的溶剂中溶解性较差,这极大地阻碍了纤维素的接枝改性。离子液体作为一种“新型绿色溶剂”,无毒、易回收、热稳定好、几乎无蒸汽压,对纤维素具有良好的溶解能力,是纤维素接枝改性的理想反应介质[5]。纤维素接枝改性的方法有可逆加成-断裂链转移聚合、开环聚合、原子转移自由基聚合等,其中原子转移自由基聚合 (Atom Transfer Radical Polymerization, ATRP) 法反应过程活性可控,可以在纤维素分子上接枝大小均匀的分子刷,合成各种分子结构可控、侧链分子量分布均匀的功能性纤维素聚合物[6~8]。Tang等[9]在离子液体中,通过ATRP法在纤维素上接枝了聚甲基丙烯酸二乙氨基乙酯 (MCC-g-PDEAEMA),其自组装形成的胶束能够在不同pH环境下呈现不同的形态,是一种良好的pH响应性药用高分子材料。Zhong等[10]以离子液体为反应介质,利用ATRP法在纤维素上接枝了甲基丙烯酸甲酯 (cellulose-g-PMMA),聚合物在水中形成的胶束呈现出明显的核壳结构,并对阿司匹林具有良好的包覆和药物缓释效果。
经过改性后的纤维素聚合物在分子结构上可划分为亲水性链段和疏水性链段,通过在疏水性纤维素主链上接枝亲水性的pH敏感性功能基团,一方面可以使聚合物形成核壳结构,减少了其内部的药物泄露和溶解性差等问题[11],另一方面可以使药物在不同外界pH条件下进行不同程度的释放[12, 13],进而使药物有针对性地在病变部位进行释放,减少对正常组织的毒副作用[14]。Wang等[15]利用ATRP法在乙基纤维素 (EC) 上接枝了PDEAEMA (EC-g-PDEAEMA),聚合物胶束对模型药物利福平包载后,在pH 6.6缓冲溶液中的药物释放量大于pH7.4的缓冲溶液。Song等[16]在离子液体氯化-1-烯丙基-3-甲基咪唑[Amim]Cl中,合成了纤维素接枝L-聚乳酸 (Cellulose-g-PLLA),并对亲水性的维生素C进行了包载,药物释放动力学研究发现,随着侧链PLLA聚合度的增加,聚合物微球对维生素C的释放动力学会发生相应改变。能够影响载药胶束药物释放动力学的因素有很多,如聚合物结构中亲水性和疏水性结构的比例,聚合物分子量大小,药物的负载方式等[17~19],其中,药物的亲水性和疏水性对纤维素聚合物载药胶束的药物释放动力学影响的研究还鲜有报道。
本研究在离子液体[Amim]Cl中,利用ATRP法在微晶纤维素分子上均匀地接枝了pH敏感性的聚4-乙烯基吡啶 (P4VP) 分子刷,合成了具有pH敏感性的药物载体材料MCC-g-P4VP,并分别以亲水性的罗丹明B和疏水性的阿司匹林为模型药物,制得了两种模型药物的MCC-g-P4VP载药胶束,通过对二者的载药胶束在不同pH条件下进行体外药物释放实验,探索了MCC-g-P4VP胶束在不同pH条件下对药物的释放动力学规律,对比分析了载药胶束对亲水性药物和疏水性药物的释放机制,以期进一步为纤维素接枝聚合物胶束在药物缓释方面的应用提供理论依据。
2 实验部分 2.1 实验试剂CuBr纯度99%,阿拉丁试剂公司;4-乙烯基吡啶 (4-VP),纯度99%,阿拉丁试剂公司;五甲基二乙烯基三胺 (PMDETA),99%,天津市恒兴化学试剂有限公司;微晶纤维素 (分子量范围36000~37000),分析纯,天津市光复精细化工研究所;2-溴异丁酰溴 (BiB) 纯度98%,阿拉丁试剂公司;[Amim]Cl,纯度为99%,上海复捷化学有限公司;透析袋 (截留分子量为3500),上海源叶生物科技有限公司;罗丹明B,99%,阿拉丁试剂公司;阿司匹林,98%,博美生物科技试剂公司。
2.2 实验过程 2.2.1 MCC-g-P4VP的制备取一定量的MCC、[Amim]Cl于三口瓶中,加热、搅拌将MCC溶解,之后在冰水浴中滴加定量的甲苯和2-溴异丁酰溴的混合溶液,常温下反应24 h,将反应后的溶液加入到过量蒸馏水中,析出大量白色沉淀,抽滤、洗涤,冷冻干燥即得到大分子引发剂MCC-g-BiB;取一定质量的MCC-g-BiB、[Amim]Cl于三口瓶中加热溶解并通入氮气,待完全溶解后,加入一定配比的CuBr、五甲基二乙烯基三胺、4-乙烯基吡啶,60℃反应12 h,最后将反应液倒入过量蒸馏水中,析出沉淀,抽滤、洗涤并冷冻干燥,即得到pH敏感性纤维素接枝共聚物MCC-g-P4VP。MCC-g-P4VP的合成路线如图 1所示。
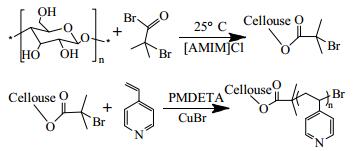
|
图 1 在离子液体中利用ATRP法制备MCC-g-P4VP的合成路线 Fig.1 Synthesis of MCC-g-P4VP via ATRP in ionic liquids |
称取40 mg MCC-g-P4VP聚合物,10 mg模型药物罗丹明B,溶于10 mL的DMSO中,超声15 min,常温搅拌12 h,加入2 mL的蒸馏水诱导聚合物形成载药胶束,将溶液移入透析袋 (截留分子量为3500) 中并将其在1 L去离子水中透析48 h,每6 h换一次去离子水,将透析液冷冻干燥得到包载有罗丹明B的载药胶束粉末;包载阿司匹林的载药胶束和罗丹明B的制备方法相同;空白胶束除不加药物外,制备方法和载药胶束相同。胶束的载药率 (DL%) 和包封率 (EE%) 分别用式 (1) 和式 (2) 计算:
| $ 载药率\left( {DL\% } \right) = \frac{{{m_0}}}{{{m_1}}} \times 100\% $ | (1) |
| $ 包封率\left( {EE\% } \right) = \frac{{{m_0}}}{{{m_2}}} \times 100\% $ | (2) |
式中m0为聚合物胶束中包覆的药物量 (g);m1为聚合物胶束总量 (g);m2为投入的药物总量 (g)。
2.2.3 药物释放实验分别在10 mL pH为5.8、7.4、8.0的三种磷酸缓冲溶液中加入10 mg载药胶束进行溶解,将溶液转移至透析袋 (截留分子量为3500),密封后分别置于90 mL相应pH值的外界缓冲溶液中,并在37℃的恒温摇床中进行药物释放。定时取10 mL外界释放液,同时加入相应的新鲜缓冲溶液。在相应波长处检测介质中两种药物含量,每组实验重复3次取平均值。原料药释放实验为在pH值7.4的缓冲液中加入与胶束内所含药物量相等的原料药并移入透析袋中,其他条件同载药胶束药物释放实验相同。
2.2.4 标准曲线的绘制和体外药物释放率的计算分别将一定量的阿司匹林和罗丹明B溶于磷酸盐缓冲溶液,配制多种浓度药物的标准溶液,分别在208 nm和554 nm波长处测定二者标准液的吸光度。得到阿司匹林的标准曲线方程:Y=0.20581+0.06197X (R2=0.9993);罗丹明B的标准曲线方程:Y=0.03623+0.03621X (R2=0.9998)。取10 mg载药胶束粉末溶于磷酸缓冲液中,用紫外分光光度计在相应波长处测定罗丹明B和阿司匹林的吸光度,得到聚合物胶束内的药物含量。载药胶束在不同外界环境下的累积药物释放量利用公式 (3) 计算:
| $ 累积释药量\left( \% \right) = \frac{{0.09 \times {C_n} + 0.01 \times \sum {{C_{n - 1}}} }}{{\mathop W\nolimits_0 }} $ | (3) |
式中W0为10 mg载药胶束中含有的药物质量,Cn为检测时间内第n次测量时释放液中药物的浓度 (mg·L-1),Cn-1为第n-1次测量时释放液中药物的浓度 (mg·L-1);ΣCn-1为前n-1次测量出的药物浓度之和。
2.2.5 MCC-g-P4VP接枝聚合物的水解取0.1 g MCC-g-P4VP接枝聚合物加入盛有2 mL丙酮,3 mL THF和0.5 mL 70%硫酸溶液的三口瓶中,40℃油浴中搅拌反应24 h后,抽滤得到棕色固体,用大量甲醇反复洗涤产物,即得水解产物P4VP。
2.3 药物释放动力学药物从以聚合物为基质的载体中释放的机理非常复杂,至今还未有较为完整的理论和解释,目前常采用药物释放动力学模型对药物缓释的机理进行分析,常用的动力学模型有:零级模型Q = Kt;一级模型ln (1-Q) =-Kt;Higuchi模型Q = Kt1/2和Ritger-Pappas模型lnQ =nlnt+lnK;式中Q为药物在时间t的累积释放量,K为动力学常量。Ritger-Pappas方程中,n为扩散常数,其大小表征释放机制:n ≤ 0.45时,药物释放机制为Fickian扩散;0.45 < n < 0.89时,为non-Fickian扩散,药物释放为混合型,即扩散与骨架溶蚀机制相结合;n ≥ 0.89时,符合骨架溶蚀的机理[20~22]。本实验通过药物释放动力学模型对载药胶束的药物释放曲线进行拟合,进一步对两种药物缓释过程的机理进行分析。
2.4 表征傅里叶红外光谱仪 (FT-IR,FTS-135),美国BIO-RAD公司;核磁共振光谱仪 (Avance500),德国Bruker公司,DMSO-d6为溶剂,TMS为内标进行测试;X射线衍射仪 (Bruker D8),德国Bruker公司;透射电子显微镜 (100CX-Ⅱ) 日本日立公司;紫外-可见分光光度计 (UV-2501PC) 日本岛津公司;动态光散射仪 (Nano-ZS90) Malvern公司;凝胶渗透色谱仪 (Waters150) Varian公司,实验条件:温度25℃,流动相为四氢呋喃 (色谱纯),流速0.8 mL·min-1,标样为聚苯乙烯。JWY-200A型张力仪 (承德大华有限公司),实验条件:5~400 mg·L-1胶束的水溶液并测定各溶液的表面张力值,确定聚合物的CMC值。
3 结果与讨论 3.1 纤维素接枝物MCC-g-P4VP的红外表征由FT-IR图谱 (图 2) 可以看出,微晶纤维素经过酰化反应后,在1750 cm-1处明显地多出了一个羰基 (C=O) 特征峰 (图 2,曲线b),这表明2-溴异丁酰溴已经成功接枝在了微晶纤维链上,证明已合成了纤维素大分子引发剂。由接枝共聚物图谱 (图 2,曲线c) 发现,在1600和1558 cm-1处的特征峰是吡啶环中C-N键的特征吸收峰,1452和1414 cm-1处的峰是吡啶环中C=C键的伸缩振动吸收峰。在1070与1000 cm-1处的峰是C-H键的面内弯曲振动吸收峰,825 cm-1的峰是C-H键的面外弯曲振动吸收峰。由此红外图谱可以确定合成了MCC-g-P4VP。
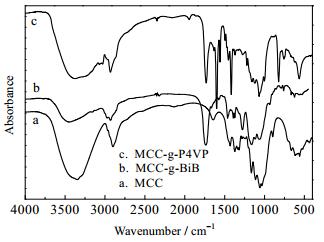
|
图 2 MCC、MCC-BiB及MCC-g-P4VP的FT-IR谱图 Fig.2 FT-IR spectra of MCC, MCC-g-BiB and MCC-g-P4VP copolymer |
由图 3 MCC-g-BiB的1H-NMR图 3A可知,化学位移δ 1.9和δ 1.7(b) 处出现了酰溴基团的双甲基峰,在δ 4.0~6.0(a) 之间的多重质子峰是微晶纤维素主链对应的多重质子峰;由纤维素大分子引发剂的图谱可以进一步确定2-溴异丁酰溴已经成功接枝在纤维主链上,证明合成了MCC-g-BiB。由图 3中MCC-g-P4VP的1H-NMR图 3B可以发现,δ 1.5(d) 和δ 2.1(c) 处的峰为4-乙烯吡啶中亚甲基和次甲基的质子峰,δ 8.3(b) 和δ 6.4(a) 处的峰为4-乙烯吡啶环上靠近N原子和远离N原子的两种质子峰,δ 0.9(e) 处是甲基质子振动峰。由此可以确定通过ATRP法合成了纤维素接枝聚合物MCC-g-P4VP。
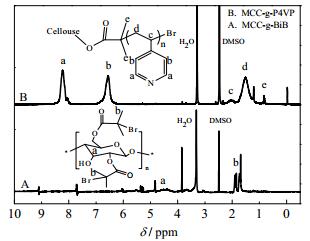
|
图 3 MCC-g-BiB和MCC-g-P4VP的1H-MR图 Fig.3 1H-NMR spectra of MCC-g-BiB and Cellulose-g-P4VP copolymer |
利用凝胶渗透色谱对侧链P4VP的分子量和分子量分布的测试结果如图 4所示,侧链聚4-乙烯基吡啶成单峰分布,其分子量 (Mn) 为38052,分子量分布 (Mw/Mn) 为1.26,此结果表明利用ATRP法合成的聚合物MCC-g-P4VP的侧链分子量分布较窄,ATRP反应过程活性可控,侧链均匀地接枝在纤维素骨架上,形成均匀的接枝聚合物分子刷,有利于聚合物MCC-g-P4VP自组装形成形状规则的胶束。
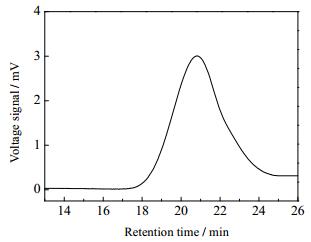
|
图 4 聚合物MCC-g-P4VP侧链P4VP的GPC曲线 Fig.4 GPC curves of side chain P4VP on MCC-g-P4VP copolymers |
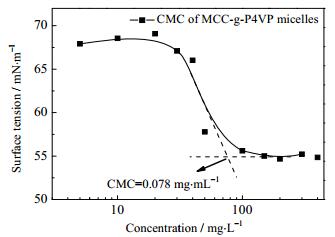
通过表面张力法测定聚合物胶束CMC值的结果如图 5所示,MCC-g-P4VP聚合物胶束在水中的临界胶束浓度为0.078 mg·mL-1,具有较小的CMC值,这表明聚合物胶束具有良好的耐稀释特性,同时也使得共聚物胶束作为一种药物载体能够在体液循环中保持良好的稳定性[23]。
|
图 5 MCC-g-P4VP胶束水溶液的表面张力随浓度的变化曲线 Fig.5 Surface tension as a function of MCC-g-P4VP concentration |
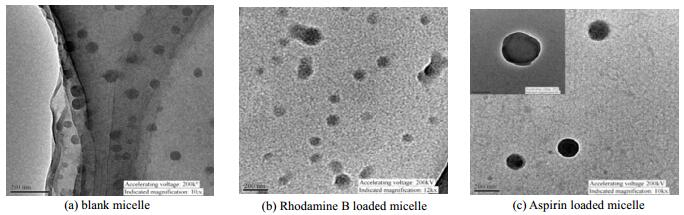
透射电子显微镜 (TEM) 下观察空白聚合物胶束和载药胶束的形态如图 6所示,从表征结果来看空白胶束 (图 6(a)) 的形态为规整的球形结构。图 6(b)为包载了罗丹明B后的胶束TEM图,从图中看到载药后胶束粒径有所增大,并且载药后胶束无明显交联现象;MCC-g-P4VP包载有阿司匹林的胶束TEM图 (图 6(c)) 中,胶束具有明显的内核-外壳结构,分散性较好,形态较稳定。利用DLS测定了胶束载药前后的粒径和粒径分布,结果表明,空白胶束的粒径为97.3 nm (PDI=0.062),载药后胶束粒径增大,包载罗丹明B的胶束和包载阿司匹林的胶束的粒径分别为134.7 nm (PDI=0.160) 和156.3 nm (PDI=0.153)。这些结果表明模型药物罗丹明B和阿司匹林已经分别被包覆在胶束粒子内。
|
图 6 空白胶束、包载罗丹明B胶束和包载阿司匹林胶束的透射电子显微镜图像 Fig.6 TEM micrographs of blank micell, Rhodamine B loaded micelle and Aspirin loaded micelles |
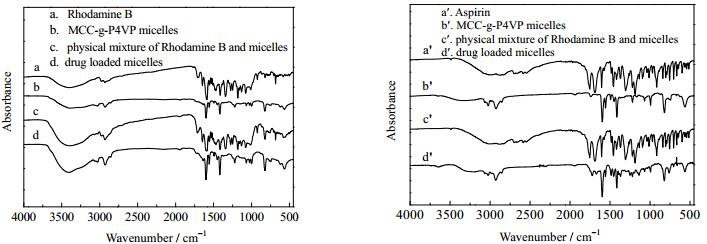
胶束载药前后的红外光谱图如图 7所示,从罗丹明B和MCC-g-P4VP的物理混合物图谱 (图 7c) 中可以看出,二者的特征峰只是简单的叠加关系[24], 主要表现为罗丹明B的红外光谱特征。对MCC-g-P4VP空白胶束 (图 7b) 和载药胶束谱图 (图 7d) 进行比较, 可看出载药胶束图谱峰形和MCC-g-P4VP的图谱峰形基本一致, 罗丹明B的红外光谱特征峰均明显减弱或消失, 说明罗丹明B分子在MCC-g-P4VP内部后,其分子振动受到限制而不能显现其原有的红外特性[25]。从以上的分析可得知,MCC-g-P4VP胶束已经将模型药物罗丹明B包覆。MCC-g-P4VP对模型药物阿司匹林包载前后的红外光谱图也出现了相似的结果。
|
图 7 聚合物胶束对罗丹明B和阿司匹林包载前后的红外光谱图 Fig.7 FT-IR spectra of polymeric micelles before and after Rhodamine B and Aspirin loading |
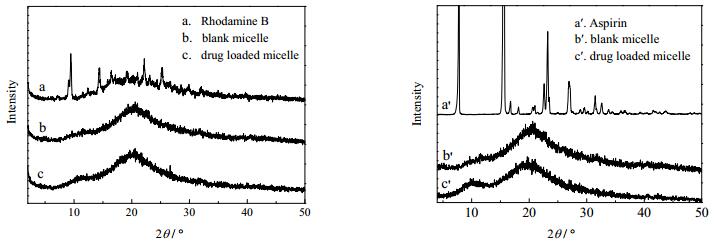
胶束载药前后的XRD表征结果如图 8所示,在罗丹明B和阿司匹林的XRD图谱中,2θ = 5~35°有一些十分典型的尖锐特征衍射峰;在MCC-g-P4VP的XRD图谱 (图 8b) 中,由于聚合物MCC-g-P4VP结晶性质较弱,因此在2θ = 5~35°处无特征衍射峰,出现了一个非晶态散射峰;在罗丹明B和阿司匹林载药胶束的XRD图谱中,由于药物被封装在非晶形的共聚物胶束中,在2θ = 5~35°的相应位置处的晶体衍射峰已经基本消失,这与Luo等人先前的研究结果相一致[26],其原因可能为结晶状的阿司匹林和罗丹明B被包覆在无定形态聚合物内后,失去了其有序的排列方式,以分子态或无定型态存在[27],这些都说明了纤维素聚合物胶束MCC-g-P4VP实现了对两种药物的包覆,得到了二者的载药胶束。
|
图 8 聚合物胶束对罗丹明B和阿司匹林包载前后的XRD比较 Fig.8 XRD patterns of polymeric micelles before and after Rhodamine B and Aspirin loading |
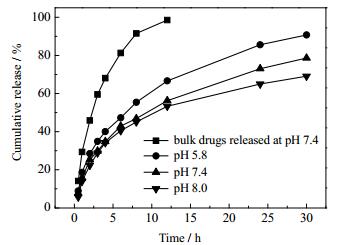
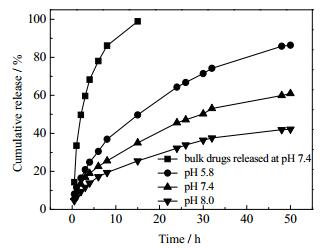
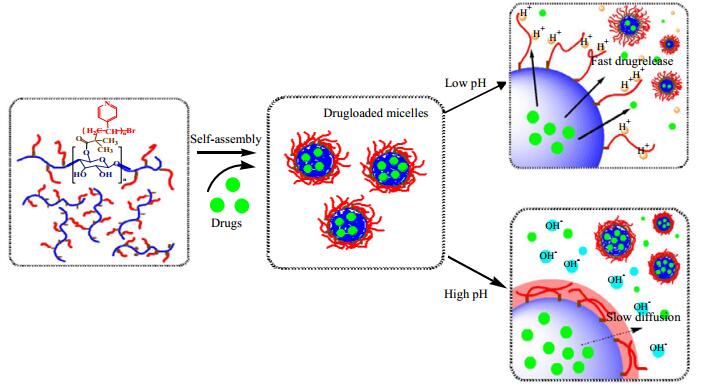
通过UV-Vis测试及公式 (1) 和公式 (2) 计算得出MCC-g-P4VP胶束对罗丹明B的载药率和包封率分别为17.04%和68.15%,对阿司匹林的载药率和包封率分别为20.41%和81.63%,聚合物胶束对两种药物具有良好的包覆效果。两种载药胶束在不同pH条件下对模型药物的释放结果如图 9和图 10所示,载药胶束具有良好的药物缓释性能且在酸性环境中的药物释放程度大于碱性环境,这是因为在酸性条件下,聚合物侧链4-乙烯基吡啶基团上的N原子发生质子化现象,使得侧链上带有许多H+,带电基团之间的静电排斥作用及胶束亲水性的增加导致胶束结构的溶胀甚至解离[28, 29],加快对药物的释放。这使得载药胶束能够在肿瘤组织处 (pH约为5.5) 达到对药物的快速释放。碱性条件下侧链去质子化,胶束形成紧密的球粒,对其内部的药物束缚较强,药物释放程度较酸性条件下小。从图中还可以看出,在pH为5.8的磷酸盐缓冲液中,亲水性的罗丹明B累积释放为90%的时间约为30 h,而疏水性的阿司匹林累积释放为90%的时间约为50 h,包载有亲水性药物的胶束药物释放速度较快,包载有疏水性药物的胶束在药物释放的过程中具有更加明显的pH响应性。图 11为载药胶束在不同pH条件下的药物释放示意图。
|
图 9 包载罗丹明B的胶束在不同pH条件下对药物的释放曲线 Fig.9 Drug release profiles of Rhodamine B loaded micelles at different pH conditions |
|
图 10 包载阿司匹林的胶束在不同pH条件下对药物的释放曲线 Fig.10 Drug release profiles of Aspirin loaded micelles at different pH conditions |
|
图 11 低pH值与高pH值条件下的药物释放机制 Fig.11 Schematic diagram of drug release under low and high pH |
表 1为在不同pH条件下亲水性模型药物罗丹明B释放曲线的动力学模型拟合结果,从表 1中可知,在不同pH条件下亲水性模型药物罗丹明B的释放过程与Ritger-Pappas方程有较好的拟合效果,n≤0.45,符合Fickian扩散,整个释放过程以扩散机制为主,载药胶束中亲水性的罗丹明B主要靠介质水溶液的渗透作用向介质进行扩散,这使得载药胶束在三种不同pH值条件下对药物的释放情况差别较小,药物释放速度较快,载药胶束表现出的pH敏感性较弱。
| 表 1 罗丹明B释放曲线动力模型拟合表 Table 1 Kinetic fitting results of Rhodamine B release |
表 2为疏水性模型药物阿司匹林释放曲线的动力学模型拟合情况,从表 2中可以看出载药胶束对阿司匹林的体外释放过程与Ritger-Pappas方程有较好的拟合效果,0.45 < n < 0.89,这表明载药胶束对阿司匹林释放为non-Fickian扩散,即释放过程为溶蚀机制和扩散机制的协同作用[30, 31],载药胶束在不同pH条件下对阿司匹林的释放表现出了明显的pH敏感性。
| 表 2 阿司匹林释放曲线动力模型拟合表 Table 2 Kinetic fitting results of Aspirin release |
从表 1和表 2中的拟合结果可知,两种载药胶束在酸性条件下的体外药物释放符合一级动力学释药模型,即药物自多孔聚合物基质溶出的机制[32]。这说明在酸性条件下胶束在质子化后,由于带电侧链在静电斥力的作用下,药物能够从胶束壳层的空隙向介质中释放。两种载药胶束在中性和碱性条件的药物释放与Ritger-Pappas方程有较好的拟合效果。
4 结论(1) 以离子液体氯化-1-烯丙基-3-甲基咪唑为反应介质,利用ATRP法在微晶纤维素上接枝了pH敏感性的P4VP,合成了具有pH敏感性的MCC-g-P4VP聚合物分子刷,聚合物侧链分子刷的分子量分布窄,大小均匀。
(2) 空白聚合物胶束的粒径为90 nm左右,载药后胶束粒径有所增大,呈现出内核-外壳结构,分散性较好。FT-IR和XRD的结果表明模型药物被包覆在聚合物胶束中,MCC-g-P4VP聚合物胶束具有良好的载药性能。
(3) 包载有亲水性药物与疏水性药物的两种载药胶束在不同pH条件下均表现出了一定的pH响应性,包载有疏水性药物阿司匹林的胶束在不同pH条件下对药物的释放表现出了更为明显的pH响应性。聚合物胶束在酸性条件下的体外药物释放符合一级动力学释药模型,在中性和碱性条件的药物释放符合Ritger-Pappas释药模型。
| [1] | REN Lian-zhen(任联振), REN Peng-gang(任鹏刚), ZHANG Xiao-liang(张晓亮). Preparation and mechanical properties of natural cellulose/PVA composite hydrogels(天然纤维素/PVA复合水凝胶的形成机理及力学性能研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(4): 1003-1009. |
| [2] | YE Dai-yong(叶代勇), HUANG Hong(黄洪), FU He-qing(傅和青), et al. Advances in cellulose chemistry(纤维素化学研究进展)[J]. Journal of Chemical Industry and Engineering(化工学报) , 2006, 57(8): 1782-1791. |
| [3] | YUAN Li (袁丽). Preparation of stimuli-responsive nanomaterials and their application in controlled drug delivery (刺激响应性纳米药物控释系统的制备及应用研究) [D]. Shanghai (上海): Fudan University (复旦大学), 2013. |
| [4] | YIN Chan(尹婵), WEI Xiao-yi(魏晓奕), LIJi-hua (李积华), et al. The research progress of cellulose modification technology(天然植物纤维素的改性技术及研究进展)[J]. Guangdong Chemical Industry(广东化工) , 2012, 39(15): 17-19. DOI:10.3969/j.issn.1007-1865.2012.15.010. |
| [5] | Kubisa P. Ionic liquids as solvents for polymerization processes-Progress andchallenges[J]. Progress in Polymer Science , 2009, 34(12): 1333-1347. DOI:10.1016/j.progpolymsci.2009.09.001. |
| [6] | HALIDAN Mai-maiti(哈丽丹·买买提), KAIBINUER Ai-erken(开比努尔·艾尔肯), MINAWAER Wu-maier(米娜瓦尔·乌买尔). Preparation of cellulose graft poly (butyl methacrylate) copolymers byhomogeneous ATRP(ATRP法均相制备纤维素/甲基丙烯酸丁酯接枝聚合物)[J]. Journal of Chemical Industry and Engineering(化工学报) , 2014, 65(3): 1111-1117. |
| [7] | ZHANG Jia-hong(张家宏), LIU Xiao-ning(刘晓宁), ZHONG Yu(仲玉), et al. The boron absorption performance of tentacular hydrophilic hydroxylamine resin prepared via atom transfer radical polymerization(基于ATRP法制备的触角状亲水性羟胺树脂的吸硼性能的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28(6): 1328-1333. |
| [8] | Zampano G, Bertoldo M, Bronco S. Poly (ethyl acrylate) surface-initiated ATRP grafting from wood pulp cellulouse fibers[J]. Carbohydrate Polymers , 2009, 75(1): 22-31. DOI:10.1016/j.carbpol.2008.06.005. |
| [9] | Tang E J, Du K D, Feng X Y, et al. Controlled synthesis of cellulose-graft-poly[2-(diethylamino)-ethyl methacrylate] by ATRP in ionic liquid[AMIM]Cl and its pH-responsive propert[J]. European Polymer Journal , 2015, 66(2): 228-235. |
| [10] | ZHONG Li-li(钟黎黎), GAO Yuan(高源), ZHANG Li-ping(张力平). Synthesis of cellulose-g-PMMA and its micelles using as drug carriers(cellulose-g-PMMA的合成及其胶束作为药物载体的研究)[J]. Chemistry and Industry of Forest Products(林产化学与工业) , 2015, 35(1): 23-29. |
| [11] | Astafieva I, Zhong X F, Eisenberg A. Criticalmicellization phenomenainblockpolyelectrolyte solutions[J]. Macromolecules , 1993, 26(26): 7339-7352. DOI:10.1021/ma00078a034. |
| [12] | LuoY L, Yang X L, Xu F, et al. pH-triggered PMAA-b-HTPB-b-PMAA copolymer micelles:physicochemical characterization and camptothec in release[J]. Colloid and Polymer Science , 2014, 292(5): 1061-1072. DOI:10.1007/s00396-013-3149-9. |
| [13] | ZHANG Xiao-jun(张晓君), LIU Hui(刘辉), HU Hai-yang(胡海洋), et al. Preparation and in vitro evaluation of paclitaxel-loaded copolymeric micelles(聚合物胶束作为药物传递系统的研究进展)[J]. Journal of Shenyang Pharmaceutical University(沈阳药科大学学报) , 2014, 31(8): 589-590. |
| [14] | LIU Zhen-zhen (刘真真). Synthesis and pH-sensitive behavior of amphiphilic block copolymers (两亲性嵌段共聚物的合成及其敏感行为研究) [D]. Hefei (合肥): Anhui University (安徽大学), 2013. |
| [15] | Wang D Q, Tan J J, Kang H L, et al. Synthesis, self-assembly and drug release behaviors of pH-responsive copolymers ethyl cellulose-graft-PDEAEMA through ATRP[J]. Carbohydrate Polymers , 2011, 84(1): 195-202. DOI:10.1016/j.carbpol.2010.11.023. |
| [16] | SONG Juan(宋娟), CHENG Jing(程晶), CHEN Shi-xiong(陈世雄), et al. Synthesis and release property of modified cellulose microspheres(改性纤维素微球的制备及其药物缓释性能研究)[J]. Chemical Reagents(化学试剂) , 2014, 36(8): 678-682+746. |
| [17] | LUO Yang-lin, Yu Wei, Xu Feng. pH-responsive PMAA-b-PEG-b-PMAA triblock copolymer micelles for prednisone drug release and release kinetics[J]. Polymer bulletin , 2012, 69(5): 597-620. DOI:10.1007/s00289-012-0774-2. |
| [18] | HAN Xue(韩雪), CAO JIANG yong-quan(曹蒋永荃), ZHOU Jiang-ling(周江玲), et al. A pH-responsive dual-drug delivery system based on chitosan(基于壳聚糖的pH响应双重药物释放系统研究)[J]. Acta Polymerica Sinica(高分子学报) , 2015(12): 1471-1476. DOI:10.11777/j.issn1000-3304.2015.15127. |
| [19] | LI Wen-jian(黎文建), PENG Hai-long(彭海龙), XIONG Hua(熊华), et al. pH-responsive amphiphilic chitosan derivative-based nanomicelles:Preparation, characterization and in vitro release of Vitamin D3(pH响应两亲性壳聚糖衍生物纳米胶束制备、表征及对维生素D3的体外释放研究)[J]. Science and Technology of Food Industry(食品工业科技) , 2014, 35(10): 125-128. |
| [20] | ZHANG Xiao-tong(张晓彤), LIANG Jun-hu(梁俊虎), REN Chuang(任创), et al. Release kinetic model studies of functionalized mesoporous materials SBA-15 as aspirin carriers(功能化SBA-15在药物阿司匹林缓释的动力学模型)[J]. Journal of Petrochemical Universities(石油化工高等学校学报) , 2012, 25(2): 1-4. |
| [21] | Siepmann J, Peppas N A. Modeling of drug release from delivery systems base on hydroxypropyl methylcellulose (HPMC)[J]. Advanced Drug Delivery Reviews , 2001, 48(2): 139-157. |
| [22] | JIANG Xue-hua(蒋学华). Introduction to the method of drug evaluation(药物评价方法概论)[M].Chengdu(成都): Sichuan University Press(四川大学出版社), 2005: 73-81. |
| [23] | TENG Shuang(滕双), WANG Yan-ping(王艳萍), HAO Hong(郝红), et al. Preparation and properties of polylactide-poly (ethylene glycol) block copolymer micelles(聚乳酸-聚乙二醇嵌段共聚物胶束的制备及性能研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2016, 30(4): 971-977. |
| [24] | TAN Qing-hua(谭清华), YANG Jiang-jing(杨江静), TANG Yan-hui(唐艳辉), et al. Preparation and characterization of inclusion complex arteannuin with β-cyclodextrin(青蒿素-β-环糊精包合物的制备及表征)[J]. Journal of Jishou University(吉首大学学报) , 2013, 34(4): 72-76. |
| [25] | ZHANG Bin(张斌), QING Lin(秦岭), ZHANG Ling-ling(张玲玲), et al. Preparation and characterization of inclusion complex ofβ-cyclodextrin and its derivative withchlorpyrifos(环糊精及其衍生物与毒死蜱包合物的制备及表征)[J]. Chinese Journal ofPesticide Science(农药学学报) , 2010, 12(2): 127-134. |
| [26] | LUO Ying(罗颖), LI Le(李乐), WANG Yan-ge(王衍戈), et al. Preparation and characteristic of hydroxycamptothecin-loaded PLA nanoparticles using dialysis method(透析法制备载羟基喜树碱-聚乳酸纳米粒及其理化性质研究)[J]. Journal of Xiamen University(厦门大学学报) , 2010, 49(6): 832-837. |
| [27] | Swaminathan S, Pastero L, Serpe L, et al. Cyclodextrin-based nanosponges encapsulating camptothecin:physicochemical characterization, stability and cytotoxicity[J]. European Journal of Pharmaceutics and Biopharmaceutics , 2010, 74(2): 193-201. DOI:10.1016/j.ejpb.2009.11.003. |
| [28] | YANG You-qiang (杨友强). Preparation and structure-performance relationship of pH-sensitive polymers and their self-assembled micelle drug delivery system (pH响应聚合物及其胶束给药系统:制备和结构性能关系) [D]. Guangzhou (广州): South China University of Technology (华南理工大学), 2012. |
| [29] | Nazar M, Ayub R G, Naseem S, et al. Preparation and characterization of hybrid pH-sensitive hydrogels of chitosan-co-acrylic acid for controlled release of verapamil[J]. Journal of Materials Science Materials in Medicine , 2010, 21(10): 2805-2816. DOI:10.1007/s10856-010-4134-1. |
| [30] | WANG Yi-hang(王一行), ZHAO Xia(赵峡), WU Jian(吴健), et al. Preparation of propylene glycol alginate sodium sulfate sustained-release tablets and evaluation of its drug release in vitro(藻酸双酯钠缓释片的制备及体外释放特性研究)[J]. Chinese Journal of Marine Drugs(中国海洋药物) , 2014, 33(6): 59-64. |
| [31] | WANG Rui (王蕊). Preparation of chitosan-palygorskite-polyvinyl alcohol ternary complex film and its sustained release behaviors to ivermectin (壳聚糖-坡缕石-聚乙烯醇三元复合膜的制备及其对伊维菌素的缓释行为) [D]. Lanzhou (兰州): Northwest Normal University (西北师范大学), 2013. |
| [32] | ZHOU Xue(周雪), XUE Yu-chen(薛雨晨), HE Zhi-yong(贺智勇), et al. Study on the preparation and in vitro release characterization of aspirin PEG-PLGA sustained-release microspheres(阿司匹林PEG-PLGA缓释微球的制备以及体外释药的考察)[J]. Chinese Journal of Hospital Pharmacy(中国医院药学杂志) , 2014, 34(22): 1889-1893. |




