2. 大理大学 药学与化学学院,云南 大理 671000
2. College of Pharmacy and Chemistry, Dali University, Dali 671000, China
美洲大蠊(periplaneta americana, PA)属昆虫纲,蜚蠊目,蜚蠊科,是地球上起源最早、生命力最顽强的昆虫类群之一[1]。作为一种应用较为广泛的昆虫药物[2],美洲大蠊提取物中含有海藻糖、肌醇、苯丙氨酸、天冬酰胺等多种糖蛋白和氨基酸,具有增强机体免疫力、保护肝脏、促进组织修复和广泛的抗肿瘤等作用[3]。自20世纪80年代以来,相继研发并且在国内获批上市的美洲大蠊制剂有康复新液、肝龙胶囊、心脉隆等,其中康复新液在应用于皮肤创伤修复时具有很好的促进创口愈合作用,并能降低伤口感染[4]。然而,同其它几种已经开发的用于提高创伤修复效果的药物,比如透明质酸[5]、芦荟胶[6]、积雪草苷[7]一样,美洲大蠊提取物的主要活性物质多为易溶于水的极性大分子,不易透过皮肤表皮层到达病变部位,其药效及应用在一定程度受到了限制。
脂质体(liposome, LIP)作为一种药物载体,是一种具有双分子层结构,与人体细胞膜相似的人工生物膜[8],其与皮肤角质层具有相似的结构和很好的生物相容性,其包裹药物时能够更好地透过表层皮肤,并储存在表皮与真皮之间,形成药物储库,达到持续释药、提高治疗效果的目的[9]。脂质材料在生物体内可降解,对人体无毒无刺激[10],但由于其具有流动性,贴合性差,易造成药物流失,把脂质体制成凝胶制剂时,更易于涂布于皮肤上。本研究采用乙醇注入法制备柔性脂质体,将磷脂、胆固醇、柔性剂等膜材溶于乙醇中,水溶性药物溶于水相中,将有机相注入水相中一步形成脂质体[11]。
本文针对皮肤创伤修复制剂难以有效透过皮肤这一问题,将美洲大蠊提取物制备成柔性脂质体凝胶,并对该柔性脂质体凝胶的性能进行表征,为美洲大蠊提取物高性能皮肤透过制剂的开发提供基础。
2 实验 2.1 实验原料和仪器 2.1.1 实验原料美洲大蠊提取物(云南大理大学提供,总氨基酸成分含量约为60%);超纯水(超纯水系统制得,RO-DI);胆固醇(阿拉丁,分析纯);吐温-20(源叶,生物级);高纯蛋黄卵磷脂(日本丘比株式会社,PC≥90%);无水乙醇(北京化工厂,分析纯);1, 2-丙二醇(Amethyst,≥99.8%),卡波姆-940(Macklin,EP)。
2.1.2 实验仪器电子分析天平(XA105DU,瑞士Mettler Toledo集团);纳米粒径电位分析仪(Nano-ZS90,英国Malvern仪器有限公司);实验室纯水系统(Smart-S30,上海和泰仪器有限公司);扫描电子显微镜(JSM-7800F,日本Jeol公司);透射电镜(HT7800,日本Hitachi);高效液相色谱(Waters 2695,美国Waters公司);电热恒温水浴锅(HH-1,北京科伟永兴有限公司)。
2.2 实验方法 2.2.1 PAE标准曲线的绘制PAE标准溶液的配制:精密称取PAE 0.050 0 g于50 mL的容量瓶内,用超纯水定容,作为储备液。用移液枪分别精密汲取适量储备液,用超纯水稀释,得到质量浓度为10、20、50、100、200、300、400、500、600、800 μg·mL-1的PAE标准溶液。在波长282 nm处,对10个标准溶液进行高效液相色谱分析,得到出峰位置的峰面积,并以浓度为横坐标,峰面积为纵坐标进行回归分析,计算得到标准曲线:y = 4 077.9x + 7 760.7,R2 = 0.999 9,表明在10~800 μg·mL-1 PAE浓度与峰面积之间有良好的线性关系。
2.2.2 PAE-ULIP的制备采用乙醇注入法制备PAE-ULIP,准确称取适量的高纯蛋黄卵磷脂和胆固醇、吐温-20于烧杯中,并加入适量无水乙醇使其充分溶解作为有机相;准确称取适量PAE于烧杯中,加入一定量的纯水使其溶解,溶解后全部转入锥形瓶;将锥形瓶置于恒温磁力搅拌水浴锅中,维持温度并搅拌,然后将有机相缓慢注入锥形瓶中即得到PAE-ULIP。通过水浴超声对脂质体进行分散匀化,乙醇的去除可以通过减压蒸发的方式[12],脂质体溶液于4 ℃冰箱冷藏保存。
2.2.3 包封率的测定精密称取0.1 mL的脂质体混悬液于10 mL离心管中,加入0.3 mL鱼精蛋白(10 mg·mL-1)搅匀[13]。静置3 min,加入5.0 mL生理盐水,3 500 r·min-1离心20 min,吸取上清液,高效液相色谱测定,计算药物游离量;另称取0.1 mL脂质体混悬液于10 mL离心管中,加入5.0 mL乙醇破乳,高效液相色谱测定,计算药物总量。脂质体的包封率EE计算如下式:
EE=(总药量-介质中未包入的药量)/总药量×100%
2.2.4 凝胶的制备凝胶的制备主要包括PAE-ULIP凝胶的制备与PAE凝胶的制备。
PAE-ULIP为混悬液,用于皮肤给药时存在诸多不便,而凝胶基质可以较好地施敷[14-15]。称取1.2 g的1, 2-丙二醇与10 mL去离子水混合均匀,制成混合液;同时称取0.8 g卡波姆-940置于混合液中,充分溶胀后得到凝胶基质。取15 mL PAE-ULIP混悬液与凝胶基质混合搅拌均匀,得到PAE-ULIP凝胶。
称取PAE 300 mg溶解于15 mL纯水中,同时取凝胶基质10 mL,将二者充分混合均匀,即得到PAE凝胶。
2.2.5 体外释药与透皮实验将制备的PAE-ULIP凝胶、PAE-LIP凝胶、PAE凝胶采用透析袋法分析比较这3种凝胶的体外释放度。接受介质为pH=7.4的PBS缓冲溶液,调节至适宜的电磁搅拌速度,保证释放介质与透析袋流动接触,测量0、0.5、1、2、4、6、8、12、24、36 h的释药量,每次取样后补充相同体积的新鲜释放介质,使用HPLC测量PAE活性物质的含量。
皮肤是药物经皮给药的吸收途径,同时也是药物进行渗透传递的主要生理屏障[16]。PAE中含有大量的生物大分子,不易通过角质层到达活性表皮层[17]。通过制备柔性脂质体凝胶包载PAE时,能够使其较好地进入皮肤组织发挥药效。以PAE凝胶为对照,PAE-ULIP凝胶为实验组,采用人工皮肤膜Strat-M进行体外透皮研究,考察PAE-ULIP凝胶的体外透皮性能。
Strat-M膜是扩散透皮测试专用人工生物膜,高分子量药物通过Strat-M的渗透与人体皮肤非常相似,专用于各种医学实验,皮肤专用[18-19]。
将裁剪合适的人工膜固定在透皮实验装置的扩散池和接收池之间。接收池(15 mL,d=15 mm)中加入含0.1%吐温-80的磷酸盐缓冲液(PBS,pH=7.4),设定温度为37 ℃、转速为300 r·min-1。实验组在扩散池中加入0.5 g柔性脂质体凝胶,分别于0.5、1、2、4、6、8、12、24 h取样0.5 mL,每次取样后补充0.5 mL新鲜的释放介质。HPLC测定样品中PAE浓度,计算单位面积累积释放量;对照组以同样方法进行。累计释放量计算如下式:
| ${Q_n} = \frac{{\sum\limits_{i = 1}^n {{\rho _i}{V_i} + {\rho _n}V} }}{A}$ |
式中:Qn为药物的累积释放量,V为接收室总体积(15 mL),ρn为第n次取样时接收液中药物的质量浓度,ρi为第n次取样前所检测到药物的质量浓度,Vi为取样量体积(0.5 mL),A为有效扩散面积(1.77 cm2)。
2.2.6 抗炎性能采用酶联免疫吸附法检测PAE-ULIP凝胶的抗炎性能。脂多糖(LPS)能够刺激RAW264.7细胞产生炎症反应,释放炎症因子,通过测量细胞培养液中炎症因子TNF-α的浓度间接表征药物的抗炎性能。
测定原理:采用抗原与抗体的特异反应将待测物与酶连接,再利用酶与底物产生的颜色反应,在450 nm最大吸收波长处测定有色产物的吸光值,吸光值大小与待测物浓度成正比,可用于定量测定RAW264.7细胞中TNF-α等细胞因子浓度,进而直接反映炎症发生的程度,并由此推断药物抗炎性能。
3 结果与分析 3.1 正交试验极差分析法优选配方根据相关文献[20-23]中制备过程因素对性能的影响,主要考察的因素有5个,分别是:温度θ(A)、搅拌转速N(B)、有机相与水相的比例Qa:Qw(C)、卵磷脂与胆固醇的比例ρ(EPC): ρ(CHO)(D)、卵磷脂的质量浓度ρ(EPC)(E);每个因素选取4个水平,以包封率EE为考察指标对正交方案进行极差分析,并最终得出最优方案。设计L16(45)的正交试验因素与水平表 1。
|
|
表 1 正交试验因素与水平表 Table 1 Factors and levels for orthogonal tests |
正交试验结果如表 2所示,其中Mij(i=1, 2, 3, 4;j=1, 2, 3, 4, 5)为j列不同水平i所对应的EE之和,根据极差Rj大小可以排列出因素的主次顺序,EE影响的主次顺序为:C>E>B>D>A。由Rj的大小可以看出,因素Qa:Qw极差最大,也就是说其对EE的影响也最大,故在制备过程中要控制好因素Qa:Qw;而卵磷脂浓度、转速、ρ(EPC): ρ(CHO) 3者对EE的影响相近,其中又以卵磷脂浓度影响最大,故制备过程中也应控制好卵磷脂浓度;温度对EE的影响最小。所以PAE-LIP制备较好的因素水平搭配是A3B3C1D3E4。具体就是温度为40 ℃,转速为750 r·min-1,Qa:Qw=1:1,ρ(EPC): ρ(CHO) = 7.5:1,ρ(EPC) = 20 mg·mL-1。
|
|
表 2 正交试验结果 Table 2 Results of the orthogonal test |
通过正交试验的极差分析,提升有机相中卵磷脂的浓度最有可能提高脂质体的EE(24.6%),因此保持其他条件不变(温度:40 ℃,转速:750 r·min-1,Qa:Qw=1:1,ρ(EPC): ρ(CHO) = 7.5:1),设置卵磷脂的质量浓度分别为20、30、45、60、90、120、150 mg·mL-1,进行实验,得到一个较高EE(41.6%)下卵磷脂的质量浓度为45 mg·mL-1。对吐温20的最佳用量进行探究,以EE为考察指标,设计不同浓度梯度的吐温20用量的实验组,分别为(卵磷脂:表面活性剂) 6:1、8:1、10:1、12:1、15:1。实验结果如表 3所示,当质量比m(EPC): m(表面活性剂)=10:1时,EE最高,为46.2%。对于乙醇注入法,如果包封材料溶于水相,EE通常比较低[24],本研究针对乙醇注入法,通过优化实验方案,得到的EE处于较高水平。
|
|
表 3 不同吐温20的用量对包封率的影响 Table 3 Effects of Tween-20 ratios on encapsulation efficiency |
电镜下观察PAE-ULIP混悬液的样品,如图 1(a)、(b)所示,其分散良好,呈球形,结构完整;该脂质体具有明显的磷脂双分子层结构,如图 1(c)所示,为7~10 nm,与文献[25]报道所测结果(~10 nm)一致。使用纳米粒径电位分析仪对PAE-ULIP的粒径分布进行测量,平均粒径为458.7 nm,PDI为0.149,粒径分布较为均匀。

|
图 1 脂质体的电镜形貌 Fig.1 Electron micrographs of liposomes |
体外释药结果如图 2所示,PAE-ULIP凝胶、PAE凝胶、PAE-LIP凝胶3者均在24 h达到释放平衡,其累计释放率分别为61.8%、60.4%、52.1%,3者均具有一定的缓释效果;在总体释放特性上,PAE-ULIP凝胶与PAE凝胶相似,PAE-LIP凝胶在整个释药过程内其释药量始终低于另外2者;柔性脂质体相比普通脂质体有一个更好的磷脂膜变形能力,更容易透过透析袋,导致PAE-ULIP凝胶0~2 h释药速率快于PAE-LIP凝胶,其累计释放率分别为22.1%、17.5%,有相对优异的初始释放速率;2 h后PAE-ULIP凝胶释放减缓,表现出更持久的缓释效果。
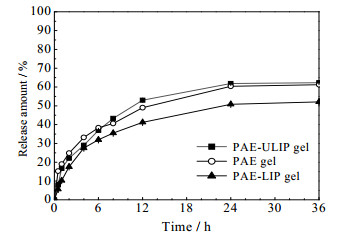
|
图 2 PAE凝胶、PAE-LIP凝胶与PAE-ULIP凝胶体外释放曲线(0~36 h) Fig.2 In vitro release curves of PAE gel, PAE-LIP gel and PAE-ULIP gel(0~36 h) |
PAE-LIP凝胶、PAE-ULIP凝胶与PAE凝胶单位面积累积释放量随时间变化曲线如图 3所示。其中所制备的PAE-ULIP凝胶表面光泽、细腻,放置48 h无分层,其黏度为46.7 Pa·s,pH为6.5,根据《中华人民共和国药典》2015版(第4部)及相关文献[26-27],黏度与pH均在优良范围内;可以看到,PAE凝胶几乎很难透过Strat-M膜,而PAE-ULIP凝胶能够较好地透过Strat-M膜,且PAE-ULIP凝胶的透过性优于PAE-LIP凝胶。24 h的PAE-ULIP凝胶的单位面积累积释放量为(690±38) μg·cm-2,PAE-LIP凝胶的单位面积累积释放量为(550±36) μg·cm-2,PAE凝胶几乎不能透过Strat-M膜。表明柔性脂质体凝胶包载PAE时,能够在一定程度上增强药物的皮肤透过性能。
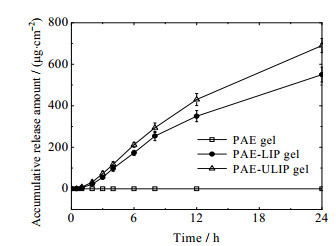
|
图 3 PAE-LIP凝胶、PAE-ULIP凝胶与PAE凝胶Strat-M膜透过实验结果 Fig.3 The Strat-M permeation results of PAE-LIP gel, PAE-ULIP gel and PAE gel |
对PAE-ULIP凝胶进行抗炎性能表征,并将结果同PAE药液的抗炎性能进行比较,所得结果如表 4所示。未加药物时,细胞上清液中的TNF-α浓度为1 181.6 ng·mL-1,分别加入2种剂型的药物后,细胞上清液中TNF-α的浓度分别为667.7和862.6 ng·mL-1,炎症因子的释放均得到了抑制;加入LPS刺激后,细胞上清液中的TNF-α浓度为1 529.3 ng·mL-1,分别加入2种剂型的药物后,细胞上清液中TNF-α的浓度分别为1 153.6和1 095.9 ng·mL-1,炎症因子的释放也得到了抑制。说明本研究中的PAE-ULIP凝胶剂型对PAE的有效成分的抗炎活性没有明显影响,同样具有抗炎活性。
|
|
表 4 PAE对LPS刺激和未刺激RAW264.7细胞释放细胞因子TNF-α的影响 Table 4 Effects of PAE on the release of cytokine TNF-α from LPS-stimulated and unstimulated RAW264.7 cells |
(1) 通过乙醇注入法,以包封率为考察指标设计正交试验,最终得到制备PAE-ULIP凝胶的优选配方;所制备的PAE-ULIP包封率为46.2%,平均粒径为458.7 nm。
(2) 对于本研究的生物大分子药物体系,通过Strat-M的渗透与人体皮肤是十分相似。0~24 h的实验结果表明PAE凝胶几乎不能透过该生物膜,但PAE-ULIP凝胶单位面积累积透过量达690 μg·cm-2,有较好的皮肤透过性能;
(3) 抗炎性能实验表明,PAE-ULIP凝胶与PAE药液抗炎效果基本一致。
| [1] |
司金光, 张涛, 李凌宇, 等. 美洲大蠊的化学成分研究[J]. 中国药学杂志, 2018, 53(3): 178-181. SI J G, ZHANG T, LI L Y, et al. Chemical constituents from periplaneta americana[J]. Chinese Pharmaceutical Journal, 2018, 53(3): 178-181. |
| [2] |
胡艳芬, 吕小满, 王玉梅, 等. 美洲大蠊药用价值研究进展[J]. 医学综述, 2008, 14(18): 2822-2824. HU Y F, LYU X M, WANG Y M, et al. Research advance in medicinal value of periplaneta americana[J]. Medical Recapitulate, 2008, 14(18): 2822-2824. |
| [3] |
何正春, 彭芳, 宋丽艳, 等. 美洲大蠊化学成分及药理作用研究进展[J]. 中国中药杂志, 2007, 32(21): 2326-2331. HE Z C, PENG F, SONG L Y, et al. Review on investigations related to chemical constituents and biological activities of periplaneta americana[J]. China Journal of Chinese Materia Medica, 2007, 32(21): 2326-2331. |
| [4] |
高洁, 朱娟娟, 刘瑾华, 等. 美洲大蠊提取物促组织修复作用机制研究进展[J]. 四川动物, 2019, 38(2): 121-126. GAO J, ZHU J J, LIU J H, et al. Research progress on the tissue repair mechanism of periplaneta americana extract[J]. Sichuan Journal of Zoology, 2019, 38(2): 121-126. |
| [5] |
金艳, 李大伟, 祝美华, 等. 透明质酸在皮肤创伤修复中的应用[J]. 食品与药品, 2014, 16(5): 373-376. JIN Y, LI D W, ZHU M H, et al. Application of hyaluronic acid in wound repair of skin[J]. Food and Drug, 2014, 16(5): 373-376. |
| [6] |
袁慧杰, 廖紫琼, 欧阳道福, 等. 芦荟胶外涂对大鼠背部创面愈合和疤痕形成的影响[J]. 中国现代应用药学, 2018, 35(1): 53-56. YUAN H J, LIAO Z Q, OUYANG D F, et al. Effect of aloe vera gel on wound healing and scar formation in back of rats[J]. Chinese Journal of Modern Applied Pharmacy, 2018, 35(1): 53-56. |
| [7] |
刘志锋, 赵慧男, 聂绍良. 积雪草苷药理作用及其机制的研究进展[J]. 广东医学, 2009, 30(4): 649-651. LIU Z F, ZHAO H N, NIE S L. Progress of study on pharmaceutical activities and mechanisms of asiaticoside[J]. Guangdong Medical Journal, 2009, 30(4): 649-651. |
| [8] |
MASHAGHI S, JADIDI T, KOENDERINK G, et al. Lipid nanotechnology[J]. International Journal of Molecular Sciences, 2013, 14(2): 4242-4282. DOI:10.3390/ijms14024242 |
| [9] |
HONEYWELL-NGUYEN P L, BOUWSTRA J A. Vesicles as a tool for transdermal and dermal delivery[J]. Drug Discovery Today: Technologies, 2005, 2(1): 67-74. |
| [10] |
SCHMID M H, KORTING H C. Therapeutic progress with topical liposome drugs for skin disease[J]. Advanced Drug Delivery Reviews, 1996, 18(3): 335-342. DOI:10.1016/0169-409X(95)00019-4 |
| [11] |
CORTESI R, ESPOSITO E, GAMBARIN S, et al. Preparation of liposomes by reverse-phase evaporation using alternative organic solvents[J]. Journal of Microencapsulation, 1999, 16(2): 251-256. DOI:10.1080/026520499289220 |
| [12] |
FAN M, XU S, XIA S, et al. Preparation of salidroside nano-liposomes by ethanol injection method and in vitro release study[J]. European Food Research & Technology, 2008, 227(1): 167-174. |
| [13] |
孙维彤, 黄桂华, 叶杰胜, 等. 鱼精蛋白凝聚法测定脂质体和纳米脂质体包封率[J]. 中国药学杂志, 2006, 41(22): 1716-1720. SUN W T, HUANG G H, YE J S, et al. Determination of encapsulation efficiencies of liposomes and nanoliposomes by protamine aggregation method[J]. Chinese Pharmaceutical Journal, 2006, 41(22): 1716-1720. |
| [14] |
齐宪荣, 刘明辉, 张克斌, 等. 硝酸益康唑脂质体凝胶的释放和经皮渗透性研究[J]. 中国新药杂志, 2001, 10(7): 507-510. QI X R, LIU M H, ZHANG K B, et al. The release and percutaneous permeation of econazole nitrate in liposome gel[J]. Chinese New Drugs Journal, 2001, 10(7): 507-510. |
| [15] |
刘敏敏, 李锂, 马小来. 积雪草苷柔性纳米脂质体凝胶剂的研制及体外评价[J]. 中国医药工业杂志, 2013, 44(11): 1120-1122. LIU M M, LI L, MA X L. Preparation and in vitro evaluation of asiaticoside ultrafl exible liposomal gel[J]. Chinese Journal of Pharmaceuticals, 2013, 44(11): 1120-1122. |
| [16] |
CHIARA S, ANNA MARIA F. Vesicular carriers for dermal drug delivery[J]. Expert Opinion on Drug Delivery, 2009, 6(8): 813-825. DOI:10.1517/17425240903071029 |
| [17] |
徐莲英, 蔡贞贞, 张彤. 中药透皮特性研究的思路与方法[J]. 中医外治杂志, 2005, 14(1): 6-7. XU L Y, CAI Z Z, ZHANG T. Thought and method of study on transdermal characteristics of traditional Chinese Medicine[J]. Journal of External Therapy of Traditional Chinese Medicine, 2005, 14(1): 6-7. |
| [18] |
TAKASHI U, KADHUM W R, SAYUMI K, et al. Prediction of skin permeation by chemical compounds using the artificial membrane, Strat-MTM[J]. European Journal of Pharmaceutical Sciences, 2015, 67C: 113-118. |
| [19] |
HAQ A, GOODYEAR B, AMEEN D, et al. Strat-M® synthetic membrane: Permeability comparison to human cadaver skin[J]. International Journal of Pharmaceutics, 2018, 547(1/2): 432-437. |
| [20] |
郭海燕, 莫穗林. 脂质体物理稳定性和包封率的影响因素[J]. 中国新药杂志, 2004, 13(6): 498-501. GUO H Y, MO S L. Factors affecting physical stability and envelope rate of liposomes[J]. Chinese New Drugs Journal, 2004, 13(6): 498-501. |
| [21] |
张晓丽, 吴品昌, 刘宇, 等. 乙醇注入法制备莪术醇脂质体[J]. 中国实验方剂学杂志, 2012, 18(4): 10-12. ZHANG X L, WU P C, LIU Y, et al. Preparation technology of curcumol liposome by ethanol injection method[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(4): 10-12. |
| [22] |
欧春凤, 梁艳兰, 沈生文, 等. 乙醇注入法制备姜黄素脂质体工艺研究[J]. 南方农业学报, 2011, 42(10): 1259-1262. OU C F, LIANG Y L, SHEN S W, et al. Preparation of liposomal in curcumin using ethanol injection method[J]. Journal of Southern Agriculture, 2011, 42(10): 1259-1262. |
| [23] |
徐东伟, 刘同祥. 乙醇注入法制备柚皮素脂质体及其质量评价[J]. 中南药学, 2015, 13(12): 1266-1269. XU D W, LIU T X. Preparation and quality evaluation of naringenin liposomes by ethanol injection method[J]. Central South Pharmacy, 2015, 13(12): 1266-1269. |
| [24] |
孙维彤. 抗肿瘤药物脂质体研究[M]. 北京: 化学工业出版社, 2015. SUN W T. Studies on liposomes as anti-tumor agent[M]. Beijing: Chemical Industry Press, 2015. |
| [25] |
BALBINO T A, AOKI N T, GASPERINI A A M, et al. Continuous flow production of cationic liposomes at high lipid concentration in microfluidic devices for gene delivery applications[J]. Chemical Engineering Journal, 2013, 226(12): 423-433. |
| [26] |
杨媛媛, 姜旭, 王宇卿. 正交试验优化复方粉背雷公藤凝胶剂处方[J]. 中国药房, 2017, 28(7): 961-963. YANG Y Y, JIANG X, WANG Y Q. Formulation optimization of compound tripterygium hypoglaucum gel by orthogonal test[J]. China Pharmacy, 2017, 28(7): 961-963. |
| [27] |
马鑫斌, 王利胜, 巴文强. 雷公藤凝胶剂的制备工艺研究[J]. 中国药物经济学, 2016, 11(11): 26-30. MA X B, WANG L S, BA W Q. Study on preparation of tripterygium wilfordii gels[J]. China Journal of Pharmaceutical Economics, 2016, 11(11): 26-30. |




