2. 福建省船舶与海洋工程重点实验室, 福建 厦门 361021
2. Provincial Key Laboratory of Naval Architecture & Ocean Engineering, Xiamen 361021, China
高效的储氢技术是氢能运用中的关键环节之一。近期的研究表明,金属有机框架物(metal-organic frameworks,MOFs)由于具有较大的比表面积和容易调控的孔结构,并可通过调整合成方法改变表面特性来增强氢分子与配体之间的相互作用,在储氢领域展现了良好的应用前景[1-3]。然而,当前的研究也表明,MOFs中仍存在对氢吸附作用弱的中孔和大孔,同时还需提高试样的结构强度和遇水稳定性,且由于氢在MOFs上主要发生物理吸附,只有降低到诸如液氮的低温时才发生显著吸附[4-7]。
在Rowsell等[8]提出向MOFs注入形核或通过结构穿插来调节MOFs孔结构的思路后,由于兼具提高试样的储氢容量和结构强度并具有导热各向异性的特点,以活性炭、碳纳米材料和石墨烯等碳基材料穿插MOFs的研究受到重视[9-10]。Rallapalli等[11]以微孔活性炭(activated carbon,AC)穿插MIL-101(Cr)后,在77 K、6 MPa时,氢在试样上的最大吸附量提高了58.8%。Prabhakaran等[12]将担载了纳米铝颗粒的活性炭对MIL-101(Cr)穿插,试样在298 K、100 kPa时氢的最大吸附量增大3倍,试样的结构稳定性也同时得到提高。Prasanth等[13]以担载Li+的活性炭NORIT-RB3对MIL-101(Cr) 穿插后,在77 K、107 Pa时氢在试样上的吸附量从72.5增大到143.9 mg⋅g−1。Petit等[14]以质量分数为5%~46% 的氧化石墨烯(graphene oxide,GO)和MOF-199混合后发现,制备试样与原MOF-199的孔隙率相近,但由于比微孔容积的增大提高了氢吸附量。Kumar等[15]以石墨烯穿插MOFs后发现,以质量分数为5% 的添加比率穿插制备的M/DOBDC试样的比表面积增加了200~300 m2⋅g−1,氢在77 K、0.1 MPa下的质量储氢密度也从质量分数为1.6% 提高到1.9%。与此同时,考虑到吸附平衡模型在系统设计、数学建模与数值模拟中的重要性,氢在MOFs上吸附平衡的研究受到关注,且由于发生在超临界温度区域的氢以微孔内、单分子层吸附为特征,基于势能理论的杜比宁-亚斯塔夫(Dubinin-Astakhov,DA)方程和Langmuir系列方程的应用受到重视[16-18]。总体而言,已展开的研究主要针对以单一碳基材料穿插MOFs的试样,对不同碳基材料穿插试样储氢行为的研究还较少,并且也还未开展氢在穿插试样上吸附平衡模型的研究。
鉴此,依据前期的研究结论[19],本研究选择不同类别的碳基材料并以质量分数为1% 的添加比率穿插MIL-101(Cr),随后开展制备试样的结构表征与微观形貌观察、氢吸附等温线测试,在比较Langmuir系列方程预测精度后,计算氢在试样上的极限吸附热和等量吸附热,由此比较氢在穿插试样上的吸附平衡。
2 试验部分制备试样的试剂主要有九水硝酸铬(Cr(NO3)2·9H2O)、对苯二甲酸(H2BDC)、氟化铵(NH4F)、醋酸钠(CH3COONa)和无水乙醇(C2H6O),均由阿拉丁试剂提供;AX-21和SAC-02活性炭由美国AMOCO公司和宁德鑫森炭业股份有限公司提供;层状石墨烯(graphene sheets-3D, GS-3D)和GO由河北新奥燃气集团和苏州碳丰科技有限公司提供;去离子水由厦门绿荫试剂玻璃仪器有限公司供应。测试用氢气、氮气和液氮选择厦门林德气体公司提供的纯度大于99.999% 的高纯度气体和低温液体。
选择醋酸钠作为矿化剂,通过溶剂热法制备MIL-101(Cr)试样。称取4.0 g的Cr(NO3)2·9H2O和1.66 g的H2BDC溶于浓度为0.05 mol⋅L−1的50 mL CH3COONa水溶液中,均匀混合、超声波震荡30 min,置入布设聚四氟乙烯内衬的不锈钢高压反应釜内,于鼓风干燥箱中程序升温至200 ℃后恒温晶化12 h。自然冷却后,混合溶液经离心分离、水洗干燥,并依次用60 mL浓度为0.03 mol⋅L−1的NH4F水溶液和无水乙醇在60 ℃下、间隔12 h回流2次。初始试样经充分水洗、离心后在150 ℃下真空干燥5 h后备用。
碳基材料@MIL-101(Cr)试样的制备。AX-21活性炭、SAC-02活性炭、GS-3D、GO均通过同等程度的球磨(钢球数量配比Φ6:Φ10:Φ20=300:8:6,转速为300 r⋅min−1,球磨时间为30 min)、74 μm筛网过筛,称量质量分数为1%(57.2 mg)球磨后的碳基材料、4.0 g的Cr(NO3)2·9H2O和1.66 g的H2BDC加入50 mL浓度为0.05 mol⋅L−1的CH3COONa水溶液中,充分搅拌、溶解,然后采取与制备MIL-101(Cr)试样相同的合成步骤[20]。
运用TESCAN MIRA4扫描电子显微镜(scanning electron microscope,SEM)对制备试样作电镜分析,选用Micromeritics 3Flex全自动微孔吸附仪测试77.15 K氮在试样上的吸脱附数据,并通过多层吸附理论(Brunauer-Emmett-Teller,BET)标绘和霍瓦思-卡瓦泽(Horvath-Kawazoe, HK)方程计算,确定试样的比表面积和孔径大小与分布。77.17 ~87.15 K、极低压力区域和较高压力区域内氢在试样上的吸附等温线分别通过Micromeritics 3Flex全自动微孔吸附仪和Setaram PCT Pro E&E高压气体吸附分析仪测试。
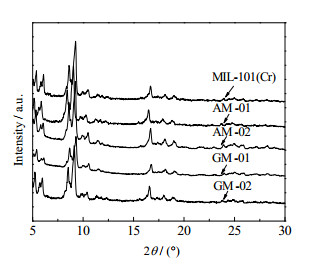
3 结果与讨论 3.1 试样结构图 1为MIL-101(Cr)和经AX-21活性炭、SAC-02活性炭、GS(3D)、GO穿插的试样AM-01、AM-02、GM-01、GM-02的XRD谱图。从图 1中可以发现,5种试样的谱图峰值变化基本一致,说明穿插并未形成新物相。相对而言,AM-01和GM-02的杂峰较少,表明晶型结构更加规则稳定。
|
图 1 试样的XRD谱图 Fig.1 XRD spectra of the samples |
图 2为试样的扫描电镜图。从图 2(a)中可以发现,制备的试样与文献报道的MIL-101(Cr)晶体呈正八面体的结果相吻合[21]。根据MIL-101(Cr)的孔结构特征,对比图 2(b)~(e)中的晶形及晶体间隙,可以认为穿插的碳基材料并未进入MIL-101(Cr)的特征孔内,而只是在晶体间隙中充填,在影响晶体生长而改变晶形的同时,也通过晶体之间连锁的增强而改变间隙内的孔结构。

|
图 2 试样的SEM图 Fig.2 SEM images of the samples |
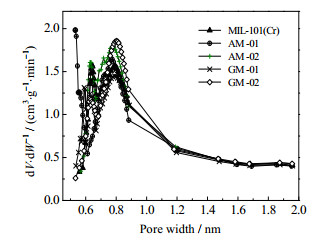
确定的比表面积、比微孔容积dV/dW、微孔平均孔径和孔大小及分布见表 1和图 3。从图 3中可看到,除了GM-01,其余3个试样在0.8 nm附近的峰值均较穿插前的高。比较表 1中的数据可以发现,GM-02试样的比表面积最大,其次为AM-01;穿插使试样的平均孔径减小,说明穿插在晶体间隙内的碳基材料与晶体之间形成了孔径较小的孔。从表 1中还可以发现,在0~2 nm的微孔区域,AM-01的比微孔容积最大,AM-02和GM-02的也较穿插前的大,但GM-01的略有减小;在最适合于氢吸附的0.6~0.9 nm,AM-01和GM-01的比微孔容积分别为0.456、0.357 cm3⋅g−1。
|
|
表 1 试样的结构参数 Table 1 Structural parameters of the samples |
|
图 3 碳基材料穿插MIL-101(Cr)试样的孔径分布(PSD) Fig.3 Pore size distributions (PSD) of carbon based material incorporated MIL-101(Cr) |
在极低压力区域,吸附量与吸附平衡压力之间符合亨利定律,即
| $ {n}_{\text{abs}}\approx {n}_{\text{exc}}\approx {B}_{\text{AS}}\left(\frac{p}{kT}\right)={H}_{\text{p}}\cdot p $ | (1) |
式中:nabs为绝对吸附量,mmol⋅g−1;nexc为过剩吸附量,mmol⋅g−1;BAS为第一维里系数,mol⋅K⋅Pa−1;p为压力,MPa;k为玻尔兹曼常数;T为热力学温度,K;Hp为亨利定律常数,mmol⋅Pa−1⋅g−1。极限吸附热可由下式计算[22]
| $ {q_{{\text{st0}}}} = RT + R\frac{{{\rm{d}}\left( {\ln {H_{\text{p}}}} \right)}}{{{\rm{d}}\left( {\frac{1}{T}} \right)}} $ | (2) |
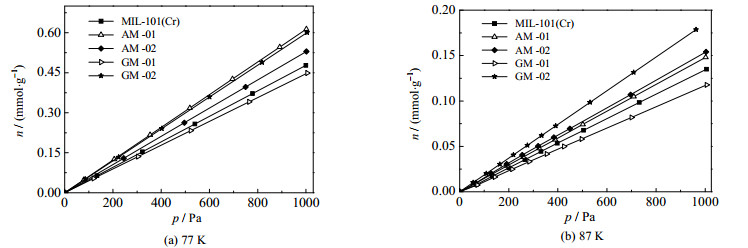
式中:qst0为极限吸附热,kJ⋅mol−1;R为摩尔气体常数,J⋅mol−1⋅K−1。通过式(1)~(2),运用图 4 (图中n为氢吸附量)氢在试样上极低压力区域的吸附平衡数据确定的Hp和qst0列于表 2。从表 2可以看出,温度较高时极限吸附热较大;氢在MIL-101(Cr)上的平均极限吸附热为8.343 kJ⋅mol−1,而氢在AM-01和GM-02上的分别为8.637和8.565 kJ⋅mol−1,表明此2种材料的穿插增强了氢分子与试样之间的相互作用。从表 2中的数据还可发现,氢在AM-02和GM-01上的极限吸附热较其在未穿插试样上的小,GS-3D和比表面积较小的活性炭的穿插并未增强氢分子与试样之间的相互作用。
|
图 4 极低压力区域下氢在试样上的吸附等温线 Fig.4 Isotherms of hydrogen adsorption on the samples at extra-low pressures |
|
|
表 2 氢在试样上吸附时的亨利定律常数与极限吸附热 Table 2 Henry law constants and limit isosteric heats of hydrogen adsorption on the samples |
考虑到绝对吸附量具有更明显的工程意义,而试验测试的为过剩吸附量。因此,根据Gibbs关于吸附的定义[23],将过剩吸附量换算为绝对吸附量,即
| $ {n_{{\text{abs}}}} = {n_{{\text{exc}}}} + {V_{\text{a}}}{\rho _{\text{g}}} $ | (3) |
| $ {n_{{\text{exc}}}} = {n_{{\text{abs}}}} - {V_{\text{a}}}{\rho _{\text{g}}} = {V_{\text{a}}}{\rho _{\text{a}}} - {V_{\text{a}}}{\rho _{\text{g}}} = {V_{\text{a}}}\left( {{\rho _{\text{a}}} - {\rho _{\text{g}}}} \right) $ | (4) |
式中:Va为吸附相比体积,cm3⋅g−1;ρg为本体相密度,g⋅cm−3;ρa为吸附相密度,g⋅cm−3。从式(3)中可以看出,确定nabs应先确定吸附相比体积Va,在假设了超临界温度氢的吸附相态后,可通过经验公式计算Va,但超临界温度氢高压吸附的吸附相态具有不确定性[24]。相关的研究表明,超临界温度高压氢的吸附以微孔内的单分子层聚集为特征,而Langmuir系列方程可在不假设吸附相态的前提下,就可精度较高地反映具有单分子吸附特征的绝对吸附量[25-26]。因此,选择Langmuir系列方程中的Langmuir、Langmuir-Freundlish(L-F)和Toth方程对氢的高压吸附平衡数据作模型分析,即
| $ {n_{{\text{abs}}}} = {n_{\text{m}}}\frac{{bf}}{{1 + bf}} $ | (5a) |
| $ {n_{{\text{abs}}}} = {n_{\text{m}}}\frac{{{{\left( {bf} \right)}^t}}}{{1 + {{\left( {bf} \right)}^t}}} $ | (5b) |
| $ {n_{{\text{abs}}}} = {n_{\text{m}}}\frac{{bf}}{{{{\left[ {1 + {{\left( {bf} \right)}^t}} \right]}^{1/t}}}} $ | (5c) |
式中:nm为饱和吸附量,mmol⋅g−1;b为拟合参数,MPa−1;f为逸度,Pa;t为吸附剂表面能量不均匀性参数。其中,氢的逸度
| $ \varepsilon = \frac{{\left| {{n_{{\text{exc - predicted}}}} - {n_{{\text{exc - experiment}}}}} \right|}}{{{n_{{\text{exc - experiment}}}}}} \times 100\% $ | (6) |
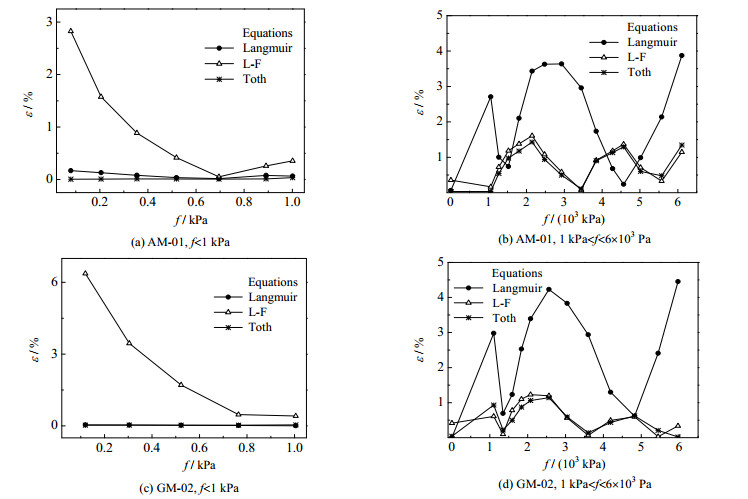
式中:ε为相对误差;nexc-predicted为过剩吸附量预测值,mmol⋅g−1;nexc-experiment为过剩吸附量实验值,mmol⋅g−1。方程参数拟合结果见表 3,ε的比较见图 5。从图 5中可以发现,在极低压力区域(< 1 kPa),由于Langmuir方程和Toth方程均可以回归成亨利定律,两方程的预测结果精度较高;而L-F方程由于在此区域无法回归亨利定律,其预测的ε最大可达6.37%。在较高压力区域(1~6×103 kPa),Langmuir方程预测氢在AM-01和GM-02上吸附平衡数据的相对误差为0.06%~3.87%、0.01%~4.45%,L-F方程为0.08%~1.61%、0.02%~1.23%,Toth方程为0.04%~1.43%、0.02%~1.14%。显然,在较高压力区域,L-F方程和Toth方程的预测结果的精度较高,而从本次的试验范围来看,选用Toth方程分析吸附数据具有最高的精度。
|
|
表 3 氢在AM-01和GM-02上吸附平衡方程参数的拟合值 Table 3 Fitted parameters for adsorption equilibrium of hydrogen on AM-01 and GM-02 |
|
图 5 方程预测77.15 K氢在试样上的过剩吸附量与试验值之间的相对误差 Fig.5 Relative errors between excess amount resulted from experiments and equations of hydrogen adsorption on samples |
由Toth方程计算的氢在试样上的绝对吸附等温线见图 6。从图 6中可以发现,在本次测试范围内,氢在试样上的过剩吸附等温线均出现了最大点,这可归因于Gibbs关于吸附的定义,随着吸附平衡压力的升高,本体相密度的增长速率比吸附相密度的大,从而使测试的过剩吸附等温线出现最大点,而绝对吸附量仅随吸附相密度单调变化,随吸附平衡压力增大而单调增大[28-29]。
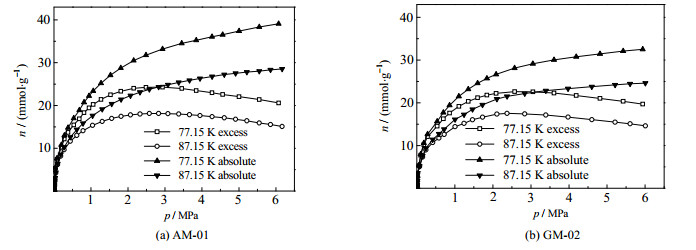
|
图 6 氢在试样上的过剩吸附等温线和由Toth方程预测的绝对吸附等温线 Fig.6 Isotherms of excess and absolute amounts of hydrogen adsorption on the samples fitted by Toth equation |
进一步运用Toth势函数计算氢在试样上的等量吸附热[30],即有
| $ {q_{{\text{st}}}} = RT\ln \left( {\frac{{{p_{\text{s}}}}}{p} \times {{\left( {bp} \right)}^t}} \right) + \lambda + zRT $ | (7) |
式中:qst为等量吸附热,kJ⋅mol−1;ps为饱和蒸气压,MPa;λ为汽化潜热,kJ⋅mol−1;z为压缩因子。选用Ozawa提出的经验公式来确定ps [24],即
| $ {p_{\text{s}}} = {p_{\text{c}}}{\left( {\frac{T}{{{T_{\text{c}}}}}} \right)^2} $ | (8) |
式中:pc为临界压力,MPa;Tc为临界热力学温度,K。根据式(7)确定的等量吸附热见图 7。从图 7中可以发现,氢在两试样上的等量吸附热均随吸附量增大而减小,体现了氢在能量不均匀表面上吸附的特点,氢分子优先在吸附剂表面高能位上吸附,随着吸附量的增加、表面活性位数量的减少,本体气相中被吸附的氢分子数量变少、等量吸附热减小。对比图 7(a)中的曲线还可发现,在温度为77.15 K时,氢在AM-01和GM-02上的等量吸附热随吸附量的变化趋势相近,在吸附量较小区域(0~10 mmol⋅g−1),氢在AM-01上的等量吸附热较大,在测试范围内相对应的平均值约为2.76和2.73 kJ⋅mol−1。图 7(b)中,87.15 K、吸附量较小时,氢在AM-01上的等量吸附热比其在GM-02上的小,但随吸附量增加,氢在AM-01上的等量吸附热将比其在GM-02上的大,对应的平均值为3.32和3.15 kJ⋅mol−1。综合等量吸附热的数值大小与其变化趋势,可以认为氢在AM-01和GM-02试样上受到的吸附作用强弱相近。
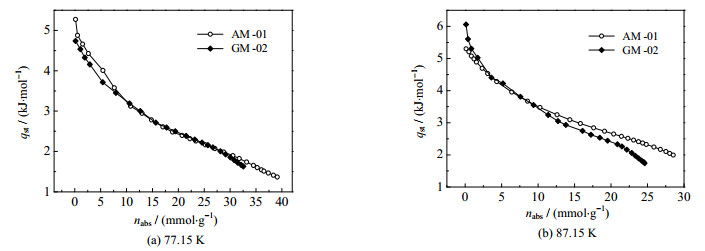
|
图 7 氢在试样上的等量吸附热 Fig.7 Isosteric heats of hydrogen adsorption on samples |
如图 8所示,在77.15 K、平衡压力为100 kPa时,氢在AM-01和GM-02上的吸附量为分别9.19和9.17 mmol⋅g−1,比其在MIL-101(Cr)上分别增加了12.2% 和12.0%;平衡压力上升至6 MPa后,吸附量分别增加至39.12和32.53 mmol⋅g−1,增加量为41.1% 和17.4%。这些数值与Rallapalli等[11]报道结果具有可比性,但AM-01的比表面积比文献[15]报道的最佳穿插试样大。
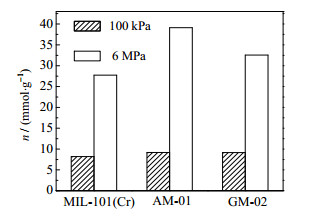
|
图 8 77.15 K不同平衡压力下氢在试样上的吸附量 Fig.8 Adsorption amounts of hydrogen on samples at 77.15 K under different equilibrium pressures |
本研究以碳基材料穿插MIL-101(Cr)改变试样结构及其储氢行为,涉及试样结构表征和氢吸附等温线测试,在综合分析碳基材料类型对试样的比表面积、微孔区域内的平均孔径、微孔容积以及氢在试样上的极限吸附热、吸附模型的预测精度和等量吸附热的影响后,得出以下结论:
(1) 以GO和较高比表面积活性炭穿插的MIL-101(Cr)试样具有更适合于氢吸附的结构。以质量分数为1%的比率分别添加比表面积为1 975、1 524 m2⋅g−1的AX-21活性炭和SAC-02活性炭穿插时,制备试样的比表面积分别提高了12.1%、9.6%,比微孔容积增加了5.7%、4.3%;以比表面积为37、2 156 m2⋅g−1的GO和GS-3D穿插试样的比表面积提高了13.0%、0.3%,但比微孔容积分别增加和减小了3.8%、1.4%。GO和较高比表面积活性炭的穿插有利于增大试样的比表面积和比微孔容积。
(2) Toth方程预测氢在碳基材料穿插MIL-101(Cr)试样上的吸附平衡具有较高精度。77.15 K时,在0~1 kPa区域,Langmuir方程、Toth方程和L-F方程预测氢在具有较大比表面积穿插试样AM-01和GO穿插试样GM-02上吸附平衡数据的平均相对误差为0.033%、0.028%、3.21%;在1~6×103 kPa区域,预测的平均相对误差为2.1%、0.66%、0.74%。在Langmuir系列方程中,Toth方程预测本次测试的氢吸附平衡数据精度最高。
(3) 氢在GO和具有较大比表面积活性炭穿插MIL-101(Cr)试样上的等量吸附热数值相近。在7.15~87.15 K、0~6 MPa范围,与氢在MIL-101(Cr)上的最大吸附量相比,氢在具有较大比表面积活性炭穿插试样AM-01和GO穿插试样GM-02上的最大吸附量分别提高了41.1% 和17.4%,相应的等量吸附热为2.96~8.37 kJ⋅mol−1、3.06~8.44 kJ⋅mol−1。可选用GO或具有较大比表面积的活性炭穿插制备储氢用MIL-101(Cr)复合材料。
| [1] |
LATROCHE M, SUZY S, SERRE C, et al. Hydrogen storage in the giant-pore metal-organic frameworks MIL-100 and MIL-101[J]. Angewandte Chemie-International Edition, 2006, 45(48): 8227-8231. DOI:10.1002/anie.200600105 |
| [2] |
CHANCHETTI L F, LEIVA D R, LOPES DE FARIA L I, et al. A scientometric review of research in hydrogen storage materials[J]. International Journal of Hydrogen Energy, 2020, 45(8): 5356-5366. DOI:10.1016/j.ijhydene.2019.06.093 |
| [3] |
孔乾乾, 鲁金明, 张集, 等. 双金属有机骨架材料的制备及其吸附性能研究[J]. 高校化学工程学报, 2021, 35(2): 348-352. KONG Q Q, LU J M, ZHANG J, et al. Preparation and adsorption properties of bimetallic organic framework materials[J]. Journal of Chemical Engineering of Chinese Universities, 2021, 35(2): 348-352. DOI:10.3969/j.issn.1003-9015.2021.02.020 |
| [4] |
MURRAY L J, DINCA M, LONG J R. Hydrogen storage in metal-organic frameworks[J]. Chemical Society Reviews, 2009, 38: 1294-1314. DOI:10.1039/b802256a |
| [5] |
WANG K K, WANG Q M, WANG X, et al. Intramolecular hydrogen bond-induced high chemical stability of metal-organic frameworks[J]. Inorganic Chemistry Frontiers, 2020, 7(19): 3548-3554. DOI:10.1039/D0QI00772B |
| [6] |
LIU H Y, GAO G M, BAO F L, et al. Enhanced water stability and selective carbon dioxide adsorption of a soc-MOF with amide-functionalized linkers[J]. Polyhedron, 2019, 160: 207-212. DOI:10.1016/j.poly.2018.12.048 |
| [7] |
CHOI H J, DINCA M, DAILLY A, et al. Hydrogen storage in water-stable metal-organic frameworks incorporating 1, 3-and 1, 4-benzenedipyrazolate[J]. Energy & Environmental Science, 2010, 3(1): 117-123. |
| [8] |
ROWSELL J L C, YAGHI O M. Strategies for hydrogen storage in metal-organic frameworks[J]. Angewandte Chemie- International Edition, 2005, 44(30): 4670-4679. DOI:10.1002/anie.200462786 |
| [9] |
ICHIKAWA T, CHEN D M, ISOBE S, et al. Hydrogen storage properties on mechanically milled graphite[J]. Materials Science & Engineering, B: Advanced Functional Solid-State Materials, 2003, 108(1): 138-142. |
| [10] |
LIU D, GU W Y, ZHOU L, et al. Recent advances in MOF-derived carbon-based nanomaterials for environmental applications in adsorption and catalytic degradation[J]. Chemical Engineering Journal, 2022, 427: 131503. DOI:10.1016/j.cej.2021.131503 |
| [11] |
RALLAPALLI P B, RAJ M C, PATIL D V, et al. Activated carbon@MIL-101(Cr): A potential metal-organic framework composite material for hydrogen storage[J]. International Journal of Energy Research, 2013, 37(7): 746-753. DOI:10.1002/er.1933 |
| [12] |
PRABHAKARAN P K, CATOIRE L, DESCHAMPS J. Aluminium doping composite metal-organic framework by alane nanoconfinement: Impact on the room temperature hydrogen uptake[J]. Microporous Mesoporous Materials, 2017, 243: 214-220. DOI:10.1016/j.micromeso.2017.02.032 |
| [13] |
PRASANTH K P, JOHNNY D. Doping activated carbon incorporated composite MIL-101 using lithium: impact on hydrogen uptake[J]. Journal of Materials Chemistry A: Materials for Energy and Sustainability, 2015, 3(13): 7014-7021. DOI:10.1039/C4TA07197B |
| [14] |
PETIT C, BURRESS J, BANDOSZ T J. The synthesis and characterization of copper-based metal-organic framework/graphite oxide composites[J]. Carbon, 2010, 49(2): 563-572. |
| [15] |
KUMAR R, RAUT D, RAMAMURTY U, et al. Remarkable improvement in the mechanical properties and CO2 uptake of MOFs brought about by covalent linking to graphene[J]. Angewandte Chemie-International Edition, 2016, 55(27): 7857-7861. DOI:10.1002/anie.201603320 |
| [16] |
BIMBO N, SHARPE J E, TING V P, et al. Isosteric enthalpies for hydrogen adsorbed on nanoporous materials at high pressures[J]. Adsorption, 2014, 20(2/3): 373-384. |
| [17] |
TEDDS S, WALTON A, BROOM D P, et al. Characterisation of porous hydrogen storage materials: carbons, zeolites, MOFs and PIMs[J]. Faraday Discussions, 2011, 151: 75-94. DOI:10.1039/c0fd00022a |
| [18] |
HOU X X, SULIC M, ORTMANN J P, et al. Experimental and numerical investigation of the cryogenic hydrogen storage processes over MOF-5[J]. International Journal of Hydrogen Energy, 2016, 41(6): 4026-4038. DOI:10.1016/j.ijhydene.2015.12.187 |
| [19] |
孙廷铨. 基于碳基材料穿插的MOFs复合储氢材料制备[D]. 厦门: 集美大学, 2021. SUN T Q. Synthesis of MOFs composite for hydrogen storage based on incorporation of carbon-based materials [D]. Xiamen: Jimei University, 2021. |
| [20] |
郭金涛, 陈勇, 荆钰, 等. 以醋酸盐为矿化剂合成金属有机骨架MIL-101[J]. 高等学校化学学报, 2012, 33(4): 668-672. GUO J T, CHEN Y, JING Y, et al. Synthesis of metal organic framework MIL-101 with acetate as mineralization agent[J]. Chemical Journal of Chinese Universities, 2012, 33(4): 668-672. |
| [21] |
FEREY G, MELLOT D C, SERRE C. A chromium terephthalate-based solid with unusually large pore volumes and surface area[J]. Science, 2005, 309(5743): 2040-2042. DOI:10.1126/science.1116275 |
| [22] |
郑青榕, BIRKETT G, DO D D. 甲烷在活性炭上吸附的实验及理论分析[J]. 天然气化工(C1化学与化工), 2009, 34(1): 41-45. ZHENG Q R, Birkett G, Do D D. Theoretical and experimental analysis of methane adsorption on activated carbon[J]. Natural Gas Chemical Industry, 2009, 34(1): 41-45. |
| [23] |
MENON P G. Adsorption at high pressures[J]. Chemical Preview, 1968, 68(3): 277-294. |
| [24] |
OZAWA S, KUSUMI S, OGINO Y. Physical adsorption of gases at high pressure Ⅳ. An improvement of the Dubinin-Astakhov adsorption equation[J]. Journal of Colloid and Interface Science, 1976, 56(1): 83-91. |
| [25] |
DO D D, DO H D. Adsorption of supercritical fluids in non-porous and porous carbons: analysis of adsorbed phase volume and density[J]. Carbon, 2003, 41(9): 1777-1791. |
| [26] |
周理, 吕昌忠, 王怡林, 等. 述评超临界温度气体在多孔固体上的物理吸附[J]. 化学进展, 1999, 11(3): 221-226. ZHOU L, LYU C Z, WANG Y L, et al. Physisorption of gases on porous solids at above-critical temperatures[J]. Progress in Chemistry, 1999, 11(3): 221-226. |
| [27] |
ZHOU L, ZHOU Y P. Determination of compressibility factor and fugacity coefficient of hydrogen in studies of adsorptive storage[J]. International Journal of Hydrogen Energy, 2001, 26(6): 597-601. |
| [28] |
BÉNARD P, CHAHINE R. Modeling of high-pressure adsorption isotherms above the critical temperature on micro-porous adsorbents: application to methane[J]. Langmuir, 1997, 13(4): 808-813. |
| [29] |
周理, 李明, 周亚平. 超临界甲烷在高表面活性炭上的吸附测量及其理论分析[J]. 中国科学(B辑), 2000, 30(1): 49-56. ZHOU L, LI M, ZHOU Y P. Adsorption measurement and theoretical analysis of supercritical methane on high surface activated carbon[J]. Scientia Sinica(Chimica), 2000, 30(1): 49-56. |
| [30] |
KLOUTSE A F, ZACHARIA R, COSSEMENT D, et al. Isosteric heat of hydrogen adsorption on MOFs: Comparison between adsorption calorimetry, sorption isosteric method, and analytical models[J]. Applied Physics A, 2015, 121(4): 1417-1424. |




