2. 昆明理工大学 冶金与能源工程学院,云南 昆明 650093
2. College of Metallurgical and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China
工业黄磷通常采用电炉法,即将磷矿石、硅石和焦炭混合炉料送入电炉,利用电加热至熔融并发生化学反应,使元素磷升华,含磷炉气进入气体冷凝系统,分离、精制得到单质磷[1, 2]。焦炭在制磷电炉中作为磷酸盐中五氧化二磷的还原剂,又是化学反应中的导电体与导热体,硅石与磷矿中的氧化钙生成低共熔炉渣,不仅起到助熔剂的作用,还可以大大降低磷矿反应温度[3~5],然而电炉法黄磷生产中电耗占生产总成本的50%左右,属于高耗能产业,其中还原反应耗热和炉渣带走热量约占总能耗的80%以上[6],因此,探寻能进一步降低磷矿石还原分解和排渣温度的造渣助熔剂,是解决目前电炉法黄磷电耗高的有效途径。
国内外许多学者涉及助熔剂降低炉渣熔融温度方面的研究,如,为了降低气化炉渣温度,在研究煤灰分熔融性特征温度规律的基础上,通过添加钠系、钙系和铁系及其复合物,结果表明形成矿物相类型与添加剂直接相关,灰熔融温度变化亦不同,但均可形成新的低共熔物从而降低煤的灰熔融温度[7, 8],以适应不同排渣方式和气化工艺的选择;Van等研究获得了熔渣熔融温度主要受矿物组成和矿物相影响的结论[9~12];Vassilev等通过研究,证明熔渣中Ca、Mg、Fe和Na含量越高,熔渣灰熔融温度(AFTs)越低,反之熔渣中Si、Al和Ti含量的增加则会提高AFTs[11],近期研究表明,AFTs的变化与添加剂组成以及混合比例密切相关[13~15];Wang等研究了添加NaCl、Al2O3和SiO2对熔渣的影响,发现其熔化温度随着NaCl的增加或SiO2的减少而降低,但与Al2O3添加比关系则是先升高后降低[13];Húlan等在黏土加热及冷却过程中发生的内部反应历程及其弹性与非弹性的机械性能的研究中提到用钾长石作助熔剂,在1000℃以下有利于体系形成玻璃相[16];Mandal等用石灰作铁矿石丸助熔剂,结果表明,形成铝硅酸钙矿物相是降低烧结温度的主要原因[17];Ryshchenko等研究了石英-长石作为陶瓷制品助熔剂,通过理论计算估计了石英-长石的助熔能力,并对其机理进行了分析[18];刘云河从提高炉渣活性角度出发,以铝土矿替代硅石用于电炉造渣,不仅不会影响正常排渣温度,还可将炉渣活性系数m(Al2O3)/m(SiO2)由原来的0.096提高到0.3,有利于炉渣资源化利用[19]。
钾长石用作电炉法黄磷生产助剂未见研究报告,但根据现有熔渣助熔剂助熔机理和研究结果[20~23],钾长石较硅石富含碱金属和铝氧化物,其助熔效果应优于硅石,因此,本文拟通过二者进行电炉法黄磷生产助熔剂理论分析和实验对比研究,为实际工业生产提供实验依据。
2 实验 2.1 实验原料与仪器实验原料分别为钾长石、磷矿石、硅石、焦炭,分别取自云南各地,粉磨过180目筛,筛余量<5%,氧化钙(AR),二氧化硅(AR),氩气(>99.99%);其他试剂均为分析纯。
灰熔点测定仪,型号:HR-4A,鹤壁市华泰仪器仪表有限公司;超音频感应加热设备,型号:YFL-25,中国•郑州英福伦电气有限公司;快速压紧制粉机,镇江市科瑞制样有限公司,火焰光度计,型号:HG-5,北京市检测仪器厂;X射线衍射仪,型号:D/max-3B,日本理学公司;TG-DSC仪器,型号:STA449F3,德国耐池NETZSCH公司;标准检验筛,180目,孔径0.088 mm,浙江萧山永发电器有限公司。
2.2 分析与表征采用D/max-3B型X射线衍射仪,在扫描角度(2θ)为10~90°测定样品XRD衍射谱图;热重分析仪TGA-103用于分析样品随着温度的变化其质量与热量的损失;HSC Chemistry5.0用于理论上的热力学分析;原料及料渣中磷的含量测定采用磷钼酸喹啉重量法,钾的测定采用火焰光度法,表 1、表 2为各原料分析数据。
| 表 1 各原料化学组成成分 Table 1 Chemical composition of raw materials / % |
| 表 2 焦炭工业分析 Table 2 Industry analysis of coke / % |
在热力学分析基础上,用氧化钙替代磷矿石还原分解产物,模拟电炉法黄磷生产酸度值配比,通过灰熔融特征温度[24]优化氧化硅添加量,且与等酸度值钾长石体系进行对比,并结合XRD、TG-DSC分析手段,探讨钾长石用于电炉法黄磷生产原理;以氩气作保护气体,以磷转化率、钾气化率为考察指标,在超音频感应加热炉内进行硅石和钾长石体系对比实验研究,研究钾长石作为助熔剂的理论依据。
3 结果与讨论 3.1 热力学分析| ${\rm{2C}}{{\rm{a}}_{\rm{3}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{2}}}{\rm{ + 10C = 6CaO + }}{{\rm{P}}_{\rm{4}}}{\rm{(g) + 10CO(g)}}$ | (1) |
| ${\rm{2C}}{{\rm{a}}_{\rm{3}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{2}}}{\rm{ + 10C + 6Si}}{{\rm{O}}_{\rm{2}}}{\rm{ = 6CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + }}{{\rm{P}}_{\rm{4}}}{\rm{(g) + 10CO(g)}}$ | (2) |
| ${\rm{7C}}{{\rm{a}}_{\rm{3}}}{{\rm{(P}}{{\rm{O}}_{\rm{4}}}{\rm{)}}_{\rm{2}}}{\rm{ + 35C + 6KAlS}}{{\rm{i}}_{\rm{3}}}{{\rm{O}}_{\rm{8}}}{\rm{ =\\ 3}}{{\rm{K}}_{\rm{2}}}{\rm{O(g) + 15CaSi}}{{\rm{O}}_{\rm{3}}}{\rm{ + 3C}}{{\rm{a}}_{\rm{2}}}{\rm{A}}{{\rm{l}}_{\rm{2}}}{\rm{Si}}{{\rm{O}}_{\rm{7}}}{\rm{ + 7}}{{\rm{P}}_{\rm{4}}}{\rm{(g) + 35CO(g)}}$ | (3) |
式(1)~(3)是磷酸钙直接碳热还原分解及在不同助剂下最易进行途径的反应方程式,利用HSC Chemistry5.0软件计算所得吉布斯自由能与温度的关系如图 1所示。
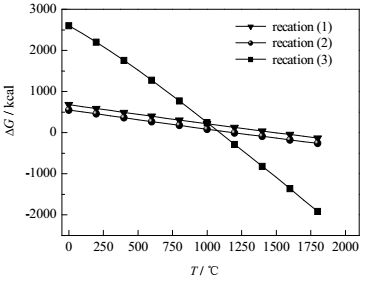
|
图 1 应式(1)~(3)的△G-T的关系曲线图 Fig.1 Profiles of △G-T of the chemical reaction equations (1)~(3) |
图 1可知,反应式(1)~(3)的△G均随着温度的增加而下降,发生反应即△G = 0时各温度分别为:1517、1217和1117℃,反应式(3)与反应式(1)相比,反应开始的温度下降了400℃,与反应式(2)相比,温度下降了100℃。根据电炉法黄磷生产原理,与磷酸钙直接还原相比,引入硅石后可改变磷酸钙还原过程,从而降低主反应活化能,据此类推,钾长石也可能是首先与磷酸钙发生了更容易进行的中间反应,继而降低体系的反应温度。
热力学平衡常数
| ${\rm{ln}}K_{\rm{P}}^\Theta = - \frac{{\Delta G_{\rm{T}}^\Theta }}{{RT}}$ | (4) |
式中,R为理想气体常数,
上述三个反应的热力学平衡常数KPΘ随温度的变化关系如图 2所示。

|
图 2 反应式(1)~(3)的KPΘ -T的关系曲线图 Fig.2 Profiles of KPΘ -T of the chemical reaction equations (1)~(3) |
反应平衡常数越大,反应进行的程度越高,由图 2可知,反应式(1)与式(2)的反应平衡常数很接近,其斜率大小相当,约为0.43,而式(3)的KPΘ对温度的变化则十分敏感,其斜率为1.08,由此可知,以△G = 0时温度为基础,提高相同温度,反应式(3)进行得更彻底;另一方面,在反应式(2)△G = 0时的温度下,式(3)可充分进行,说明钾长石替换硅石后不仅可降低反应温度、排渣温度,而且相同温度下可进一步提高磷的转化率。
3.2 熔融特征温度测定电炉法生产黄磷的炉渣,实际是磷酸钙分解产物-氧化钙与助熔剂二氧化硅的高温反应产物,因此,参照实际生产酸度值范围,用氧化钙代替磷酸钙还原分解产物,在不同酸度比值下与二氧化硅混合进行灰锥熔融温度测定,优选出CaO-SiO2体系最佳配比,作为后续研究依据。图 3为CaO-SiO2混合物在不同酸度值下的特征温度。

|
图 3 SiO2/CaO不同酸度比下的特征温度对比图 Fig.3 Comparison of characteristic temperatures ofSiO2/CaO under different acidities |
由图 3可知,SiO2/CaO的酸度比在0.85时配料体系各特征温度最低,即硅钙比为0.85时助熔效果最好,以此值为参照,拟定钾长石体系下的酸度值。表 3列出了两种助熔剂下的灰锥熔融特征温度,从表 3可知,硅石-CaO和钾长石-CaO体系下的流动温度相比较纯SiO2-CaO体系分别降低了63和173℃,即相同酸度值下,用钾长石替换硅石,其流动温度可降低110℃,由此说明,当用钾长石作助熔剂时,排渣温度理论上可比硅石体系降低110℃ (酸度值为体系中酸性氧化物与碱性氧化物的质量比,即m(SiO2+Al2O3)/m(CaO+MgO+K2O+Na2O)。
| 表 3 不同助熔剂体系在酸度比为0.85下的特征温度 Table 3 Characteristic temperatures of systems with different fluxes under acidity ratio of 0.85 |
图 4、图 5分别是酸度值为0.85下硅石-氧化钙和钾长石-氧化钙体系TG-DSC实验结果。
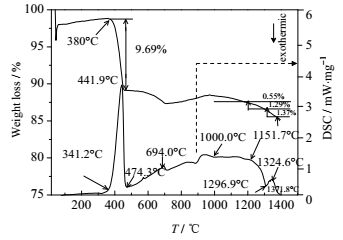
|
图 4 酸度值0.85时硅石-氧化钙体系TG-DSC曲线 Fig.4 TG-DSC curves of silica and calcium oxide under acidity value of 0.85 |
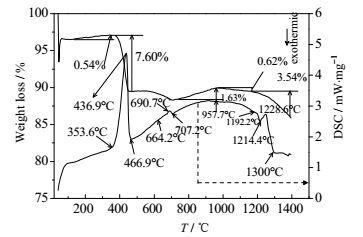
|
图 5 酸度值0.85时钾长石-氧化钙体系TG-DSC曲线 Fig.5 TG-DSC curves of potassium feldspar and calcium oxide under acidity value of 0.85 |
由图 4可知:低于474.3℃为体系脱除游离水及结合水,之后至694℃为β-石英转变为α-石英,此为吸热过程,继续升温至1000℃为α-石英转化为α-鳞石英,过程吸热并伴有质量增加;当温度超过1000℃时,CaO与SiO2反应生成Ca2SiO4(C2S),并有少量SiO2挥发逸出;温度超过1296.9℃时,CaO与SiO2继续生成C2S,同时形成C2S与CaO低共熔物,并形成以1324.6℃为中心的吸热峰,此时有大量液相生成,此温度范围与灰熔融特征温度测定值(1305℃)接近;由于液相的存在,进一步促进C2S的生成,继续升温,在C2S生成的同时,C2S又与CaO、SiO2反应分别生成C3S和CS,但与低共熔物形成之前相比,热量曲线和质量曲线的斜率变化并不十分明显,高温阶段反应亦较温和,体系反应结束温度为1371.8℃。
由图 5可知,在694.0℃前,其体系过程与图 4类似,仅是吸热峰值中心值略有差异;低共熔物形成温度为1228.6℃,稍高于灰熔融特征温度(1195℃),较硅石体系提前96.0℃,且与低共熔物形成之前相比,热变化曲线斜率较大,说明温度对反应十分敏感,这与平衡常数KPΘ分析相一致,体系反应结束温度约1300℃,较硅石体系提前71.8℃。根据钾长石高温分解特性和CaO置换K2O机理,钾长石体系下低共熔物应为钾长石及其初步分解产物、CaAl2Si2O8、Ca2Al2SiO7,低共熔物熔点为1228.6℃,并伴有K2O气化升华,故较硅石体系而言,失重较大。
3.4 硅石、钾长石助熔体系下的XRD衍射谱图分析通过表征知原料钾长石在温度为900、1000、1100℃时衍射峰形状是一致的,高于1100℃是无定型的非晶体,钾长石衍射峰如图 6所示。
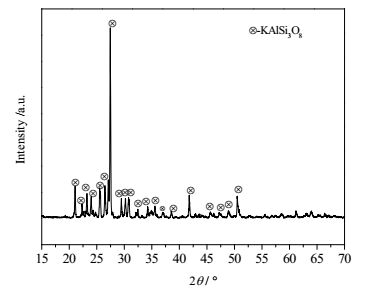
|
图 6 钾长石衍射图 Fig.6 XRD pattern of potash feldspar |
图 7是硅石-CaO体系在不同温度下的XRD对比图,体系所用原料硅石是天然石英,升温至1150℃时转化为了鳞石英;900℃时,生成了微量的belite型Ca2SiO4,随着温度升高生成物越多;1150℃时CaO几乎消失,与鳞石英生成大量的belite型Ca2SiO4;升温至1200℃时,此温度范围内C2S峰变宽弱化,高钙盐C3S、C3S2大量生成;继续升温至1300℃,体系形成大量液相,C2S与富余的SiO2生成CS,此温度范围内形成CS与C3S2低共熔物。
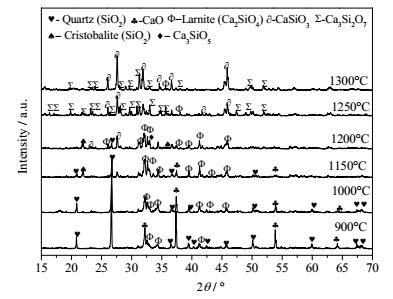
|
图 7 硅石与CaO在酸度比为0.85时不同温度下的XRD衍射图 Fig.7 XRD patterns of silica and CaO at different temperatures under acidity value of 0.85 |
图 8是钾长石与CaO体系在不同温度下的XRD对比图,900℃时主要是CaO和钾长石特征峰,有少量KAlSi3O8分解释放出SiO2生成KAlSi2O6,部分继续分解为KAlSiO4,新生成的SiO2反应活性好,与CaO反应生成C2S,并随温度的升高C2S生成越多;1000℃时,KAlSi2O6继续分解为KAlSiO4促进C2S生成,同时KAlSiO4与CaO发生置换反应生成Ca2Al2SiO7并释放出K2O和SiO2,少量C2S与SiO2生成wal型CS,此温度下CaO逐渐减弱并随后消失,钾长石开始软化;在1150℃时KAlSi3O8和KAlSi2O6形成低共熔物至特征峰减弱并随后消失,液相的产生促进Ca2Al2SiO7生成,钾长石及其初步分解产物进一步释放出SiO2,并与C2S反应转化为CS;至1200℃钾长石的熔融分解产物与wal-CaSiO3进一步反应生成CaAl2Si2O8,并与钾长石及其初步分解产物、Ca2Al2SiO7形成低共熔物,特征峰减弱并随后消失,此温度与特征温度相近,并与TG-DSC分析的热量变化转折温度点相一致。
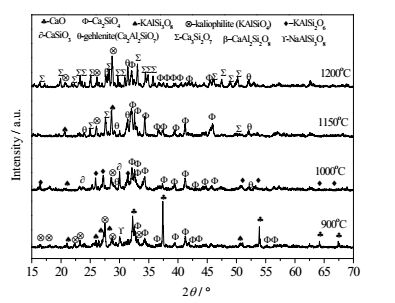
|
图 8 钾长石与CaO在酸度比为0.85时不同温度下的XRD衍射图 Fig.8 XRD patterns of potash feldspar and CaO at different temperatures under acidity value of 0.85 |
综上,硅石-CaO体系熔融温度降低的原因是生成了belite的CaSiO4;钾长石-CaO体系相对于硅石-CaO体系熔融温度降低的主要原因是该体系下钾长石的熔点低,1150℃就形成了NaAlSi3O8、KAlSi2O6低温熔融化合物,随着温度升高,1200℃时钾长石及其初步分解产物与CaAl2Si2O8、Ca2Al2SiO7形成低共熔体,形成的液相为后续反应提供反应介质增加了反应的接触面积,有效降低了钾长石-CaO体系的反应温度。
3.5 硅石、钾长石助熔下实际体系对比实验体系配料酸度值为0.85,焦炭量为理论用量的105%,各原料称量后混合均匀,配料后磷矿石-硅石-焦炭体系中P2O5含量为20.51%,磷矿石-钾长石-焦炭体系中P2O5含量为19.07%、K2O含量为2.34%,每次称取混合物20.00 g (干基),放入石墨钳锅内,外加刚玉管,用氩气作保护气体在超音频感应加热设备中进行还原反应,分别于900~1300℃进行不同体系实验研究,反应时间为1 h,温度间隔为100℃,称量反应残渣总量,并分析其P2O5和K2O含量,再进行体系磷转化率和钾气化率计算,结果如表 4所示。
| 表 4 磷矿石在硅石和钾长石助熔下实验结果表 Table 4 Experimental results of phosphate ore studied using silica and potash feldspar as flux |
实际体系对比实验表明:要使残渣中P2O5含量小于2%时,磷矿石-硅石-焦炭体系反应温度需达到1300℃,而磷矿石-钾长石-焦炭体系只需1200℃,进一步验证了前述分析结果。
4 结论钾长石替换硅石作电炉法黄磷生产助剂,其助熔机理主要体现在两个方面,一是钾长石分解释放出高活性SiO2,促进Ca3(PO4)2分解;二是钾长石分解产物与体系反应的硅、铝酸钙盐在更低的温度下形成低共熔物,为反应物扩散提供了媒介作用,可得如下结论:
(1) 热力学分析和实际体系对比实验结果表明,以钾长石替换硅石作助熔剂,可使磷酸钙反应温度降低100℃。由流动温度得出SiO2-CaO体系熔融最低温度为1368℃ (酸度值为0.85),此酸度值下硅石、钾长石体系相应流动温度为1305℃、1195℃,钾长石体系较硅石体系排渣温度可降低110℃。
(2) 由TG-DSC和XRD衍射图分析可知,钾长石体系在1150℃时形成KAlSi3O8和KAlSi2O6低共熔物,1200℃时钾长石及其初步分解产物与CaAl2Si2O8、Ca2Al2SiO7构成多元低共熔物体系,在较低温度下出现液相,是钾长石能使电炉法黄磷生产降温节能的主要原因。
符号说明:
| AFTs | -灰熔融温度 | HT | -半球温度,℃ |
| Aad | -空气干燥基灰分的质量分数,% | LOI | -灼烧失量,% |
| DT | -变形温度,℃ | Mad | -空气干燥基水分的质量分数,% |
| FCad | -空气干燥基固定碳的质量分数,% | ST | -软化温度,℃ |
| FT | -流动温度,℃ | Vad | -空气干燥基挥发分的质量分数,% |
| [1] | Xu X, Wang P. Current situation and development of yellow phosphorus production in China[J]. Chemical Techno Economics , 2001, 3: 7-9. |
| [2] | Wei Q. Development and application of new process for yellow phosphorus filtration during yellow phosphorus production[J]. Sulphur Phosphorus & Bulk Materials Handling Related Engineering , 2012, 107(2): 1-2. |
| [3] | Hou Y, Wu J, Liu S. Raw material pre-treatment method and raw material pre-treatment process system suitable for kin phosphoric acid process:USP 20, 160, 083, 255[P]. 2016-03-24. |
| [4] | Nanjing Chemical Industry Company Phosphate (南京化学工业公司磷肥厂). Yellow phosphorus production by electric furnace method(电炉法生产黄磷)[M].Beijing(北京): Chemical Industry Press(化学工业出版), 1978. |
| [5] | LI Xi(李茜), HU Biao(胡彪), WU Yuan-xin(吴元欣), et al. Process parameters and kinetics of smelting reduction technology for low-grade phosphate ore reduction(熔融法还原中低品位磷矿的工艺及动力学)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28(4): 905-910. |
| [6] | Ga Y, Dong G L, Zhang J, et al. The risk factors and environmental risk prediction during the production of yellow phosphorus[J]. Meteorological and Environmental Research , 2014, 5(10): 17-21. |
| [7] | LI Ping(李平), LIANG Qin-feng(梁钦锋), LIU Xia(刘霞), et al. Effects of flux on flow temperature of coal ashes(助熔剂对高灰熔点煤灰流动温度的影响)[J]. Journal of East China University of Science and Technology(Natural Science Edition)((华东理工大学学报(自然科学版)) , 2010, 36(4): 475-481. |
| [8] | CHENG Yi(程翼), LI Han-xu(李寒旭), WU Cheng-li(武成利). Effect of fluxes on ash fusion characteristics of Huainan coal(助熔剂对淮南煤灰熔融特性的影响行为研究)[J]. Coal Technology(煤炭技术) , 2005, 24(12): 90-92. DOI:10.3969/j.issn.1008-8725.2005.12.048. |
| [9] | Song W J, Tang L H, Zhu X D, et al. Effect of coal ash composition on ash fusion temperatures[J]. Energy & Fuels , 2009, 24(1): 82-89. |
| [10] | Van Dyk J C, Benson S A, Laumb M L, et al. Coal and coal ash characteristics to understand mineral transformations and slag formation[J]. Fuel , 2009, 88(6): 1057-1063. DOI:10.1016/j.fuel.2008.11.034. |
| [11] | Vassilev S V, Kitano K, Takeda S, et al. Influence of mineral and chemical composition of coal ashes on their fusibility[J]. Fuel Processing Technology , 1995, 45(1): 27-51. DOI:10.1016/0378-3820(95)00032-3. |
| [12] | Liu B, He Q, Jiang Z, et al. Relationship between coal ash composition and ash fusion temperatures[J]. Fuel , 2013, 105: 293-300. DOI:10.1016/j.fuel.2012.06.046. |
| [13] | Wang Y, Zhao Q, Ma H, et al. Experimental study on ash fusion characteristics of Zhundong coal[J]. Journal of Chinese Society of Power Engineering , 2013, 33: 841-846. |
| [14] | Selvakumaran P, Lawerence A, Bakthavatsalam A K. Effect of additives on sintering of lignites during CFB combustion[J]. Applied Thermal Engineering , 2014, 67(1): 480-488. |
| [15] | Zhang G, Reinmöller M, Klinger M, et al. Ash melting behavior and slag infiltration into alumina refractory simulating co-gasification of coal and biomass[J]. Fuel , 2015, 139: 457-465. DOI:10.1016/j.fuel.2014.09.029. |
| [16] | Húlan T, Kaljuvee T, Štubňa I, et al. Investigation of elastic and inelastic properties of Estonian clay from a locality in Kunda during thermal treatment[J]. Journal of Thermal Analysis and Calorimetry , 2016, 124(3): 1153-1159. DOI:10.1007/s10973-016-5280-6. |
| [17] | Mandal A K, Sarkar A, Sinha O P. Utilization of lime gines as an effective binder as well as fluxing agent for making fluxed iron ore pellets[J]. Journal of The Institution of Engineers (India):Series D , 2016, 97(1): 69-75. DOI:10.1007/s40033-015-0079-3. |
| [18] | Ryshchenko M I, Shchukina L P, Fedorenko E Y, et al. Possibility of obtaining ceramogranite using quartz-feldspar raw material from Ukraine[J]. Glass and Ceramics , 2008, 65(1): 23-26. |
| [19] | LIU He-yun(刘河云). Replacement of silica with bauxite in yellow phosphorus production to improve phosphorus slag activity(用铝矾土代替硅石生产黄磷, 提高制磷炉渣活性)[J]. Phosphate & Compound Fertilizer(磷肥与复肥) , 2013, 28(3): 65-65, 72. |
| [20] | Primavera A, Pontoni L, Mombelli D, et al. EAF slag treatment for inert materials' production[J]. Journal of Sustainable Metallurgy , 2016, 2(1): 3-12. DOI:10.1007/s40831-015-0028-2. |
| [21] | Zamyatin O A, Plekhovich A D, Zamyatina E V, et al. Glass-forming region and physical properties of the glasses in the TeO2-MoO3-Bi2O3 system[J]. Journal of Non-Crystalline Solids , 2016, 452: 130-135. DOI:10.1016/j.jnoncrysol.2016.08.027. |
| [22] | Gao J, Wen G, Huang T, et al. Effect of slag-steel reaction on the structure and viscosity of CaO-SiO2-based mold flux during high-Al steel casting[J]. Journal of Non-Crystalline Solids , 2016, 452: 119-124. DOI:10.1016/j.jnoncrysol.2016.08.036. |
| [23] | Yong Fan, Etsuro Shibata, Atsushi Iizuka, et al. Crystallization behavior of copper smelter slag during molten oxidation[J]. Metallurgical and Materials Transactions B , 2015, 46(5): 2158-2164. DOI:10.1007/s11663-015-0365-3. |
| [24] | Zhang G, Reinmöller M, Klinger M, et al. Ash melting behavior and slag infiltration into alumina refractory simulating co-gasification of coal and biomass[J]. Fuel , 2015, 139: 457-465. DOI:10.1016/j.fuel.2014.09.029. |
| [25] | Wu J, Chen Z, Ma W, et al. Thermodynamic estimation of silicon tetrachloride to trichlorosilane by a low temperature hydrogenation technique[J]. Silicon , 2015, 9(1): 69-75. |
| [26] | GUO Xin(国鑫), SHI You-min(施有民), ZHENG Hua-an(郑化安), et al. Thermodynamic study on diphenyl carbonate synthesis with different feedstocks(不同反应原料合成碳酸二苯酯的热力学研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2016, 30(4): 754-760. |




