2. 公安海警学院 船艇指挥系,浙江 宁波 315801;
3. 中国地质科学院矿产资源研究所 国土资源部盐湖资源与环境研究重点开放实验室,北京 100037
2. Department of Vessel Command, China Maritime Police Academy, Ningbo 315801, China;
3. MLR Key Laboratory of Saline Lake Resources and Environment, Institute of Mineral Resources, Chinese Academy of Geological Sciences, Beijing 100037, China
近年,随着全球资源与环境问题的日益突出,锂作为一种可替代传统燃料的新型能源材料而备受重视[1, 2]。全球锂资源量一半以上都赋存于盐湖卤水中,如何开发利用其中的锂资源在无机盐化工、湿法冶金等领域已成为一个热点问题[3, 4]。研究者们对不同类型的盐湖已开发了多种卤水提锂技术,如:太阳池升温沉锂法[5]、碳酸盐沉淀法[6, 7]、净化吸附法[8, 9]、和氯化物锂混盐煅烧法[10]等。由于富锂盐湖一般处于交通、能源条件较差的地区,无论是运输沉淀剂还是浓缩富锂卤水的费用,都使其生产成本大为增加[4]。为此,本文提出了就近采用碳酸盐型盐湖卤水作为天然沉淀剂,从盐湖卤水中提取碳酸锂的新思路。中国藏北扎北盐湖为硫酸钠亚型,初步估算锂资源储量已达50万吨(以LiCl计)[11, 12]。该盐湖距碳酸盐型盐湖扎布耶茶卡较近,富碳酸根的卤水易于得到。本文以脱硫除镁的扎北盐湖高锂卤水(Li+ =16.20 g·L-1)为原料,扎布耶富碳酸根卤水(CO32- =39.51 g·L-1)为天然沉淀剂,对两种卤水进行兑卤、升温沉淀出碳酸锂,以为我国西藏富锂盐湖的开发提供相关参考。
2 实验材料和方法实验共使用了两种卤水。一种是扎北夏季卤水经脱硫除镁后,蒸发浓缩所得的高锂卤水,其密度为1.301 g·mL-1,pH值为10.46,以BI表示,在实验中用作提锂的原料卤水。另一种是扎布耶夏季盐田富碳酸根卤水,其密度为1.320 g·mL-1,pH值为10.71,以BII表示,在实验中作天然沉淀剂。BI和BII卤水组成见表 1所示。实验所用试剂皆为分析纯(北京化工厂、国药集团化学试剂有限公司),使用的水为去离子水(298.15 K时,电导率小于1×10-3 S·m-1)。
|
|
表 1 卤水BI和BII的主要化学组成 Table 1 Main chemical compositions of the brine BI and brine BII |
取200 mL的高锂卤水BI与一定体积的BII置入1 L的三口圆底烧瓶中,水浴加热至实验设定温度(CC1-K20恒温水浴,Huber公司,德国),兑卤实验中的温度条件及沉淀剂比例参见表 2。在120 r·min-1不断搅拌下(JJ-1型精密搅拌器, 荣华仪器有限公司,中国),发生反应:2Li+ + CO32- = Li2CO3。溶液变为乳白色悬浊液时,在设定温度下陈化15 min,趁热过滤获得滤饼和滤液。滤饼在105℃烘箱中烘干1 h,使用研钵研磨,过80目筛网得到碳酸锂混盐样品,称重(BL-6205电子天平,岛津公司,日本)。对滤液取样,通过化学分析确定滤液中残留的Li+及其它离子的浓度。
|
|
表 2 兑卤沉淀实验条件 Table 2 Experimental conditions of brine mixing and precipitation |
对兑卤比VBII/VBI为1.75,90℃所制备的碳酸锂混盐样品,用约3倍质量的100℃去离子水进行调浆,趁热过滤。滤饼在烘箱中105℃下烘干1 h,过80目筛网得到纯化Li2CO3样品。
2.3 分析与表征为防止实验中溶液样品发生自析盐现象,溶液样品均用移液管量取5.0 mL的溶液置于100 mL的容量瓶中,用去离子水稀释至刻度进行保存。固相样品研磨混匀以保证成分均一。样品中K+,Na+,Li+,Mg2+及Ca2+的含量采用原子吸收法进行检测(WFX-120原子吸收光度计,瑞利分析仪器公司,中国),SO42-采用重量法测定,Cl-采用硝酸银容量法测定; CO32-和HCO3-的浓度采用甲基橙和酚酞做指示剂,用0.1 mol·L-1的HCl滴定测定;硼酸根浓度为在甘露醇饱和情况下,使用酚酞做指示剂,用0.05 mol·L-1的NaOH滴定测定[13]。对所制备的纯Li2CO3粉末采用X射线衍射仪(D/MAX-RB,日本理学,日本,CuKα靶,工作电压40 kV,电流100 mA,扫描速度8°·min-1)测定其物相,以及扫描电子显微镜(Hitachi-S4800 FESEM,日立公司,日本)观测样品微观形貌。
3 实验结果为获得兑卤沉淀碳酸锂混盐的最佳工艺条件,本文对沉淀剂卤水BII与料液卤水BI的兑卤比及兑卤沉淀温度因素(参见表 2)对产物纯度及锂收率的影响进行了研究。
3.1 不同兑卤比实验按不同兑卤比例,分别将100,150,200,250,300,350,400,450,500 mL体积的BII兑入200 mL的BI中,所得混合溶液中的Li+浓度随兑入BII体积的增加而逐步降低,但CO32-浓度随兑入BII的体积而逐渐升高(本文中,卤水混合过程中的体积效应小于1%,予以忽略)。兑卤所得系列溶液中Li+/CO32-摩尔比分别为5.40,4.03,3.23,2.71,2.36,2.09,1.91,1.72,1.58。在90℃温度及不同兑卤比条件下,所得碳酸锂混盐样品的质量与纯度,以及过滤后滤液中残留的Li+含量参见表 3。为便于比较,表 3中沉淀物质量均用1 L混合卤水所沉淀出的混盐质量表示。
|
|
表 3 不同兑卤条件所得混合卤水中Li+和CO32-浓度及90℃沉淀所得碳酸锂混盐的纯度和收率 Table 3 Concentrations of Li+ and CO32- under different VBII/VBI ratios and Li2CO3 purity and yields after precipitation at 90℃ |
在5~90℃不同温度条件下,按照VBII/VBI=1.75的兑卤比条件,沉淀所得碳酸锂混盐样品的质量与纯度,以及过滤后滤液中残留的Li+含量见表 4。
|
|
表 4 兑卤比为1.75不同温度条件下沉淀所得碳酸锂混盐的纯度和收率 Table 4 Li2CO3 purity and yields after precipitation with VBII/VBI =1.75 under different temperatures |
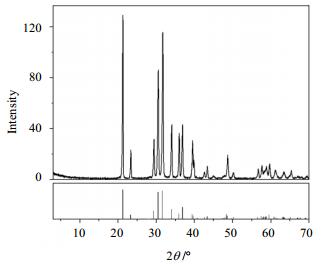
对85.18 g最佳兑卤条件下所制备的碳酸锂混盐样品,用250 mL、100℃的去离子水趁热调浆、淋洗、过滤。滤饼烘干研磨后,过80目筛网得到64.52 g提纯碳酸锂粉末样品。提纯所得碳酸锂粉末样品的化学组成如表 5所示:Li2CO3含量99.85%,粉末样品的XRD图谱如图 1所示,SEM照片参见图 2。
|
|
表 5 提纯碳酸锂粉末样品的化学组成 Table 5 Chemical compositions of the prepared Li2CO3 powder |
|
图 1 提纯Li2CO3粉末的XRD谱图 Fig.1 XRD pattern of the purified Li2CO3 powder |

|
图 2 提纯Li2CO3粉末的SEM照片 Fig.2 SEM micrograph of the purified Li2CO3 powder |
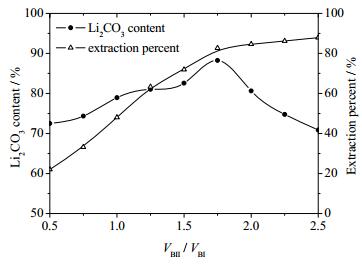
从表 3可见,实验中随着兑卤比(VBII/VBI)从0.5到2.5不断提高,Li+/CO32-摩尔比从5.04逐渐降至1.58,所得混合卤水由锂过量逐渐转变为碳酸根过量。由表 3所列实验结果,作VBII/VBI对所沉淀混盐中碳酸锂含量及锂收率的影响关系图,如图 3所示。
|
图 3 VBII/VBI与产物Li2CO3含量及锂收率的关系 Fig.3 Relationship between VBII/VBI and Li2CO3 contents and lithium extraction percentage |
兑卤比对产物碳酸锂含量的影响,呈峰值前递增、峰值后递减状态。产物含量的峰值为88.25%,VBII/VBI比为1.75;增大兑卤比,有利于提高卤水锂收率。但是在锂收率达到82.66%之前,随VBII/VBI比增加,锂收率迅速增长。而在此之后,锂收率增长缓慢。这主要是由于在不同兑卤比条件下,混合卤水溶液中的Li+/CO32-摩尔比不同所致。当VBII/VBI<1.75时,混合卤水中Li+过量,VBII/VBI>1.75时,混合卤水中CO32-过量,只有当兑卤比VBII/VBI=1.75时,卤水中Li+与CO32-之比接近碳酸锂沉淀所需的化学计量比(2:1)。所以当兑卤比VBII/VBI=1.75时,碳酸锂沉淀过程中由表面吸附所带出的共沉淀杂质最少[14],产物中碳酸锂的含量达最大值,此时溶液中大部分Li+已经被沉淀。从不同兑卤比提锂实验研究可见,VBII/VBI =1.75是最优的沉锂条件,此时所的沉淀产物中碳酸锂的含量最高,并且锂收率也较大。
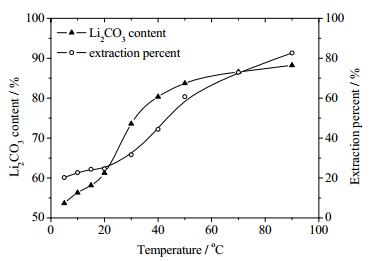
4.2 不同沉淀温度对对产物纯度及锂收率的影响根据表 4作沉淀温度对产物Li2CO3含量及锂收率的影响关系图(图 4)。从图 4可见,由于碳酸锂溶解度具有逆温度效应[15],产物中的碳酸锂含量总体呈随沉淀温度升高而相应增加的趋势。当沉淀温度低于40℃时,产物中Li2CO3含量随沉淀温度升高而显著增加,平均每升高1℃含量增加0.76%;当沉淀温度在高于40℃时,沉淀混盐中Li2CO3含量却增长缓慢,平均每升高1℃含量仅增加0.16%。这主要是因为当温度在40℃以下时溶液基本不蒸发,沉淀中杂质主要为碳酸锂沉淀中由表面吸附所带出的共沉淀物。随温度的升高共沉淀效应逐渐减弱[14],在5~40℃,产物中Li2CO3含量随沉淀温度升高显著增加。当温度在40℃以上时,由于溶液蒸发量变大析出较多混盐,导致Li2CO3含量随温度升高而增加的趋势减弱。此外,当沉淀温度低于20℃时,实验中碳酸锂收率稳定在24%左右;而沉淀温度高于30℃以后,碳酸锂收率迅速升高,到90℃碳酸锂收率达82.66%。这主要是由于混合卤水的盐度极高(~430 g·L-1),盐效应使溶液在低温时的CO32-有效浓度远低于真实浓度。但是,随混合卤水温度升高,HCO3-电离度升高[16],溶液中CO32-的有效浓度显著增加,使碳酸锂收率也随之升高。
|
图 4 沉淀温度与产物Li2CO3含量及锂收率的关系 Fig.4 Relationship between precipitation temperatures and Li2CO3 contents and lithium extraction percentag |
从样品的XRD图谱(图 1)可见,所制备的纯Li2CO3粉末的各衍射峰与天然碳酸锂-扎布耶石[17]的标准谱(JCPDS:72-1216)完全一致,未发现其它杂质峰。粉末为单斜晶系扎布耶石晶态物质。从SEM照片(图 2)可见,碳酸锂晶形由于溶蚀而发生部分缺失,呈柱状或片状分布。其粒径分布不均,多在1~5 μm,颗粒的分散性较好,具有较大的表面积。
4.4 与扎布耶茶卡卤水单独升温沉锂的比较相比直接使用扎布耶茶卡卤水升温沉锂[18],通过扎北BI卤水与扎布耶盐田BII卤水兑卤,所得提锂卤水Li+起始浓度(6.69 g·L-1)是扎布耶茶卡浓缩锂卤水中的Li+浓度(2.62 g·L-1)的2.55倍,通过兑卤沉淀所析出混盐中碳酸锂含量增长了7.46%,锂收率增长了21.32%左右。说明采用兑卤工艺进行多盐湖联合开发,相比单盐湖通过卤水升温沉锂工艺独立开采,在产物的收率和纯度上均更具优势。
5 结论实验以脱硫除镁的扎北高锂卤水BI为原料,扎布耶盐田富碳酸根卤水BII为天然沉淀剂,通过对兑卤比及温度对所沉淀混盐中碳酸锂含量及收率影响的研究,确定在兑卤比VBII/VBI=1.75、90℃条件下进行兑卤沉淀是最优的提取条件。在此条件下,兑卤沉淀所获混盐中碳酸锂含量为88.25%,锂收率为82.66%。对兑卤沉淀的碳酸锂混盐进行进一步的调浆、水洗,最终获得了纯度为99.85%的Li2CO3粉末。所得产物粉末粒径多在1~5 μm,呈柱状或片状,粉末颗粒的分散性较好,具有较大的表面积。通过利用扎北盐湖附近的富碳酸根卤水作为天然沉淀剂,可避免工业沉淀剂对湖泊自然环境造成的影响与破坏,并同时降低碳酸锂的生产成本。相对单盐湖升温沉锂,采用脱硫除镁扎北高锂卤水与扎布耶盐田富碳酸根卤水进行兑卤,能大幅提高料液卤水中的Li+浓度、沉淀所得碳酸锂混盐在收率和含量上更有优势,更适于在交通不便、工业能源条件较差的西藏高原进行卤水锂资源的提取。
| [1] | LIU Li-jun(刘丽君), WANG Deng-hong(王登红), LIU Xi-fang(刘喜方), et al. The main types, distribution features and present situation of exploration and development for domestic and foreign lithium mine(国内外锂矿主要类型、分布特点及勘查开发现状)[J]. Geology in China(中国地质) , 2017, 44(2): 263-278. |
| [2] | ZHAO Xiao-yu(赵晓昱). Review on new techniques for lithium extraction from seawater and brine(海卤水提锂新技术研究现状及展望)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2017, 31(3): 497-508. |
| [3] | Jaskula B W. Lithium, USGS Mineral Yearbook[DB/OL]. U. S. Geological Survey, 2016-11-16[2017-10-01]. https://minerals.usgs.gov/minerals/pubs/commodity/lithium/myb1-2014-lithi.pdf. |
| [4] | GAO Feng(高峰), ZHENG Mian-ping(郑绵平), NIE Zhen(乜贞), et al. Brine lithium resource in the salt lake and advances in its exploitation(盐湖卤水锂资源及其开发进展)[J]. Acta Geoscientica Sinica(地球学报) , 2011, 32(4): 483-492. |
| [5] | ZHENG Mian-ping (郑绵平), BU Ling-zhong (卜令忠), DENG Yue-jin (邓月金), et al. Method of using solar pond to precipite crystallized lithium carbonate from carbonate style brine(利用太阳池从碳酸盐型卤水中结晶析出碳酸锂的方法): CN, 1398786 [P]. 2002-09-04. |
| [6] | LIU Kai(刘凯), LIANG Qu(梁渠), PANG Sha-sha(庞莎莎), et al. Separation of lithium and magnesium in salt lake brine with high ratio of magnesium to lithium(高镁锂比盐湖卤水中锂镁沉淀法的分离研究)[J]. Chemical Reagents(化学试剂) , 2017, 39(5): 534-538. |
| [7] | CUI Xiao-qin(崔小琴), CHENG Fang-qin(程芳琴), ZHANG Ai-hua(张爱华), et al. Study on precipitation separating technique for magnesium and lithium from salt lake brine(盐湖卤水镁锂沉淀分离工艺研究)[J]. Inorganic Chemicals Industry(无机盐工业) , 2012, 44(7): 33-35. |
| [8] | CAO Wei(曹伟), SUN Shu-ying(孙淑英), SONG Xing-fu(宋兴福), et al. Preparation of Lithium Carbonate from a Li-bearing Desorption Solution(含锂脱附液制备碳酸锂)[J]. The Chinese Journal of Process Engineering(过程工程学报) , 2016, 16(3): 424-430. DOI:10.12034/j.issn.1009-606X.215395. |
| [9] | Hawash S, Kader E A E, Diwani G E. Methodology for selective adsorption of lithium ions onto polymeric aluminum (Ⅲ) hydroxide[J]. Journal of American Science , 2010, 6(11): 301-309. |
| [10] | YANG Jian-yuan (杨建元), XIA Kang-ming (夏康明). The method of lithium carbonate, magnesium oxide and hydrochloric acid production from high-Mg and low-Li brine (用高镁含锂卤水生产碳酸锂、氧化镁和盐酸的方法): CN, 1724372 [P]. 2006-01-25. |
| [11] | ZHENG Xi-yu(郑喜玉), ZHANG Ming-gang(张明刚), XU Chang(徐昶), et al. Salt lakes of China(中国盐湖志)[M].Beijing(北京): Science Press(科学出版社), 2002: 109-110. |
| [12] | Gao F, Zheng M, Song P, et al. The 273.15 K-isothermal evaporation experiment of lithium brine from the zhabei salt lake, tibet, and its geochemical significance[J]. Aquatic Geochemistry , 2012, 18(4): 343-356. DOI:10.1007/s10498-012-9168-1. |
| [13] | Analysis Group, Qinghai Saline Lake Institute, Chinese Academy of Sciences (中国科学院青海盐湖研究所分析室). Analysis methods for brine and salt(卤水和盐的分析方法)[M].2nd ed.Beijing(北京): Science Press(科学出版社), 1988: 159-232. |
| [14] | Wuhan University(武汉大学). Analytical chemistr(分析化学)[M].3rd ed.Beijing(北京): Higher Education Press(高等教育出版社), 1995: 316-324. |
| [15] | XIAO Shu-yang (肖树阳). Experimental study of brine heating-uo with solar pond(盐湖卤水利用太阳池升温实验研究) [D]. Beijing (北京). The University of Chinese Academy of Sciences (中国科学院大学), 2013. |
| [16] | He S L, Kan A T, Tomson M B. Inhibition of calcium carbonate precipitation in NaCl brines from 25 to 90℃[J]. Applied Geochemistry , 1999, 14(1): 17-25. DOI:10.1016/S0883-2927(98)00033-X. |
| [17] | LIN Yue-mei(林月美), ZHANG Han-qing(张汉卿), ZHENG Mian-ping(郑绵平). The new lithium minerals-crystal structure of Zabuyelite(新的锂矿物——扎布耶石的晶体结构)[J]. Chinese Science Bulletin(科学通报) , 1989, 34(12): 920-923. |
| [18] | BU Ling-zhong(卜令忠), NIE Zhen(乜贞), ZHENG Mian-ping(郑绵平), et al. Study on quick extraction of lithium by heating carbonate-type brine at a series of temperature conditions(系列升温条件下碳酸盐型卤水快速提锂研究)[J]. Journal of Salt and Chemical Industry(盐业与化工) , 2009, 38(6): 1-4. |




