2. 国家"江苏先进生物与化学制造协同创新中心",江苏 南京 210009;
3. 南京工业大学 材料化学工程国家重点实验室,江苏 南京 210009
2. Jiangsu National Synergetic Innovation Center for Advanced Materials(SICAM), Nanjing 210009, China;
3. State Key Laboratory of Materials Oriented Chemical Engineering, Nanjing Tech University, Nanjing 210009, China
3-乙氧基丙酸乙酯(英文名Ethyl 3-ethoxypropionate,简称EEP)是一种低挥发性的醚酯溶剂,由于其挥发速度慢,溶液黏度低,对很多聚合物具有较强的溶解性,被广泛地应用于电子、清洗、涂料、印刷油墨以及医药中间体合成等行业。目前,工业上生产EEP主要采用丙烯酸乙酯(EA)和乙醇的碱催化加成反应,常用的催化剂为乙醇钠[1]和强碱性阴离子交换树脂[2]。乙醇钠催化法相对较为经济,但需要在反应结束后破坏乙醇钠,产生较多含盐废水;阴离子交换树脂耐高温性能差,反应必须控制温度在35℃以下。因此开发高活性易分离的非均相固体碱催化剂对EEP的高效清洁生产具有重要意义。
由于负载型碱金属催化剂具有较为宽广的碱性范围以及制备方法简单等优点,得到了广泛的研究和应用[3~5]。夏春谷等[6]采用KF/Al2O3作为催化剂,以CH3CN为溶剂,室温下反应18 h,EEP收率为90%。Kharat等[7, 8]以NaY分子筛为载体,采用CsCO3溶液进行离子交换得到CsY分子筛催化剂,回流温度下反应12 h,EA的转化率为76.3%。虽然负载型碱金属催化剂具有较高活性,但是活性组分易流失。Yang等[9]认为负载型碱金属催化大豆油酯交换反应中反应物和产物覆盖活性位点并与之发生反应,导致碱量减少造成失活。Libor等[10]认为菜籽油酯交换反应中K元素的流失与反应体系中的醇羟基数量和位阻有关,醇羟基数量越少,羟基之间的位阻越大,K流失量越少。KNO3作为中性化合物,负载在载体Al2O3上经焙烧后可生成强碱性位,表现出优异的催化活性,是一种高效、经济的固体碱催化剂[11, 12],但在EEP合成中应用、催化稳定性及活性组分流失方式未见文献报道。
本文以KNO3为前驱体,γ-Al2O3为载体,采用等体积浸渍法制备了不同负载量的固体碱催化剂,考察了催化剂在焙烧过程中前驱体和载体之间的相互作用关系,及其在EA和乙醇加成制备EEP中的催化性能,研究活性组分在反应中的存在形式、作用机理以及影响催化剂重复使用性能的失活原因,为合成EEP的高稳定性固体碱催化剂研制提供基础。
2 实验部分 2.1 实验试剂γ-Al2O3(化学纯),上海凌峰化学试剂有限公司;硝酸钾(化学纯),国药集团化学试剂有限公司;无水乙醇(化学纯),无锡市亚盛化工有限公司;丙烯酸乙酯(化学纯),上海凌峰化学试剂有限公司。
2.2 催化剂制备催化剂由等体积浸渍法制备:以制备10%(wt) K2O/Al2O3催化剂为例,称取0.4 g KNO3溶于适量的水中,再称取4 g γ-Al2O3溶于上述KNO3溶液,超声溶解2 h,60℃下干燥6 h,N2氛围下600℃焙烧4 h,得到KNO3和Al2O3质量比为10%的催化剂,记作10%K2O/Al2O3。(通过改变前驱体KNO3与载体γ-Al2O3的质量比分别制备20%、30%、40% K2O/Al2O3的催化剂)。
2.3 催化剂表征X射线衍射(XRD)分析在日本Rigaku公司SmartLab衍射仪上进行,其中,CuKα为射线源,管电压40 kV,管电流40 mA,扫描范围2θ=10~80°,扫描步长0.02°,扫描速度20 °·min-1。傅里叶变换红外光谱(FT-IR)是在ThemoNicolet公司的AVATAR 360型傅里叶变换红外光谱仪上测定的,测试波数范围为4000~400 cm-1,分辨率:4 cm-1,扫描次数:32次。测试在常温下进行,样品采用溴化钾压片。N2吸附-脱附(N2-Adsorption Desorption)是在日本BEL SORP Ⅱ比表面积孔容分析仪上进行测定的,测定前样品于200℃下真空预处理2 h。采用BET法计算比表面积,BJH法分析孔结构。CO2程序升温脱附(CO2-TPD)是在美国Micromeritics公司的2920型吸附仪器上进行,以CO2为吸附质,He为载气。X射线荧光光谱分析(XRF)是在德国Bruker公司生产的SRS3400型X射线荧光光谱仪上测定。Hammett指示剂法表征催化剂的碱强度,具体步骤[13]为:取约0.2 g焙烧后的催化剂样品于表面皿上,然后滴加0.1 mL的Hammett指示剂,观察固体碱催化剂表面指示剂颜色变化。催化剂能够使指示剂由它的酸式颜色变为其共轭碱的颜色时,说明该固体碱的碱强度大于这种指示剂的H_值。所采用的Hammett指示剂分别为溴百里酚蓝(H_=7.2),酚酞(H_=9.8),2, 4-二硝基苯胺(H_=15.0),4-二硝基苯胺(H_=18.4)。
2.4 丙烯酸乙酯与乙醇加成反应将27.6 g乙醇和1.0 g催化剂加入四口烧瓶反应器中,反应器配有冷凝管、温度计和机械搅拌。采用油浴控温,待温度升至设定的反应温度,逐滴滴加10.0 g丙烯酸乙酯,滴加结束后开始计时,反应过程中间隔一定时间取样分析。采用气相色谱进行定量分析,以正丙醇为内标物。EA转化率和EEP选择性计算公式见(1) 和(2)。
| ${X_{{\rm{EA}}}} = 1 - \frac{{{\omega _{{\rm{EA}}}}{m_0}}}{{{M_{{\rm{EA}}}}{n_{{\rm{EA0}}}}}}$ | (1) |
| ${{S}_{\text{EEP}}}=\frac{{{{\omega }_{\text{EEP}}}{{m}_{0}}}/{{{M}_{\text{EEP}}}}\;}{{{n}_{\text{EA0}}}-{{{m}_{0}}{{\omega }_{\text{EA}}}}/{{{M}_{\text{EA}}}}\;}$ | (2) |
本文首先采用XRD、N2吸附-脱附等表征催化剂结构,确定适宜的负载量,采用FT-IR和CO2-TPD表征前驱体与载体之间的相互作用关系,确定催化剂中碱活性位来源。然后考察KNO3负载量,催化剂用量,醇酯摩尔比以及反应温度对丙烯酸乙酯和乙醇的加成反应的影响,最后研究催化剂重复使用性能,研究活性组分在反应中的存在形式、作用机理以及影响催化剂重复使用性能的失活原因。
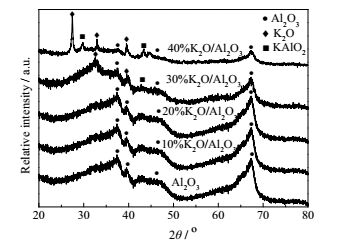
3.1 催化剂的表征图 1为K2O/Al2O3的XRD谱图,图中衍射峰37.5°,39.5°,45.6°,66.6°分别归属于γ-Al2O3立方相的(311)、(222)、(400)、(440) 晶面(JCPDS卡号10-0425)。衍射峰27.6°,33.0°,39.0°分别归属于K2O的(200),(420),(220) 晶面(JCPDS卡号47-1701),表明催化剂经过焙烧之后,KNO3分解为K2O。同时,29.1°,43.1°处出现了KAlO2的衍射峰(JCPDS卡号02-0897),表明在催化剂的焙烧过程中,KNO3与Al2O3反应生成了KAlO2新物种,形成了K-O-Al结构。当负载量低于30%时,未观察到明显的K2O和KAlO2衍射峰,表明低负载量下,KNO3在载体上高度分散,未形成晶相[14]。
|
图 1 K2O/Al2O3的XRD谱图 Fig.1 The XRD patterns of K2O/Al2O3 |
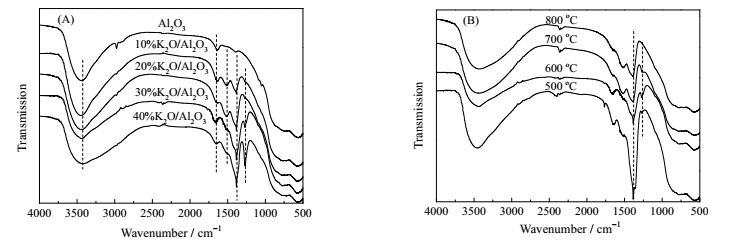
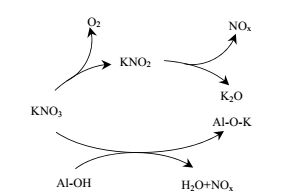
图 2是K2O/Al2O3的FT-IR谱图。3460 cm-1处出现的宽而大吸收峰可部分归结为K-O-Al结构的特征吸收峰。1640 cm-1处出现的小吸收峰为样品吸收空气中的H2O形成的O-H弯曲振动峰。1540 cm-1处为CO32-的特征吸收峰,可归因于K2O与空气中的CO2反应生成碳酸盐。谱图中1384 cm-1处为NO3-的特征吸收峰,从图 2(A)中可以看出,随着负载量的增加,NO3-峰强度逐渐增加。从图 2(B)中可以看出,当30%K2O/Al2O3的焙烧温度由500℃升至800℃时,NO3-峰强度逐渐减小,说明升高温度有利于KNO3分解生成K2O。对于负载型碱金属催化剂在焙烧活化过程中,碱性活性位的来源以及前驱体与载体之间的相互作用关系存在多种理论。朱建华等[15]认为KNO3/Al2O3在高温焙烧下会生成K2[Al(NO3)5]新物种,而600 ℃真空焙烧时K2[Al(NO3)5]会继续分解。Xie等[16]认为KNO3在载体上先分解生成KNO2,KNO2继续分解为K2O,从而产生碱性活性位。从FT-IR谱图中可以看出1270 cm-1处出现了KNO2特征吸收峰,说明高温焙烧时,KNO3的分解过程为:KNO3先分解为KNO2,KNO2在高温下继续分解为K2O,这与Xie等人[16]的研究结论一致。同时图 2(B)中,随着温度的升高,KNO2的峰强度逐渐减小,进一步验证温度的升高有利于KNO3分解生成K2O。因此,KNO3与载体Al2O3之间的相互作用关系如图 3表示,KNO3经过高温焙烧分解生成KNO2,KNO2在高温下继续分解K2O,同时KNO3和载体Al2O3在高温下相互作用生成K-O-Al结构。
|
图 2 不同负载量K2O/Al2O3(A)和30%K2O/Al2O3不同焙烧温度(B)的FT-IR谱图 Fig.2 FT-IR spectra of K2O/Al2O3 with different loading amounts (A) and 30%K2O/Al2O3 prepared under different calcined temperatures (B) |
|
图 3 KNO3与Al2O3之间相互作用关系图 Fig.3 Scheme of interaction between KNO3 and Al2O3 |
从表 1的K2O/Al2O3孔结构参数表中可以看出,前驱体KNO3的加入明显地改变了载体Al2O3的结构参数。具体表现为,随着负载量的增加,最可几孔径逐渐增加,孔容和比表面积均逐渐减小。当负载量超过30%时,最可几孔径由原来的3.75 nm突变为4.82 nm,可能的原因是KNO3进入催化剂的小孔,导致小孔塌陷,而大孔受影响较小,平均孔径变大[17],说明当KNO3负载量超过一定量时,会改变载体的孔径和孔道结构的规整性,破坏载体的结构。
| 表 1 K2O/Al2O3的孔结构参数 Table 1 Pore properties of K2O/Al2O3 |
K2O/Al2O3的碱强度和碱量可以分别通过Hammett指示剂法和CO2-TPD结果计算得出。结果表明,不同负载量的催化剂均能使2, 4-二硝基苯胺变色,而不能使4-硝基苯胺变色,说明催化剂的碱强度在15.0~18.4之间,属于中强碱。根据CO2-TPD计算得到的K2O/Al2O3碱量分布如表 2所示,可以看出,K2O/Al2O3具有两种碱性位,分别是由K-O-Al提供的弱碱性位和由K2O提供的强碱性位。随着负载量的增加,弱碱性位的碱量逐渐减小,而强碱性位的碱量逐渐增加,总碱量由0.52 mmol·g-1增加到2.37 mmol·g-1,说明增加负载量有利于增强催化剂碱性。综合催化剂的孔结构参数表征结果,KNO3的负载量过高会对载体的结构造成破坏,本文确定适宜的KNO3负载量为30%。
| 表 2 K2O/Al2O3的CO2-TPD结果 Table 2 CO2-TPD results of K2O/Al2O3 |
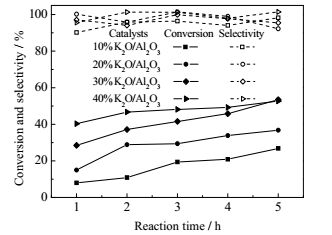
考察乙醇和EA摩尔比为6:1,反应温度为70℃,催化剂用量为EA的10%(wt)时,其对EA和乙醇加成反应的催化性能结果如图 4所示。在30%K2O/Al2O3的催化作用下,EA和乙醇加成反应5 h,EA转化率最高为53.6%,EEP选择性为98.8%。同时,随着KNO3负载量的增加,催化剂的碱性越强,反应的转化率也越高,但当KNO3负载量由30%增加为40%时,转化率并没有较大的提高,其原因可能在于40%K2O/Al2O3催化剂的载体结构遭到破坏,导致不是所有的碱性活性位都能与反应液完全接触[18]。
|
图 4 K2O/Al2O3的催化活性 Fig.4 Catalytic performance of K2O/Al2O3 |
在反应时间5 h条件下,分别考察催化剂用量、乙醇和EA摩尔比、反应温度对反应的影响,结果如表 3所示。当反应温度为70℃,醇酯摩尔比为6:1,随着催化剂用量的增加,EA的转化率逐渐增加,说明增加催化剂的用量可以提高EA转化率。当催化剂用量为10%(wt),反应温度70℃,EA转化率随着醇酯摩尔比增大而增大,醇酯摩尔比由3:1增至6:1时,EA转化率由25.0%提高至53.6%,但当醇酯摩尔比提高至10:1时,EA转化率没有提高,因此确定醇酯最佳摩尔比为6:1。当催化剂用量为10%(wt),醇酯摩尔比为6:1,升高温度可以提高EA转化率,但当温度升高到80℃,EA转化率下降,其可能的原因在于,常温常压下,乙醇的沸点为79℃,80℃下乙醇部分挥发,导致醇酯比下降,EA的转化率下降。
| 表 3 不同工艺条件下30% K2O/Al2O3催化反应结果 Table 3 Catalytic reaction results of 30%K2O/Al2O3 under different processing conditions |
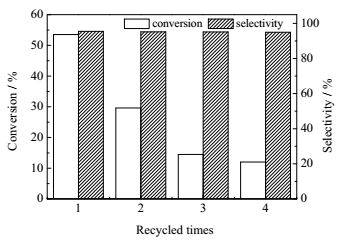
在催化剂用量为10%(wt),反应温度70℃,醇酯摩尔比为6:1,反应时间5 h条件下,考察了催化剂30%K2O/Al2O3的循环使用稳定性。反应结束后,过滤回收催化剂,N2氛围下600℃焙烧4 h后再循环使用,反应结果如图 5所示。在第二次重复性实验中,EA转化率从53.6%下降至23.9%,推测催化剂活性下降的原因可能在于催化剂中部分活性位流失,导致催化剂逐渐失活。
|
图 5 30% K2O/Al2O3重复使用性能 Fig.5 The recyclability of 30% K2O/Al2O3 |
采用XRF测定了催化剂中K、Al元素含量,并计算出催化剂中K/Al摩尔比,结果如表 4所示。催化剂重复使用4次后,K/Al摩尔比由0.18降至0.08,即,当反应中载体Al2O3质量不变时,K元素损失量为55.6%。催化剂在第二次重复使用时,K元素含量下降最明显,第三、四次含量几乎不变,这一变化规律与催化剂4次循环反应后EA的转化率变化相一致。由此可以验证,K元素的流失,是导致催化剂重复使用催化效率降低的主要原因。
| 表 4 催化剂重复使用次数和K流失的关系 Table 4 Potassium leaching from 30%K2O/Al2O3 at different recycled times |
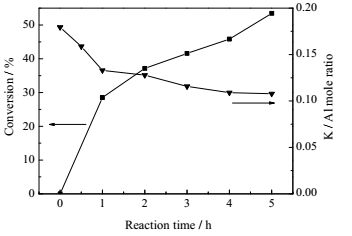
同时,对单次反应催化剂中K元素的流失量随反应时间变化规律进行考察,结果如图 6所示。从图 6中可以看出,在反应刚开始的一个小时内,K元素流失速度最快,由最初的0.18下降到0.14,同时在这段时间内EA的转化率增加最快。随着反应的进行,K元素的流失速度逐渐降低,并最终趋向平衡,说明催化剂中部分K元素具有较高的稳定性,并不能完全溶于乙醇。
|
图 6 30%K2O/Al2O3反应时间和K流失的关系 Fig.6 Potassium leaching from 30%K2O/Al2O3 as a function of reaction time |
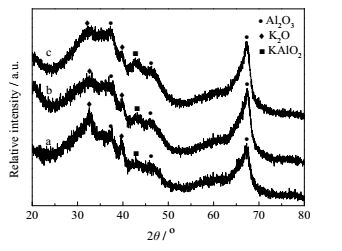
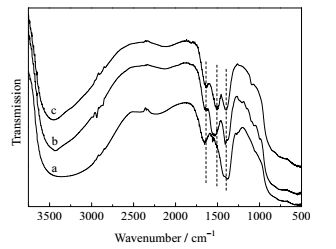
接着,考察了流失到溶液中的K元素在溶液中的形式存在。采用饱和MgCl2溶液对反应后的溶液进行滴定,无Mg(OH)2沉淀产生,由此可以证明,反应液中不存在OH-。从图 7的新鲜催化剂与反应4次后催化剂的XRD谱图对比可以看出,33.0°和39.0°处表示K2O晶体衍射峰强度明显减小,43.1°的处表示KAlO2晶体衍射峰强度几乎不变,说明催化剂中溶解于反应液的是K2O中的K元素,而K-O-Al结构中的K元素溶解量很少。乙醇洗涤4次之后的催化剂与反应4次之后的催化剂XRD谱图中K2O和KAlO2衍射峰强度相同,可以证明,催化剂中K2O和反应液中的乙醇存在反应-溶解过程。图 8的FT-IR谱图结果同样可以证明,催化剂中溶解于反应液中的主要是K2O中的K元素(新鲜催化剂与反应4次后催化剂中3460 cm-1处表示K-O-Al结构的特征吸收峰强度几乎没有变化,而1540 cm-1和1384 cm-1处表示CO32-和NO3-峰强度减小)。同时,乙醇洗涤4次后得到的催化剂与反应4次后催化剂的红外特征吸收峰强度基本一样(3460 cm-1、1540 cm-1和1384 cm-1),与XRD表征结果一致,证明,催化剂中K2O和反应液中的乙醇存在反应-溶解过程,而K-O-Al结构较为稳定。但是K-O-Al属于弱碱性位,催化效果并不明显,强碱性位K2O与乙醇反应生成的乙醇钾溶解流失是导致催化剂重复使用性能降低的主要原因。
|
图 7 K2O/Al2O3的XRD谱图 Fig.7 XRD patterns of K2O/Al2O3 (a) fresh catalyst (b) after five runs (c) washed five times with ethanol |
|
图 8 K2O/Al2O3的FT-IR谱图 Fig.8 FT-IR spectra of K2O/Al2O3 (a) fresh catalyst (b) after five runs (c) washed five times with ethanol |
虽然催化剂在重复使用多次之后K2O会与乙醇发生反应-溶解过程,但是催化剂的载体结构并未被破坏。因此,通过计算得出K元素流失的摩尔量,将等摩尔量的KNO3通过再次浸渍的方法负载到失活催化剂上,N2氛围下600℃焙烧4 h后,得到的催化剂在相同的条件下进行反应,5 h后EA转化率50.1%,EEP选择性99.3%,几乎与新鲜催化剂的催化性能相同,说明通过再次负载流失的钾量可以恢复催化剂活性。失活以及再生催化剂的孔结构参数如表 5所示,失活催化剂最可几孔径的减小,孔容和比表面积的增加,再一次验证催化剂失活是由于活性组分的流失造成。经过再生之后的催化剂最可几孔径增加,原因在于再次负载上去的KNO3和Al2O3之间会发生相互作用生成K-O-Al,一定程度上会破坏载体结构。
| 表 5 K2O/Al2O3的孔结构参数 Table 5 Pore properties of 30% K2O/Al2O3 |
尽管K2O/Al2O3在EA和乙醇的加成反应中表现了较高的催化活性,但阻碍其工业化主要原因在于乙醇与催化剂上的钾物种相互作用生成乙醇钾,并从载体上脱落,这种K元素的反应-溶解过程是不可逆的[19],导致催化剂中的强碱性位减少,催化剂的重复使用性能降低。因此,抑制固体碱催化剂中K2O与有机醇反应后生成的乙醇钾流失过程,是提高含K元素固体碱催化剂稳定性的途径,研究能直接稳定乙醇钾的固体碱催化剂是重要的研究方向。
4 结论以γ-Al2O3为载体,KNO3为前驱体,通过等体积浸渍法制备了不同负载量的K2O/Al2O3催化剂,研究了催化剂在EA和乙醇加成反应体系中的性能和活性下降原因,得出以下结论:
(1) K2O/Al2O3催化剂具有由K2O提供的强碱性位和K-O-Al提供的弱碱性位两种碱性活性位。其中K2O是KNO3经过高温焙烧分解生成KNO2,KNO2在高温下继续分解生成的,同时KNO3和载体Al2O3相互作用生成K-O-Al。提高KNO3的负载量可增强催化剂碱强度,但会破坏载体结构,降低催化剂比表面积和孔容。
(2) 30% K2O/Al2O3在EA和乙醇的加成反应中具有最高的催化活性,当反应温度为70℃,乙醇和EA摩尔比为6:1,催化剂用量为EA的10%(wt)时,EA的转化率为53.6%,EEP的选择性为98.8%。
(3) K2O/Al2O3催化剂中的强碱性位K2O与乙醇反应生成乙醇钾,乙醇钾溶解于反应液导致活性位流失是造成催化剂活性显著下降的主要原因,通过将流失的钾再次负载可以恢复催化剂活性。
符号说明:
| MEA | —丙烯酸乙酯的摩尔质量,g·mol-1 | SEEP | —EEP的选择性 |
| MEEP | —EEP的摩尔质量,g·mol-1 | XEA | —丙烯酸乙酯的转化率 |
| m0 | —反应液总质量,g | ωEA | —反应液中最终丙烯酸乙酯的质量含量,% |
| nEA0 | —丙烯酸乙酯初始物质的量,mol | ωEEP | —反应液中最终EEP的质量含量,% |
| [1] | YU Xiao-ou (俞小鸥), WANG Shu-min (王树敏), DENG Yi-jian (邓一建), et al. Method for preparing ethyl 3-ethoxypropionate (3-乙氧基丙酸乙酯的制备方法): CN, 101423475B[P]. 2009-05-06. |
| [2] | LUO Xin-peng (罗鑫鹏), WU Xiao-qiang (吴小强). Method for preparing ethyl 3-ethoxypropionate (一种合成3-乙氧基丙酸乙酯的制备方法): CN, 104016861A[P]. 2014-09-03. |
| [3] | Yoshio O, Hideshi H. Solid base catalysis (固体碱催化)[M]. GAO Zi (高滋), LE Ying-hong (乐英红), HUA Wei-ming (华伟明), trans. Shanghai (上海): Fudan University Press (复旦大学出版社), 2013. |
| [4] | GUO Deng-feng(郭登峰), ZHAO Hui-jing(赵会晶), ZHAO Wen(赵文), et al. Synthesis of 2-allyloxyethanol catalyzed with KF/attapulgite(凹凸棒负载KF催化合成乙二醇烯丙基醚)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28(2): 270-274. |
| [5] | XIN Shi-cai(邢世才), ZHENG Lan(郑岚), WANG Yu-qi(王玉琪), et al. Direct synthesis of dimethyl carbonate with CO2 and CH3OH catalyzed by KOH/C under supercritical conditions(KOH/C催化超临界CO2与CH3OH直接合成碳酸二甲酯的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(5): 1120-1125. |
| [6] | Yang L, Xu L W, Xia C G. Highly efficient KF/Al2O3-catalyzed versatile hetero-Michael addition of nitrogen, oxygen, and sulfur nucleophiles to α, β-ethylenic compounds[J]. Tetrahedron Letters , 2005, 46(19): 3279-3282. DOI:10.1016/j.tetlet.2005.03.112. |
| [7] | Zamanian S, Kharat A N. Cyanoethylation of alcohols and amines by cesium-modified zeolite Y[J]. Chinese Journal of Catalysis , 2014, 35(2): 264-269. DOI:10.1016/S1872-2067(12)60751-7. |
| [8] | Zamanian S, Kharat A N. Catalytic olefin hydroalkoxylation by nano particles of pollucite[J]. Australian Journal of Chemistry , 2015, 68(6): 981-986. DOI:10.1071/CH14492. |
| [9] | Yang Z Q, Xie W L. Soybean oil transesterification over zinc oxide modified with alkali earth metals[J]. Fuel Processing Technology , 2007, 88(6): 631-638. DOI:10.1016/j.fuproc.2007.02.006. |
| [10] | Capek L, Hajek M, Kutalek P, et al. Aspects of potassium leaching in the heterogeneously catalyzed transesterification of rapeseed oil[J]. Fuel , 2014, 115(1): 443-451. |
| [11] | Evangelista J P D C, Gondim A D, Souza L D, et al. Alumina-supported potassium compounds as heterogeneous catalysts for biodiesel production:a review[J]. Renewable & Sustainable Energy Reviews , 2016, 59: 887-894. |
| [12] | Xie W L, Chen J. Heterogeneous interesterification of triacylglycerols catalyzed by using potassium-doped alumina as a solid catalyst[J]. Journal of Agricultural & Food Chemistry , 2014, 62(43): 10414-10421. |
| [13] | Sun L B, Liu X Q, Zhou H C. Design and fabrication of mesoporous heterogeneous basic catalysts[J]. Chemical Society Reviews , 2015, 44(15): 5092-5147. DOI:10.1039/C5CS00090D. |
| [14] | Noiroj K, Intarapong P, Luengnaruemitchai A, et al. A comparative study of KOH/Al2O3 and KOH/NaY catalysts for biodiesel production via transesterification from palm oil[J]. Renewable Energy , 2009, 34(4): 1145-1150. DOI:10.1016/j.renene.2008.06.015. |
| [15] | Zhu J H, Wang Y, Chun Y, et al. Exploration on the unusually strong basic properties of KNO3/Al2O3 and K2CO3/Al2O3[J]. Chinese Journal of Chemical Physics , 1998, 11(2): 178-183. |
| [16] | Xie W L, Hong P, Chen L G. Transesterification of soybean oil catalyzed by potassium loaded on alumina as a solid-base catalyst[J]. Applied Catalysis A:General , 2006, 300(1): 67-74. DOI:10.1016/j.apcata.2005.10.048. |
| [17] | XIN Qin(辛勤), LUO Meng-fei(罗孟飞). Modern research methods for catalysis(现代催化研究方法)[M].Beijing(北京): Science Press(科学出版社), 2009. |
| [18] | Pisitpong I, Chesta J, Apanee L, et al. The transesterification of palm oil using KOH supported on bentonite in a continuous reactor[J]. International Journal of Green Energy , 2013, 11(9): 987-1001. |
| [19] | Kutalek P, Capek L, Smolakova L, et al. Aspects of stability of K/Al2O3 catalysts for the transesterification of rapeseed oil in batch and fixed-bed reactors[J]. Chinese Journal of Catalysis , 2014, 35(7): 1084-1090. DOI:10.1016/S1872-2067(14)60054-1. |




