2. 中国天辰工程有限公司 技术发展部, 天津 300400;
3. 河北工业大学 化工学院, 天津 300401
2. Technical Development Department, China Tianchen Engineering Co. Ltd., Tianjin 300400, China;
3. College of Chemical Engineering, Hebei University of Technology, Tianjin 300401, China
乙醇酸甲酯(MG)有着兼具羟基和酯基官能团的独特结构,能够通过水解、氧化脱氢、氢化、氨解、羰化等反应制备一系列下游产品,同时也是众多树脂、橡胶、纤维素、半导体的优良溶剂,是一类重要的化工中间体[1-4]。MG的制备方法有甲酸甲酯与甲醛偶联法、甲醛羰化酯化法、甲缩醛和甲酸法、草酸二甲酯加氢还原法等,这些方法中,草酸二甲酯(DMO)加氢还原制备乙醇酸甲酯被认为是具有高效环保特性的、最有前途的制备方法[5-8],如何提高该方法中加氢催化剂的性能是现阶段的研究热点。
DMO加氢反应是串联反应,随着加氢程度的不断加深,DMO加氢还原过程会依次生成乙醇酸甲酯、乙二醇(EG)、乙醇,同时伴随着一系列的副产物出现[9]。Ag基催化剂由于Ag在解离吸附H2方面的能力较差,深度加氢活性能力较弱,因此可以获得更高的MG选择性,这使其成为DMO加氢制备MG的主要催化剂之一[10-12],但由于Ag属于贵金属,单纯制备Ag基催化剂无法实现工业化。当单组分催化剂在催化反应中存在不足时,在单组分催化剂中引入新的组分是值得一试的。郭向前等[13]制备的双金属CuO-Ag2O/SiO2催化剂在合适的实验条件下获得DMO的转化率为92.3%、MG选择性为83.6%,并能维持500 h的优异催化性能;Zhuang等[14]通过非金属P改性Co/SiO2催化剂,使得Co/SiO2的催化性能得到改善,其DMO转化率为94.6%、MG选择性为88.1%。由此,可以看出,在Ag基催化剂中引入新的组分是改善Ag基催化剂的有效途径。
本研究以自行合成的树枝状纤维形二氧化硅纳米球(KCC-1)为载体,采用等体积浸渍法制备Ag/KCC-1及Ag-Ni/KCC-1负载型催化剂,优化活性组分Ag的负载量(质量分数),并通过加入助活性组分Ni,降低贵金属Ag的使用量,在降低催化剂成本的同时,提高其在DMO加氢制MG反应中的催化性能。
2 实验材料与方法 2.1 实验材料正硅酸乙酯(分析纯)、环己烷(分析纯)、甲醇(分析纯),购自天津市大茂化学试剂厂;正戊醇(分析纯)、草酸二甲酯(分析纯)、乙醇酸甲酯(分析纯)、乙二醇(色谱纯)、乙醇(色谱纯),购自上海麦克林生化科技有限公司;1-十六烷基溴代吡啶(分析纯),购自天津希恩思生化科技有限公司;尿素(分析纯),购自福辰化学试剂有限公司;硝酸银(分析纯),购自天津市汇杭化工科技有限公司;硝酸镍(分析纯),购自天津市光复科技发展有限公司;氮气(高纯氮)、氢气(高纯氢),购自液化空气有限公司。
2.2 催化剂制备方法 2.2.1 KCC-1的制备取定量1-十六烷基溴代吡啶、尿素置于三口烧瓶中,加入去离子水搅拌溶解,得溶液a;取定量的正硅酸乙酯、正戊醇、环己烷置于烧杯中搅拌均匀,得溶液b;将b缓慢滴加入a中,持续搅拌30 min,得溶液c,将c移入带聚四氟内衬的水热反应釜中,以1 ℃⋅min−1升温至120 ℃,反应240 min;将母液取出后离心分离,得到的固体用乙醇和乙酸乙酯分别离心洗涤3次;将固体放置烘箱于110 ℃干燥12 h,移入马弗炉中550 ℃焙烧6 h,得到白色固体粉末,即为KCC-1。
2.2.2 Ag/KCC-1催化剂的制备以KCC-1为载体,采用等体积浸渍法,制备Ag/KCC-1催化剂。将定量的硝酸银溶于去离子水中,用滴管缓慢滴加到制得的KCC-1中,滴加完毕后超声搅拌20 min,在室温下静置24 h后,放入烘箱110 ℃干燥6 h,移入马弗炉中400 ℃焙烧4 h,得x1Ag/KCC-1催化剂(x1为Ag负载量)。
2.2.3 Ag-Ni/KCC-1催化剂的制备以KCC-1为载体,采用等体积浸渍法,制备Ag-Ni/KCC-1催化剂。将定量的硝酸银和硝酸镍共同溶于去离子水中,用滴管缓慢滴加到制得的KCC-1中,滴加完毕后超声搅拌20 min,在室温下静置24 h,放入烘箱110 ℃干燥6 h,移入马弗炉中以400 ℃焙烧4 h,得x1Ag-x2Ni/KCC-1催化剂(x2为Ni的负载量)。
2.3 催化剂分析方法扫描电镜(SEM)在30 kV和10 nA工作条件下,在ZEISS MERLIN Compact型高分辨率场发射扫描电镜上进行;X射线衍射(XRD)在40 kV和80 mA工作条件下,用Rigaku Ultima Ⅳ型衍射仪对样品进行分析,辐射源为Cu靶(波长λ=0.154 06 nm),分析在测角速率为20 (°)⋅min−1,2θ=5°~80°条件下完成;N2吸附-脱附表征采用美国Micromeritic公司生产的ASAP 2020比表面积和孔隙度分析测试仪,催化剂将在110 ℃干燥12 h,并在573 K下抽真空脱附6 h,之后在液氮温度下吸附N2,结果采用多分子层吸附理论(BET)法计算比表面积、孔径分布计算(BJH)法计算孔分布;X射线光电子能谱分析(XPS)采用ESCALAB 250Xi型X射线光电子能谱仪分析催化剂表面的元素含量和结合能,Al Kα为X射线光源,使用C 1s的结合能(284.8 eV)进行校准。
2.4 催化剂评价及产物分析方法 2.4.1 催化剂评价方法以DMO为原料加氢制备MG的反应在固定床中进行,其流程如图 1所示。将制得的催化剂研磨、压片、粉碎、筛分,取粒径为0.3~0.5 mm的颗粒2 mL装填到反应器中间恒温段,催化剂上方放置θ环,起到防止催化剂吹散的作用。反应时,用泵将DMO甲醇溶液打入混合器与氢气混合,预热后进入反应器进行反应,反应产物经冷凝器冷凝后进入气液分离器,不凝气经背压阀减压后进入尾气吸收装置,收集液体产物,使用气相色谱进行分析。
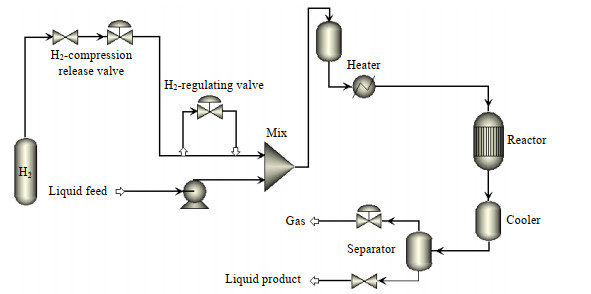
|
图 1 催化剂评价流程图 Fig.1 Flow chart of the catalyst evaluation process |
采用FULI 9790 Ⅱ气相色谱仪进行产物分析,色谱柱型号为HJ.PEG-20M(30 m×0.32 mm×0.25 μm),FID检测器,进样室温度为220 ℃,检测室温度为220 ℃,柱箱程序升温:初始温度50 ℃,稳定3 min,以10 ℃⋅min−1升温至150 ℃,稳定10 min。
通过以MG为标准物的校正因子归一化法计算DMO的转化率CDMO、MG的选择性SMG、EG的选择性SEG、EtOH的选择性SEtOH,计算公式如下:
| $ \frac{{{f_1}}}{{{f_{\text{MG}}}}} = \frac{{{A_{\text{MG}}}{m_1}{M_{\text{MG}}}}}{{{A_1}{m_{\text{MG}}}{M_1}}} $ | (1) |
| $ {C_{\text{DMO}}} = \frac{{{A_{\text{MG}}}{f_{\text{MG}}} + {A_{\text{EG}}}{f_{\text{EG}}} + {A_{\text{EtOH}}}{f_{\text{EtOH}}} + {S_{\text{Other}}}}}{{{A_{\text{DMO}}}{f_{\text{DMO}}} + {A_{\text{MG}}}{f_{\text{MG}}} + {A_{\text{EG}}}{f_{\text{EG}}} + {A_{\text{EtOH}}}{f_{\text{EtOH}}} + {S_{\text{Other}}}}} $ | (2) |
| $ {S_{\text{MG}}} = \frac{{{A_{\text{MG}}}{f_{\text{MG}}}}}{{{A_{\text{MG}}}{f_{\text{MG}}} + {A_{\text{EG}}}{f_{\text{EG}}} + {A_{\text{EtOH}}}{f_{\text{EtOH}}} + {S_{\text{Other}}}}} $ | (3) |
| $ {S_{\text{EG}}} = \frac{{{A_{\text{EG}}}{f_{\text{EG}}}}}{{{A_{\text{MG}}}{f_{\text{MG}}} + {A_{\text{EG}}}{f_{\text{EG}}} + {A_{\text{EtOH}}}{f_{\text{EtOH}}} + {S_{\text{Other}}}}} $ | (4) |
| $ {S_{\text{EtOH}}} = \frac{{{A_{\text{EtOH}}}{f_{\text{EtOH}}}}}{{{A_{\text{MG}}}{f_{\text{MG}}} + {A_{\text{EG}}}{f_{\text{EG}}} + {A_{\text{EtOH}}}{f_{\text{EtOH}}} + {S_{\text{Other}}}}} $ | (5) |
式中:f1为待求物质的相对校正因子;A1为待求物质的峰面积;m1为待求物质的质量,g;M1为待求物质的分子量;fMG为MG的相对校正因子,设为1;AMG为MG的峰面积;mMG为MG的质量,g;MMG为MG的分子量;ADMO为DMO的峰面积;fDMO为DMO的相对校正因子;AEG为EG的峰面积;fEG为EG的相对校正因子;AEtOH为EtOH的峰面积;fEtOH为EtOH的相对校正因子;SOther为副产物选择性。
3 实验结果与讨论 3.1 Ag/KCC-1催化剂的表征及催化性能选取Ag负载量为0%、5%、10%、15%、20% 的5种催化剂,记为:0Ag/KCC-1、5Ag/KCC-1、10Ag/KCC-1、15Ag/KCC-1、20Ag/KCC-1,对其结构性质进行表征,结果如下。
3.1.1 Ag/KCC-1催化剂的SEM图对不同负载量的Ag/KCC-1催化剂进行电镜扫描,得到催化剂形貌如图 2所示。从图 2可以看出,未负载的KCC-1为球形,表面具有密集清晰的褶皱状孔道,这是其比表面积较大的主要原因,有利于进行表面改性以提高其催化性能。随着Ag负载量的不断增加,KCC-1表面褶皱越来越不明显,当Ag负载量大于15% 时,KCC-1表面褶皱基本观察不到,且出现大量不规则块状物,说明Ag负载量较大时,对其表面会有一定程度的覆盖,亦可引起比表面积在一定程度上的降低。

|
图 2 Ag/KCC-1催化剂的SEM图 Fig.2 SEM images of Ag/KCC-1 catalysts |
对不同Ag负载量的Ag/KCC-1进行N2吸附-脱附表征,其比表面积SBET、孔容Vp、孔径Dp如表 1所示,N2吸附等温线和孔径分布分别如图 3和图 4所示。从表 1可以看出,随着Ag负载量的增加,催化剂的比表面积、孔容都呈现逐渐减小的趋势,而平均孔径逐步增大,判断是由于银负载到KCC-1表面后,堵塞了一部分较小的孔径,而对较大的孔径影响小,从而导致比表面积减小,平均孔径却有一定的增加。
|
|
表 1 Ag/KCC-1催化剂的比表面积 Table 1 Specific surface areas of Ag/KCC-1 catalysts |
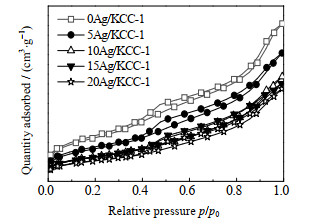
|
图 3 Ag/KCC-1催化剂的N2吸附等温线 Fig.3 N2 adsorption isotherms of Ag/KCC-1 catalysts |
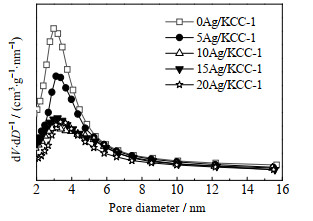
|
图 4 Ag/KCC-1催化剂的孔径分布图 Fig.4 Pore size distribution of Ag/KCC-1 catalysts |
从图 3中可以看出,Ag/KCC-1催化剂均拥有朗格缪尔Ⅳ型吸附等温线,表明催化剂为多孔孔道结构,在相对压力p/p0 > 0.5存在明显的滞后环,根据滞后环为H3型可分析催化剂的介孔分布并不均匀。
从图 4中可以看出,KCC-1的介孔集中在2~6 nm,负载Ag后,介孔峰的峰强度和峰面积均明显降低,而当Ag负载量大于10% 后,介孔峰面积变化变缓,结合表 1分析,进一步验证了Ag负载量增加导致的比表面积降低,主要是由于载体中部分孔径被堵塞所造成。
3.1.3 Ag/KCC-1催化剂的XRD分析为得到Ag的特征峰,将Ag/KCC-1催化剂在反应条件下经H2还原处理后再进行XRD分析,谱图如图 5所示。谱图显示不同负载量的Ag基催化剂均在衍射角2θ=38.1 °、44.3 °、64.4 °、77.4 °处出现明显特征峰,分别归属于单质Ag的(111)、(200)、(220)、(311)晶面(PDF#87-0717)。并且随着负载量的增大,特征峰愈加明显。通过Schereer公式可近似得到Ag的平均粒径dAg如表 2所示,可见,随着Ag负载量的增加,Ag的平均粒径也在逐渐增大。
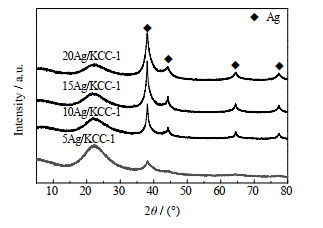
|
图 5 还原后Ag/KCC-1催化剂的XRD谱图 Fig.5 XRD patterns of reduced Ag/KCC-1 catalysts |
|
|
表 2 Ag/KCC-1催化剂的晶粒粒径 Table 2 Crystalline sizes of Ag/KCC-1 catalysts |
对Ag/KCC-1催化剂进行XPS分析,其Ag 3d的谱图和催化剂表面Ag含量如图 6和表 3所示。从图 6可看出,对于15Ag/KCC-1催化剂,在368 eV和374 eV处的2个峰分别归属于Ag 3d5/2和Ag 3d3/2,随着Ag负载量的增加,Ag 3d轨道的结合能随之向高结合能方向偏移,根据结合能数值变化范围,判断Ag以Ag2O形式存在于催化剂中,结合能升高是由Ag2O质量分数增加所致;从表 3可以看出,催化剂表面的Ag质量分数也在不断增长,这也表明Ag与KCC-1之间存在相互作用,且随着Ag质量分数增加,其结合能亦有一定程度的增加。
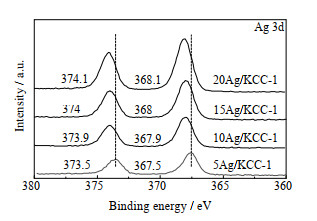
|
图 6 Ag/KCC-1催化剂的XPS谱图 Fig.6 XPS spectra of Ag/KCC-1 catalysts |
|
|
表 3 Ag/KCC-1催化剂XPS表征结果 Table 3 XPS characterization results of Ag/KCC-1 catalysts |
采用2.4.1节中的反应流程,将Ag/KCC-1催化剂用于DMO加氢制备MG中,反应条件:温度为200 ℃、压力为3 MPa、H2与DMO物质的量比为100、液时空速(LHSV)=0.5 h−1,其反应结果如表 4所示。从表 4可以看出,随着Ag负载量的增加,DMO的转化率CDMO均呈逐渐增大的趋势;MG的收率YMG整体亦呈增加的趋势,但Ag负载量超过15% 后,YMG降低,结合选择性SMG和SEG来看,MG收率的降低是由于其选择性降低所导致。结合3.1节的表征可以推断,随着Ag负载量不断增加,反应物可接触的活性位点增多以及活性组分Ag与载体的相互作用加强,使得DMO的转化率及收率不断增大;但Ag负载量并非越大越好,负载量的增加同样会使比表面积减少、孔容孔径产生变化,当载体的负载量大于15% 时,活性组分Ag与载体的相互作用已趋于最大,而过多的活性位点会导致MG深度加氢生成EG,致使MG选择性降低。由此,对于Ag/KCC-1催化剂,Ag负载量为15% 时性能较佳。
|
|
表 4 Ag/KCC-1催化剂的反应结果 Table 4 Reaction results of Ag/KCC-1 catalysts |
根据3.1节所得结果,维持活性组分总负载量15% 不变,利用Ni代替部分Ag,制备Ag与Ni质量比m(Ag): m(Ni)分别为14:1、12:3、10:5、7.5:7.5、5:10、3:12的催化剂,命名为:14Ag-1Ni/KCC-1、12Ag-3Ni/KCC-1、10Ag-5Ni/KCC-1、7.5Ag-7.5Ni/KCC-1、5Ag-10Ni/KCC-1、3Ag-12Ni/KCC-1,对其进行表征和催化性能评价。
3.2.1 Ag-Ni/KCC-1催化剂的SEM图对不同负载量的Ag-Ni/KCC-1催化剂进行电镜扫描,得到催化剂形貌如图 7所示。

|
图 7 Ag-Ni/KCC-1催化剂的SEM图 Fig.7 SEM images of Ag-Ni/KCC-1 catalysts |
从图 7中可以看出,当负载总量不变时,m(Ag): m(Ni)在14:1~3:12,KCC-1表面褶皱均有一定的覆盖,且均有不同程度的块状物存在,但其球形度相对完整,仍能保持KCC-1的纤维状表面结构,该结构对活性物质的分散具有促进作用。
3.2.2 Ag-Ni/KCC-1催化剂的结构性质通过N2吸附-脱附表征,不同m(Ag): m(Ni)的Ag-Ni/KCC-1催化剂的比表面积SBET、孔容Vp、孔径Dp如表 5所示,N2吸附等温线和孔径分布分别如图 8和9所示。从表 5可以看出,各催化剂的孔容、孔径变化不大,但引入1% Ni的14Ag-1Ni/KCC-1,其比表面积最大,说明Ni的引入有利于Ag在催化剂表面的分散,使比表面积在一定程度上有所提高,但继续增加Ni的质量分数,比表面积呈持续降低的趋势,分析是由于活性组分总负载量较大,少量的Ni与Ag协同作用,可以在一定程度上起到分散Ag的作用,而Ni的继续增加,其本身亦会团聚、堵塞孔道,从而使比表面积持续降低。
|
|
表 5 Ag-Ni/KCC-1催化剂的比表面积 Table 5 Specific surface areas of Ag-Ni/KCC-1 catalysts |
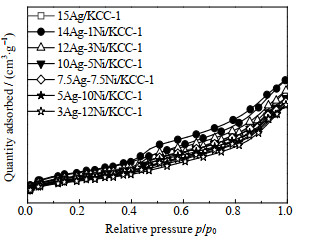
|
图 8 Ag-Ni/KCC-1催化剂的N2吸附等温线 Fig.8 N2 adsorption isotherms of Ag-Ni/KCC-1 |
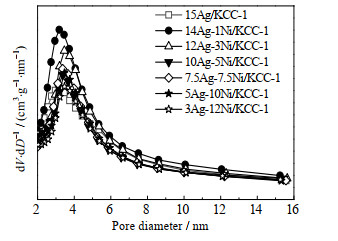
|
图 9 Ag-Ni/KCC-1催化剂的孔径分布图 Fig.9 Pore size distribution of Ag-Ni/KCC-1 catalysts |
从图 8可以看出,Ag-Ni/KCC-1催化剂仍拥有朗格缪尔Ⅳ型吸附等温线,并在相对压力p/p0 > 0.5拥有与Ag /KCC-1类似的H3型滞后环,表明用Ni替代Ag后并未完全改变催化剂的结构特征。
从图 9可以看出,当活性组分总量一定时,催化剂14Ag-1Ni/KCC-1、12Ag-3Ni/KCC-1比其他催化剂峰强度更大,孔径分布更为集中,结合表 5,说明适量Ni的加入有利于催化剂表面活性组分的分散。
3.2.3 Ag-Ni/KCC-1催化剂的XRD分析为得到Ag和Ni的特征峰,将Ag-Ni/KCC-1催化剂在反应条件下经H2还原处理后再进行XRD分析,谱图如图 10所示,并通过Schereer公式近似得到Ag的平均粒径dAg,列于表 6。从图 10可以看出,m(Ag): m(Ni)较大时在2θ=38.1 °、44.3 °、64.4 °、77.4 °处出现明显特征峰,分别归属于单质Ag的(111)、(200)、(220)、(311)晶面(PDF#87-0717),随着m(Ag): m(Ni)的不断减小,在2θ=44.4 °、51.8 °、76.3 °处出现特征峰,归属于单质Ni的(111)、(200)、(220)晶面(PDF#87-0712);从表 6可以看出,负载总量不变时,m(Ag): m(Ni)在14:1~3:12,晶粒粒径总体呈先小后大的趋势,说明m(Ag): m(Ni)达到适宜的比例时才能有较好的协同作用,从而增加其表面分散性,而过多的单一Ag或Ni存在会引起同种物质团聚,导致晶粒粒径变大,不利于活性组分的表面分散。
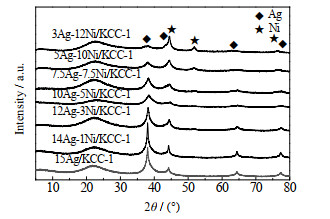
|
图 10 还原后的Ag-Ni/KCC-1催化剂的XRD谱图 Fig.10 XRD patterns of reduced Ag-Ni/KCC-1 catalysts |
|
|
表 6 Ag-Ni/KCC-1催化剂的晶粒粒径 Table 6 Crystalline sizes of Ag-Ni/KCC-1 catalysts |
为进一步分析Ag-Ni/KCC-1催化剂,对其进行了XPS分析,其Ag 3d、Ni 2p的谱图和催化剂表面Ag、Ni质量分数如图 11和表 7所示。如图 11所示,对于Ag-Ni/KCC-1催化剂,在368.7 eV和374.7 eV附近的2个峰分别归属于Ag 3d5/2和Ag 3d3/2;用Ni替代部分Ag后,Ag 3d轨道的结合能有所增长,Ni 2p轨道结合能亦呈现一定的增长趋势。从XPS原理分析,结合能的变化是多种因素共同导致的,如得失电子、原子所处化学环境、成键情况等,据此推测,Ag和Ni具有一定的相互作用,使其存在Ag向Ni的电子云转移,导致Ag负载量降低但电子云密度减少,使Ag 3d结合能维持在368.6~368.8 eV;而Ni负载量虽增多但电子云密度亦在增加,共同作用的结果使Ni 2p结合能在一定范围内呈不规律的波动;表 7给出,催化剂表面Ag和Ni的质量分数随m(Ag): m(Ni)的变化呈规律性变化,活性组分负载趋势符合试验设计。

|
图 11 Ag-Ni/KCC-1催化剂的XPS谱图 Fig.11 XPS spectra of Ag-Ni/KCC-1 catalysts |
|
|
表 7 Ag-Ni/KCC-1催化剂的XPS表征结果 Table 7 XPS characterization results of Ag-Ni/KCC-1 catalysts |
对Ag-Ni/KCC-1催化剂进行反应评价,其结果如表 8所示。可见,Ag-Ni/KCC-1催化剂中,当Ag负载量低于10% 时,DMO转化率会大幅度降低;Ag负载量低于7.5% 时,MG和EG选择性、MG收率均会大幅度降低;而EtOH选择性明显增加。结合3.2节中的表征分析,催化剂中Ag作为主活性组分,其质量分数大大降低会使催化剂的主活性组分减少,在反应中反应物与Ag的有效接触机会变少,从而使催化剂的催化性能大大降低;而Ni作为助活性组分,其适量的加入能够增加Ag的分散度,抑制Ag颗粒的聚集,并通过相互作用,提高活性组分与载体的结合能,提高催化剂的选择性加氢性能。综合来看,12Ag-3Ni/KCC-1的总体催化性能较优。
|
|
表 8 Ag-Ni/KCC-1催化剂的反应结果 Table 8 Reaction results of Ag-Ni/KCC-1 catalysts |
研究制备了Ag/KCC-1和Ag-Ni/KCC-1负载型催化剂,并将其用于DMO加氢制MG的催化反应中。在Ag/KCC-1中引入适量的Ni,在降低成本的同时,可明显提高催化剂表面活性组分的分散性,增强活性组分与载体之间的结合能,提高其选择性加氢的催化性能。在相同的反应条件下,与15Ag/KCC-1相比,12Ag-3Ni/KCC-1其DMO转化率由90.37% 提高至96.75%,MG选择性由90.77% 提高至92.48%,MG收率由82.04% 提高至89.47%,为该催化剂的进一步改进和工业放大提供借鉴。
| [1] |
唐叔平, 高振明, 罗正鸿. 草酸二甲酯加氢制乙醇酸甲酯工艺条件优化[J]. 上海化工, 2018, 43(4): 20-23. TANG S P, GAO Z M, LUO Z H. Optimization on conditions for the hydrogenation of dimethyl oxalate to methyl glycolate[J]. Shanghai Chemical Industry, 2018, 43(4): 20-23. DOI:10.3969/j.issn.1004-017X.2018.04.012 |
| [2] |
李祥祥, 朱贻安, 周静红, 等. 银和铜催化草酸二甲酯加氢制乙醇酸甲酯反应机理的理论研究[J]. 天然气化工—C1化学与化工, 2018, 43(6): 17-23. LI X X, ZHU Y A, ZHOU J H, et al. Insights into the reaction mechanism of dimethyl oxalate hydrogenation to methyl glycolate over Ag and Cu catalysts[J]. Low-Carbon Chemistry and Chemical Engineering, 2018, 43(6): 17-23. |
| [3] |
ZHOU J F, DUAN X P, YE L M, et al. Enhanced chemoselective hydrogenation of dimethyl oxalate to methyl glycolate over bimetallic Ag-Ni/SBA-15 catalysts[J]. Applied Catalysis A: General, 2015, 505: 344-353. |
| [4] |
孔令鑫. 乙醇酸甲酯加氢铜基催化剂的改性和失活机理研究[D]. 天津: 天津大学, 2020. KONG L X. Study on the modification and deactivation mechanism of Cu based catalyst for hydrogenation of methyl glycolate [D]. Tianjin: Tianjin University, 2020. |
| [5] |
欧阳梦瑶. 草酸二甲酯加氢制乙醇酸甲酯银基催化剂的研究[D]. 天津: 天津大学, 2016. OUYANG M Y. Study on silver based catalysts for hydrogenation of dimethyl oxalate to methyl glycolate [D]. Tianjin: Tianjin University, 2016. |
| [6] |
CHEN H M, TAN J J, CUI J L, et al. Promoting effect of boron oxide on Ag/SiO2 catalyst for the hydrogenation of dimethyl oxalate to methyl glycolate[J]. Molecular Catalysis, 2017, 433: 346-353. DOI:10.1016/j.mcat.2017.02.039 |
| [7] |
LEE J S, KIM J C, KIM Y G. Methyl formate as a new building block in C1 chemistry[J]. Applied Catalysis, 1990, 57(1): 1-30. DOI:10.1016/S0166-9834(00)80720-4 |
| [8] |
WANG B W, XU Q, SONG H, et al. Synthesis of methyl glycolate by hydrogenation of dimethyl oxalate over Cu-Ag/SiO2 catalyst[J]. Journal of Natural Gas Chemistry, 2007, 16(1): 78-80. DOI:10.1016/S1003-9953(07)60030-9 |
| [9] |
龚海燕. Cu/SiO2催化草酸二甲酯加氢制乙醇酸甲酯的反应性能[J]. 化学反应工程与工艺, 2014, 30(2): 169-174. GONG H Y. Hydrogenation of dimethyl oxalate to methyl glycolate on Cu/SiO2 catalyst[J]. Chemical Reaction Engineering and Technology, 2014, 30(2): 169-174. |
| [10] |
OUYANG M Y, WANG Y, ZHANG J, et al. Three dimensional Ag/KCC-1 catalyst with a hierarchical fibrous framework for the hydrogenation of dimethyl oxalate[J]. RSC Advances, 2016, 6(16): 12788-12791. |
| [11] |
YIN A Y, GUO X Y, DAI W L, et al. High activity and selectivity of Ag/SiO2 catalyst for hydrogenation of dimethyl oxalate[J]. Chemical Communications, 2010, 46(24): 4348-4350. |
| [12] |
张大洲, 卢文新, 商宽祥, 等. 草酸二甲酯加氢制乙醇酸甲酯反应网络分析及其多相加氢催化剂研究进展[J]. 化工进展, 2023, 42(1): 204-214. ZHANG D Z, LU W X, SHANG K X, et al. Reaction network analysis of dimethyl oxalate hydrogenation to methyl glycolate and recent progress in the heterogeneous catalysts[J]. Chemical Industry and Engineering Progress, 2023, 42(1): 204-214. |
| [13] |
郭向前, 钱俊峰. 草酸二甲酯催化加氢制备乙醇酸甲酯工艺研究[J]. 广州化工, 2015, 43(18): 91-93. GUO X Q, QIAN J F. Study on the process for catalytic hydrogenation of dimethyl oxalate to methyl glycollate[J]. Guangzhou Chemical Industry, 2015, 43(18): 91-93. |
| [14] |
ZHUANG Z L, LI Y H, CHEN F, et al. Synthesis of methyl glycolate by hydrogenation of dimethyl oxalate with a P modified Co/SiO2 catalyst[J]. Chemical Communications, 2022, 58(12): 1958-1961. |




