氢作为一种新型燃料,是煤、石油等最为理想的替代品。利用太阳能光催化分解水制氢被认为是解决能源问题最理想的途径,受到广泛重视[1~7]。
由于光生电子和空穴在催化剂表面容易复合,直接光催化分解水制氢效率低[8]。在光催化反应体系中加入电子给体作牺牲剂,能显著提高光催化分解水制氢效率。加入的电子给体必须是价廉、易得的。水中的有机污染物作为电子给体,既促进光催化制氢,又消除了污染,是一种有前途的光催化制氢方法。本课题组对污染物为电子给体光催化制氢进行了系统的研究[8, 9~12],其他课题组也开展类似的工作[13, 14]。生物质有机物是一类可大量从自然界获得的廉价电子给体。利用生物质光催化制氢已有较多的文献报道,主要是糖类,例如,葡萄糖[15~17]。甘油作为一种生物质,主要来源于工业生产生物柴油的副产品[18],其作为电子给体光催化制氢研究较少[19, 20]。
由于存在析氢过电位,半导体光催化剂表面通常都需要负载助催化剂。最好的析氢助催化剂是Pt等贵金属,但其在地壳丰度低、价格昂贵。开发地壳丰度高、廉价的非贵金属助催化剂是光催化制氢研究的热点。层状MoS2是一种有前途的非贵金属析氢助催化剂[21, 22]。
然而,本体的MoS2析氢活性很低。计算表明,MoS2的析氢活性来源于所谓的Mo边缘(1 0 1 0) 上的S原子[23]。因此,通过化学或机械的方法将本体MoS2剥离为单层或薄层, 增加暴露的边缘,提高制氢活性。此外,对于本体MoS2,电子在层间的传输存在较大的电阻,是制氢活性低的另一个原因[24, 25]。因此,制备暴露活性边缘多,层数少的薄层MoS2负载在光催化剂表面上,是提高其制氢活性的重要手段。
本文采用水热法合成了层数较少的薄层MoS2,然后在DMF中超声剥离,通过浸渍法将MoS2负载在TiO2上,制备了薄层MoS2/TiO2。以甘油为电子给体研究了MoS2制备与剥离条件对MoS2/TiO2制氢活性的影响。结果表明,DMF剥离后的薄层MoS2活性显著提高,是未剥离的4.18倍。进一步地,研究以甘油为电子给体的光催化制氢体系反应规律及机理。
2 实验 2.1 试剂除PVP(德国BASF,进口分装),P25 TiO2(德国Degussa)外,其它试剂均为国药试剂,分析纯。
2.2 制备MoS2MoS2的制备参考文献[26]:将0.500 g Na2MoO4·2H2O和0.600 g TAA(聚乙烯吡咯烷酮),溶于40 mL蒸馏水,搅拌15 min,加入0.140 g PVP,加水至50 mL,装入高压反应釜,200℃水热24 h。产物离心,蒸馏水洗涤3次,乙醇洗涤1次,60℃干燥12 h,得到的MoS2标记为MoS2-P。不加PVP,在上述相同条件下制备MoS2,标记为MoS2-W。
2.3 制备剥离MoS2/TiO2超声剥离MoS2参考文献[27]:称取一定量MoS2,加入DMF(用量为10 mg MoS2/1mLDMF),超声剥离6 h,离心15 min,转速12000 r·min-1,弃去固渣得分散液。取10 mL分散液蒸干,得固体残渣MoS2,称重,计算出剥离分散液中MoS2浓度为4.5 mg·mL-1。
移液管移取一定量上述分散液, 加入0.500 g P25 TiO2,搅拌10 h后旋转蒸发脱除DMF, 80℃真空干燥12 h,研磨得剥离负载光催化剂,标记为x%(wt) MoS2-P-D/TiO2,x %(wt)表示负载MoS2的质量百分数。类似地,将水热法制备的MoS2配成各浓度的悬浮液,不超声剥离负载于P25TiO2,标记为x%(wt) MoS2-P/TiO2。
为考察溶剂影响,采用蒸馏水代替DMF超声剥离离心后负载在P25TiO2上,标记为x%(wt) MoS2-P-W/TiO2。为考察PVP的影响,不加PVP制备MoS2的采用同样方法剥离负载在P25TiO2上,标记为x%(wt) MoS2-W-D/TiO2。
2.4 光催化反应光催化反应在容积为190 mL,一面为平面的Pyrex瓶中进行。加入0.100 g催化剂、100 mL甘油溶液。光照前,将反应液通N230 min,赶尽Pyrex瓶中的O2(通过气相色谱分析是否存在O2峰),然后用400 W高压汞灯在磁力搅拌下光照1 h。氢气检测在气相色谱仪上进行(检测器为TCD,分离柱为13X分子筛柱,氮气为载气)。
2.5 分析表征样品的XRD在XD-3X射线衍射仪(北京普析仪器有限责任公司)上测得,采用Cu靶,λ=0.15406 nm。扫描电镜为日本JSM-6701F型扫描电镜,配有能量散射光谱仪(EDS)。采用U-3310 UV-Vis Spectrometer(日本HITACHI公司)光谱仪测试样品的紫外-可见漫反射光谱(UV-Vis DRS),BaSO4作为参比。Zeta电位(ξ电位)在PSANAN0-2590型Zetasizer(英国马尔文公司)测定。样品制备如下:配制一系列浓度为0.100 g·L-1,pH=3、4、5、6、7、8的MoS2-PVP-D/TiO2溶液,超声分散30 min测定Zeta电位。对照实验P25 TiO2采用同样方法制备。
光催化反应产生的羟基自由基采用对苯二甲酸(TA)荧光法检测,TA能捕获·OH,产生邻羟基苯二甲酸(TAOH),该物质在312 nm波长光激发下在426 nm处产生荧光[28]。测定方法如下:称0.020 g催化剂于光照瓶中,取145 mL pH=5的TA饱和溶液,调节pH,然后补加蒸馏水至150 mL。暗态下搅拌、通氮气30 min,紫外光照0.5 h。离心除去催化剂,取上层液体,采用Hitachi F-7000荧光光谱仪检测荧光强度。
光催化反应甘油的中间产物采用安捷伦公司的6120 LCMS检测,样品制备如下:0.200 g 1.60%(wt) MoS2-PVP-D/TiO2,100 mL甘油溶液(V甘油:VH2O=1:99),通N230 min后磁力搅拌下紫外光照18 h,光照后的悬浮液抽滤,保留清夜,采用三氟乙酸调节pH=2.2。高效液相采用乙腈和水为流动相(V乙腈:VH2O=1.6 : 98.4), 流速0.45 mL·min-1,质谱测定条件:电喷雾电离,毛细管电压:4 kV,雾化空气压力:103.425 kPa,干燥气体温度;300℃,气相流速:0.50 L·min-1,负离子模式。
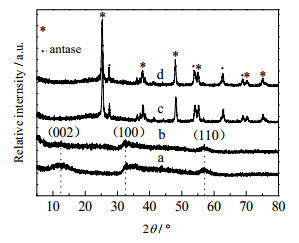
3 结果与讨论 3.1 MoS2/TiO2的性质图 1为MoS2-W(a)、MoS2-P(b)、1.60%(wt) MoS2-P-D/TiO2(c)和P25 TiO2(d)样品的X衍射图。
|
图 1 各种样品的XRD图 Fig.1 XRD patterns of various samples (a) MoS2-W (b)MoS2-P (c) 1.60%(wt) MoS2-P-D/TiO2 (d) P25 TiO2 |
MoS2-P和MoS2-W在2θ=32.7°、57.7°出现宽而弱的衍射峰,分别归属为六方相2H-MoS2 (JCPDS No. 37-1492) 的(100) 面和(110) 面[29],表明水热制备的两种MoS2结晶度都很低。本体的MoS2的(002) 面的衍射峰出现在2θ=14.0°的位置[26, 29],但本实验制备的两种MoS2的(002) 面衍射峰移到2θ=12.5°, 这是因为MoS2在z轴方向的堆积层数很少所致[30],即形成了薄层MoS2。相对于MoS2-W,加入PVP制备的MoS2-P的衍射峰非常弱,几乎不能观察到(002) 面衍射峰,这说明MoS2-P堆积层数更少[26],可能是PVP的存在阻止了MoS2沿z轴方向生长。由P25 TiO2的XRD图 1(d)可知,样品既含有锐钛矿相也含有金红石相(JCPDS No. 21-1272)。1.60%(wt) MoS2-P-D/ TiO2的XRD图 1(c)与P25 TiO2的XRD图几乎相同,观察不到MoS2衍射峰,这是由于MoS2负载量比较少,而且MoS2高度分散、结晶度低所致。
图 2(a)、(b)分别为P25 TiO2和1.60 %(wt) MoS2-P-D/TiO2的SEM图。由图可知,P25 TiO2催化剂为球状纳米粒子,粒子大小约为25~30 nm。图 2(b)与图 2(a)形貌相同,观测不到MoS2的存在。这可能是由于薄层MoS2负载量少(只有1.6 %(wt))且比较均匀分散在TiO2上,在电子轰击下MoS2会蒸发,很难直接观察到。然而,EDS光谱(图 2(c))分析标明,1.60%(wt) MoS2-P-D/TiO2样品存在Mo,S,Ti和O,证明了MoS2负载在TiO2上。图 2(d)为剥离后MoS2的DMF分散液照片。该分散液稳定,可放置四周,表明MoS2很好地分散在DMF中。因此, 当MoS2负载在P25 TiO2时,能很好地分散在TiO2上,和图 1(c)结果一致。

|
图 2 P25 TiO2 (a)、1.60%(wt) MoS2-P-D/TiO2(b)的SEM图; 1.60%(wt) MoS2-P-D/TiO2的EDS谱图(c)和MoS2-P-D分散液照片(d) Fig.2 SEM micrographs of P25 TiO2 (a), 1.60 %(wt) MoS2-P-D/TiO2(b); EDS spectrum of 1.60%(wt) MoS2-P-D/TiO2(c) and picture of MoS2-P-D dispersion (d) |
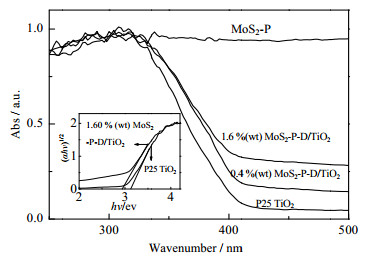
图 3为P25 TiO2负载不同质量百分数MoS2催化剂的UV-Vis漫反射吸收光谱。由图可知,纯MoS2能吸收200~700 nm的光,而P25 TiO2只能吸收波长小于420 nm的光,随着MoS2含量增加,催化剂对可见光的吸收增加,吸收波长逐渐红移,利用Kubela-Munk转换:αhν=A(hν-Eg)n,α为吸光系数,Eg为禁带宽度,h为普朗克常数,ν为光的频率,TiO2为间接半导体,n = 2。
|
图 3 样品的紫外-可见漫反射吸收光谱 Fig.3 UV-vis diffuse reflectance absorption spectra of samples 插图:P25TiO2和1.60%(wt) MoS2-P-D/TiO2的(αhν)1/2对光能(hν)作图 Inset: Plots of (αhν) 1/2 against photon energy (hν) for P25 TiO2 and 1.60 %(wt) MoS2-P-D/TiO2 |
以(αhν)1/2对hν作图,可以计算出P25 TiO2和负载1.60%(wt) MoS2-P-D/TiO2催化剂的禁带宽度分别为Eg = 3.06 eV和Eg = 2.84 eV (见内插图)。
在水中,TiO2表面存在大量的羟基[31],其表面电离平衡可用下列反应表示:
| $ > {\rm{TiOH}}_{2}^{+}\overset{{{K}_{al}}}{\longleftrightarrow} \rm{TiOH}+{{\rm{H}}^{+}} $ | (1) |
| $ >{\rm{TiOH}}_{2}^{+}\overset{{{K}_{a2}}}{\longleftrightarrow} \rm{Ti}{{\rm{O}}^{-}}+{{\rm{H}}^{+}} $ | (2) |
> TiOH表示表面羟基,Ka1是反应式(1) 的一级酸离解常数,Ka2是二级酸离解常数。
TiO2电荷零点pH(The pH of zero point of charge, pHzpc)可表示如下:
| $ \text{p}{{\text{H}}_{\text{ZPC}}}=1/2(\text{p}{{K}_{\text{al}}}+\text{p}{{K}_{\text{a2}}}) $ | (3) |
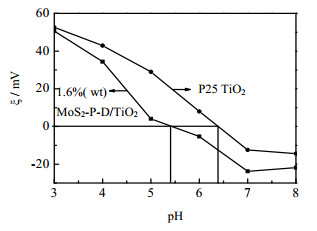
当溶液pH=pHzpc时,催化剂表面呈电中性,此时P25 TiO2表面存在大量的表面羟基 > TiOH。图 4测定P25 TiO2和1.60%(wt) MoS2-P-D/TiO2在不同pH的Zeta电位。由图 4可知,实验测得P25 TiO2的pHzpc=6.38,这一结果与文献[31]报道相符。薄层1.6 %(wt) MoS2-P-D/TiO2的pHzpc =5.38,表明负载MoS2后,催化剂表面酸性增强。
|
图 4 样品在不同pH下zeta电位 Fig.4 Zeta potential of samples at different pH |
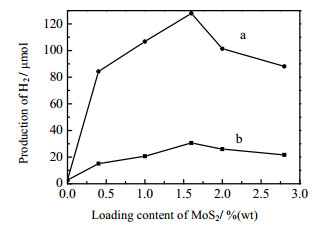
图 5为MoS2超声剥离及负载量对甘油为电子给体光催化制氢的影响。单纯的P25 TiO2光催化制氢量仅2.69 μmol·h-1,负载MoS2后光催化制氢得到极大提高,这是因为负载MoS2后降低了析氢过电势。在DMF剥离后的薄层MoS2制备的MoS2-P-D/TiO2光催化产氢远远高于未剥离MoS2制备的MoS2-P/TiO2。当负载0.40%(wt)和1.00%(wt) MoS2时,MoS2-P-D/TiO2光催化制氢分别是MoS2-P/TiO2的5.59和5.17倍。MoS2-P-D/TiO2最佳负载量为1.60%(wt) MoS2,此时催化剂制氢为127.94 μmol·h-1,相比于未剥离的MoS2-P/TiO2的30.63 μmol·h-1,光催化活性提高了4.18倍。这可归结于超声剥离使MoS2片层变得很薄,负载更分散,在TiO2表面上有更多暴露的S-Mo边缘活性点,从而仅需要很少的量MoS2就能大幅度提高制氢活性。随着MoS2负载量的进一步增加,1.60%(wt) MoS2-P-D/TiO2光催化产氢逐渐减小,这是由于当负载量过大时,MoS2占据TiO2的活性位较多,反而降低光催化剂的制氢。
|
图 5 MoS2的剥离与负载量对光催化制氢的影响 Fig.5 Effects of exfoliation and loading amount of MoS2 on photocatalytic hydrogen production a: x %(wt) MoS2-P-D/TiO2, b:x %(wt) MoS2-P/TiO2 Reaction conditions:0.100 g of catalyst, 100 mL glycerol solution(Cglycerol=1.37 mol·mL-1, natural pH), irradiation time 1h |
采用DMF为溶剂,超声剥离后的MoS2分散液浓度可达为4.50 mg·mL-1,而同样条件下水为溶剂得到MoS2分散液浓度仅为0.80 mg·mL-1,两者相差5倍多。这说明,在DMF中可以更为有效的剥离MoS2,而水作为溶剂较难分散MoS2。这可能与DMF分子中氮原子和MoS2的钼形成配位键,能稳定薄层MoS2有关。光催化制氢活性实验表明,负载相同质量分数的1.60%(wt) MoS2时,采用水超声剥离后制备的MoS2-P-W/TiO2光催化制氢为42.10 μmol·h-1,相比于未超声剥离的MoS2-P/TiO2的30.63μmol·h-1仅提高了1.37倍。而采用DMF超声剥离制备的1.60%(wt) MoS2-P-D/TiO2却可以使制氢量大幅提高至4.18倍。这说明DMF是很好的超声剥离溶剂,可以制备高活性的MoS2-P-D/TiO2光催化剂。
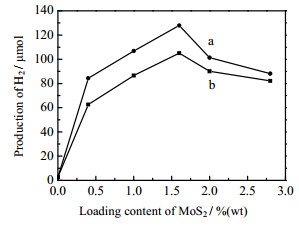
3.2.3 表面活性剂PVP的影响图 6为MoS2制备过程加入和未加PVP对MoS2/TiO2光催化制氢活性的影响。两者都是在DMF超声剥离后,然后负载在到TiO2表面上的。在实验MoS2负载量范围内(≤ 2.80%(wt),加入PVP制备的MoS2-P-D/TiO2高于未加PVP制备的MoS2-W-D/TiO2。当MoS2负载质量分数为1.6%(wt)时,制备的MoS2-P-D/TiO2光催化制氢为127.94 μmol,相比于MoS2-W-D/TiO2的105.05 μmol提高了22%。这是由于在水热合成MoS2的过程中加入的PVP,可以通过极性吡咯烷酮官能团上的N或O原子与Mo4+离子配位,阻止了MoS2沿z轴方向生长,使得制备的MoS2层数更少[32],图 1结果证明这一点。然而,未加PVP制备的MoS2-W-D/TiO2制氢活性仍然很高。其原因是,两种MoS2(MoS2-P和MoS2-W)都在DMF溶剂中进行长时间(6 h)的超声剥离。因为DMF能很好分散MoS2,所以即使在前期制备过程中未加入PVP,经6 h超声也很好地实现剥离,因而制备的MoS2-W-D/TiO2也具有很好的制氢活性。
|
图 6 MoS2制备过程中加入PVP对MoS2/TiO2光催化制氢的影响 Fig.6 Effect of PVP addition in MoS2 preparation on photocatalytic hydrogen production of MoS2/TiO2 a: x %(wt) MoS2-P-D/TiO2, b: x %(wt) MoS2-W-D/TiO2 Reaction conditions as in Fig.5 |
由于反应过程中电子给体的浓度不断变化,为了确定起始反应速率,在可检测范围之内,反应时间应尽可能短些,采用的时间为1 h。
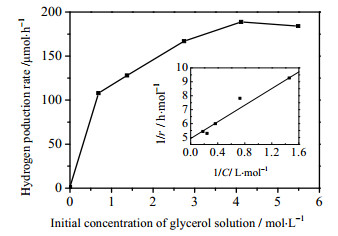
图 7为甘油初始浓度对1.60%(wt) MoS2-P-D/TiO2光催化制氢活性的影响。在较低浓度时,制氢活性随甘油浓度增加而迅速增加,但当甘油浓度增加至C甘油= 4·11 mol·L-1时,制氢活性几乎不再随甘油浓度变化。这表明甘油浓度对反应速率符合Langmuir-Hinshelwood关系式:
|
图 7 甘油溶液初始浓度对1.60%(wt) MoS2-P-D/TiO2光催化制氢的影响 Fig.7 Effects of initial glycerol concentration on photocatalytic hydrogen production with 1.60%(wt) MoS2-P-D/TiO2.Reaction conditions: same as in Fig.5 except glycerol concentration |
| $ r=\text{d}{{c}_{{{\text{H}}_{2}}}}\text{/d}t=kK{{C}_{0}}/(1+K{{C}_{0}}) $ |
这里,r为放氢反应速率,k为反应速率常数,K为吸附常数,C0为甘油初始浓度。通过线性转换可计算出(见插图) k(甘油)=2.05×10-4mol·h-1,K (甘油)=1.62 L·mol-1。
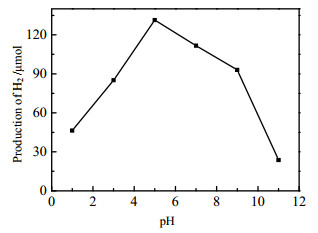
3.3.2 反应溶液初始pH的效应图 8描述了甘油溶液初始pH对1.60%(wt) MoS2-P-D/TiO2光催化制氢活性的影响。由图可知,在pH=5时,光催化制氢活性最好,为131.32 μmol·h-1。pH较低或较高时,光催化制氢活性都降低。1.60%(wt) MoS2-P-D/TiO2的电荷零点pH = 5.38。反应体系最佳pH与催化剂的pHzpc接近,表明催化剂的表面性质对制氢活性影响很大。
|
图 8 甘油溶液初始pH对1.60%(wt)MoS2-P-D/TiO2光催化制氢的影响 Fig.8 Effects of initial pH of glycerol solution on photocatalytic hydrogen production with 1.60%(wt) MoS2-P-D/TiO2. Reaction conditions: same as in Fig.5 except initial pH |
当MoS2-P-D/TiO2光催化剂中的TiO2受光激发,产生电子和空穴对。电子还原被表面吸附的H+物种,形成H2。在这个过程,助催化剂MoS2显著促进了析氢。
| $ \text{Ti}{{\text{O}}_{2}}+hv\to \text{h}_{VB}^{+}+\text{e}_{CB}^{-} $ | (4) |
| $ {{\text{H}}^{+}}+\text{e}_{\text{CB}}^{-}\to 1/2{{\text{H}}_{2}}\ \text{on}\ \text{Mo}{{\text{S}}_{2}} $ | (5) |
TiO2表面羟基是析氢H+的反应物种[9]。在光催化剂pHzpc时,表面羟基浓度最大,所以具有最高的析氢活性。
同时,空穴被表面羟基捕获,生成羟基自由基[31]
| $ {{\rm{h}}^{+}}+>\rm{TiOH}\to \rm{Ti}\cdot \rm{OH}(以下简写为\cdot \rm{OH}) $ | (6) |
吸附在催化剂表面的甘油和羟基自由基作用:
| $ \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHC}{{\text{H}}_{\text{2}}}\text{OH+14 }\!\!\times\!\!\text{ OH}\to \text{3C}{{\text{O}}_{\text{2}}}\text{+11}{{\text{H}}_{\text{2}}}\text{O} $ | (7) |
因此,在酸性条件下,存在大量的 > TiOH2+,由于静电排斥作用,不利反应(6) 进行;而在碱性条件下,存在大量的 > TiO-,> TiOH浓度降低,也不利产生羟基自由基。在pHzpc时,表面羟基 > TiOH浓度最大,产生的羟基自由基最多,能迅速氧化甘油,从而促进光催化制氢。
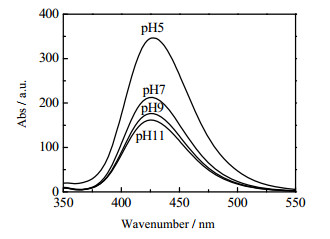
图 9为不同pH下TA捕获1.60%(wt) MoS2-P-D/TiO2光催化剂产生的·OH的荧光光谱图。由图可以看出,经0.5 h光照后,pH=5时·OH浓度最大。随着pH增加而减小。这一规律与光催化制氢规律一致。说明有效地产生·OH自由基是提高催化剂制氢活性的重要因素。基于上述实验结果,作者将光催化制氢反应速率表示为一个二级反应[9]:
|
图 9 不同pH下TA捕获光照1.60%(wt) MoS2-P-D/TiO2产生的·OH的荧光光谱图 Fig.9 Photoluminescence spectra of ·OH radicals trapped by TA (produced by 1.60%(wt) MoS2-P-D/TiO2) at different pH values after irradiation |
| $ r=\text{d}[{{\text{H}}_{2}}]/\text{d}t=k{{\theta }_{{{\text{H}}^{+}}}}{{\theta }_{\text{gly}}} $ | (8) |
r为制氢反应速率,k为反应速率常数,θH+为TiO2表面羟基覆盖度,θgly为TiO2表面甘油覆盖度。P25 TiO2表面羟基浓度很大(0.46 mmol·g-1)[33],假定TiO2表面负载少量MoS2不会改变其羟基浓度,所以当pH一定时,TiO2表面羟基覆盖度可以认为是一个常数。因此,式(8) 简化为:
| $ r=\text{d}[{{\text{H}}_{2}}]/\text{d}t={k}'{{\theta }_{\text{gly}}} $ | (9) |
因此,可以观察到甘油对制氢反应速率符合Langmuir-Hinshelwood关系式(图 7)。这也说明,甘油在催化剂表面的吸附是一个重要的因素。
为了探索甘油降解的机理,对光催化反应液进行液相色谱-质谱分析。图 10为光催化反应18 h之后甘油反应液经液相色谱分离后中间产物的质谱图。荷质比分别为59、62、75、87、89、91的质谱峰,分别代表甘油光催化反应产生的羟基乙醛、乙二醇、羟基乙酸、羟基丙二醛、甘油醛、甘油,荷质比分别为69、103、113是由三氟乙酸产生的质谱峰。根据荧光和质谱检测分析,推测MoS2/TiO2光催化氧化甘油可能的机理为:
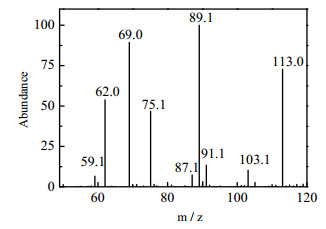
|
图 10 甘油反应液光照18 h后产生的中间产物的质谱图 Fig.10 Mass spectrum of intermediates produced from glycerol reaction solution after 18 h irradiation |
| $ \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHC}{{\text{H}}_{\text{2}}}\text{OH+ }\!\!\times\!\!\text{ OH}\to \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHCHOH }\!\!\times\!\!\text{ }\cdot {{\text{H}}_{\text{2}}}\text{O} $ | (10) |
CH2OHCHOHCHOH·与水直接作用生成CH2OHCHOHCH(OH)2以及H·,H·进一步转化为氢气[34]
| $ \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHC}{{\text{H}}_{\text{2}}}\text{OH}\cdot \text{+}{{\text{H}}_{\text{2}}}\text{O}\to \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHCH(OH}{{\text{)}}_{\text{2}}}\text{+H}\cdot $ | (11) |
CH2OHCHOHCH(OH)2不稳定,迅速转化成甘油醛
| $ \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHCH(OH}{{\text{)}}_{\text{2}}}\to \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHCHO+}{{\text{H}}_{\text{2}}}\text{O} $ | (12) |
·OH与甘油醛基按(10)-(11) 继续反应产生羟基丙二醛
·OH与甘油醛基继续氧化
| $ \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHCHO+}\cdot \text{OH}\to \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHCO}\cdot \text{+}{{\text{H}}_{\text{2}}}\text{O} $ | (13) |
| $ \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHCHO}\cdot \text{+}{{\text{H}}_{\text{2}}}\text{O}\to \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHCOOH+H}\cdot $ | (14) |
CH2OHCHOHCOOH直接与h+作用发生脱羧反应[31]
| $ \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOHCOOH+}{{\text{h}}^{\text{+}}}\to \text{C}{{\text{H}}_{\text{2}}}\text{OHCHOH}\cdot \text{+C}{{\text{O}}_{\text{2}}}\text{+}{{\text{H}}^{\text{+}}} $ | (15) |
生成的CH2OHCHOH·重复(11)~(15),先生成羟基乙醛、羟基乙酸,然后氧化为甲酸,最后氧化成水和二氧化碳[35]。
4 结论MoS2被很好地剥离并负载在TiO2上制备了光催化剂,该催化剂在甘油为电子给体的反应体系中呈现高的光催化制氢活性。MoS2负载增加了TiO2的光吸收和降低其pHzpc。DMF作为溶剂,超声分散效果明显比水好;表面活性剂PVP也促进了MoS2的剥离与提高放氢活性。MoS2在DMF剥离后的析氢活性比剥离前大大提高。MoS2最佳负载量为1.60%(wt),超声剥离MoS2制备的MoS2-P-D/TiO2放氢活性是未剥离制备的4.18倍。反应体系最佳pH与MoS2/TiO2的电荷零点pH一致。甘油浓度对放氢活性的影响符合Langmuir-Hinshelwood动力学模型。
| [1] | Gomathisankar P, Hachisuka K, Katsumata H, et al. Enhanced photocatalytic hydrogen production from aqueous methanol solution using ZnO with simultaneous photodeposition of Cu[J]. International Journal of Hydrogen Energy, 2013, 38(27): 11840-11846.DOI:10.1016/j.ijhydene.2013.06.131. |
| [2] | Sayama K, Yoshida R, Kusama H, et al. Photocatalytic decomposition of water into H2 and 02 by a two-step photoexcitation reaction using a WO3 suspension catalyst and an Fe3+/Fe2+ redox system[J]. Chemical Physics Letters, 1997, 277(4): 387-391.DOI:10.1016/S0009-2614(97)00903-2. |
| [3] | Nian J N, Hu C C, Teng H. Electrodeposited p-type Cu2O as photocatalyst for H2 evolution from water reduction in the presence of WO3[J]. Solar Energy Materials & Solar Cells, 2008, 92(9): 1071-1076. |
| [4] | Li Y, Hu Y, Peng S, et al. Synthesis of CdS nanorods by an ethylenediamine assisted hydrothermal method for photocatalytic hydrogen evolution[J]. The Journal of Physical Chemistry C, 2009, 113(21): 9352-9358.DOI:10.1021/jp901505j. |
| [5] | Peng S, An R, Wu Z, et al. Enhanced photocatalytic hydrogen evolution under visible light over CdxZn1-xS solid solution by ruthenium-doping[J]. Reaction Kinetics Mechanisms and Catalysis, 2012, 107(1): 105-113.DOI:10.1007/s11144-012-0458-9. |
| [6] | AI Zhu-yu(艾珠玉), ZHAO Wei-rong(赵伟荣), DAI Jiu-song(戴九松), et al. Modification of photocatalysts for H2 evolution from water photocatalyzation(光催化分解水制氢催化剂的修饰与改性)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2016, 30(3): 508-519. |
| [7] | Yu J, Ran J. Facile preparation and enhanced photocatalytic H2-production activity of Cu (OH)2 cluster modified TiO2[J]. Energy & Environmental Science, 2011, 4(4): 1364-1371. |
| [8] | Li Y, Xie Y, Peng S, et al. Photocatalytic hydrogen generation in the presence of chloroacetic acids over Pt/TiO2[J]. Chemosphere, 2006, 63(8): 1312-1318.DOI:10.1016/j.chemosphere.2005.09.004. |
| [9] | Li Y, Lu G, Li S. Photocatalytic hydrogen generation and decomposition of oxalic acid over platinzed TiO2[J]. Applied Catalysis A: General, 2001, 214(2): 179-185.DOI:10.1016/S0926-860X(01)00491-4. |
| [10] | Li Y, Lu G, Li S. Photocatalytic transformation of rhodamine B and its effect on hydrogen evolution over Pt/TiO2 in the presence of electron donors[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2002, 152(1): 219-228. |
| [11] | Li Y, He F, Peng S, et al. Effects of electrolyte NaCl on photocatalytic hydrogen evolution in the presence of electron donors over Pt/TiO2[J]. Journal of Molecular Catalysis A: Chemical, 2011, 341(1): 71-76. |
| [12] | Peng S, Ding M, Y T, et al. Photocatalytic hydrogen evolution in the presence of pollutant methylamines over Pt/ZnIn2S4 under visible light irradiation[J]. Journal of Molecular Catalysis, 2014, 28: 466-473. |
| [13] | Kim J, Monllor-Satoca D, Choi W. Simultaneous production of hydrogen with the degradation of organic pollutants using TiO2 photocatalyst modified with dual surface components[J]. Energy & Environmental Science, 2012, 5(6): 7647-7656. |
| [14] | Puskelova J, Baia L, Vulpoi A, et al. Photocatalytic hydrogen production using TiO2-Pt aerogels[J]. Chemical Engineering Journal, 2014, 242: 96-101.DOI:10.1016/j.cej.2013.12.018. |
| [15] | Li Y, Gao D, Peng S, et al. Photocatalytic hydrogen evolution over Pt/Cd 0.5Zn 0.5S from saltwater using glucose as electron donor: an investigation of the influence of electrolyte NaCl[J]. International Journal of Hydrogen Energy, 2011, 36(7): 4291-4297.DOI:10.1016/j.ijhydene.2011.01.038. |
| [16] | Zhou M, Li Y, Peng S, et al. Effect of epimerization of d-glucose on photocatalytic hydrogen generation over Pt/TiO2[J]. Catal Commun, 2012, 18: 21-25.DOI:10.1016/j.catcom.2011.11.017. |
| [17] | Fu X, Long J, Wang X, et al. Photocatalytic reforming of biomass: a systematic study of hydrogen evolution from glucose solution[J]. International Journal of Hydrogen Energy, 2008, 33(22): 6484-6491.DOI:10.1016/j.ijhydene.2008.07.068. |
| [18] | Zhou C H C, Beltramini J N, Fan Y X, et al. Chemoselective catalytic conversion of glycerol as a biorenewable source to valuable commodity chemicals[J]. Chemical Society Reviews, 2008, 37(3): 527-549.DOI:10.1039/B707343G. |
| [19] | Lopez C R, Melian E P, Mendez J O, et al. Comparative study of alcohols as sacrificial agents in H2 production by heterogeneous photocatalysis using Pt/TiO2 catalysts[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2015, 312: 45-54.DOI:10.1016/j.jphotochem.2015.07.005. |
| [20] | Fujita S, Kawamori H, Honda D, et al. Photocatalytic hydrogen production from aqueous glycerol solution using NiO/TiO2 catalysts: Effects of preparation and reaction conditions[J]. Applied Catalysis B: Environmental, 2016, 181: 818-824.DOI:10.1016/j.apcatb.2015.08.048. |
| [21] | Wei L, Chen Y, Lin Y, et al. MoS2 as non-noble-metal co-catalyst for photocatalytic hydrogen evolution over hexagonal ZnIn2S4 under visible light irradiations[J]. Applied Catalysis B: Environmental, 2014, 144: 521-527.DOI:10.1016/j.apcatb.2013.07.064. |
| [22] | Kanda S, Akita T, Fujishima M, et al. Facile synthesis and catalytic activity of MoS2/TiO2 by a photodeposition-based technique and its oxidized derivative MoO3/TiO2 with a unique photochromism[J]. Journal of Colloid and Interface Science, 2011, 354(2): 607-610.DOI:10.1016/j.jcis.2010.11.007. |
| [23] | JaramilloT F, Jorgensen K, et al. Identification of active edge sites for electrochemical H2 evolution from MoS2 nanocatalysts[J]. Science, 2007, 317(5834): 100-102.DOI:10.1126/science.1141483. |
| [24] | Firmiano E G S, Cordeiro M A L, Rabelo A C, et al. Graphene oxide as a highly selective substrate to synthesize a layered MoS2 hybrid electrocatalyst[J]. Chemical Communications, 2012, 48(62): 7687-7689.DOI:10.1039/c2cc33397j. |
| [25] | Laursen A B, Kegnaes S, Dahl S, et al. Molybdenum sulfides efficient and viable materials for electro-and photo electrocatalytic hydrogen evolution[J]. Energy & Environmental Science, 2012, 5(2): 5577-5591. |
| [26] | Wang X, Zhang Z, Chen Y, et al. Morphology-controlled synthesis of MoS2 nanostructures with different lithium storage properties[J]. Journal of Alloys and Compounds, 2014, 600: 84-90.DOI:10.1016/j.jallcom.2014.02.127. |
| [27] | Ji S S, Yang Z, Zhang C, et al. Exfoliated MoS2 nanosheets as efficient catalysts for electrochemical hydrogen evolution[J]. Electrochimica Acta, 2013, 109: 269-275.DOI:10.1016/j.electacta.2013.07.094. |
| [28] | BarretoJ C, Smith G S, Strobel N H, et al. Terephthalic acid: a dosimeter for the detection of hydroxyl radicals in vitro[J]. Life Sciences, 1995, 56(4): 89-96. |
| [29] | Tian Y, He Y, Zhu Y. Low temperature synthesis and characterization of molybdenum disulfide nanotubes and nanorods[J]. Materials Chemistry Physics, 2004, 87(1): 87-90.DOI:10.1016/j.matchemphys.2004.05.010. |
| [30] | Hwang H, Kim H, Cho J. MoS2 nanoplates consisting of disordered graphene-like layers for high rate lithium battery anode materials[J]. Nano Letters, 2011, 11(11): 4826-4830.DOI:10.1021/nl202675f. |
| [31] | Hoffmann M R, Martin S T, Choi W Y, et al. Environmental applications of semiconductor photocatalysis[J]. Chemical Reviews, 1995, 95(1): 69-96.DOI:10.1021/cr00033a004. |
| [32] | Kumar P R, Venkateswarlu M, Satyanarayana N. Three-dimensional lithium manganese phosphate microflowers for lithium-ion battery applications[J]. Journal of Applied Electrochem, 2012, 42(3): 163-167.DOI:10.1007/s10800-012-0383-7. |
| [33] | Hermann M, Boehm H P. Über die chemie der oberfläche des titandioxids. Ii. Saure hydroxylgruppen auf der oberfläche[J]. Zeitschrift für Anorganische und Allgemeine Chemie, 1969, 368(1-2): 73-86.DOI:10.1002/(ISSN)1521-3749. |
| [34] | Chemseddine A, Boehm H P. A study of the primary step in the photochemical degradation of acetic acid and chloroacetic acids on a TiO2 photocatalyst[J]. Journal of Molecular Catalysis, 1990, 60(3): 295-311.DOI:10.1016/0304-5102(90)85253-E. |
| [35] | LI Min(李敏), LI Yue-xiang(李越湘), PENG Shao-qin(彭绍琴), et al. Photocatalytic hydrogen generation using glycerol waste water over Pt/TiO2(利用甘油废水Pt/TiO2光催化制氢)[J]. Journal of Molecular Catalysis(China)(分子催化), 2008, 22(2): 760-171. |




