多粘菌素E是一种碱性多肽类抗生素[1],用于饲料添加剂,提高动物的抗病能力,并能被动物代谢降解[2, 3];对革兰氏阴性菌如泛耐药不动杆菌和铜绿假单胞菌引起的疾病有很强的治疗作用;具有多药耐药性[4],多粘菌素E以其广泛的用途和独特的性质,其需求量越来越大[5],所以提高多粘菌素E的效价迫在眉睫。
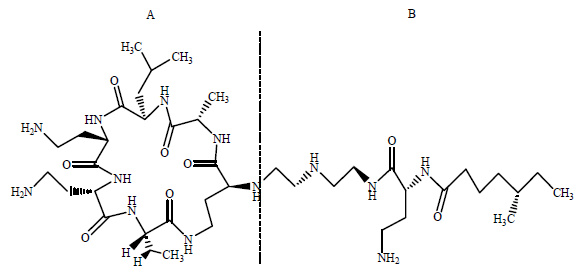
泡沫分离技术[6]是基于表面活性原理,通过底部鼓泡使目的产物选择性的吸附于气液界面[7],达到分离、富集的目的[8]。多粘菌素E分子结构[9, 10]中包含A、B两部分,如图 1所示。其中A部分是7个氨基酸组成的亲水性环,B部分具有一个长的疏水性尾部,这种具有表面活性的结构为从发酵液中泡沫分离多粘菌素E提供结构基础。吴兆亮等人[11]采用泡沫分离的方法分离发酵液中的多粘菌素E,得到多粘菌素E的浓缩液,浓缩倍数达到15,收率为95%,前景广阔且实用。传统的多粘菌素E以离子交换法[12]从发酵液中提取,此方法能耗大,产生新的污染源,成本高。采用泡沫分离的方法分离多粘菌素E成本低,效率高,操作简单,容易实现规模化生产等优点[13],并已经成功应用于多种生物大分子如蛋白质[14, 15]、酶[16]等的富集和分离中。
|
图 1 多粘菌素E的分子结构式 Fig.1 Molecular structural formula of polymyxin E |
在发酵过程中随着产物的增加会造成严重的产物抑制作用,使得发酵液中多粘菌素E的总效价较低。需要采用发酵与泡沫分离耦合的方式在线分离部分产物,以解除产物抑制。目前,发酵与泡沫分离耦合已经在细菌发酵[17],真菌发酵[18],细胞培养[19]等方面展开研究。Cui等[20]通过在发酵罐中装有膜组件制成发酵与泡沫分离耦合装置,来截留菌体,在线分离乳酸链球菌肽,解决了产物抑制作用,但存在营养物质流失的问题。Zhang等[21]通过泡沫分离与发酵耦合在线回收乳酸链球菌肽,提高乳酸链球菌肽的效价。但是此方法对于效价提高有限制性,首先在罐内耦合,必须中和发酵与分离的条件,无法使得发酵与分离均采用最佳条件;同时存在菌体随着泡沫分离被携带的问题。
基于以上问题,本文提出了一种多粘菌素E的生产工艺,应用发酵、膜分离与泡沫分离耦合通过蠕动泵构成循环回流装置生产多粘菌素E。研究了不同耦合开始时间、间歇时间、流速、单次分离时间对多粘菌素E效价的影响。在耦合操作时,利用蠕动泵将发酵液通过膜过滤器进入泡沫分离塔,产物和液体通过膜而菌体被截留在发酵罐中继续发酵,保证了菌体的恒定;在泡沫分离塔底部装有气泡分布器,通过鼓气产生气泡进行泡沫分离多粘菌素E,移除部分产物可以有效解除产物抑制;由于通过膜过滤器部分营养物质进入泡沫分离塔,所以采用的是循环回流的方式将泡沫分离后的余液回流回发酵罐中,保证了营养物质的充分利用;同时采用罐体外耦合,发酵的操作条件和泡沫分离的操作条件分别控制,发酵与分离都可以满足最佳的操作条件;应用泡沫分离方法分离目的产物不产生新的污染源,并减轻多粘菌素E发酵后续分离压力。
2 材料和方法 2.1 实验材料 2.1.1 仪器与试剂752型紫外-可见光分光光度计 (上海精密科技仪器有限公司);85-2恒温加热磁力搅拌器 (杭州仪表电机有限公司);LZB-3WB转子流量计 (常州科德热工仪表有限公司);微孔滤膜过滤器 (上海医药工业研究所);PHS-3C酸度计 (杭州奥利龙仪器有限公司);1100ChemStation高效液相色谱仪 (安捷伦科技有限公司)。
酵母粉、蛋白胨、琼脂为生物试剂;葡萄糖、氯化钠、氨水、磷酸二氢钾、硫酸铵、硫酸亚铁等为分析纯;硫酸多粘菌素E标准品、乙腈为色谱纯。
2.1.2 菌种和培养基多粘菌素E的产生菌多粘类芽孢杆菌 (Bacillus polymyxa CICC21777),本实验室收藏,作为本文研究所用的菌种。
活化培养基 (g⋅L-1):葡萄糖10.0,酵母粉10.0,蛋白胨1.0,氯化钠1.0,琼脂15.0,水余量,氨水调节pH到7.0,121℃高压蒸汽灭菌20 min;
种子培养基 (g⋅L-1):葡萄糖20.0,酵母粉40.0,氯化钠1.0,磷酸二氢钾0.5,水余量,氨水调节pH到6.8,121℃高压蒸汽灭菌20 min。
发酵培养基 (g⋅L-1):葡萄糖20.0、蛋白胨10.0、硫酸铵10.0、氯化钠1.0、硫酸亚铁0.1、磷酸二氢钾0.1,水余量,氨水调节pH到7.0,121℃高压蒸汽灭菌20 min。
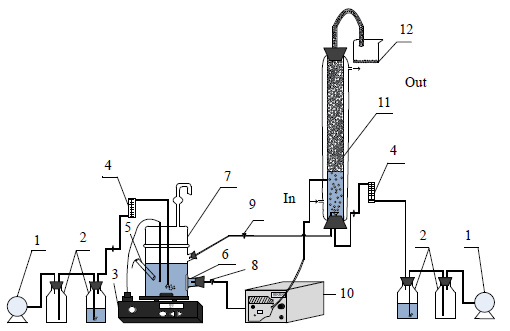
2.2 实验方法 2.2.1 循环回流发酵与膜分离、泡沫分离耦合操作装置的构建循环回流发酵与膜分离、泡沫分离耦合操作的装置如图 2所示。将发酵、膜分离与泡沫分离耦合通过蠕动泵将生物反应器与泡沫分离塔构成循环回流装置制备多粘菌素E。其中膜过滤器安装在发酵罐内,不便更换。为解决膜的堵塞问题,本文的膜过滤器由6张混合纤维素膜构成,通过6条管路分别经由蠕动泵流入泡沫分离塔。耦合前关闭6个阀门,耦合进行时开启其中一条管路,若出现堵塞现象则换下一条管路。图中同一功能的6条管路以一条管路代替。
|
图 2 循环回流发酵与膜分离、泡沫分离耦合操作装置 Fig.2 Schematic diagram of the experimental setup coupled with circulating reflux fermentation, foam fractionation and membrane separation. 1. air compressor 2. wild-mouth bottle 3. constant temperature and speed magnetic stirrer 4. air flowmeter 5. pH meter 6. film filter 7. bioreactor 8. discharge valve 9. reflux valve 10. peristaltic pump 11. foam fractionation column 12. foam liquid |
在耦合操作时,利用蠕动泵将发酵液通过膜过滤器进入泡沫分离塔,产物和液体通过膜而菌体被截留在发酵罐中继续发酵;在泡沫分离塔底部装有气泡分布器,通过鼓气产生气泡进行泡沫分离,在泡沫分离塔顶部收集多粘菌素E的浓缩液,分离一定时间后,通过回流的方式将泡沫分离后的余液回流回发酵罐中。多次重复此操作,直至发酵结束。
2.2.2 检测方法生物量通过测定600 nm的光密度 (Optical density,OD),并绘制生物量与OD值的关系曲线,用菌体干重 (Dry cell weight,DCW) 表示生物量。
菌体的生长曲线见公式 (1):
| $DCW=1.243\times \text{O}{{\text{D}}_{600}}+0.033,{{\text{R}}^{2}}=0.9998$ | (1) |
采用高效液相色谱[22](High-performance liquid chromatography,HPLC) 定量分析多粘菌素E效价,操作参数为:色谱柱C18(3.5 μm,4.6 mmx160 mm,Agilent),流动相为乙腈,波长215 nm,流速1 mL⋅min-1,柱温25±2°C;色谱图峰面积 (X) 与多粘菌素E效价 (Y) 之间的关系见公式 (2)。
| $Y=5.872X,{{\text{R}}^{2}}=0.9994$ | (2) |
多粘菌素E的效价用活性重量单位U表示,其物理意义为1 μg=30 U,即含有1 μg多粘菌素E生物活性成分的效价为30 U。
2.2.3 多粘类芽孢杆菌发酵与泡沫分离在初始pH为7.0,气速150 mL⋅min-1,温度33℃的条件下进行多粘类芽孢杆菌发酵,自发酵开始后每隔2.0 h取样,测定其菌体生长曲线及代谢过程,以了解菌体生长及代谢情况,并间接找到耦合开始时间的大致范围。
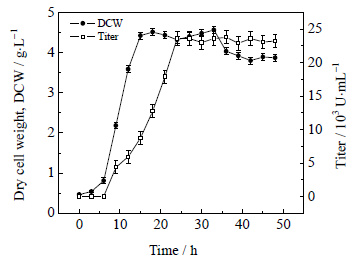
3 结果与讨论 3.1 多粘类芽孢杆菌发酵多粘类芽孢杆菌的生长曲线以及多粘菌素E的代谢曲线如图 3所示。
|
图 3 多粘类芽孢杆菌发酵过程 Fig.3 Dry cell weight profiles of B. polymyxa as a function of fermentation time |
由图 3可知,多粘类芽孢杆菌的发酵周期为48.0 h,在发酵的前3.0 h是菌体的迟缓期,细菌增殖缓慢,第3.0 h到第14.0 h是细菌增殖的对数期,菌体干重增长迅速,第14.0 h到35.0 h是菌体生长的稳定期,菌体干重维持在一个比较平衡的位置。第35.0 h以后,菌体开始进入衰亡期,随着营养物质的减少,菌体代谢缓慢,芽孢越来越多,此时菌体干重呈下降趋势。
实验结果表明多粘类芽孢杆菌生长类型为产物部分偶联型,其中在迟缓期、对数期有少量多粘菌素E产生,稳定期最多,在第24.0 h多粘菌素E效价达到最大,之后几乎不再累积,主要是因为多粘菌素E的产物抑制作用和发酵液中营养物质的缺乏。所以为了获得最大的效价,在发酵的稳定期移除部分产物,解除产物抑制并通过循环回流提高营养物质的利用率十分必要。
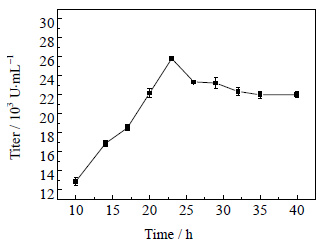
3.2 循环回流发酵与膜分离、泡沫分离耦合开始时间的确定耦合开始时间的不同直接影响产物抑制解除的强度。泡沫分离条件为气速[23]220 mL⋅min-1,pH为5.0[24]。采用在流速16 mL⋅min-1,连续操作,单次分离时间为60 min条件下,分别研究不同耦合开始时间10.0、14.0、17.0、20.0、23.0、26.0、29.0、32.0、35.0、40.0 h时,多粘菌素E效价的变化,结果如图 4所示。
|
图 4 不同耦合开始时间对多粘菌素E效价的影响 Fig.4 Effects of coupling starting time on polymyxin E titer |
如图 4可知,在第23.0 h开始进行耦合效价达到最大;第6.0 h到第14.0 h之间,菌体处于对数期,在这个时间进行耦合严重影响菌体生长,所以耦合效价较低。发酵的第24.0 h的时候产物浓度最大,开始产生产物抑制,在这个时间之前开始耦合,可以达到很好的效果,24.0 h到35.0 h之间产物量积累越来越多,开始耦合的时间越晚,抑制作用越大,效价越低,35.0 h以后菌体进入衰亡期,菌体开始死亡,在此时间段进行耦合对效价基本没有影响,没有起到解除产物抑制的作用。
3.3 循环回流发酵与膜分离、泡沫分离耦合对菌体生长的影响在23.0 h开始循环耦合,流速16 mL⋅min-1,连续操作,单次分离时间为60 min的条件下,测定循环回流发酵与膜分离、泡沫分离耦合,对比非耦合发酵对菌体生长的影响如图 5所示。
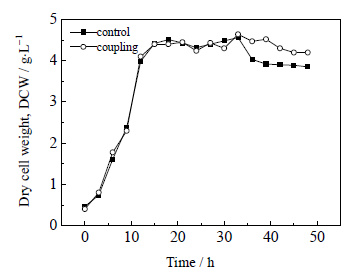
|
图 5 循环回流发酵与膜分离、泡沫分离耦合装置对菌体生长的影响 Fig.5 Effects of coupling technique on cell growth |
由图 5可知,循环回流发酵与膜分离、泡沫分离耦合装置延长了菌体生长的稳定期。主要由于在发酵的23.0 h开始进行耦合移除了包围在菌体周围的产物,消除这些产物或者副产物对生产菌的抑制作用,保证了菌体含量的稳定。循环耦合解除产物抑制的前提下,发酵罐中的膜可以有效截留菌体,阻止其进入泡沫分离塔中随泡沫溢出,泡沫分离后将余下的营养物质回流回发酵罐,保证菌体含量的稳定。
3.4 循环回流发酵与膜分离、泡沫分离耦合对效价的影响设定开始耦合时间为发酵的第23.0 h,流速16 mL⋅min-1,单次分离时间为60 min,连续操作,比较其循环耦合操作对发酵效价的影响如图 6所示。
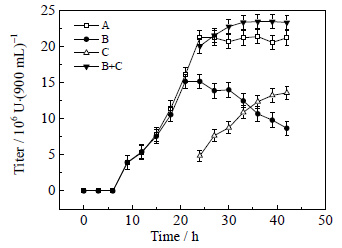
|
图 6 循环回流发酵与膜分离、泡沫分离对多粘菌素E效价的影响 Fig.6 Effects of the coupling technique on polymyxin E titer A: polymyxin E titer without circulating reflux and fermentation coupling membrane and foam separation; B: polymyxin E titer by circulating reflux and fermentation coupling membrane and foam separation; C: foam fluid titer; B+C: Total titer. |
由图 6可知,B为循环耦合发酵罐中发酵液效价;C为循环耦合期间泡沫分离得到消泡液的效价变化情况;B+C为循环耦合发酵液的总效价。耦合操作开始后,循环耦合发酵液的效价逐渐降低,消泡液效价逐渐积累,循环耦合总效价较非耦合效价高。A为非耦合发酵液效价,在24.0 h之后产物达到最高,不再积累,循环耦合效价积累持续到33.0 h左右。主要由于23.0 h开始耦合,移除部分产物,解除了产物抑制,提高了多粘菌素E的单位效价。
3.5 循环回流发酵与膜分离、泡沫分离耦合间歇时间的确定在开始耦合时间为23.0 h,流速16 mL⋅min-1,单次分离时间为60 min,比较不同间歇时间 (0.0、0.5、1.0、1.5、2.0和2.5 h) 对效价的影响, 结果如图 7所示。
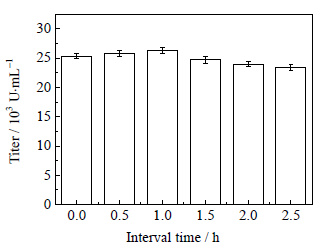
|
图 7 间歇时间对多粘菌素E效价的影响 Fig.7 Effects of interval time on polymyxin E titer |
由图 7可知,间歇时间为1.0 h时,产物效价最高,间歇时间大于1.0 h时,随着间歇时间的加长,产物增长率高于分离率,产物抑制解除不充分。间歇时间1.0 h较连续操作更适宜菌体生长。在耦合过程中,单次泡沫分离60 min后,分离塔中多粘菌素E含量很低,将塔中剩余的营养物质回流回发酵罐中,可以有效降低发酵罐中多粘菌素E的浓度,解除产物抑制作用。1.0 h后,营养物质与发酵液充分混匀,并产生多粘菌素E,为防止再次产生产物抑制,则继续进行耦合,重复之前过程直至发酵结束。
3.6 循环回流发酵与膜分离、泡沫分离耦合液体流速的确定为研究液体流速对多粘菌素E效价的影响,采用了在开始耦合时间为23.0 h,间歇时间为1.0 h,单次分离时间为60 min的条件下,不同的液体流速 (4、8、12、16、20、24 mL⋅min-1) 对多粘菌素E效价的影响如图 8所示。
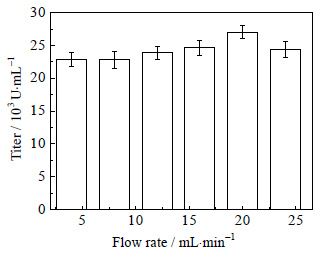
|
图 8 流速对多粘菌素E效价的影响 Fig.8 Effects of flow rate on polymyxin E titer |
由图 8可知,随流速的增大,产物的效价先增大后减少,在流速为20 mL⋅min-1的时候达到最大,流速小于20 mL⋅min-1达到一定分离体积所需时间很长,使产物分离的不完全,产物在发酵罐中积累,有一定的产物抑制,效价低。流速越大,需要时间越短,产物积累在未达到产物抑制的范围内,效价较高,但是大于20 mL⋅min-1,流速过快,影响菌体生长,使得总效价较低。
3.7 循环回流发酵与膜分离、泡沫分离耦合单次分离时间的确定为保证营养物质的充分利用,保证循环回流的最有效进行,需要选择最佳单次分离的时间。设定了开始耦合时间为23.0 h,间歇时间为1.0 h,流速为20 mL⋅min-1进行循环耦合,不同单次分离时间 (30、45、60、75、90 min) 对多粘菌素E效价的影响,结果如图 9所示。
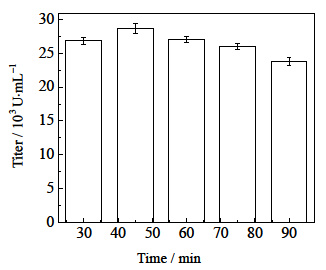
|
图 9 单次分离时间对多粘菌素E效价的影响 Fig.9 Effects of single separation time on polymyxin E titer |
由图 9可知,在单次分离时间为45 min时,产物的效价最高,说明单次分离时间在45 min的时候效果最好,单次分离时间低于45 min,单次分离时间过短,多粘菌素E分离量少没有充分解除产物抑制。单次分离时间高于45 min,分离时间过长,使得营养物质不能及时回流到发酵罐中,发酵罐中营养物质不充分,降低菌体浓度,导致多粘菌素E效价不高。
3.8 不同生产工艺对多粘菌素E发酵的影响按3种方式分别进行发酵:(1) 进行摇瓶发酵;(2) 进行非耦合上罐发酵;(3) 进行循环回流发酵与膜分离,泡沫分离耦合发酵。比较3种不同的发酵工艺对多粘菌素E效价的影响如图 10所示。
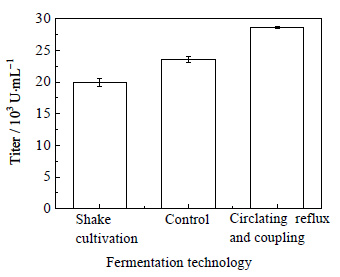
|
图 10 不同发酵工艺对多粘菌素E效价的影响 Fig.10 Effects of different fermentation technologies on polymyxin E titer |
由图 10可知,循环耦合发酵的效价比非耦合发酵的总效价高出了21%,耦合发酵工艺相对于摇瓶培养多粘菌素E总效价提高43%。Zhang[22]通过回收细胞并优化操作条件来强化多粘菌素E的发酵过程,本文通过循环回流的方式截留菌体,菌体未流失,无需回收细胞就有效的提高了多粘菌素E的效价。
4 结论结果表明循环回流发酵与膜分离、泡沫分离耦合装置可以延长菌体稳定期,有效解除产物抑制,阻止菌体流失,保证充分的营养物质。在发酵的稳定期中14.0到23.0 h多粘菌素E的产生速率较之后高很多,后期速率低主要是由于产物抑制引起的,发酵同时在线移除部分产物,应用膜截留菌体,减少菌体流失,应用循环回流提供营养物质的利用率。
通过实验确定最佳条件为耦合开始时间为23.0 h,间歇时间为1.0 h,液体流速为20 mL⋅min-1,单次分离时间为45 min。发酵48.0 h后,多粘菌素E的效价达到28634 U⋅mL-1相比优化前效价 (23597 U⋅mL-1) 提高了21%。此发酵工艺可节约能源,对于发酵生产其他产物有一定的借鉴价值。
| [1] | Davis S D, Iannetta A, Wedgwood R J. Paradoxical synergism and antagonism between serum and the antibacterial activity of colistin[J]. The Journal of Infectious Diseases , 1971, 123(4): 392-398. DOI:10.1093/infdis/123.4.392. |
| [2] | Jun Y, Jeun S, Kang S, et al. Colistin therapy for multidrug-resistant gram-negative infection:clinical outcome and risk factors[J]. Infection , 2013, 41(6): 1195-1198. DOI:10.1007/s15010-013-0522-z. |
| [3] | Kassamali Z, Rotschafer J C, Jones R N, et al. Polymyxins:wisdom does not always come with age[J]. Clinical Infectious Diseases , 2013, 57(6): 877-883. DOI:10.1093/cid/cit367. |
| [4] | Azzopardi E A, Ferguson E L, Thomas D W. Colistin past and future:A bibliographic analysis[J]. Journal of Critical Care , 2013, 28(2): 213-219. DOI:10.1016/j.jcrc.2012.11.015. |
| [5] | Falagas M E, Michalopoulos A. Polymyxins:old antibiotics are back[J]. The Lancet , 2006, 367(9511): 633-634. DOI:10.1016/S0140-6736(06)68241-X. |
| [6] | SHI Meng(史萌), LIU Gui-min(刘桂敏), WU Zhao-liang(吴兆亮), et al. High concentration CTAB recovery from aqueous solutions by foam separation processes(泡沫分离回收水溶液中高浓度CTAB的工艺)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2016, 30(2): 358-363. |
| [7] | LI Xi(李希), LI Zhao-qi(李兆奇), GUAN Xiao-ping(管小平), et al. Progress in hydrodynamics of gas-liquid bubble columns(气液鼓泡塔流体力学研究进展)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(4): 765-779. |
| [8] | Stevenson P, Jameson G J. Modelling continuous foam fractionation with reflux[J]. Chemical Engineering and Processing:Process Intensification , 2007, 46(12): 1286-1291. DOI:10.1016/j.cep.2006.10.010. |
| [9] | Orwa J, Govaerts C, Gevers K, et al. Study of the stability of polymyxins B1, E1 and E2 in aqueous solution using liquid chromatography and mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis , 2002, 29(1): 203-212. |
| [10] | Suzuki T, Hayashi K, Fujikawa K, et al. The chemical structure of polymyxin E:the identities of polymyxin E1 with colistin A and of polymyxin E2 with colistin B[J]. The Journal of Biochemistry , 1965, 57(2): 226-227. DOI:10.1093/oxfordjournals.jbchem.a128082. |
| [11] | WU Zhao-liang (吴兆亮), TONG Bin (佟斌), ZHOU Li-ya (周丽亚), et al. Separation preparation method of polymyxin E (多粘菌素E 的分离制备方法): CN, 200510122187[P]. 2006-7-12. |
| [12] | Jain A K, Sahu P K, Mohan P, et al. Ion exchange resins-pharmaceutical and clinical applications[J]. Asian Journal of Biomaterial Research , 2016, 2(2): 51-61. |
| [13] | NAN Sui-fei(南碎飞), WANG Fei(王斐), WANG Qin(王钦), et al. Process integration of nanofiltration and foam separation for disposal of waste water with low concentration ammonium perfluorooctanoate(纳滤和泡沫分离联合处理含全氟辛酸铵废水的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2009, 23(4): 709-714. |
| [14] | Mohan S, Lyddiatt A. Protein separation by differential drainage from foam[J]. Biotechnology and Bioengineering , 1994, 44(10): 1261-1264. DOI:10.1002/(ISSN)1097-0290. |
| [15] | WEI Dian-jie(韦殿杰), LI Rui(李瑞), WU Zhao-liang(吴兆亮), et al. Experimental study on the foam fractionation column with partial horizontally flowing foam phase for the separation of bovine serum albumin(泡沫相部分水平泡沫分离塔强化分离牛血清蛋白的工艺研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2011, 25(4): 597-602. |
| [16] | Lambert W D, Du L, Ma Y, et al. The effect of pH on the foam fractionation of β-glucosidase and cellulase[J]. Bioresource Technology , 2003, 87(3): 247-253. DOI:10.1016/S0960-8524(02)00240-7. |
| [17] | Liu W, Zheng H, Wu Z, et al. Effects of pH profiles on nisin fermentation coupling with foam separation[J]. Applied Microbiology Biotechnology , 2010, 85(5): 1401-1407. DOI:10.1007/s00253-009-2217-z. |
| [18] | Kottmeier K, Günther T J, Weber J, et al. Constitutive expression of hydrophobin HFB1 from trichoderma reesei in pichia pastoris and its pre-purification by foam separation during cultivation[J]. Engineering in Life Sciences , 2012, 12(2): 162-170. DOI:10.1002/elsc.201100155. |
| [19] | Taura K, Yamamoto S, Hayashi S, et al. A new bioreactor for paclitaxel production based on foam separation[J]. Asia Pacific-Journal of Chemical Engineering , 2014, 9(1): 75-80. DOI:10.1002/apj.v9.1. |
| [20] | Cui X, Zhang D, Zheng H, et al. Study on the process of fermentation coupling with foam fractionation and membrane module for nisin production[J]. Asia Pacific Journal of-Chemical Engineering , 2014, 9(4): 623-628. |
| [21] | Zheng H, Zhang D, Guo K, et al. Online recovery of nisin during fermentation coupling with foam fractionation[J]. Journal of Food Engineering , 2015, 162: 25-30. DOI:10.1016/j.jfoodeng.2015.04.006. |
| [22] | Zhang D, Dong K, Xu D, et al. Process improvement for fermentation coupling with foam separation:a convenient strategy for cell recycle[J]. Asia Pacific Journal of Chemical Engineering- , 2015, 10(3): 466-475. DOI:10.1002/apj.v10.3. |
| [23] | TONG Bin(佟斌), LIU Gui-min(刘桂敏), WU Zhao-liang(吴兆亮), et al. Study on extraction process of polymyxin E by foam separation(泡沫分离提取多粘菌素E的工艺研究)[J]. Science and Technology of Food Industry(食品工业科技) , 2007, 28(5): 153-156. |
| [24] | ZHAO Yan-li(赵艳丽), WU Zhao-liang(吴兆亮), TONG Bin(佟斌), et al. Recovery of polymyxin E by two stages foam fractionation(两级泡沫分离回收多粘菌素E)[J]. Food Research and Development(食品研究与开发) , 2009, 30(6): 62-66. |




