2. 国家能源生物燃气高效制备及综合利用技术研发(实验)中心,北京 100083;
3. 中国农业大学烟台研究院,山东 烟台 264670
2. R&D Center for Efficient Production and Comprehensive Utilization of Biobased Gaseous Fuels, Energy Authority, National Development and Reform Committee(BGFeuls), Beijing 100083, China;
3. Institute of Yantai, China Agricultural University, Yantai 264670, China
据统计,2016年我国玉米年产量为2.2亿吨[1],按照草谷比1.1计算[2],玉米秸秆年产量约为2.4亿吨。大量的秸秆若不能得到有效地处理将会对环境造成严重的污染[3]。厌氧发酵可以将废弃物转化为沼气,后者可部分替代化石燃料[4]。秸秆发酵沼气的甲烷含量通常比畜禽粪便为原料的低[5],有研究报道畜禽粪便发酵沼气的甲烷含量可达到71%[6],秸秆发酵沼气中甲烷含量仅为55%[7]。较低的甲烷含量会降低沼气的热值,降低沼气的价值。因此,沼气提纯逐渐成为沼气利用的必要过程[8]。目前,沼气提纯主要有高压水洗、变压吸附、化学吸收和膜分离等方法[9-13]。这些提纯方法均在厌氧反应器外进行,需要额外的提纯设备,成本相对较高[14]。同时,在提纯过程中有2%~10%的CH4损失[15],不仅浪费了资源,而且这些温室气体还会对环境造成影响。
近年来,有研究向厌氧发酵体系中通入外源H2,利用嗜氢产甲烷菌的代谢还原CO2生成CH4,从而在发酵罐中实现沼气的提纯[16-17]。但是,也有研究报道通入外源氢导致发酵液pH升高到8.0以上[14],使甲烷菌的活性会受到一定程度影响。目前,对于秸秆连续发酵通入外源H2后甲烷发酵是否可以正常进行的研究鲜有报道。本研究以玉米秸秆为原料进行60 d连续中温厌氧发酵实验,考察通入外源H2对厌氧发酵过程中产气和沼气组成的影响,以及发酵体系中挥发性脂肪酸(VFAs)和pH等参数的变化。
2 材料与方法 2.1 实验材料本研究所用的玉米秸秆取自中国农业大学上庄实验田,为自然风干的玉米秸秆。取回的秸秆用粉碎机(HC-1000Y2)粉碎后过40目筛备用。粉碎后的秸秆使用时加水稀释至总固体(TS)含量质量百分率为5%。厌氧发酵罐使用的接种污泥取自实验室运行良好的鸡粪中温厌氧发酵罐的新鲜出料。秸秆和接种污泥的基本性质如表 1所示。
|
|
表 1 秸秆与接种污泥的基本性质 Table 1 Characteristics of corn straw and inoculum |
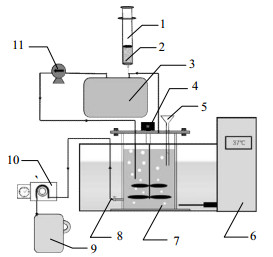
实验装置为实验室自制全混式反应器(completely stirred tank reactor, CSTR),流程如图 1所示,总容积为2.5 L,有效容积为2.0 L。实验组反应器每天进出料之后使用注射器向气袋中充入一定量的H2(H2浓度 > 99.9992%,通入量见表 2),同时使用气泵N86KTDCB(流量为5.5 L·min-1)每间隔5 s由气袋向反应器中循环通入气体10 s;本试验同时运行一个不通入H2的反应器作为对照组,该反应器在进出料时手动摇匀。两个反应器的水力停留时间(HRT)均为20 d,进料TS浓度和容积负荷(OLR)见表 2。每天手动从进料口进料,用蠕动泵出料,每天进出料100 mL。为了使反应器具有一定缓冲能力,在进料中补充1 000 mg-N·L-1的碳酸氢铵。反应器浸置于(37±1) ℃恒温水箱中。实验运行方案如表 2所示。
|
图 1 连续CSTR试验装置 Fig.1 Schematic diagram of the continuous CSTR setup 1. syringe 2. hydrogen 3. gas bag 4. agitator 5. feeding port 6. water bath 7. reactor 8. effluent port 9. effluent bucket 10. peristaltic pump 11. air pump |
|
|
表 2 实验运行方案 Table 2 Summary of reactor operation conditions |
TS和VS采用烘干法测定[18];COD采用重铬酸钾法[18];氨氮采用水杨酸-次氯酸盐光度法测定[19];pH值采用玻璃电极(Orion 5-Star pH) pH计测定;纤维素、半纤维素和木质素采用范氏洗涤法测定[20]。采用元素分析仪(Vario Macro, Elementar德国)测定元素组成,主要包括碳(C)、氢(H)、氮(N)、硫(S)和氧(O),其中O由差减法计算得到[21]。VFAs采用岛津GC-2010Plus气相色谱仪测定,采用30 m × 0.25 mm × 0.25 μm的毛细柱Rtx-wax色谱柱和和FID检测器,载气(氮气)分压为0.4 MPa,流量40 mL·min-1,氢气流量为20~30 mL·min-1,进样口、色谱柱和检测口温度分别为230、60和250℃。沼气成分(N2、CH4与CO2)采用岛津GC8A气相色谱仪测定,色谱柱采用Φ10 m × 2 mm不锈钢管,载气(氢气)分压为0.38 MPa,流量为20~30 mL·min-1,进样口、色谱柱和检测口温度分别为120、50和120 ℃;氢气含量采用日本岛津GC-8A气相色谱仪进行测定,色谱柱采用13X分子筛柱,载气N2,流量30 mL·min-1,进样口、色谱柱和检测口温度分别为120、60和120 ℃,电流80 mA。液相氢采用H2微电极(UnisenseA/S,丹麦)测定。
2.4 反应方程式及计算公式丙酸、丁酸产氢气反应[22]:
| $ \mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{COO}^{-}+3 \mathrm{H}_{2} \mathrm{O}=\mathrm{CH}_{3} \mathrm{COO}^{-}+\mathrm{HCO}_{3}^{-}+\mathrm{H}^{+}+3 \mathrm{H}_{2} \quad \Delta G^{0'}=+76 \mathrm{kJ} \cdot \mathrm{mol}^{-1} $ | (1) |
| $ \mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{COO}^{-}+2 \mathrm{H}_{2} \mathrm{O}=2 \mathrm{CH}_{3} \mathrm{COO}^{-}+\mathrm{H}^{+}+2 \mathrm{H}_{2} \quad \Delta G^{0'}=+48 \mathrm{kJ} \cdot \mathrm{mol}^{-1} $ | (2) |
乙酸产甲烷反应[22]:
| $ \mathrm{CH}_{3} \mathrm{COO}^{-}+\mathrm{H}_{2} \mathrm{O}=\mathrm{CH}_{4}+\mathrm{HCO}_{3}^{-} \quad \Delta G^{0'}=-31 \mathrm{kJ} \cdot \mathrm{mol}^{-1} $ | (3) |
H2和CO2产甲烷反应[22]:
| $ 4 \mathrm{H}_{2}+\mathrm{HCO}_{3}^{-}+\mathrm{H}^{+}=\mathrm{CH}_{4}+3 \mathrm{H}_{2} \mathrm{O} \quad \Delta G^{0'}=-135.6 \mathrm{kJ} \cdot \mathrm{mol}^{-1} $ | (4) |
秸秆厌氧发酵的麦斯威尔方程[23]:
| $ \mathrm{C}_{n} \mathrm{H}_{x} \mathrm{O}_{y} \mathrm{N}_{z}+\frac{1}{4}(4 n-x-2 y+7 z) \mathrm{H}_{2} \mathrm{O}=\frac{1}{8}(4 n+x-2 y-3 z) \mathrm{CH}_{4}\\+\frac{1}{8}(4 n-x+2 y-5 z) \mathrm{CO}_{2}+z \mathrm{NH}_{4} \mathrm{HCO}_{3} $ | (5) |
氢气利用率:
| $ T=\left(V_{1}-V_{2}\right) / V_{1} $ | (6) |
V1为H2通入量,V2为沼气中H2量
pH和碱度关系[24]:
| $ {\text{pH = p}}{K_{a, 1}} + \lg \frac{{\frac{{重碳酸盐碱度}}{{{\text{50}}\;{\text{000}}}}}}{{\frac{{{\text{C}}{{\text{O}}_{\text{2}}}(g)}}{{{K_{\text{H}}}}}}} $ | (7) |
其中:
| $ {K_{\text{H}}} = \frac{{{\text{C}}{{\text{O}}_{\text{2}}}{\text{(g)}}}}{{{\text{C}}{{\text{O}}_{\text{2}}}{\text{(aq) + }}{{\text{H}}_{\text{2}}}{\text{C}}{{\text{O}}_{\text{3}}}}}{\text{ = 38 atm}} \cdot {\text{mo}}{{\text{l}}^{ - {\text{1}}}}{\text{ (35 ℃}}{\text{)}} $ |
| $ {\text{p}}{{\text{K}}_{{\text{a, 1}}}} = - \lg {K_{a, 1}} $ |
| $ K_{a, 1}=\frac{\left[\mathrm{H}^{+}\right]\left[\mathrm{HCO}_{3}^{-}\right]}{\left[\mathrm{H}_{2} \mathrm{CO}_{3}\right]}=5 \times 10^{-7} \quad\left(35^{\circ} \mathrm{C}\right) $ |
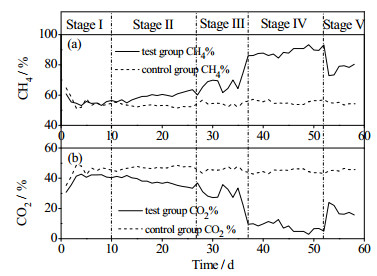
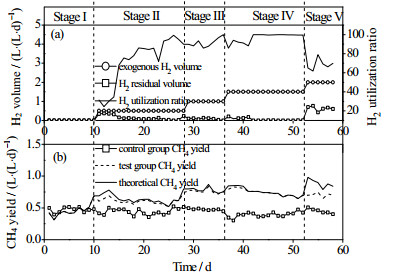
本实验启动后第10 d产气基本稳定,之后通入不同体积的H2开始提纯实验。图 2(a)和图 2(b)分别为CH4和CO2含量的变化。图 3(a)为实验组H2利用率,图 3(b)为实验组和对照组CH4容积产率。投入的有机物(CnHxOyNz)的分解反应可以用式(5)表示。将本研究使用的秸秆元素组成代入式(5)可推如下式:
|
图 2 沼气中CH4和CO2含量 Fig.2 Concentrations of CH4 and CO2 in biogas |
|
图 3 氢气利用率和产甲烷性能 Fig.3 Profiles of H2 utilization ratio and CH4 yield |
| $ \mathrm{C}_{3.2} \mathrm{H}_{5.5} \mathrm{O}_{22} \mathrm{N}_{0.1}+0.9 \mathrm{H}_{2} \mathrm{O}=1.7 \mathrm{CH}_{4}+1.4 \mathrm{CO}_{2}+0.1 \mathrm{NH}_{4} \mathrm{HCO}_{3} $ | (8) |
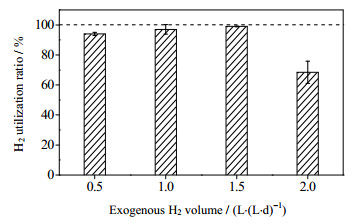
根据式(8)可以推算出本研究中对照组CH4浓度为55%,碳酸氢盐碱度为6 169 mg CaCO3·L-1。本实验中,对照组在稳定运行期间平均CH4和CO2容积产率分别为0.44和0.38 L·(L·d)-1,甲烷浓度为54%与式(8)的理论甲烷浓度基本相同。根据式(4)的化学计量方程,全部CO2转换为CH4需要1.5 L·(L·d)-1氢气。实验采用逐步提高H2通入量的方法提纯沼气。若H2可以全部利用,当外源H2通入量为0.5、1和1.5 L·(L·d)-1时,沼气中甲烷含量理论值分别为69%、85%和100%。图 4为各阶段运行稳定后氢气的转化率,Ⅱ、Ⅲ和Ⅳ阶段氢气转化率分别为94%、97%和99%,沼气中实际CH4含量分别为63%、77%和93%。
|
图 4 不同H2通入量的H2利用率 Fig.4 Profiles of H2 utilization ratio under different H2 addition amounts |
为研究CO2能否被完全利用,本研究进行了第Ⅴ阶段实验,通入2 L·(L·d)-1外源H2。此时,H2是过量通入,若CO2完全被H2还原,H2剩余量应为1 L,甲烷含量为62%(沼气中包含1 L氢气)。当通入过量H2时,H2不能被完全利用,此阶段发酵罐内甲烷含量为54% (包含剩余H2)。若去除H2计算,此阶段甲烷浓度为75%,相较于第Ⅳ阶段的93%明显降低。推测是因为过量的H2无法被全部消耗,反应器内氢分压过高导致发酵不稳定[25]。表 3为各阶段产气情况总结。有研究发现通入外源氢可使牛粪和乳清混合发酵沼气中甲烷提纯到96%[14],通入外源氢气可以将中温水稻秸秆发酵沼气中甲烷提纯到86%,高温发酵甲烷提纯到91%[16],均与本研究中秸秆发酵结论相似。根据表 3数据进行分析,当H2通入量为0.5、1和1.5 L·(L·d)-1时,通入每升氢气产生的甲烷分别是0.24、0.27、和0.27 L,而每升氢理论上产生的甲烷是0.25 L (如式(4)所示)。根据氢气的市场价进行简单折算,所得的甲烷价值仅为氢气的1/6。实际上,氢气提纯沼气产生甲烷更多的是利用多余或过剩的电能电解水产生的氢气,利用甲烷的可储存性,实现电能向燃气能源的转化。电转气技术(power to gas)在多能源互补供给中发挥重要的作用。该技术被视为是欧洲实现能源转型的关键技术,如德国包括计划和在建在内的power to gas项目有20个以上,可将过剩电能转换甲烷氢气等气体进行能量储存[26]。
|
|
表 3 各阶段反应器性能总结 Table 3 Summary of reactor performance at each state |
图 5是由式(5)作出的pH、CO2与碳酸氢盐碱度关系。由式(5)可知,加入外源H2降低沼气中的CO2浓度会导致pH升高。本研究中,对照组碳酸氢盐碱度为5 500 mg CaCO3·L-1实验组碳酸氢盐碱度为4 600 mg CaCO3·L-1。图 6为实验组和对照组pH的变化,1.5 L·(L·d)-1阶段运行稳定后实验组随着CO2含量46%由降低到7%,pH达到了8.04,对照组pH为7.17。嗜乙酸产甲烷菌最适pH在7~7.5 [27],通入外源H2导致了不利于产甲烷菌生存的偏碱性的环境。
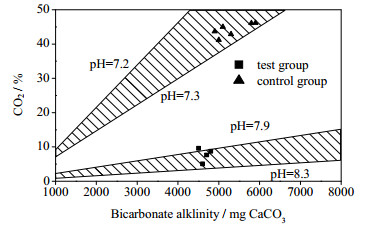
|
图 5 pH、CO2浓度与碳酸氢盐碱度关系 Fig.5 Relationship between pH/CO2 contents and bicarbonate alkalinity |
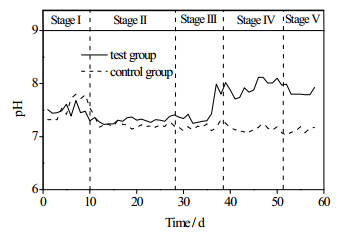
|
图 6 连续发酵pH的变化 Fig.6 Profiles of pH variation during continuous fermentation |
表 4对各阶段TS和VS去除率进行了总结。使用SPSS19.0对实验组和对照组的TS和VS去除率进行单因素方差分析,p值均大于0.05,可认为实验组和对照组的TS和VS去除率均无显著性差异。由此可知,通入外源H2对秸秆厌氧消化过程中有机物的降解作用并无明显的影响。
|
|
表 4 各阶段TS和VS去除率总结 Table 4 Summary of TS and VS removal rates at each state |
图 7(a)和(b)分别为实验组和对照组乙酸和丙酸浓度变化。从热力学角度分析,在标准状态下丙酸和丁酸代谢产氢产乙酸过程中需要消耗能量(ΔG0'分别为+76 kJ·mol-1和+48 kJ·mol-1),不能自发进行。当反应体系中氢分压过高是容易抑制丙酸和丁酸的降解[25, 28]。H2和CO2合成甲烷的反应是放能反应(ΔG0' = -135.6 kJ·mol-1),消耗H2可以推动前丙酸氧化生成乙酸和氢气反应的进行。
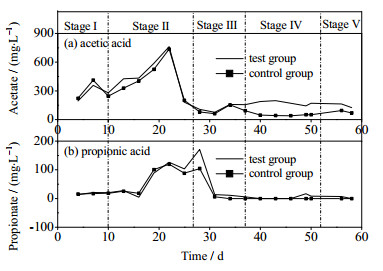
|
图 7 连续发酵乙酸和丙酸的变化 Fig.7 Profiles of acetic acid and propionic acid concentrations during fermentation |
图 8为实验组和对照组1.5 L·(L·d)-1阶段发酵24 h后的VFA和液相氢浓度,运行稳定后,实验组乙酸浓度为(170±39) mg·L-1,丙酸浓度为(8±5) mg·L-1,丁酸未检测出;而对照组仅检测出乙酸浓度为(45±5) mg·L-1。两组实验的VFAs均稳定在相对相抵的浓度,通入外源氢气并未对VFAs的降解产生严重的抑制。有研究在牛粪和乳清混合厌氧发酵反应器中通入外源H2,试验发现外源H2的通入可以增加CH4含量,同时反应体系中乙酸浓度增加,丙酸浓度基本不变[14],与本实验研究结果相近。通入外源H2的实验组液相氢浓度为(2.6±1.2) μmol·L-1,明显低于对照组(20.7±7.4) μmol·L-1。30 ℃氢气在水中饱和浓度为762 μmol·L-1 [29],实验组和对照组的液相氢浓度均远低于饱和浓度。研究报道外源H2的通入可以丰富发酵系统中的同型产乙酸菌,使嗜氢产甲烷菌处于优势[14, 30],显著提高嗜氢产甲烷菌的活性[31],本试验实验组液相氢浓度低于对照组,通入H2并未对VFA的降解造成抑制。
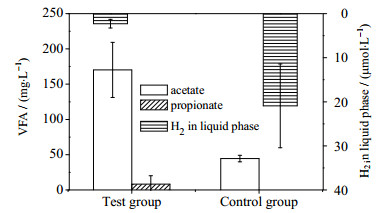
|
图 8 外源氢通入1.5 L·(L·d)-1阶段VFA和液相氢浓度 Fig.8 Concentrations of VFA and H2 in liquid phase with H2 flowrate of 1.5 L·(L·d)-1 |
玉米秸秆连续中温厌氧发酵实验中适量通入外源H2可以实现沼气的提纯,外源H2的通入不会对发酵产气造成严重的影响,通入1.5 L·(L·d)-1外源H2可以使沼气中CH4体积百分率由54%提纯到93%。由于CO2的消耗,实验组反应器出液pH达到了8.04。实验组液相氢浓度低于对照组,通入外源H2未导致丙酸和丁酸的明显增加,也未对TS和VS的去除率造成明显的影响。通入外源H2是一种具有良好效果的沼气提纯方法。
符号说明:
| Ka, 1 | — H+·HCO3-与H2CO3平衡系数,5×10-7 (35 ℃) | TS | —总固体,% |
| KH | — CO2与H2CO3平衡系数,38 atm·mol-1 (35 ℃) | V1 | —氢气通入量,L |
| pKa, 1 | —系数,-log Ka, 1 | V2 | —沼气中氢气量,L |
| T | —氢气利用率,% | VS | —挥发性固体,% |
| [1] |
国家统计局. 中国统计年鉴[M]. 北京: 中国统计出版社, 2017. National Bureau of Statistics. China statistical yearbook[M]. Beijing: China Statistics press, 2017. |
| [2] |
左旭, 王红彦, 王亚静, 等. 中国玉米秸秆资源量估算及其自然适宜性评价[J]. 中国农业资源与区划, 2015, 36(6): 5-10, 29. ZUO X, WANG H Y, WANG Y J, et al. Estimation and suitability evaluation of corn straw resources in China[J]. Chinese Journal of Agricultural Resources and Regional Planning, 2015, 36(6): 5-10, 29. |
| [3] |
GUO J B, CUI X, SUN H, et al. Effect of glucose and cellulase addition on wet-storage of excessively wilted maize stover and biogas production[J]. Bioresource Technology, 2018, 259: 198-206. DOI:10.1016/j.biortech.2018.03.041 |
| [4] |
CHEN Y, CHENG J J, et al. Inhibition of anaerobic digestion process:A review[J]. Bioresource Technology, 2008, 99(10): 4044-4064. DOI:10.1016/j.biortech.2007.01.057 |
| [5] |
李海红, 巴琦玥, 闫志英, 等. 不同原料厌氧发酵及其微生物种群的研究[J]. 中国环境科学, 2015, 35(5): 1449-1457. LI H H, BA Q Y, YAN Z Y, et al. Studies on microbial community of different materials and anaerobic fermentation[J]. China Environmental Science, 2015, 35(5): 1449-1457. DOI:10.3969/j.issn.1000-6923.2015.05.023 |
| [6] |
HANSEN K H, ANGELIDAKI I, AHRING B K, et al. Improving thermophilic anaerobic digestion of swine manure[J]. Water Research, 1999, 33(8): 1805-1810. DOI:10.1016/S0043-1354(98)00410-2 |
| [7] |
尉月丽.麦秸厌氧消化过程的优化与调控[D].青岛: 青岛科技大学, 2011. YU Y L. Optimization of the process of anaerobic digestion on wheat straw[D]. Qingdao: Qingdao University of Science and Technology, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10426-1012324556.htm |
| [8] |
李秀金, 周斌, 袁海荣, 等. 中国沼气产业面临的挑战和发展趋势[J]. 农业工程学报, 2011(S2): 352-355. LI X J, ZHOU B, YUAN H R, et al. China biogas industry-challenges and future development[J]. Transactions of the Chinese Society of Agricultural Engineering, 2011(s2): 352-355. |
| [9] |
KADAM R, PANWAR N L. Recent advancement in biogas enrichment and its applications[J]. Renewable & Sustainable Energy Reviews, 2017, 73(June): 892-903. |
| [10] |
COZMA P, WUKKOVITS W, MAMALIGA I, et al. Modeling and simulation of high pressure water scrubbing technology applied for biogas upgrading[J]. Clean Technologies & Environmental Policy, 2015, 17(2): 373-391. |
| [11] |
WU B, ZHANG X, XU Y, et al. Assessment of the energy consumption of the biogas upgrading process with pressure swing adsorption using novel adsorbents[J]. Journal of Cleaner Production, 2015, 101(AUG): 251-261. |
| [12] |
刘应书, 魏广飞, 张辉, 等. 沼气提纯过程中醇胺溶液吸收CO2传质性能[J]. 化工学报, 2013, 64(11): 4096-4104. LIU Y S, WEI G F, ZHANG H, et al. Masstransfer in CO2 absorption by alkanolamine aqueous solution for biogas purification[J]. CIESC Journal, 2013, 64(11): 4096-4104. |
| [13] |
CHEN X Y, VINHTHANG H, RAMIREZ A A, et al. Membrane gas separation technologies for biogas upgrading[J]. RSC Advances, 2015, 5(31): 24399-24448. DOI:10.1039/C5RA00666J |
| [14] |
GANG L, ANGELIDAKI I. Hollow fiber membrane based H2, diffusion for efficient in situ biogas upgrading in an anaerobic reactor[J]. Applied Microbiology & Biotechnology, 2013, 97(8): 3739-3744. |
| [15] |
涂睿, 黎军, 王萌, 等. 利用外源氢气纯化升级沼气的研究进展[J]. 化工学报, 2014, 65(5): 1587-1593. TU R, LI J, WANG M, et al. Research progress of biogas upgrading with external resource of hydrogen gas[J]. CIESC Journal, 2014, 65(5): 1587-1593. DOI:10.3969/j.issn.0438-1157.2014.05.005 |
| [16] |
林春绵, 叶媛媛, 邓小宁, 等. 外源氢气连续导入沼气发酵系统原位合成甲烷的实验研究[J]. 高校化学工程学报, 2017, 31(4): 892-898. LIN C M, YE Y Y, DENG X N, et al. In situ synthesis of CH4 in an anaerobic fermentation system by continuous introduction of exogenous H2[J]. Journal of Chemical Engineering of Chinese Universities, 2017, 31(4): 892-898. DOI:10.3969/j.issn.1003-9015.2017.04.019 |
| [17] |
LUO G, ANGELIDAKI I. Co-digestion of manure and whey for in situ biogas upgrading by the; addition of H2:Process performance and microbial insights[J]. Applied Microbiology and Biotechnology, 2013, 97(3): 1373-1381. DOI:10.1007/s00253-012-4547-5 |
| [18] |
贺延龄. 废水的厌氧生物处理[M]. 北京: 中国轻工业出版社, 1998. HE Y L. Anaerobic biological treatment of wastewater[M]. Beijing: China Light Industry Press, 1998. |
| [19] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 第4版. 北京: 中国环境科学出版, 2012. State Environmental Protection Administration. Water and wastewater monitoring and analysis method[M]. 4th ed. Beijing: China Environmental Science Press, 2012. |
| [20] |
YUAN X, MA L, WEN B, et al. Enhancing anaerobic digestion of cotton stalk by pretreatment with a microbial consortium (MC1)[J]. Bioresource Technology, 2016, 207(Feb): 293-301. |
| [21] |
SHEN X L, HUANG G Q, YANG Z L, et al. Compositional characteristics and energy potential of Chinese animal manure by type and as a whole[J]. Applied Energy, 2015, 160(Dec): 108-119. |
| [22] |
SCHINK S B. Energetics of syntrophic cooperation in methanogenic degradation[J]. Microbiology and Molecular Biology Reviews, 1997, 61(2): 262-280. |
| [23] |
野池达野. 甲烷发酵[M]. 北京: 化学工业出版社, 2014. NOIKE T. Methane fermentation[M]. Beijing: Chemical Industry Press, 2014. |
| [24] |
RITTMANN B E, MCCARTY P L.环境生物技术: 原理与应用[M].文湘华, 王建龙, 译, 清华大学出版社, 2014: 508. RITTMANN B E, MCCARTY P L. Environmental biotechnology: Principles and applications[M]. WEN X H, WANG J L. trans. Beijing: Tsinghua University Press, 2004: 508. |
| [25] |
李建昌, 张无敌. 氢分压对种间氢转移的影响[J]. 云南师范大学学报(自然科学版), 2005, 25(5): 21-25, 27. LI C J, ZHANG W D. The effect of partial hydrogen pressure on interspecies hydrogen transfer[J]. Journal of Yunnan Normal University (Natural Sciences Edition), 2005, 25(5): 21-25, 27. DOI:10.3969/j.issn.1007-9793.2005.05.007 |
| [26] |
罗承先. 德国采用电转气技术实现低碳化[J]. 中外能源, 2017, 22(4): 20-26. LUO C X. Application of power-to-gas technology for low carbonation[J]. Sino-Global Energy, 2017, 22(4): 20-26. |
| [27] |
O'FLAHERTY V, MAHONY T Ć, O'KENNEDY R, et al. Effect of pH on growth kinetics and sulfide toxicity thresholds of a range of methanogenic, syntrophic, and sulfate-reducing bacteria[J]. Process Biochemistry, 1998, 33(5): 555-569. DOI:10.1016/S0032-9592(98)00018-1 |
| [28] |
SIRIWONGRUNGSON V, ZENG R J, ANGELIDAKI I. Homoacetogenesis as the alternative pathway for H2 sink during thermophilic anaerobic degradation of butyrate under suppressed methanogenesis[J]. Water Research, 2007, 41(18): 4202-4210. |
| [29] |
WIESENBURG D A, GUINASSO N. Equilibrium solubilities of methane, carbon monoxide, and hydrogen in water and sea water[J]. Journal of Chemical & Engineering Data, 1979, 24(4): 356-360. |
| [30] |
WANG W, XIE L, LUO G, et al. Performance and microbial community analysis of the anaerobic reactor with coke oven gas biomethanation and in situ biogas upgrading[J]. Bioresour Technol, 2013, 146(10): 234-239. |
| [31] |
LUO G, JOHANSSON S, BOE K, et al. Simultaneous hydrogen utilization and in situ biogas upgrading in an anaerobic reactor[J]. Biotechnology & Bioengineering, 2012, 109(4): 1088-1094. |




