无水氯化镁是一种重要的无机化工产品,广泛应用于冶金、建材、化学、食品、医药、农业等各个领域。随着金属镁需求量的日益增加,作为制造金属镁的优质原料,无水氯化镁的开发也日益引起多方的关注与重视[1]。柴达木盆地的察尔汗盐湖是世界第二大盐湖,也是我国最大的氯化物型钾镁盐湖,其钾资源储量约占全国的87.6%[2],氯化镁储量仅次于死海,居世界第二位[3]。该盐湖经中间产品光卤石生产KCl过程中,每生产1 t氯化钾则废弃老卤(含氯化镁质量分数33%) 40 m3,大量的氯化镁没有利用[4, 5],导致了镁盐的局部富集。从长期来看,不仅造成了资源浪费, 而且还在一定程度上破坏了盐湖的资源结构, 严重影响盐湖无机矿物资源的持续开发利用[6],因此察尔汗盐湖钾、镁资源综合开发迫在眉睫。
无水氯化镁是制备金属镁的原料,但是六水氯化镁不能直接脱水得到无水氯化镁,由此开发了铵光卤石法[7]、醇氨法[8]等脱水制备无水氯化镁技术。Dolezal,Henry[9]曾利用MgCl2-NH4Cl-H2O三元体系相平衡合成铵光卤石NH4Cl·MgCl2·6H2O,并对铵光卤石进行脱水、脱铵,从而制得高纯度的无水氯化镁。因此,在盐湖卤水提取钾资源的过程中,若加入氯化铵,使其与卤水中的氯化镁转化为溶解度较小的铵光卤石,通过适当的控制操作条件便可同时获得纯度较高的氯化钾与铵光卤石产品,从而克服了氯化镁不易结晶析出的难题,NH4Cl-MgCl2-KCl-H2O体系相图是指导该新工艺的理论基础。吴敬雪等[10]研究了60℃时该体系的溶解度数据并设计了该温度下分离钾镁资源的工艺路线。在60℃下开发工艺具有高耗能、易造成设备腐蚀等缺点。由于受气候和地域等因素的限制,单一温度的相图并不能研究该体系的析盐规律,不能指导盐湖中钾、镁等资源的综合开发与利用,鉴于此本文对0℃NH4Cl-MgCl2-KCl-H2O四元体系相平衡进行了研究。
2 实验 2.1 实验试剂实验所用药品(表 1)均为分析纯,纯度不低于99%。所用水为蒸馏水。
| 表 1 实验试剂 Table 1 Chemicals used in the study |
实验均在常压下采用等温法[11]测定固液相平衡的溶解度数据。反应是在含有乙醇的恒温水浴中进行的,其温度可以在±0.1℃的范围内波动。平衡器采用直玻璃管,管内装样量约为整个体积的2/5,将电动搅拌机放入恒温水浴中搅拌,经测定该体系15 h达到平衡。
实验时将水温控制在(0±0.1)℃,用电子天平称取一定配比的氯化铵、氯化镁、氯化钾,加入玻璃管中,再加入一定量的水。将玻璃管固定在转盘上,搅拌至平衡停止搅拌。将玻璃管垂直静置至液相澄清,用胶头滴管取出约1/3的上清液并倒出湿渣进行分析。
2.3 分析方法NH4+-甲醛氧化法[12];Mg2+-EDTA络合滴定法[13];Cl--银量法[14];K+-差减法。固相物相鉴定采用湿渣法结合XRD作进一步鉴定。每组实验均进行平行测定,纯固相的含量由湿固相减去饱和液相确定。
考虑取样及滴定过程的误差,液相组成误差 < 2%(wt)。
3 结果与讨论 3.1 0℃时NH4Cl-MgCl2-KCl-H2O相平衡数据表 2为0℃时NH4Cl-MgCl2-KCl-H2O四元体系相平衡数据,根据表 2绘制相图(图 1),图 2为局部放大图,图 3为对应共饱点的XRD谱图。
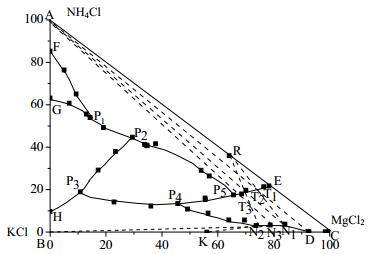
|
图 1 0℃时NH4Cl-MgCl2-KCl-H2O体系相图 Fig.1 Phase diagram of the NH4Cl-MgCl2-KCl-H2O system at 0℃ |
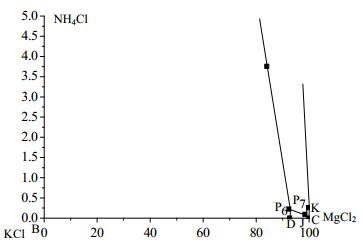
|
图 2 0℃时NH4Cl-MgCl2-KCl-H2O体系局部相图 Fig.2 Partially enlarged phase diagram of the NH4Cl-MgCl2-KCl-H2O system at 0℃ |
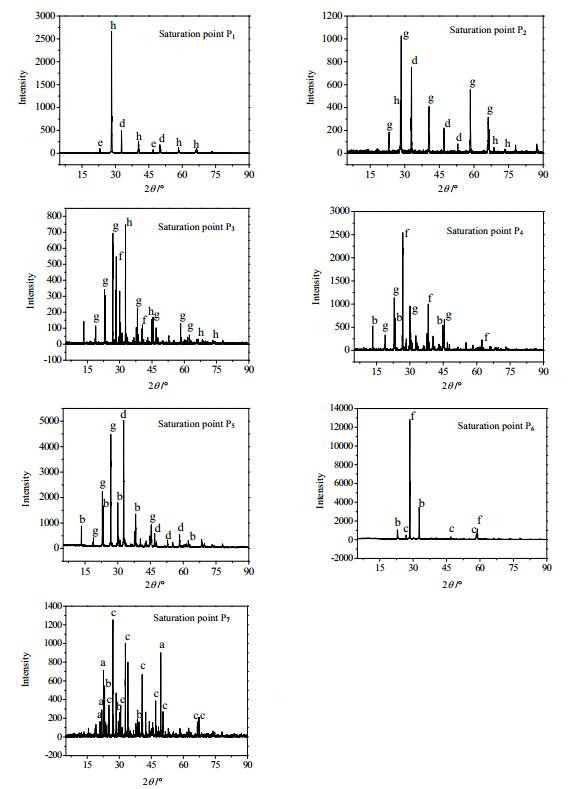
|
图 3 共饱点对应的平衡固相的XRD谱图 Fig.3 XRD patterns of solids at the saturation points a. MgCl2·6H2O b. NH4Cl·MgCl2·6H2O c. KCl·MgCl2·6H2O d. NH4Cl e. (NH4n, K1-n)Cl f. KCl g. (NH4n, K1-n)Cl·MgCl2·6H2O h. (K1-n, NH4n)Cl |
| 表 2 0℃时NH4Cl-MgCl2-KCl-H2O体系相平衡实验数据 Table 2 Phase equilibrium data of NH4Cl-MgCl2-KCl-H2O system at 0℃ |
由图 1和图 2可知,0℃时NH4Cl-MgCl2-KCl-H2O四元体系存在7个共饱点和8个结晶区和14条单变度曲线。点P1为NH4Cl、(NH4n,K1-n)Cl和(K1-n,NH4n)Cl的共饱点,P2为NH4Cl、(K1-n,NH4n)Cl和(NH4n,K1-n)Cl·MgCl2·6H2O的共饱点,P3为KCl、(K1-n,NH4n)Cl和(NH4n,K1-n)Cl·MgCl2·6H2O的共饱点,P4为KCl、NH4Cl·MgCl2·6H2O和(NH4n,K1-n)Cl·MgCl2·6H2O的共饱点,P5为NH4Cl、NH4Cl·MgCl2·6H2O和(NH4n,K1-n)Cl·MgCl2·6H2O的共饱点,P6为KCl、KCl·MgCl2·6H2O和NH4Cl·MgCl2·6H2O的共饱点,P7为MgCl2·6H2O、KCl·MgCl2·6H2O和NH4Cl·MgCl2·6H2O的共饱点。
8个结晶区分别为:AEP5P2P1FA为NH4Cl结晶区;BDP4P3HB为KCl的结晶区;CJP7KC为MgCl2·6H2O的结晶区;FGP1F为(NH4n,K1-n)Cl的结晶区;HP3P2P1GH为(K1-n, ,NH4n)Cl的结晶区;P3P4P5P2P3HC为(NH4n,K1-n)Cl·MgCl2·6H2O的结晶区;EP5P4P6P7KE为NH4Cl·MgCl2·6H2O的结晶区;CDP6P7C为KCl·MgCl2·6H2O的结晶区。
与60℃下该体系的相图对比[10]可发现,0℃时氯化钾和铵光卤石的结晶区有所减小,表明温度的升高可使氯化钾和铵光卤石的结晶区扩大,高温有利于铵光卤石的析出。
3.2 NH4Cl-MgCl2-KCl-H2O相图的应用查阅相关资料发现[9],在三元体系MgCl2-KCl-H2O中存在极小的MgCl2·6H2O结晶区,这导致了提钾后的母液中剩余大量MgCl2无法结晶析出,使得MgCl2的分离较为困难。结合0℃时NH4Cl-MgCl2-KCl-H2O相图发现,向三元体系MgCl2-KCl-H2O中加入NH4Cl后,出现了较大的KCl和NH4Cl·MgCl2·6H2O结晶区,这使得在四元体系中,将MgCl2以铵光卤石的形式从提钾母液中分离出来成为可能。
由图 1可知,光卤石组成点落在K点,向光卤石中加一定量的水使其溶解析出KCl固体,剩余母液为D,此时D中含有大量MgCl2。向D中加入氯化铵,系统点落在AD线上由D向A移动。当系统点落在DT1内时,此时系统点位于铵光卤石结晶区EP5P4P6P7KE内。R点为铵光卤石的组成点,由杠杆原理可知,当系统点落在T1点时,铵光卤石的收率最大,剩余母液为N1。蒸发掉部分水分后加入氯化铵,同样当系统组成点落在T2点时,铵光卤石的收率最大,剩余母液为N2。全部母液N2与一定量的光卤石和水混合,结晶析出KCl,过滤分离KCl后剩余母液为N3,向N3中加入氯化铵,系统组成点落在T3,过滤分离析出的铵光卤石后剩余母液为N2,N2可返回使用构成稳定循环生产[15],该工艺的流程如图 4所示。
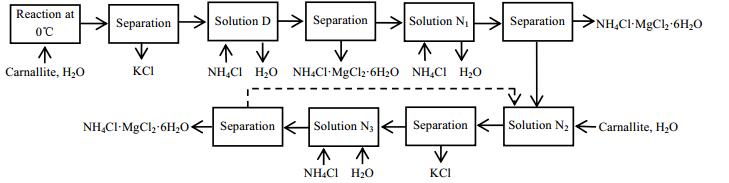
|
图 4 工艺流程图 Fig.4 Flow chart of KCl and NH4Cl·MgCl2·6H2O production processes |
以察尔汗盐湖日晒蒸发产物光卤石(KCl·MgCl2·6H2O)为原料,以1000 kg KCl·MgCl2·6H2O为基准,根据物料守恒计算结果如表 3所示,经分析,该工艺可使氯化钾的收率达到91.16%,氯化镁的收率达到77.1%,60℃条件下开发的工艺[10]氯化钾的收率达到86.6%,氯化镁的收率达82.38%,表明温度的升高对氯化镁收率的提高影响不大。综合来看,0℃条件下开发工艺可提高氯化钾的收率,且具有降低能耗、不易造成设备腐蚀等优点,为盐湖中钾、镁资源的综合开发利用提供了理论指导。
| 表 3 以光卤石为原料分离KCl的相图计算 Table 3 Calculated results based on the phase diagrams to produce KCl and NH4Cl·MgCl2·6H2O |
(1) 通过等温法测定了0℃时NH4Cl-MgCl2-KCl-H2O四元体系的溶解度数据,并绘制了相图。分析相图可知,该相图存在7个共饱点和8个结晶区,结晶区分别为:MgCl2·6H2O结晶区;KCl结晶区;NH4Cl结晶区;KCl·MgCl2·6H2O结晶区;NH4Cl·MgCl2·6H2O结晶区;(K1-n, NH4n)Cl结晶区;(NH4n, K1-n)Cl结晶区和(NH4n, K1-n)Cl·MgCl2·6H2O结晶区。
(2) 根据0℃时NH4Cl-MgCl2-KCl-H2O体系相图,设计了以光卤石和氯化铵为原料分离氯化钾和氯化镁的工艺,该工艺可使氯化钾的收率达到91.16%,氯化镁达到77.1%,分离得到的铵光卤石可用于生产无水氯化镁,实现镁资源的综合利用。
| [1] | ZHOU Huan(周桓), YUAN Jian-jun(袁建军). Progress in preparation technology of high purity anhydrous magnesium chloride(高纯无水氯化镁制备技术的进展)[J]. The Chinese Journal of Process Engineering(过程工程学报), 2004, 4(3): 276-281. |
| [2] | Wang X M, Miller J D, Cheng F Q, et al. Potash flotation practice for carnallite resources in the Qinghai Province, PRC[J]. Minerals Engineering, 2014, 66-68: 33-39.DOI:10.1016/j.mineng.2014.04.012. |
| [3] | HUANG Shan-shan(黄姗姗), WANG Hong-xia(王红霞), AN Yu-sheng(安玉生), et al. Progress of study on preparing anhydrous magnesium chloride based on bichofite(水氯镁石制备无水氯化镁研究进展)[J]. Guangzhou Chemical Industry(广州化工), 2013, 41(14): 24-26.DOI:10.3969/j.issn.1001-9677.2013.14.009. |
| [4] | ZHOU Yuan(周园), LI Li-juan(李丽娟), WU Zhi-jian(吴志坚), et al. Exploitation and comprehensive utilization for Qinghai salt lakes(青海盐湖资源开发及综合利用)[J]. Progress in Chemistry(化学进展), 2013, 25(10): 1613-1624. |
| [5] | WU Zhi-ming(乌志明), LI Fa-qiang(李法强). Development of magnesium chloride resources in salt lakes of Qinghai(青海盐湖氯化镁资源开发)[J]. Journal of Salt Lake Research(盐湖研究), 2001, 9(2): 61-65. |
| [6] | ZHANG Peng-xi(张彭熹). Natural salt lake resources of China and their development(中国盐湖自然资源及其开发利用)[M].Beijing(北京): Science Press(科学出版社), 1999. |
| [7] | ZHOU Huan(周桓), HU Cai-hua(胡彩花), YUAN Jian-jun(袁建军), et al. Technology of preparing high-purity anhydrous magnesium chloride by glycol-ammonia method(乙二醇氨法制备高纯无水氯化镁工艺研究)[J]. Journal of Salt and Chemical Industry(盐业与化工), 2007, 36(4): 1-5. |
| [8] | ZHOU Ning-bo(周宁波), CHEN Bai-zhen(陈白珍), HE Xin-kuai(何新快), et al. Preparation and characterization of anhydrous magnesium chloride by reaction of ammonia and ammonium carnallite(铵光卤石氨法无水氯化镁的制备与表征)[J]. Journal of Functional Materials(功能材料), 2005, 36(7): 129-131. |
| [9] | Dolezal H. Dehydration of Magnesium Chloride: US, US 3962408[P]. 1976-06-08. https://link.springer.com/article/10.1007/s11458-006-0046-5 |
| [10] | Wu J X, Zhang G C, Zhao B, et al. Phase diagrams of the quaternary system KCl-MgCl2-NH4Cl-H2O at t=60.00 ℃ and their application[J/OL]. Journal of Solution Chemistry, 2016[2016-12-22]. http://link.springer.com/article/10.1007/s10953-016-0558-7. |
| [11] | SU Yu-guang(苏裕光), LÜ Bing-ling(吕秉玲), WANG Xiang-rong(王向荣). The study on phase diagram of inorganic chemical production (I): theoretical foundation(无机化工生产相图分析)[M].Beijing(北京): Chemical Industry Press(化学工业出版社), 1985: 223-257. |
| [12] | Department of Chemistry, Zhejiang University (浙江大学化学系). Analytical chemistry experiment(分析化学实验)[M].Beijing(北京): Higher Education Press(高等教育出版社), 2003. |
| [13] | GONG Chuang-zhou(弓创周), WANG Shui-zan(王水赞), DING Lin(丁灵), et al. Improvement on main content determination method in industrial magnesium sulfate standard(工业硫酸镁标准中主含量测定方法的改进)[J]. Inorganic Chemicals Industry(无机盐工业), 2009, 41(12): 61-62.DOI:10.3969/j.issn.1006-4990.2009.12.020. |
| [14] | YANG Sheng(杨胜). Determination of chlorion in water by silver measuring method(银量法测定水中氯离子)[J]. Sichuan Electric Power Technology(四川电力技术), 1996(5): 33-35. |
| [15] | CAO Ji-lin(曹吉林), HOU Li-hong(侯丽红), LIU Xiu-wu(刘秀伍). Phase diagrams of Na2CO3-NaCl-H2O2-H2O system at 15℃ and 25℃ and their application(15℃和25℃时Na2CO3-NaCl-H2O2-H2O体系相图及其应用)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2009, 23(5): 742-747. |




