2. 河北工业大学 化工学院, 天津市本质安全化工技术重点实验室, 天津 300130;
3. 河北省现代海洋化工技术协同创新中心, 天津 300130
2. Tianjin Key Laboratory of Intrinsically Safe Chemical Technology, School of Chemical Engineering and Technology, Hebei University of Technology, Tianjin 300130, China;
3. Hebei Collaborative Innovation Center of Modern Marine Chemical Technology, Tianjin 300130, China
锂及其化合物具有优异的物理化学性能,在国民经济中占有重要的战略地位,素有“工业味精”和“21世纪能源金属”等美称[1]。近年来,随着新能源汽车的快速发展,人们对锂资源的需求量也日益增大。世界范围内锂资源储量丰富,约59% 分布于盐湖中[2]。目前,盐湖卤水提锂技术主要有蒸发结晶法、沉淀法、膜法、萃取法、吸附法及电化学吸附法等[3]。其中电化学吸附对锂离子的选择性高、过程能耗低、绿色环保,是在复杂共存离子环境的低锂卤水中有效的提锂方法之一[4]。围绕电化学提锂技术,基于LiMn2O4(LMO)活性材料的LiMn2O4/Li1-xMn2O4(LMO/L1-xMO)(下标x为LiMn2O4在氧化还原过程中的失电子数)“摇椅式”电极体系实现了Li+的同步吸附与解吸,降低了电极成本,提高了提锂效率[5-7],但其循环性能、交换容量仍有待提升[8]。碳纳米管(CNT)的一维纤维状结构可以有效连接电极活性材料,提升电极导电能力,但应用过程中面临易于团聚、分散性差的问题[9]。氧化石墨烯(GO)以其独特的二维结构、优异的电学性能和良好的生物相容性,在导电复合材料领域获得广泛关注[10]。本研究基于LMO/L1-xMO“摇椅式”电极体系,对LMO电极进行CNT掺杂改性制备了CNT-LMO膜电极。利用CNT与GO间的π-π键相互作用,制备了CNT-GO-LMO膜电极,在LMO活性电极材料上成功构建了“互联互通”三维致密导电网络结构。探究两改性电极组成的“摇椅式”电极体系对提锂性能的影响,为电化学提锂技术的进一步优化提供思路。
2 实验部分 2.1 电极制备采用高温固相法制备LMO粉末[11]。将LMO、乙炔黑(ACET)(天津市化学试剂一厂)和LA132黏结剂(四川茵地乐科技有限公司)按质量比为8:1:1混合,分散于体积分数为50% 的乙醇溶液中,超声分散均匀后得到LMO电极浆料。将LMO电极中质量分数为5%、10%、15% 的ACET替换为等量的GO(昂星新型碳材料常州有限公司)与CNT(上海麦克林生化科技有限公司)的混合物,其中GO与CNT的质量比为1:1。得到CNT-GO-LMO(CNT-GO-LMO-1、CNT-GO-LMO-2、CNT-GO-LMO-3)膜电极浆料。将LMO电极中10% 的乙炔黑替换为CNT,混合分散于乙醇溶液得到CNT-LMO膜电极浆料。用涂膜器将电极浆料分别均匀涂覆在碳布上,置于70 ℃的烘箱中干燥8 h,得到富锂态电极—LMO、CNT-LMO、CNT-GO-LMO(CNT-GO-LMO-1、CNT-GO-LMO-2、CNT-GO-LMO-3)。分别以富锂态电极为阳极,Ag/AgCl电极为阴极,置于KCl电解液中,在恒定电压(1.0 V)进行脱锂,反应完全(电流 < 0.1 mA)后获得对应的贫锂态电极—L1-xMO、CNT-L1-xMO、CNT-GO-L1-xMO(CNT-GO-L1-xMO-1、CNT-GO-L1-xMO-2、CNT-GO-L1-xMO-3)。
2.2 结构表征采用X射线衍射仪(XRD,型号:D8 Discover,德国布鲁克AXS有限公司)对产物进行结构表征,得到相应材料的晶体结构;扫描电子显微镜(SEM,型号:Quanta 450 FEG,FEI香港有限公司)用于分析电极的表面形貌;激光显微拉曼光谱仪(型号:in Via Reflex,Renishaw)用于测定CNT、GO的缺陷程度;利用原子吸收分光光度计(型号:AA320CRT,上海精密科学仪器公司)测定各离子浓度。
2.3 电化学测试在0.05 mol⋅L−1的LiCl溶液中,利用电化学工作站(型号:CHI660E,上海辰化仪器有限公司),以计时电位法(CP)对LMO/L1-xMO电极体系进行充放电测试,电压范围为−1.0 ~ 1.0 V,操作电流密度为1 mA⋅cm−2。利用双电极体系的循环伏安法(CV)分析各电极的Li+嵌/脱过程,扫描速率设置为0.1、0.2、0.3、0.4、0.5 mV⋅s−1。
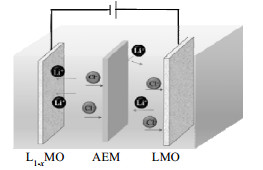
2.4 电化学提锂过程采用“摇椅式”电极体系(LMO/L1-xMO、CNT-LMO/CNT-L1-xMO、CNT-GO-LMO/CNT-GO-L1-xMO)从高镁锂比的盐湖卤水中选择性吸附Li+,提锂过程如图 1所示。以0.05 mol⋅L−1的LiCl和1.0 mol⋅L−1的MgCl2混合溶液为提取液,0.05 mol⋅L−1的KCl溶液为回收液,两室之间以阴离子交换膜(AEM)分开,电极间距为4.5 cm,电压恒定为1.0 V,阴极室的搅拌速率为600 r⋅min−1。提锂过程中阴阳极发生的反应如下[12]:
| $ {\text{L}}{{\text{i}}^{\text{ + }}}{\text{ + }}{{\text{e}}^ - }{\text{ + L}}{{\text{i}}_{{\text{1 - }}x}}{\text{M}}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}}{\text{ = LiM}}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}} $ | (1) |
| $ {\text{LiM}}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}} - {{\text{e}}^ - }{\text{ = L}}{{\text{i}}^{\text{ + }}}{\text{ + L}}{{\text{i}}_{{\text{1 - }}x}}{\text{M}}{{\text{n}}_{\text{2}}}{{\text{O}}_{\text{4}}} $ | (2) |
|
图 1 电化学提锂过程示意图 Fig.1 Schematic diagram of electrochemical lithium extraction process |
根据提锂前后各离子浓度,计算相关性能参数,提锂容量ELi为单位有效质量的电极材料对目标离子的电吸附容量[13];提锂速率rE为每分钟的提锂容量;电流效率η为Li+迁出所需电荷量与电源提供电荷量的比值;单位能耗E指每回收1 mol的Li+所需的电能;分离系数αLi-Mg是回收液中Li+与Mg2+的浓度比与提取液中初始Li+与共存离子浓度比的比值。具体计算方法如式(3)~(7)。
| $ {E_{{\text{Li}}}} = \frac{{{\rho _{\text{R}}}{V_{\text{R}}} + \sum\limits_0^J {{\rho _j}{V_j}} }}{m} $ | (3) |
| $ {r_E} = \frac{{{E_{{\text{Mt}}}}}}{t} $ | (4) |
| $ \eta = \frac{{F \cdot {E_{{\text{Li}}}}m}}{{10{M_{{\text{Li}}}}\int_0^t {I(t){\rm{d}}t} }} $ | (5) |
| $ E = \frac{{{M_{{\text{Li}}}}U\int_0^t {I(t){\rm{d}}t} }}{{3.6{E_{{\rm{Li}}}}m}} $ | (6) |
| $ {\alpha _{{\text{Li - Mg}}}} = \frac{{{c_{{\text{Li - }}t}}/{c_{{\text{Mg - }}t}}}}{{{c_{{\text{Li - 0}}}}/{c_{{\text{Mg - 0}}}}}} $ | (7) |
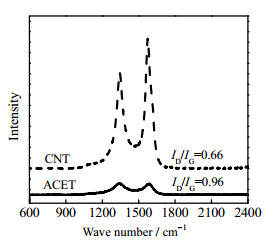
Raman光谱是通过C原子的特征峰表征碳材料结构性质的重要方法之一[14]。图 2为ACET与CNT的Raman图,其中,位于1 300和1 580 cm−1处的特征峰分别为ACET与CNT材料中C原子的晶格缺陷以及sp2杂化的面内伸缩振动,其相对强度(ID/IG)可反映二者表面的缺陷和无序性,ID/IG越低则材料石墨化程度越高、导电性能越好。ACET与CNT的特征峰ID/IG分别为0.96与0.66,这表明,与ACET相比,CNT的石墨化程度更高,电子可在其有序sp2杂化的碳六边石墨化网络结构上高速传递,使其具有更高的导电性能。这一特性为LMO膜电极提锂性能的进一步优化提供了理论支撑。
|
图 2 ACET和CNT的Raman图 Fig.2 Raman spectra of ACET and CNT |
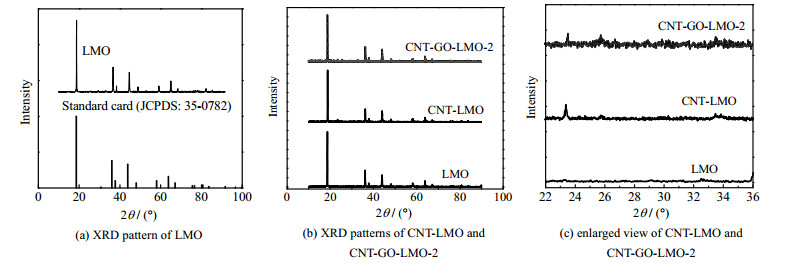
为优化LMO膜电极的导电和提锂性能,同步制备了CNT-LMO和CNT-GO-LMO-2膜电极材料。对比两电极XRD图谱,结果如图 3所示,与LMO电极相比,在引入CNT后,CNT-LMO电极在2θ为23.3°有CNT的特征峰出现,引入CNT和GO后,CNT-GO-LMO-2电极在23.5°和25.6°处分别出现了CNT和GO的特征峰[15]。与此同时,两改性电极均保留着LMO的标准峰,这说明本研究在成功制备CNT-LMO、CNT-GO-LMO-2电极的同时保证了LMO晶体结构的完整性,为改性电极对锂离子的特异性筛分提供了可能。
|
图 3 膜电极材料XRD衍射图 Fig.3 XRD patterns of film electrode material |
为进一步探究电极材料的表面形貌,分别对LMO粉末和LMO、CNT-LMO、CNT-GO-LMO-2膜电极进行了SEM表征,结果如图 4所示。LMO粉末为典型的八面体晶体结构(图 4(a))。LMO膜电极的SEM图片表明其中ACET颗粒团聚严重,呈点状分布,且大部分LMO晶体裸露而未形成有效的导电网络结构(图 4(b)),这种导电网络的缺陷在一定程度上抑制了LMO晶体的有效活性面积和提锂能力。图 4(c)中,引入一维CNT之后所形成的网状结构虽有效减少了LMO晶体的裸露,但CNT-LMO结构过于疏松,且微米级别空隙较大,对其导电性能的增强有一定的局限性。在CNT掺杂的基础上,引入二维GO材料,一维CNT和二维GO“线—面”结合可形成致密“互联互通”三维导电网络结构,有利于电子在CNT-GO-LMO-2膜电极内快速穿梭。图 4(d)中CNT-GO-LMO-2膜电极的电镜图像也验证了加入CNT-GO之后得到的完整致密的导电网络。这种结构有效减小了电子传递阻力,有利于提高电极活性材料的利用效率,强化LMO在提锂过程中的速率和容量性能。从微观角度出发,纠缠的碳纳米管被GO表面的官能团分离并分散在LMO表面,同时这些纤维状碳纳米管插入GO片层间,通过π-π键相互作用形成三维网络结构。这种网络结构使GO和CNT具有更大的表面积,与活性材料紧密接触,产生更好的相互作用[16]。

|
图 4 电极材料SEM形貌表征图片 Fig.4 SEM images of electrode material |
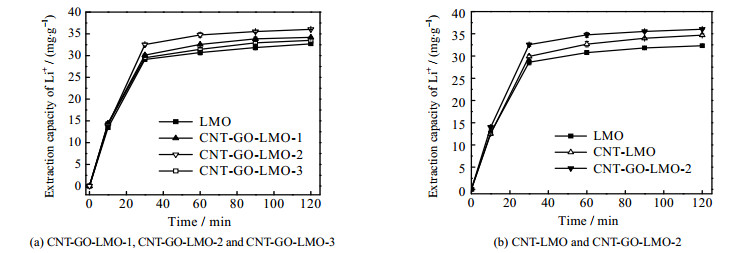
为探究GO、CNT掺杂量对提锂性能的影响,利用摇椅式电极体系,在1.0 V下进行电化学提锂反应。在120 min的反应过程中,Li+的提取容量的变化如图 5(a)所示。当GO、CNT掺杂量(质量分数)为10% 时提锂性能最佳,在此掺杂量下,考察CNT引入对提锂性能的影响,对比发现,反应终止时,CNT-LMO和CNT-GO-LMO-2电极的提锂容量与LMO相比,分别提高了7.95%、11.54% (图 5(b))。
|
图 5 不同膜电极的提锂容量 Fig.5 Lithium extraction capacity of different film electrodes |
为量化反应的快慢,对比了30 min时的提取速率,LMO、CNT-LMO、CNT-GO-LMO-2 3种膜电极的提取速率分别为:0.954、0.997、1.085 mg⋅(g⋅min)−1。与CNT-LMO膜电极相比,借助GO与CNT间的π-π键堆积作用,CNT-GO-LMO-2电极中形成了丰富的导电互联通道,实现了LMO氧化还原反应中电子的快速转移,提高了电极的提锂速率。此外,本组曾报道过GO掺杂LiMn2O4膜电极(GO-LMO)的提锂性能,其提锂容量为35.29 mg⋅g−1,提取速率为1.044 mg⋅(g⋅min)−1。由于CNT-GO-LMO-2电极表面存在致密的导电网络,其性能要优于GO-LMO[13]。表 1为不同膜电极提锂的性能参数。对比发现,改性膜电极的镁锂分离系数、电流效率均高于LMO电极,且单位能耗更低。其中CNT-GO-LMO-2膜电极表现最佳,这是因为CNT-GO的掺杂使CNT-GO-LMO-2电极表面形成了良好的三维导电网络结构。CNT的空心管状结构增加了Li+嵌入/脱嵌的活性位点,其薄壁结构可缩短离子扩散路径从而显著加快电化学动力学。GO的亲水官能团(环氧化物、羟基官能团)与吸附的水分子之间形成的氢键网络可以加速离子迁移,降低离子扩散能垒,降低传递阻力[17]。
|
|
表 1 不同膜电极的提锂性能 Table 1 Lithium extraction parameters of different film electrodes |
为评估CNT-GO-LMO-2在Li+电吸附领域的性能,横向比较了不同电极材料的提锂能力。表 2给出了CNT-GO-LMO-2和其他已报道电极材料的相关提锂容量,表中Tr-oh代表削面八角体,CF代表连续流动,s代表串联,AC代表活性炭。对比发现合成的LMO电极提锂性能已达到文献水平,在此基础上开发的CNT-GO-LMO-2电极在模拟卤水中提锂容量均高于其他电极材料,这说明CNT-GO-LMO-2电极在实际卤水中有一定应用前景。
|
|
表 2 CNT-GO-LMO-2与其他报道的电极材料性能对比 Table 2 Property comparison between CNT-GO-LMO-2 and other reported electrode materials |
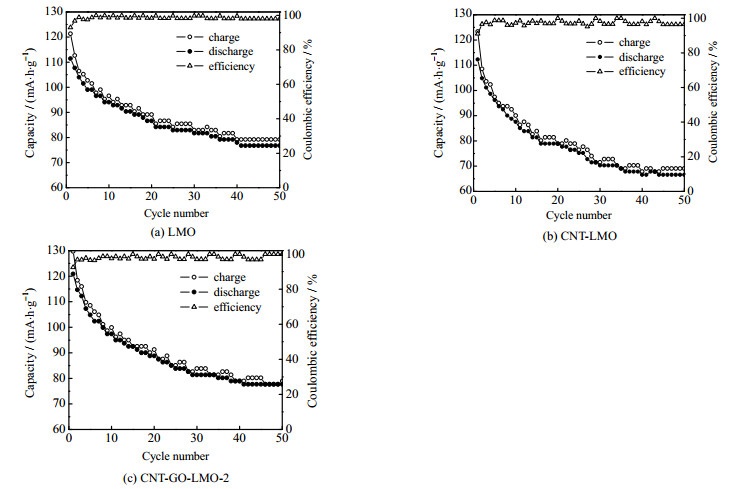
将富锂态和贫锂态电极组成摇椅式电极体系(LMO/L1-xMO、CNT-LMO/CNT-L1-xMO、CNT-GO-LMO-2/CNT-GO-L1-xMO-2)进行充放电测试,电压范围为−1.0~1.0 V。3种膜电极50次循环充放电测试曲线如图 6(a)~(c)所示。3种电极在0.05 mol⋅L−1的LiCl溶液中的初始充放电容量以及最终的容量保持率如表 3所示。
|
图 6 各电极体系充放电稳定性测试曲线 Fig.6 Charge and discharge stability curves of each electrode system |
|
|
表 3 不同膜电极50次充放电测试后的电极容量 Table 3 Electrode capacity of different film electrodes after 50 charge discharge tests |
由于Mn3+的歧化反应造成的Mn2+溶损和充放电过程的Jahn-teller效应造成的LMO结构变化,各电极的充放电电量在初期下降比较快,之后逐渐趋于稳定。经50次充放电测试后发现,引入CNT后,CNT-LMO膜电极、CNT-GO-LMO-2膜电极容量衰减较为明显。考虑到本研究引入多壁碳纳米管(MWCNTS),首次充放电存在一定的不可逆容量[24],因此两改性膜电极循环性能略有下降。但与LMO相比,在强化提锂性能的同时,CNT-GO-LMO-2电极仍能保持一定的容量保持率。综合本工作中Li+的提取速率和提锂容量、分离系数、单位能耗及电极循环稳定性,认为CNT-GO-LMO-2为最优的掺杂改性膜电极。
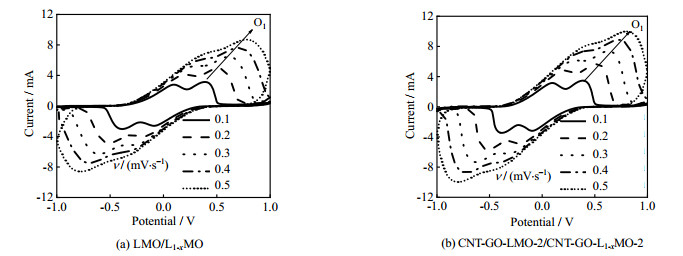
利用循环伏安(CV)法进一步分析了CNT-GO-LMO-2膜电极在溶液中的Li+的嵌/脱过程。LMO、CNT-GO-LMO-2电极在不同扫描速率下均表现出两对氧化还原峰,见图 7。随着扫描速率的增加,氧化峰与还原峰的电位差变大,两峰的位置分离更加明显,说明电极极化现象随扫描速率的增加而加重。同时,发现两电极的氧化峰O1电流Ip随着扫描速率的增加而增加,其中CNT-GO-LMO-2膜电极具有更大的氧化还原电流,这说明其电化学活性较高。
|
图 7 不同扫描速率下LMO/L1-xMO和CNT-GO-LMO-2/CNT-GO-L1-xMO-2电极体系的CV曲线 Fig.7 CV curves of LMO/L1-xMO and CNT-GO-LMO-2/CNT-GO-L1-xMO-2 system at different scan rates |
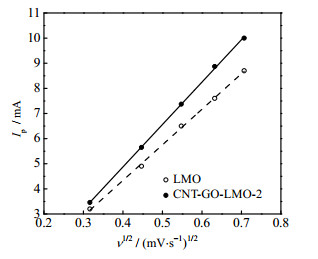
两电极的峰值电流与扫描速率的1/2次方的拟合曲线如图 8所示,可以看出两者具有良好的线性关系(
| $ {I_{\rm{P}}} = 2.69 \times 1{0^5} \times {n^{3/2}}AD_{{\rm{Li}}}^{1/2}{c_0}{\nu ^{1/2}} $ | (8) |
|
图 8 LMO电极和CNT-GO-LMO-2电极的氧化峰电流Ip与扫速平方根ν1/2的线性拟合曲线 Fig.8 Linear fitting of oxidation peak current Ip and square root of sweep velocity ν1/2 for LMO and CNT-GO-LMO-2 electrodes LMO CNT-GO-LMO-2 |
经计算,LMO和CNT/GO-LMO-2电极的扩散系数为1.79×10−13和2.54×10−13 cm2⋅s−1,CNT-GO-LMO-2膜电极的Li+扩散速率明显提高。在一维CNT和二维GO的共同作用下,Li+的迁移动力学显著提升。这说明CNT-GO掺杂有效提高了CNT-GO-LMO-2电极表面活性材料的利用效率,改善了Li+的迁移动力学。
4 结论本研究以LMO/L1-xMO摇椅式结构电极为基础,制备了CNT和CNT-GO掺杂的膜电极(CNT-LMO、CNT-GO-LMO),将其用于高Mg2+/Li+的提取液中进行锂的提取,得到如下结论:
(1) 一维材料CNT的引入在电极形成了疏松多孔的网状结构,有效减少了LMO晶体的裸露,但其结构不够致密,导电性发挥略有欠缺。引入GO后,一维CNT与二维GO相互连接,在电极表面形成了致密“互联互通”三维导电网络结构,加速了电子在电极中的传输。
(2) 对比LMO、CNT-LMO、CNT-GO-LMO-2几种膜电极在以高镁锂溶液为提取液时的提锂性能,发现CNT-GO-LMO-2膜电极表现最佳,提锂容量为36.04 mg⋅g−1,提取速率为1.085 mg⋅(g⋅min)−1,分离系数达到608.70。经50次循环充放电后,两改性电极仍保持一定的循环稳定性。
(3) 通过对CNT-GO-LMO-2膜电极进行CV测试,表明在LiCl溶液体系下该电极体系的电化学提锂过程受电极的内扩散控制,CNT-GO-LMO-2膜电极的扩散系数为2.54×10−13 cm2⋅s−1,较LMO膜电极明显提高。
符号说明:
A ⎯ 电极面积,cm2 I(t) ⎯ 系统在实验过程中的电流,A
c0 — Li+浓度,mol⋅cm−3 MLi ⎯ Li的摩尔质量,6.941 g⋅mol−1
cLi-0 ⎯ 初始时刻提取液中Li+的浓度,mol⋅L−1 m ⎯ 电极中LMO的有效质量,g
cLi-t ⎯ t时刻回收液中Li+的浓度,mol⋅L−1 n ⎯ 反应转移电子数(对于LMO,n≈1)
cMg-0 ⎯ 初始时刻提取液中Mg2+的浓度,mol⋅L−1 R2 ⎯ 决定系数
cMg-t ⎯ t时刻回收液Mg2+的浓度,mol⋅L−1 rE ⎯ 离子提取速率,mg⋅(g⋅min)−1
DLi —活性材料的化学扩散系数,cm2⋅s−1 t ⎯ 实验时间,min
E —单位摩尔锂离子电化学吸附时所消耗的电能, U ⎯ 操作电压,V
W⋅h⋅mol−1 Vj ⎯ 取样体积,L
ELi ⎯ 提锂容量,mg⋅g−1 VR ⎯ 回收液的最终体积,L
EMt ⎯ t时刻的提锂容量,mg⋅g−1 αLi-Me ⎯ Li+与Men+(杂质离子)的分离系数
F ⎯ 法拉第常数,96 485 C⋅mol−1 η ⎯ 电流效率,%
ID ⎯ D峰(~1 320 cm)的强度,a.u. ν ⎯ 扫描速率,mV⋅s−1
IG ⎯ G峰(~1 580 cm)的强度,a.u. ρj ⎯ 样品中Li+的质量浓度,mg⋅L−1
Ip ⎯ 峰电流,mA ρR ⎯ 回收液中离子的最终质量浓度,mg⋅L−1
| [1] |
贾航, 何利华, 徐文华, 等. 膜分离法及电化学吸附法盐湖提锂的研究进展[J]. 稀有金属与硬质合金, 2017, 45(1): 11-16. JIA H, HE L H, XU W H, et al. Research progress of lithium recovery from salt lake brines with membrane separation method and electrochemical-adsorptive method[J]. Rare Metals and Cemented Carbides, 2017, 45(1): 11-16. |
| [2] |
高峰, 乜贞, 郑绵平. 兑卤法从硫酸钠亚型盐湖卤水中制备碳酸锂[J]. 高校化学工程学报, 2018, 32(2): 472-477. GAO F, NIE Z, ZHENG M P. Preparation of lithium carbonate from sodium sulfate subtype brine by a brine mixing method[J]. Journal of Chemical Engineering of Chinese Universities, 2018, 32(2): 472-477. DOI:10.3969/j.issn.1003-9015.2018.02.029 |
| [3] |
LIU G, ZHAO Z W, GHAHREMAN A. Novel approaches for lithium extraction from salt-lake brines: A review[J]. Hydrometallurgy, 2019, 187: 81-100. DOI:10.1016/j.hydromet.2019.05.005 |
| [4] |
蒋晨啸, 陈秉伦, 张东钰, 等. 我国盐湖锂资源分离提取进展[J]. 化工学报, 2022, 73(2): 481-503. JIANG C X, CHEN B L, ZHANG D Y, et al. Progress in isolating lithium resources from China salt lake brine[J]. CIESC Journal, 2022, 73(2): 481-503. |
| [5] |
郭志远, 纪志永, 陈华艳, 等. 电化学提锂技术中电极材料和电极体系的研究进展[J]. 化工进展, 2020, 39(6): 2294-2303. GUO Z Y, JI Z Y, CHEN H Y, et al. Progress of electrode materials and electrode systems in electrochemical lithium extraction process[J]. Chemical Industry and Engineering Progress, 2020, 39(6): 2294-2303. DOI:10.16085/j.issn.1000-6613.2020-0108 |
| [6] |
ZHAO M Y, JI Z Y, ZHANG Y G, et al. Study on lithium extraction from brines based on LiMn2O4/Li1-xMn2O4 by electrochemical method[J]. Electrochimica Acta, 2017, 252: 350-361. DOI:10.1016/j.electacta.2017.08.178 |
| [7] |
XU W H, HE L H, ZHAO Z W. Lithium extraction from high Mg/Li brine via electrochemical intercalation/de-intercalation system using LiMn2O4 materials[J]. Desalination, 2021, 503: 114935. DOI:10.1016/j.desal.2021.114935 |
| [8] |
FANG J W, WANG J, JI Z Y, et al. Establishment of PPy-derived carbon encapsulated LiMn2O4 film electrode and its performance for efficient Li+ electrosorption[J]. Separation and Purification Technology, 2022, 280: 119726. DOI:10.1016/j.seppur.2021.119726 |
| [9] |
张长欢, 李念武, 张秀芹. 柔性锂离子电池的电极[J]. 化学进展, 2021, 33(4): 633-648. ZHANG C H, LI N W, ZHANG X Q. Electrode materials for flexible lithium-ion battery[J]. Progress in Chemistry, 2021, 33(4): 633-648. |
| [10] |
WANG Y, LI S S, YANG H Y, et al. Progress in the functional modification of graphene/graphene oxide: A review[J]. RSC Advances, 2020, 10(26): 15328-15345. DOI:10.1039/D0RA01068E |
| [11] |
JI Z Y, ZHAO M Y, YUAN J S, et al. Li+ extraction from spinel-type LiMn2O4 in different eluents and Li+ insertion in the aqueous phase[J]. Solvent Extraction and Ion Exchange, 2016, 34(6): 549-557. DOI:10.1080/07366299.2016.1221266 |
| [12] |
ZHAO X Y, YANG H C, WANG Y F, et al. Review on the electrochemical extraction of lithium from seawater/brine[J]. Journal of Electroanalytical Chemistry, 2019, 850: 113389. DOI:10.1016/j.jelechem.2019.113389 |
| [13] |
张帆, 纪志永, 汪婧, 等. GO/LiMn2O4膜电极构建及其提锂性能研究[J]. 材料导报, 2022, 36(11): 16-22. ZHANG F, JI Z Y, WANG J, et al. Study on the preparation of GO/LiMn2O4 film electrode and its lithium extraction property[J]. Materials Reports, 2022, 36(11): 16-22. |
| [14] |
郝思嘉, 李哲灵, 任志东, 等. 拉曼光谱在石墨烯聚合物纳米复合材料中的应用[J]. 材料工程, 2020, 48(7): 45-60. HAO S J, LI Z L, REN Z D, et al. Applications of Raman spectroscopy in graphene-based polymer nanocomposites[J]. Journal of Materials Engineering, 2020, 48(7): 45-60. |
| [15] |
YUAN G H, HUANG T, KOU Y, et al. Self-assembly of free-standing LiMn2O4-graphene flexible film for high-performance rechargeable hybrid aqueous battery[J]. Materials, 2018, 11(7): 1056. |
| [16] |
WANG X, YANG J, LI R M, et al. Deformation of single-walled carbon nanotubes by interaction with graphene: A first-principles study[J]. Journal of Computational Chemistry, 2015, 36(10): 717-722. |
| [17] |
SHI L, YING Z X, XU A, et al. Unraveling the water-mediated proton conduction mechanism along the surface of graphene oxide[J]. Chemistry of Materials, 2020, 32(14): 6062-6069. |
| [18] |
ZHOU G L, CHEN L L, LI X W, et al. Construction of truncated-octahedral LiMn2O4 for battery-like electrochemical lithium recovery from brine[J]. Green Energy & Environment, 2023, 8(4): 1081-1090. |
| [19] |
ZHAO X Y, LI G Y, FENG M, et al. Semi-continuous electrochemical extraction of lithium from brine using CF-NMMO/AC asymmetric hybrid capacitors[J]. Electrochimica Acta, 2019, 331: 135285. |
| [20] |
ZHAO A L, LIU J C, AI X, et al. Highly selective and pollution-free electrochemical extraction of lithium by a polyaniline/LixMn2O4 cell[J]. ChemSusChem, 2019, 12(7): 1361-1367. |
| [21] |
LIU D, XU W, XIONG J, et al. Electrochemical system with LiMn2O4 porous electrode for lithium recovery and its kinetics[J]. Separation and Purification Technology, 2021, 270: 118809. |
| [22] |
JANG Y J, HOU C H, PARK S, et al. Direct electrochemical lithium recovery from acidic lithium-ion battery leachate using intercalation electrodes[J]. Resources, Conservation and Recycling, 2021, 175: 105837. |
| [23] |
SHANG X H, LIU J Y, BIN H. CNT-strung LiMn2O4 for lithium extraction with high selectivity and stability[J]. Small Methods, 2022, 6(7): 2200508. |
| [24] |
CROMPTON K R, HLADKY M P, PARK H H, et al. Lithium-ion cycling performance of multi-walled carbon nanotube electrodes and current collectors coated with nanometer scale Al2O3 by atomic layer deposition[J]. Electrochimica Acta, 2018, 292: 628-638. |




