2. 上海污染控制与生态安全研究院,上海 200092
2. Shanghai Institute of Pollution Control and Ecological Security, Shanghai 200092, China
氢氧化镁(magnesium hydroxide, MH)作为重要的化工产品和中间体,有着广泛的应用。在环保领域,MH被称为“绿色安全水处理剂”,可以用于含酸废水的中和[1]、印染废水脱色[2]、重金属脱除[3-4]、烟气脱硫[5]等。MH也可以作为药物的抗酸剂[6]、抗菌杀菌剂[7-8]、纸张的保护剂[9]以及作为制备氧化镁的前驱体[10-11]。而MH作为一种环境友好型的无机阻燃剂,具有绿色环保、热稳定性高、阻燃、消烟、阻滴等优点而成为学者研究的热点[12-15]。但常温条件下合成的MH多为团聚态固体,单个颗粒平均粒径小,比表面积(BET)大,(101)面和(110)面表面极性和微观应变大,晶粒很容易产生二次团聚,在高分子聚合物材料中的分散性差,影响复合材料的加工性能。
水热改性技术是降低MH表面极性和表面微观应变、提高晶体结晶度、改善颗粒分散性的一个有效方法[16-18]。但直接水热MH料浆,由于MH的高度水化特性,使新核表面存在大量结晶水,阻碍了生长基元在新核表面的叠合,抑制了晶体生长,所以水热耗时长,能量消耗大[19-21]。研究者们又探索将氢氧化镁滤饼加入到水热矿化剂中,从而减少水热时间,提高MH的分散性。WU等[22]在CaCl2溶液中水热得到平均粒度约为0.3~0.7 μm、BET值为10.5 m2·g-1的片状MH,但是不可避免地会因Ca2+的加入而使MH的纯度有所下降。CHEN等[23]在一乙醇胺溶液中水热,可制备平均粒径0.3~0.4 μm的片状MH。CHEN等[24]在KOH溶液中水热,可以得到纯度为98.88%,BET值为10.11 m2·g-1,(101)面微观应变为2.57×10-3的片状MH。引入上述水热矿化剂,虽然能明显降低水热时间,但未能实现在体系中水热矿化剂的循环利用。
刘婷婷等[25]以浓度4 moL·L-1 NaOH为水热矿化剂,在200 ℃下水热8 h,可以制备平均粒径约为0.25 μm、厚度约为61 nm、团聚指数为10.95的六角片状MH。为了缩短水热时间,降低水热温度,高效制备符合一级阻燃用氢氧化镁标准的阻燃型氢氧化镁,本文在前期基础上,系统研究高浓度NaOH水热矿化剂的改性效果效果。NaOH经稀释后,可以作为制备MH前驱体的沉淀剂;MH反应结晶得到的NaCl滤液既可作为反应的底衬液,降低体系的过饱和度,提高常温产品的过滤性能,又能通过电解产生NaOH,实现资源的循环利用。
2 实验材料和方法 2.1 实验原料水氯镁石(MgCl2·6H2O)为青海察尔汗盐湖生产钾肥过程中排放的老卤经简单盐田自然蒸发结晶得到,水氯镁石原矿及其溶解过滤后的饱和溶液的主要离子含量组成如表 1所示,表中wB为质量分数。
|
|
表 1 MgCl2·6H2O主要离子组分含量 Table 1 Ion contents of MgCl2·6H2O |
如图 1所示为结晶-水热法制备六角片状氢氧化镁实验流程图,以100 mL浓度为4 moL·L-1 NaCl为底衬液加入到结晶反应器中,恒温到80 ℃,搅拌速率为300 r·min-1,同时采用蠕动泵以2 mL·min-1加料速度同时加入100 mL浓度为2.5 moL·L-1 MgCl2·6H2O和100 mL浓度为6 moL·L-1的NaOH,加料完成后恒温熟化60 min,当反应结束后,趁热抽滤,收集NaCl滤液作为下一次反应的底衬液,工业化生产中NaCl滤液还可以进入电解车间,电解产生的NaOH可以作为水热矿化剂循环使用。取一定质量的湿滤饼加入到容积为200 mL的PPL内衬的水热合成釜中,加入一定体积的水热矿化剂NaOH,密封后在一定水热温度下水热一定时间,自然冷却到室温后将上层NaOH液体收集,稀释后作为常温制备氢氧化镁前驱体的沉淀剂;下层料浆用去离子水稀释后抽滤,滤饼洗涤3次后在120 ℃的烘箱中干燥12 h。

|
图 1 结晶-水热法制备六角片状氢氧化镁实验流程图 Fig.1 Flow chart of the preparation of hexagonal magnesium hydroxide flake by the crystallization-hydrothermal method |
用马尔文粒度分析仪(Mastersizer 3000,英国Malvern公司)测定MH产品的团聚粒径;用场发射扫描电镜(SEM)(Nova NanoSEM450,美国FEI公司)对MH颗粒的形貌和团聚状态进行观察并直接测量具有代表性的SEM图中约200个颗粒粒径,计算其平均值作为一次平均粒径。用团聚指数定量表征团聚程度,用公式(1)计算得(HG/T 3821-2006)。X-射线多晶衍射仪(XRD)(D8 Advance,德国布鲁克AXS公司)来分析晶型,根据Scherrer式(2)计算晶体尺寸,根据Brag式(3)计算微观应变[26]。用全自动微孔物理吸附仪(ASAP2020HD88,美国麦克仪器公司)测量MH的BET值;用白度仪(XT-488N,杭州研特科技有限公司)测量MH的白度;用高分辨透射电子显微镜(HRTEM)(JEM-2100,日本电子株式会社)来观察单个典型的MH的形貌、晶面以及选区的电子衍射图(SAED);根据化工行业标准《工业用MH》HG/T 3607-2007用加热法测量干燥减量和灼烧失量,用EDTA化学滴定法滴定MH纯度。
| $T = {{{D_{50}}} /d}$ | (1) |
| $D = {{\kappa \lambda } / {(\beta \cos \theta }})$ | (2) |
| $\eta = 0.25\beta \cot \theta $ | (3) |
式中:T为团聚指数;D50为团聚粒径,单位:μm;d为一次平均粒径,单位:μm;D为晶体尺寸,单位:nm;η为微观应变;β为半峰宽,单位:Å;θ为衍射角度,单位:(Ǻ);λ为衍射波长,值为0.154 056 nm;k为常数,值为0.89。
3 实验结果与讨论MH晶体属于二价金属水合物族,有CdI2类型的层状结构,连续的六角形Mg2+离子层和OH-离子层彼此堆叠,Mg2+被OH-六次配位,从而形成Mg(OH)64-生长基元[19]。Mg(OH)64-的棱连接方式决定了MH的晶体形貌[27]。如图 2所示为Mg(OH)2 (001)面和(101)面的分子结构图及其微晶模型图,从图 2(a)中可以看出,在(001)晶面上,Mg2+与OH-是以离子键的形式进行连接,Mg(OH)64-沿着生长单元面进行伸展;而在(101)晶面上,单元层之间以弱氢键进行连接,Mg(OH)64-在单元层上层层堆叠。从图 2(b)可以看出,(001)晶面显露的是生长基元配位体的面,而(101)晶面显露的则是生长基元配位体的顶点,因此,在水热环境中(101)晶面生长较快,(001)晶面生长较慢,这也表明(001)晶面比(101)晶面更易显露,从而使得晶体呈现六角片状结构[28-29]。以NaOH为矿化剂水热改性Mg(OH)2属于“溶解-结晶”过程,在Mg(OH)2-NaOH-H2O中存在下列反应:
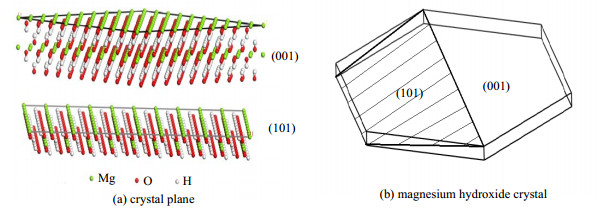
|
图 2 Mg(OH)2 (001)面和(101)面的分子结构图及其微晶模型图 Fig.2 Schematic diagram of the molecular structure of (001) and (101) crystal planeand magnesium hydroxide crystal |
| ${\rm{Mg{(OH)_2}(s) \rightleftharpoons Mg{(OH)_2}(aq)}}$ | (4) |
| ${\text{Mg(OH}}{{\text{)}}_{\text{2}}}{\text{(aq)}} \rightleftharpoons {\text{MgO}}{{\text{H}}^{\text{ + }}}{\text{ + O}}{{\text{H}}^{\text{ - }}}$ | (5) |
| ${\text{MgO}}{{\text{H}}^{\text{ + }}} \rightleftharpoons {\text{M}}{{\text{g}}^{\text{ + }}}{\text{ + O}}{{\text{H}}^{\text{ - }}}$ | (6) |
| ${\text{NaOH(aq)}} \rightleftharpoons {\text{N}}{{\text{a}}^{\text{ + }}}{\text{ + O}}{{\text{H}}^{\text{ - }}}$ | (7) |
| ${{\text{H}}_{\text{2}}}{\text{O}} \rightleftharpoons {{\text{H}}^{\text{ + }}}{\text{ + O}}{{\text{H}}^{\text{ - }}}$ | (8) |
Mg(OH)64-的生成,在界面上的吸附、结晶或脱落,除了受晶体内部结构的影响外,还受水热体系环境的影响,Mg(OH)2-NaOH-H2O体系中MgOH+和OH-的浓度会直接影响MH的重结晶过程,从而影响水热产品的分散性[30]。因此本文主要就水热矿化剂的浓度、水热时间、水热温度以及水热体系中固含量等因素来探讨水热体系环境对水热产品分散性的影响,制备符合一级阻燃用氢氧化镁。
3.1 矿化剂浓度对MH性质的影响在体系不引入其他物质的基础上,以NaOH为水热矿化剂能够明显的改善Mg(OH)2的分散性,使其(001)暴露更多,氢氧化镁粒径更大,厚度更厚。而考虑到水热后的NaOH可以作为结晶反应的原料,实现资源的循环利用,所以本实验加大NaOH的浓度,缩短水热反应的时间和降低水热温度。
3.1.1 SEM分析分别以4~15 moL·L-1 NaOH为水热矿化剂,反应釜填充量为70%,3%的固含量的料浆在180 ℃下水热6 h。如图 3所示为不同浓度矿化剂所得MH产品SEM图,如表 2所示为矿化剂浓度对MH粒径及团聚的影响,从图 3和表 2中可以看出,随着NaOH浓度增加,MH小颗粒溶解消失,晶体长大,晶体结构更完整,d由0.24增至1.10 μm,n从76增至230 nm,T由5.28减至2.53,晶体界限趋向于明显,说明NaOH浓度增加,MH的分散性提高。在高温高压碱性水热条件下,溶液黏度显著下降,电离常数升高,离子运动加快,能够降低反应过程中的活化能,并且MH胶体表面带正电,OH-易在Mg2+表面发生吸附,使晶体的生长方向发生改变,(001)面暴露更多,促进晶体的生长。而XIANG等[31]通过高温热力学计算软件HSC模拟计算Mg(OH)2-NaOH-H2O体系,证明较多的OH-为Mg(OH)64-在新核表面的叠合提供了动力,有利于Mg(OH)64-的生成,促进了晶体生长,因此在水热温度和水热时间一定时,提高矿化剂的浓度有利于促进MH的生长,提高其分散性。

|
图 3 不同浓度矿化剂所得MH产品SEM图 Fig.3 SEM micrographs of MH prepared under different mineralizer concentrations |
|
|
表 2 矿化剂浓度对MH粒径及团聚的影响 Table 2 Effects of mineralization concentrations on size and agglomeration of MH |
FANG等[17],XIANG等[31]为无机粉体在干态下的分散效果是其在聚合物基体中能否良好分散的前提条件,而I(001)/I(101)和I(001)/I(110)比值的大小反映了样品在干基状态下的分散性的强弱,其比值越大,越有利于提高样品粉体在干态下的分散性。
如图 4所示为不同浓度矿化剂所得MH的XRD图谱,如表 3所示为矿化剂浓度对MH晶习的影响,从图 4和表 3中可以看出,随着NaOH浓度增加,各峰值强度增加,各晶面尺寸增加,I(001)/I(101)由1.59增至2.47,I(001)/I(110)由7.92增至13.44,(101)面η由2.59×10-3降至2.07×10-3,(110)面的η由1.64×10-3降至1.37×10-3,因为提高OH-,这有助于Mg(OH)64-在含有较多Mg-O键的(101)和(110)面的吸附,降低了(101)和(110)面的η,使(001)暴露更多,而(101)和(110)面则受到抑制,使得MH的粒径更大,分散性能提高。而当水热介质超过12 moL·L-1后,体系中OH- 浓度过高,Mg2+ 和OH- 比例失衡,不利于Mg(OH)64-的形成,并且过多的OH-对生长界面存在屏蔽作用,从而使得晶体生长速度变慢,使其峰面强度减小,各峰面的尺寸也减小,考虑到后期的研究还想以降低水热反应时间和水热反应温度为目标,选着水热矿化剂的浓度为12 moL·L-1。
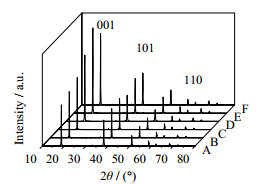
|
图 4 不同浓度矿化剂所得MH的XRD图谱 Fig.4 XRD patterns of MH prepared under different mineralizer concentrations A. 4 moL·L-1 B. 6 moL·L-1 C. 8 moL·L-1 D. 10 moL·L-1 E. 12 moL·L-1 F. 15 moL·L-1 |
|
|
表 3 矿化剂浓度对MH晶习的影响 Table 3 Effects of mineralizer concentrations on MH crystal properties |
如图 5所示为不同水热时间的MH产品SEM图,如表 4所示为水热时间对MH粒径及团聚的影响,从图 5和表 4中可以看出,当NaOH浓度固定为12 moL·L-1时,水热时间小于2 h时,MH分散性已经得到改善,形成了六方体片状,但其d < 0.5 μm,n < 80 nm,T高达11.93,达不到阻燃用MH的要求。当水热时间大于2 h后,d明显增大,n增加,T减小。当水热时间达到5 h时,其T降至3.10,分散性良好。

|
图 5 不同水热时间的MH产品SEM图 Fig.5 SEM micrographs of MH prepared under different hydrothermal times |
|
|
表 4 水热时间对 MH 粒径及团聚的影响 Table 4 Effects of hydrothermal times on size and agglomeration of MH |
如图 6所示为不同水热时间所得MH的XRD图谱,如表 5所示不同水热时间对MH晶习的影响,从图 6和表 5中可以看出,随着水热时间的增加,各峰值强度增加,各晶面尺寸增加,增加水热时间,Mg(OH)64-不断长大,使得晶体尺寸增加,结构更加完善。I(001)/I(101)由1.11增至2.54,I(001)/I(110)由4.06增至13.41。延长水热时间,增加了OH-对(101)和(110)的阻碍作用,使得(101)面的η从3.96×10-3降至2.04×10-3,(110)面的η从2.26×10-3降至1.40×10-3,而继续增加水热时间,其水热后产品的分散性并没有得到明显的提升,反而由于颗粒边缘会溶解,其T和极性面的η会稍有增加,因此选着水热时间为5 h为宜。

|
图 6 不同水热时间所得MH的XRD图谱 Fig.6 XRD patterns of MH prepared under different hydrothermal times A. 1 h B. 2 h C. 3 h D. 4 h E. 5 h F. 6 h |
|
|
表 5 不同水热时间对MH晶习的影响 Table 5 Effects of hydrothermal times on MH crystal properties |
如图 7所示为不同水热温度的MH产品SEM图,如表 6所示为水热温度对MH粒径及团聚的影响,从图 7和表 6中可以看出,随着水热温度的升高,MH的d增大,n增加,T减小。当水热温度小于140 ℃时,MH 薄片已经形成了六方体片状,但薄片之间的黏连还比较严重,因为当水热温度较低时,MH 的溶解-重结晶过程缓慢,在相同的水热时间下,Mg(OH)64-得不到充分的生长,MH 晶体结构不完善。当水热温度大于 160 ℃后,d明显增大,n增加,当水热温度为 180 ℃,T可降低到 2.83,产品分散性良好。随着水热温度增加,体系中 MgOH+的浓度增加,有利于 Mg(OH)64-的生成,促进晶体生长。但水热温度大于 170 ℃粒径和分散性相差不明显,出于能耗成本考虑,水热温度以 170 ℃为宜。

|
图 7 不同水热温度的MH产品SEM图 Fig.7 SEM micrographs of MH prepared under different hydrothermal temperatures |
|
|
表 6 水热温度对MH粒径及团聚的影响 Table 6 Effects of hydrothermal temperatures on size and agglomeration of MH |
如图 8所示为不同水热温度所得MH的XRD图谱,如表 7所示为不同水热温度对MH晶习的影响,从图 8和表 7中可以看出,在研究范围内,随着水热温度的增加,各峰值强度增加,各晶面的尺寸增大,I(001)/I(101)由1.41增至2.26,I(001)/I(110)由5.72增至12.71,(101)面的η从3.77×10-3降至2.27×10-3,(110)面的η从2.20×10-3降至1.64×10-3。温度的升高有利于MH粒子溶解,释放出Mg2+和OH-,有利于Mg(OH)64-的生成。另外(001)晶面上粒子之间是以离子键的方式连接的,其新键的形成需要更高的活化能,所以较高的水热温度有利于(001)晶面克服反应中的势能垒,促进晶体的长大。而继续增加水热温度,其水热后产品的分散性并没有得到明显地提升,结果与SEM结果相符,选着170 ℃为宜。

|
图 8 不同水热温度所得MH的XRD图谱 Fig.8 XRD patterns of MH prepared under different hydrothermal temperatures A. 100 ℃ B. 120 ℃ C. 140 ℃ D. 160 ℃ E. 170 ℃ F. 180 ℃ |
|
|
表 7 不同水热温度对MH晶习的影响 Table 7 Effects of different hydrothermal temperatures on MH crystal properties |
如图 9所示为不同固含量的MH产品SEM图,如表 8所示为不同固含量对MH粒径及团聚的影响,从图 9和表 8中可以看出,随着固含量的增加,MH的d减小,n减小。当固含量小于7%,其水热后产品的d变化不大,T< 3,n在180 nm以上。而当固含量大于10%以后,水热产品的d明显地减少,T增加,并且产品越来越不规则,产品粒度分布不均匀。这是因为增加反应釜固含量之后,使得体系中MH的浓度增加,OH-浓度相对浓度减少,削弱了颗粒和水溶液间的传热与传质,所以增加反应釜的固含量,水热产品分散性变差。

|
图 9 不同固含量的MH产品SEM图 Fig.9 SEM micrographs of MH products with different solid contents |
|
|
表 8 不同固含量对MH粒径及团聚的影响 Table 8 Effects of solid contents on size and agglomeration of MH |
|
|
表 9 不同固含量对MH晶习的影响 Table 9 Effects of solid contents on MH crystal properties |
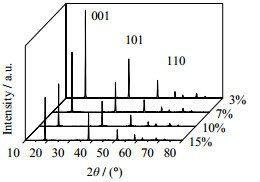
|
图 10 不同固含量下所得MH的XRD图谱 Fig.10 XRD patterns of MH products with different solid contents |
在适宜条件浓度12 moL·L-1 NaOH为水热矿化剂、7%固含量的MH料浆在170 ℃下水热5 h后的水热产品与常温下合成的MH前驱体性质的对比如图 11、12和表 10所示。

|
图 11 常温合成产品的SEM图和水热后产品的SEM及HRTEM图
Fig.11 SEM and HRTEM micrographs of products prepared under normal temperature and hydrothermal conditions
|
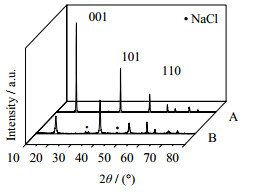
|
图 12 常温合成产品和水热后的产品的XRD图谱 Fig.12 XRD pattern of products prepared under normal temperature and hydrothermal conditions A. normal temperature products B. hydrothermal products |
|
|
表 10 常温合成产品和水热后的产品的性质对比 Table 10 Properties of products prepared under normal temperature and hydrothermal conditions |
如图 11所示为常温合成产品的SEM图和水热后产品的SEM及HRTEM图,从图 11(A)可看出,常温条件下制备的产品成细小薄片团聚在一起成插层结构,而图 11(B)为水热后产品成六方片状平铺,11(C)直接观察了单个典型的六角片状MH的形貌,如其插图所示,所选区域的SAED衍射花样显示样品为单晶结构、晶型良好、有规则的六边形对称性。如表 10所示为常温合成产品和水热后的产品的性质对比,从表 10中可以看出,水热前后产品d由水热前的0.12增至0.69 μm,BET值由42.93减至3.57 m2·g-1,T由93.04减至2.72,n由10增至185 nm,产品水热后分散性大大提高。水热之后,MH的纯度由98.12%增至99.66%,如图 12所示为常温合成产品和水热后的产品的XRD图谱,从图 12中可以看出,因为常温合成MH过程中,MH晶核易夹带NaCl等杂质,杂质包裹在MH晶格中,在过滤洗涤时难以出去,而在水热条件下,MH经理溶解-重结晶后,少量可溶性杂质溶解在NaOH中,洗涤过滤后易除去,提高了MH的纯度。相应的,常温合成的产品易发生二次团聚而包裹自由水,使得产品在烘干后含水量还高达1.69%,而水热产品的含水量仅为0.16%。水热后各峰面强度增加,(101)和(110)面的η均减小,水热后产品白度液高达97.66,灼烧失量可达31.19%,水热后产品可达到一级阻燃用MH的标准。
4 结论(1) 提高水热矿化剂NaOH的浓度,较多的OH-有利于Mg(OH)64-的生成,促进了MH晶体生长,产品的分散性提高。但体系中OH-浓度过高时,Mg2+和OH-比例失衡,对生长界面存在屏蔽作用,不利于生长基元的形成,从而使得晶体生长速度变慢。
(2) 提高水热时间,有助于Mg(OH)64-充分的生长,使得水热后MH平均粒径增加,颗粒厚度增大,(101)和(110)面的微观应变减小,产品的分散性提高。而继续增加水热时间,其水热后产品的分散性并没有得到明显地提升,反而由于颗粒边缘会溶解,其团聚指数和极性面的微观应力会稍有增加。
(3) 提高水热温度,有利于MH粒子溶解,释放出Mg2+ 和OH-,有利于Mg(OH)64-的生成;提高水热温度还有利于(001)晶面克服反应中的势能垒,促进晶体的长大,提高产品的分散性。而继续增加水热温度,其水热后产品的分散性并没有得到明显地提升。
(4) 提高料浆固含量,体系中MH的浓度增加,OH-浓度相对浓度减少,削弱了颗粒和水溶液间的传热与传质,当固含量大于10%,水热产品的一次粒径明显的减少,团聚指数增加,并且产品越来越不规则,产品分散性变差。考虑到工业应用的成本和收率,选择7%的反应釜固含量为宜。
(5) 在适宜条件浓度12 moL·L-1 NaOH为水热矿化剂、7%固含量的氢氧化镁料浆在170 ℃下水热5 h后,MH纯度达99.66%,杂质CaO含量为0.02%,白度达97.66,干燥减量为0.16%,灼烧矢量为31.19%,比表面积为3.57 m2·g-1,D50为1.88 μm,d为0.69 μm,T为2.72,n为185 nm,(101)面微观应变为2.30×10-3,符合一级阻燃型氢氧化镁的标准。
| [1] |
NIE J, YI S Z. Neutralization of acid wastewater and magnesium hydroxide slurry from seawater electrolytic pretreatment[J]. Advanced Materials Research, 2015, 1073-1076: 949-954. |
| [2] |
LI H Y, LIU S Y, ZHAO J H, et al. Removal of reactive dyes from wastewater assisted with kaolin clay by magnesium hydroxide coagulation process[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016, 494: 222-227. |
| [3] |
WANG S Y, LI G M, XU W, et al. Facile preparation and application of magnesium hydroxide assembly spheres[J]. Research on Chemical Intermediates, 2016, 42(3): 2661-2668. DOI:10.1007/s11164-015-2173-4 |
| [4] |
GUO X J, LU J, ZHANG L. Magnesium hydroxide with higher adsorption capacity for effective removal of Co(II) from aqueous solutions[J]. Journal of the Taiwan Institute of Chemical Engineers, 2013, 44(4): 630-636. DOI:10.1016/j.jtice.2012.12.020 |
| [5] |
DAGONKAR M V, BEENACKERS A A C M, PANGARKAR V G. Absorption of sulfur dioxide into aqueous reactive slurries of calcium and magnesium hydroxide in a stirred cell[J]. Chemical Engineering Science, 2001, 56(3): 1095-1101. DOI:10.1016/S0009-2509(00)00326-2 |
| [6] |
KANG J, SCHWENDEMAN S P. Comparison of the effects of Mg(OH)2 and sucrose on the stability of bovine serum albumin encapsulated in injectable poly(D, L-lactide-co-glycolide) implants[J]. Biomaterials, 2002, 23(1): 239-245. |
| [7] |
WANG Z P, LIC H, MU Y, et al. Nanoadduct relieves: Alleviation of developmental toxicity of Cr(VI) due to its spontaneous adsorption to Mg(OH)2 nanoflakes[J]. Journal of Hazardous Materials, 2015, 287: 296-305. DOI:10.1016/j.jhazmat.2015.02.005 |
| [8] |
PAN X H, WANG Y H, CHEN Z, et al. Investigation of antibacterial activity and related mechanism of a series of nano-Mg(OH)₂[J]. ACS Applied Materials and Interfaces, 2013, 5(3): 1137-1142. DOI:10.1021/am302910q |
| [9] |
GIORGI R, BOZZI C, DEI L, et al. Nanoparticles of Mg(OH)2: synthesis and application to paper conservation[J]. Langmuir the Acs Journal of Surfaces and Colloids, 2005, 21(18): 8495-8501. DOI:10.1021/la050564m |
| [10] |
LI X, ZHANG Y, ZHANGg Y, et al. Preparation of active magnesium oxide with caustic calcined magnesia by ammonia circulation method[J]. Advanced Powder Technology, 2016, 27(4): 1109-1114. DOI:10.1016/j.apt.2016.03.020 |
| [11] |
HANLON J M, DIAZ L B, BALDUCCI G, et al. Rapid surfactant-free synthesis of Mg(OH)2 nanoplates and pseudomorphic dehydration to MgO[J]. Crystengcomm, 2015, 17(30): 5672-5679. DOI:10.1039/C5CE00595G |
| [12] |
WANG Y G, LIU G D, ZHANG L Q, et al. Influence of ammonium polyphosphate on flame-retardant behavior and smoke suppression property of EVA/magnesium hydroxide composites[J]. Ferroelectrics, 2018, 523(1): 1-13. DOI:10.1080/00150193.2018.1391528 |
| [13] |
LEE C H, SAPUAN S M, HASSAN M R. Thermal analysis of kenaf fiber reinforced floreon biocomposites with magnesium hydroxide flame retardant filler[J]. Polymer Composites, 2016, 39(3): 869-875. |
| [14] |
DIAR B B, MIES M J M, DITTMIR T O. Synergistic flame retardant compositions and uses thereof in polymer composites: US, 20180105751[P]. 2018-04-19.
|
| [15] |
CASETTA M, MICHAUX G, OHL B, et al. Key role of magnesium hydroxide surface treatment in the flame retardancy of glass fiber reinforced polyamide 6[J]. Polymer Degradation and Stability, 2018, 148: 95-103. DOI:10.1016/j.polymdegradstab.2018.01.007 |
| [16] |
SIERRA-FERNANDEZ A, GOMEZ-VILLALBA L S, MILOSEVIC O, et al. Synthesis and morpho-structural characterization of nanostructured magnesium hydroxide obtained by a hydrothermal method[J]. Ceramics International, 2014, 40(8): 12285-12292. DOI:10.1016/j.ceramint.2014.04.073 |
| [17] |
FANG H X, ZHOU T, CHEN X P, et al. Controlled preparation and characterization of nano-sized hexagonal Mg(OH)2 flame retardant[J]. Particuology, 2014, 14(3): 51-56. |
| [18] |
WANG S Y, HE W Z, LIU C, et al. Characterizations and preparation of Mg(OH)2 nanocrystals through ultrasonic-hydrothermal route[J]. Research on Chemical Intermediates, 2016, 42(5): 4135-4145. DOI:10.1007/s11164-015-2264-2 |
| [19] |
HENRIST C, MATHIEU J P, VOGELS C, et al. Morphological study of magnesium hydroxide nanoparticles precipitated in dilute aqueous solution[J]. Journal of Crystal Growth, 2003, 249(1/2): 321-330. |
| [20] |
JIN D L, GU X Y, YU X J, et al. Hydrothermal synthesis and characterization of hexagonal Mg(OH)2 nano-flake as a flame retardant[J]. Materials Chemistry and Physics, 2008, 112(3): 962-965. DOI:10.1016/j.matchemphys.2008.07.058 |
| [21] |
LV J P, QIU L Z, QU B J. Controlled growth of three morphological structures of magnesium hydroxide nanoparticles by wet precipitation method[J]. Journal of Crystal Growth, 2004, 267(3/4): 676-684. |
| [22] |
WU Q L, XIANG L, JIN Y. Influence of CaCl2 on the hydrothermal modification of Mg(OH)2[J]. Powder Technology, 2006, 165(2): 100-104. DOI:10.1016/j.powtec.2006.03.023 |
| [23] |
CHEN Y B, ZHOU T, FANG H X, et al. A novel preparation of nanosized hexagonal Mg(OH)2 as a flame retardant[J]. Particuology, 2016, 24(1): 177-182. |
| [24] |
CHEN J M, LI L, SONG Y H, et al. Influence of KOH on the hydrothermal modification of Mg(OH)2 crystals[J]. Journal of Crystal Growth, 2009, 311(8): 2405-2408. DOI:10.1016/j.jcrysgro.2009.01.143 |
| [25] |
刘婷婷, 孙玉柱, 孙泽, 等. 浓海水制备氢氧化镁颗粒的水热改性[J]. 过程工程学报, 2015, 15(5): 824-830. LIU T T, SUN Y Z, SUN Z, et al. Hydrothermal modification of Mg(OH)2 particles prepared from concentrated seawater[J]. The Chinese Journal of Process Engineering, 2015, 15(5): 824-830. |
| [26] |
王英华. X光衍射技术基础[M]. 第2版.北京: 原子能出版社, 1993. WANG Y H. Foundation of X-ray Technology[M]. 2nd ed. Beijing: Atomic Energy Press, 1993. |
| [27] |
向兰, 金永成, 金涌. 氢氧化镁的结晶习性研究[J]. 无机化学学报, 2003, 19(8): 837-842. XIANG L, JIN Y C, JIN Y. Study on the Crystallization habit of magnesium hydroxide[J]. Chinese Journal of Inorganic Chemistry, 2003, 19(8): 837-842. DOI:10.3321/j.issn:1001-4861.2003.08.008 |
| [28] |
赵卓雅, 李祥高, 王世荣, 等. 六角片状氢氧化镁(001)晶面优先生长条件的研究[J]. 人工晶体学报, 2014, 43(7): 1611-1619. ZHAO Z Y, LI X G, WANG S R, et al. Study on the priority growth of (001) plane of hexagonal magnesium hydroxide[J]. Journal of Synthetic Crystals, 2014, 43(7): 1611-1619. DOI:10.3969/j.issn.1000-985X.2014.07.004 |
| [29] |
陈建铭, 张兆震, 宋云华. 水热反应条件对氢氧化镁晶体微观内应变的影响[J]. 人工晶体学报, 2011, 40(2): 396-399. CHEN J M, ZHANG Z Z, SONG Y H. Influence of hydrothermal conditions on the microscopic internal strain of magnesium hydroxide[J]. Journal of Synthetic Crystals, 2011, 40(2): 396-399. DOI:10.3969/j.issn.1000-985X.2011.02.022 |
| [30] |
YAN H, ZHANG X H, WU J M, et al. The use of CTAB to improve the crystallinity and dispersibility of ultrafine magnesium hydroxide by hydrothermal route[J]. Powder Technology, 2008, 188(2): 128-132. DOI:10.1016/j.powtec.2008.04.024 |
| [31] |
XIANG L, JIN C Y, JIN Y. Hydrothermal formation of dispersive Mg(OH)2 particles in NaOH solution[J]. Transactions of Nonferrous Metals Society of China, 2004, 14(2): 370-375. |




