在中国,工业、农业和养殖业每年产生数亿吨的有机废弃物(如秸秆、畜禽粪便、剩余污泥及其他废弃物)。如何可持续性处理有机废弃物已经成为一个全球性的挑战。对有机废弃物稳定利用(矿化挥发性固体和降低病原体)的厌氧消化技术已在世界各地应用[1]。厌氧消化技术是有机物质被厌氧菌在厌氧条件下分解产生甲烷和二氧化碳(50%~75% CH4,25%~50% CO2)的过程。其中,甲烷可用于生产热、电、压缩天然气(compressed natural gas,CNG)或液化天然气(liquefied natural gas,LNG)等[2]。同时,营养丰富的沼液是常用的有机肥[3]。同其他生化或热化学转化方法相比(如纤维乙醇),生物质厌氧消化是提供能源更有效的方法(能量产投比28/1)[4]。此外,大量露天堆放的秸秆和畜禽粪便废弃物等生物质自分解产生的甲烷排放加重了温室效应(甲烷对全球变暖的影响是二氧化碳近20倍),而厌氧消化捕集甲烷作为能源利用一定程度上能减少该问题的产生。
在厌氧消化工程发展过程中,面临的一大难题是如何提高废弃物厌氧消化的转化效率。各种不同的废弃物由于结构组成和营养不平衡等因素造成单一厌氧消化不稳定,转化效率较低。同新鲜玉米秸秆(fresh corn stover,FCS)相比,由于干玉米秸秆(dry corn stover,DCS)主要成分纤维素、半纤维素和木质素之间存在的共价键使它们紧密结合在一起,进而极大地阻碍了碳水化合物的降解[5],厌氧消化会出现发酵启动慢、发酵时间长、产气率低等问题[6],所以预处理就成为了木质纤维素厌氧消化的必须步骤。木质纤维素类原料厌氧消化的预处理方法主要有粉碎与研磨、高温处理、碱处理、生物处理和组合预处理等[7],不同处理方法的效果各异,导致最终的产气情况差异很大[8]。而且,单纯秸秆厌氧消化还存在碳氮比失衡的问题(秸秆碳氮比近70:1),而厌氧消化的最佳碳氮比为20~30:1。畜禽粪便如猪粪(pig manure,PM)由于碳氮比较低,单一厌氧消化易出现氨氮抑制的现象[9],导致难以形成厌氧产沼气菌群所需的最适生长状态[10]。城市污水处理厂的剩余污泥(excess sludge,ES)由于其细胞壁的结构对胞内易降解物质的水解有抑制作用,水解预处理是厌氧消化的限制步骤,常规污泥消化产气往往需要较长的停留时间[11],而且污泥中有机质含量较低,单一厌氧消化产气较低[12]。
针对以上问题,近年来提出了不同底物混合厌氧消化技术,已成为研究的热点之一。混合厌氧消化可以很好地调节单一原料的营养平衡,增强微生物的协同作用,从而提高有机质厌氧转化效率,同时还避免了厌氧消化设施的重复建设[13, 14]。鉴于此,本文进行了DCS和不同废弃物(PM和ES)混合预处理厌氧消化试验,考察了外加复合乳酸菌对混合废弃物微贮预处理方式对原料成分的改变及对沼气产率的影响,以期为资源化利用废弃物探索一条新的技术途径。
2 材料与方法 2.1 材料与试剂微贮原料:FCS和DCS,收集于河南省荥阳市。PM:干清粪由雏鹰集团提供;ES:由郑州市五龙口污水处理厂提供。
复合微生物及其培养:菌种来源于本实验室,分别是干酪乳杆菌(Lactobacillus casei),发酵乳杆菌(Lactobacillus fermentum)和粪链球菌(Enterococcus durans)。用MRS液体培养基分别厌氧静置培养16 h,6000 r·min-1离心后取沉淀,加入适量的无菌水,菌体浓度达到1010cfu·mL-1。MRS液态培养基组成为:酪蛋白胨10.0 g,牛肉浸取物10.0 g,酵母提取液5.0 g,葡萄糖5.0 g,乙酸钠5.0 g,柠檬酸二胺2.0 g,吐温80 1.0 g,磷酸氢二钾2.0 g,七水硫酸镁0.2 g,七水硫酸锰0.05 g,蒸馏水1.0 L,pH 6.8。
2.2 试验方法 2.2.1 PM和ES预处理由于PM和ES中都含有大量微生物、虫卵和病毒等,直接微贮易影响过程中的微生物生态系统,需要进行热处理进行消毒杀菌。将适量废弃物加入到密封玻璃瓶中在85℃水浴条件下保温1 h,冷却后用于微贮。
2.2.2 微贮方法微贮容器采用泡菜坛子,顶部用水密封以达到隔绝空气厌氧发酵的目的。收集DCS 1.5 kg,切碎成2~3 cm,按绝干质量比例加入热处理后的废弃物(DCS:PM=4:1;DCS:ES=6:1),接种含有乳酸菌的水溶液混合均匀后填装于坛子中压实(控制最终含水量为接近70%),顶部加水密封后于25~30℃保存。复合乳酸菌由Lactobacillus casei,Lactobacillus fermentum和Enterococcus durans组成。接种量分别为1.0×106个细胞/克干物质。30 d后取样测定pH值,成分变化等。对照组1为DCS单独微贮,对照组2为FCS单独青贮(不外加微生物及其他物质)。
2.2.3 沼气发酵试验本试验所用试验装置为本实验室自行研制的恒温厌氧消化装置,主要由发酵罐、循环水保温系统、流量计及控制柜组成如图 1所示。材质为不锈钢,总容积为100 L,有效容积80 L。双层夹套,用循环热水((50±2)℃)为反应器加热,发酵液温度控制在(45±2)℃。反应器内设有垂直搅拌器,机械密封。进料口在反应器顶部,底部为出料口,采用阀门控制。采用连续搅拌方式,转速为180 r·min-1。选取微贮料进行半连续厌氧消化试验,采用每天定时进出料方式,出料料液采用100目网筛将发酵残渣滤除,滤液用于配制进料料液并回用至发酵罐中,进料料液体积不足时采用自来水补足。半连续发酵试验固形物滞留时间为30 d。每日记录产气量。对照组为未经预处理的DCS。

|
图 1 恒温厌氧消化装置 Fig.1 Thermostatic anaerobic fermentation device a. gas flowmeter b. fermenter with mechanical agitator c. thermostatic water bath d. motor control cabinet |
样品采用烘干法测定样品的干重(dry matter,DM),总固体含量(total solid,TS)和挥发性固体含量(volatile solid,VS)。根据美国国家可再生能源实验(National Renewable Energy Laboratory,NREL)提供的两步水解方法[15],对样品的纤维素和半纤维素成分进行分析测定。总氮(total mitrogen,TN)测定采用凯式定氮法。样品按照重量比1:10(原料/水)混合,过滤取滤液测定pH值和有机酸,有机酸(乳酸,乙酸和丁酸)的测定采用液相色谱(Agilent Technologies 1260 Infinity),上清液过0.22 µm滤膜。分析柱为Biorad Aminex HPX-87H (300 mm × 7.8 mm),流动相为5 mmol·L-1 H2SO4,流速为0.5 mL·min-1。柱温65℃。
沼气中的CH4和CO2含量采用气相色谱仪(国美GC7980) 测定。色谱柱:碳分子筛,填充柱TDX-01型(2 m× 3 mm,美国惠普公司);载气:高纯氩气,纯度为99.999%;载气分压:0.3 MPa到0.4 MPa;检测器:热导检测器(TCD);桥流:60 mA;进样量100 μL,分流比:30:1;柱温:60℃;进样温度:150℃;检测器温度:150℃;保温层温度:150℃。
微贮样品送至上海生工生物工程股份有限公司进行高通量测序和后续数据分析。PCR扩增区域为16S rRNA的V3和V4区,使用的引物是341F (CCTACGGGNGGCWGCAG)和805R (GACTACHVGGGTATCTAATCC)。
沼气试验结束后,综合试验数据计算TS产气率,即单位原料干物质产气体积(mL·g-1),主要反映原料的产气潜力。计算公式如下:
| ${\rm{TS产气率}}({\rm{mL}} \cdot {{\rm{g}}^{ - 1}}) = \frac{V}{{X \times {\rm{TS}}}}$ |
式中:X为原料质量,g;TS为原料总固体质量百分数,%;V为累积产气量,mL。
3 结果与分析 3.1 微贮料感官质量和水溶物成分分析借鉴青贮饲料感官评定方法,能快速、直观地判断规模化混贮料是否变质(样品如图 2)。贮存30 d后,青贮FCS样品酸味明显,颜色鲜亮;DCS单独微贮的样品均发生臭鸡蛋味,原料发粘,颜色变深等现象,说明微贮失败(图片未添加),这是因为,与FCS相比,DCS在田地风干过程中由于生理环境发生变化,呼吸作用加强,很多成分如可溶性糖、可溶性蛋白质等含量逐渐下降,纤维素结晶度、聚合度提高,环绕着纤维素与半纤维素地缔合的木质素结构更加紧密[16],增加了微生物利用的难度,导致其不易于微贮成功。2个混合微贮组均无霉变腐烂现象,微贮料原料色泽呈现黄色(由于污泥颜色的原因,DCS+ES组颜色稍深),有浓郁的酸香味,说明微贮成功。后续试验没有进行DCS单独微贮失败的后续试验操作,只对复合乳酸菌微贮原料和青贮FCS进行了分析和试验。

|
图 2 原料和微贮料外观形态 Fig.2 Surface morphology of materials and silages |
微贮过程微生物活动消耗了原料中部分可溶性糖,产生了乳酸、乙酸等有机酸类物质[17]。微贮料中水溶性有机酸等指标分析见表 1。有机酸(尤其乳酸)含量是决定样品pH值的重要因素,乳酸是否为主要发酵产物是能否保证微贮质量的关键因素[18]。通过30 d厌氧处理,乳酸含量分别达到2.28%(DCS+ES)和3.24%(DCS+PM),乙酸含量相差不大。乙酸和乳酸等有机酸是甲烷发酵代谢途径中的重要中间产物,对木质纤维素类物质的沼气发酵有较大促进作用[19]。青贮FCS中乳酸含量最高为3.75%和一定量乙酸1.29%,主要是由于原料FCS中水溶性糖较高(葡萄糖5.58%,木糖5.69%),易于被微生物代谢利用,不用外加任何微生物而易于青贮。两组微贮料和青贮料pH值都降低至4.10左右。在该pH值条件下,发酵基本停止,抑制了有害微生物(如梭状芽孢杆菌和肠杆菌等)的代谢活动[20]。微贮过程中代谢产生丁酸常常作为微贮腐败的指标[21],本文两组微贮料和青贮料中丁酸含量最高只有0.55%,表明微贮过程没有受到腐败菌的影响。
| 表 1 微贮前后原料中有机酸的变化 Table 1 Organic acids in the H2O extracts of different samples |
露天堆放的秸秆、污泥和粪便废弃物等生物质在微生物和空气作用下会发生自分解造成变质及损失,在厌氧环境有效保护作用下,原料得到了很好的保质贮存。表 2列出了原料微贮前后的主要成分,可以看出微贮对结构性碳水化合物(纤维素和半纤维素)含量影响较小,少量碳水化合物被微生物代谢产生了乳酸和乙酸等有机酸。相对于沼气发酵来说,原料DCS、ES和PM中碳水化合物与总氮的比例都不合理,特别是原料ES中碳氮比最低。两组微贮料中的碳水化合物同总氮的比例更趋于合理,有利于沼气发酵。青贮料中乳酸、纤维素和半纤维素含量虽然最高,但是总氮含量稍低,产气效果稍差,这在后续的产沼气能力分析中得到了验证。
| 表 2 微贮前后原料的组成 Table 2 Composition of materials and silage |
在秸秆自然富集微生物固态发酵的基础上,通过强化微生物混合固态发酵的方法进行干秸秆微贮,以青贮FCS和微贮DCS+PM为例,原料DCS为对照。样品运用PCR方法扩增16S rRNA的V3和V4区进行高通量测序,进行细菌多样性分析。OTU样品分布韦恩图如图 3,结果表明菌群丰度由大到小依次为原料DCS>微贮DCS+PM>青贮FCS,说明在微贮或青贮条件下,DCS原料中来源于自然状态的各种微生物物种由于受到厌氧菌的抑制,数目减少。三个样品共有的OTU数目为112个,说明原料DCS中自然富集的某些微生物在微贮或青贮过程中保存了下来。
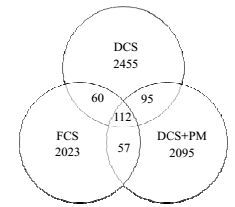
|
图 3 OTU样本分布韦恩图 Fig.3 Venn chart of OTU samples |
多样性分析结果如表 3,测序覆盖深度(Coverage指数)达到0.96,说明本次测序结果能代表样本的真实情况。Shannon和Simpson数值表明,微贮DCS+PM和青贮FCS厌氧处理会降低原料DCS中微生物群落多样性。
| 表 3 不同样品的菌群多样性分析指数 Table 3 Community richness estimators of different samples |
不同样品的菌群多样性分析指数微生物组成如表 4。结果表明原料DCS中本身带有一定的乳酸菌数量,如促进pH值降低的乳球菌属Lactococcus和乳杆菌属Lactobacillus,相对数目较低不足以在贮藏过程中形成优势菌群,所以在不外加乳酸菌的条件下不易于贮藏成功。经微贮或青贮后,乳酸菌数目大大增加,特别是乳杆菌属Lactobacillus,在微贮DCS+PM和青贮FCS中均为优势菌种。在原料DCS中占有绝对优势的细菌Streptophyta经过外加复合微生物微贮后,微贮DCS+PM样品中数目急剧下降至435,说明外加乳酸菌能够很好抑制Streptophyta的繁殖;青贮过程由于靠自身富集的微生物处理,青贮FCS中Streptophyta数目尚有1948个。其他细菌如芽孢杆菌属Bacillus,克雷伯菌属Klebsiella和魏斯氏菌属Weissella等在青贮或微贮过程中数目都有一定程度地增加,甲基杆菌属Methylobacterium,泛菌Pantoea,鞘脂单胞菌属Sphingomonas,鞘脂菌属Sphingobium,短小杆菌属Curtobacterium和根瘤菌Rhizobium都有一定程度低减少。
| 表 4 属水平上各样本主要序列数目 Table 4 Number of rank reads of each sample under genus level |
表 5为不同原料厌氧消化产沼气能力分析结果,其中TS产气率主要反映原料的产气潜力;VS产气率主要反映原料有机质的转化潜力。从结果可以看出,未经处理的原料DCS其TS产气率仅为296 mL·g-1,青贮FCS和混合微贮后各项产气指标均有大幅的提升,其中微贮DCS+PM处理的效果最好,TS产气率达到599 mL·g-1,平均容积产气率达到0.86 L·(L·d)-1。原料FCS由于其汁液营养丰富可溶性糖较多,主要成分未在风干过程中发生变化或损失,易于青贮,厌氧消化TS产气率和平均容积产气率分别达到425 mL·g-1,0.65 L·(L·d)-1,低于微贮原料,这是因为:虽然青贮秸秆的碳水化合物较微贮DCS+PM和微贮DCS+ES高,但是与总氮的比例不是很合理(碳氮比较高),所以厌氧消化产气率相对稍低。
| 表 5 不同原料厌氧消化产沼气能力分析 Table 5 Biogas production variation of four materials for anaerobic digestion |
将DCS、剩余污泥和畜禽粪便混合厌氧微贮进行沼气发酵可以突破欧盟国家用带穗玉米秸秆青贮作为主要原料的局限,大量使用干秸秆、脱穗秸秆和各种有机废弃物,适合中国国情,对彻底解决焚烧秸秆、剩余污泥填埋以及畜禽粪便面源污染问题,能起到重要作用。
4 结论1) 与新鲜秸秆相比,干秸秆由于其化学组成发生改变和自身富集乳酸菌数量不足不易于微贮成功,在添加复合乳酸菌(Lactobacillus casei,Lactobacillus fermentum和Enterococcus durans)有效抑制腐败菌条件下,DCS与PM和ES混合微贮易于成功。
2) 微贮和青贮成功的混合料中乳杆菌属Lactobacillus都成为优势菌群。pH值都降低至4.10以下,由于微生物的代谢活动产生了有机酸(主要是乳酸和乙酸),更有利于后续的沼气发酵。
3) 同DCS为单一底物的厌氧消化系统相比,混合厌氧发酵体系的产气效率显著提高。DCS+ES和DCS+PM混合厌氧消化TS产气率和平均容积产气率分别达到501 mL·g-1,0.56 L·(L·d)-1和599 mL·g-1,0.86 L·(L·d)-1。
4) 虽然青贮FCS厌氧消化产沼气效果较好,TS产气率和平均容积产气率分别达到425 mL·g-1,0.65 L·(L·d)-1,但由于一般工业化沼气生产不能及时收集新鲜秸秆只能使用风干秸秆,所以研究风干秸秆和其他废弃物混合微贮产沼气更具有实际意义及应用价值。
| [1] | Li Y B, Park S Y, Zhu J Y. Solid-state anaerobic digestion for methane production from organic waste[J]. Renewable and Sustainable Energy Reviews , 2011, 15(1): 821-826. DOI:10.1016/j.rser.2010.07.042. |
| [2] | Yang L, Ge X, Wan C, et al. Progress and perspectives in converting biogas to transportation fuels[J]. Renewable and Sustainable Energy Reviews , 2014, 40: 1133-1152. DOI:10.1016/j.rser.2014.08.008. |
| [3] | Nk oa, R . Agricultural benefits and environmental risks of soil fertilization with anaerobic digestates:a review[J]. Agronomy for Sustainable Development , 2014, 34(2): 473-492. DOI:10.1007/s13593-013-0196-z. |
| [4] | Deublein D, Steinhauser A. Biogas from waste and renewable resources:an introduction[M]. 2nd ed. Weinheim:WILEY-VCH Verlag GmbH & Co. KgaA, 2011, 85-95. |
| [5] | CHEN Yuan-yuan(陈渊源), XIE Li(谢丽), LIU Hui(刘辉), et al. Study on Anaerobic Fermentation of Cassava Stillage for VFAs Production under Room Temperature(木薯酒精废水常温厌氧发酵产酸特性研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2015, 29(5): 1279-1284. |
| [6] | SUN Chen(孙辰), LIU Rong-hou(刘荣厚). Study on rice straw pretreatment with NaOH and biogas production from anaerobic fermentation(稻秆NaOH预处理及厌氧发酵产沼气的试验研究)[J]. Journal of Agricultural Mechanization Research(农机化研究) , 2010, 32(4): 127-129. |
| [7] | CHEN Xiao-hua(陈小华), ZHU Hong-guang(朱洪光). Research progress and prospect on producing biogas from crop straws(农作物秸秆产沼气研究进展与展望)[J]. Transactions of the Chinese Society of Agricultural Engineering(农业工程学报) , 2007, 23(3): 279-283. |
| [8] | Luo Q M, Li X J, Zhu B N, et al. Anaerobic biogasification of NaOH-treated corn stalk[J]. Transactions of the Chinese Society of Agricultural Engineering , 2005, 21(2): 111-115. |
| [9] | Wu X, Yao W, Zhu J, et al. Biogas and CH4 productivity by co-digestion swine manure with three crop residues as an external carbon source[J]. Bioresource Technology , 2010, 101(11): 4042-4047. DOI:10.1016/j.biortech.2010.01.052. |
| [10] | Li R, Chen S, Li X, et al. Anaerobic codigestion of kitchen waste with cattle manure for biogas production[J]. Energy and Fuels , 2009, 23(4): 2225-2228. DOI:10.1021/ef8008772. |
| [11] | Palostathis S G, Gossett J M. A preliminary conversion mechanisms in anaerobic digestion of biological sludges[J]. Journal of Environmental Engineering , 1988, 114(3): 575-592. DOI:10.1061/(ASCE)0733-9372(1988)114:3(575). |
| [12] | Kim H W, Nam J Y, Shin H S. A comparison study on the high-rate co-digestion of sewage sludge and food waste using a temperature-phased anacrobic sequencing batch reactor system[J]. Bioresource Technology , 2011, 102(15): 7272-7279. DOI:10.1016/j.biortech.2011.04.088. |
| [13] | ZHANG Guang-yi(张光义), LI Wang-liang(李望良), ZHANG Ju-wei(张聚伟), et al. Progress in fundamental research on solid-state anaerobic fermentation technology for biogas production and its engineering application(固态厌氧发酵生产沼气技术基础研发与工程应用进展)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28(1): 1-14. DOI:10.3969/j.issn.1003-9015.2013.12.31.02. |
| [14] | Lopes W S, Leite V D, Prasad S. Influence of inoculum on performance of anaerobic reactors for treating municipal solid waste[J]. Bioresource Technology , 2004, 94(3): 261-266. DOI:10.1016/j.biortech.2004.01.006. |
| [15] | Sluiter A, Hames B, Ruiz R, et al. Determination of structural carbohydrates and lignin in biomass[R]. Colorado:National Renewable Energy Laboratory, 2011. |
| [16] | ZHOU Wei(周玮), DONG Bao-cheng(董保成), QI Yue(齐岳). The gas productions of different treated straw under mesophilic and anaerobic condition(不同处理秸秆中温厌氧发酵产气效果)[J]. China Biogas(中国沼气) , 2010, 28(3): 22-24. |
| [17] | Holzer M, Mayrhuber E, Danner H, et al. The role of Lactobacillus buchneri in forage preservation[J]. Trends in Biotechnology , 2003, 21(6): 282-287. DOI:10.1016/S0167-7799(03)00106-9. |
| [18] | WU Wen-tao(吴文韬), JU Mei-ting(鞠美庭), LIU Jin-peng(刘金鹏), et al. Effect of ensilage on bioconversion of switchgrass to ethanol based on liquid hot water pretreatment(青贮对柳枝稷制取燃料乙醇转化过程的影响)[J]. Chinese Journal of Biotechnology(生物工程学报) , 2016, 32(4): 457-467. |
| [19] | Wang Q, Kuninobu M, Ogawa H I, et al. Degradation of volatile fatty acids in highly efficient anaerobic digestion[J]. Biomass & Bioenergy , 1999, 16(6): 407-416. |
| [20] | Megias M D, Hernandez F, Cano J A, et al. Effects of different additives on the cell wall and mineral fractions of artichoke (Cynara scolymus L) and orange (Citrus aurantium L) by-product silage[J]. Journal of the Science of Food and Agriculture , 1998, 76(2): 173-178. DOI:10.1002/(ISSN)1097-0010. |
| [21] | Ambye-Jensen M, Thomsen S T, Kádár Z, et al. Ensiling of wheat straw decreases the required temperature in hydrothermal pretreatment[J]. Biotechnology for Biofuels , 2013, 6(1): 116-125. DOI:10.1186/1754-6834-6-116. |




