随着微制作技术的快速发展,基于微流控的器官芯片受到极大关注。肺芯片作为一种器官芯片,能够在体外精确模拟肺泡的三维微环境,可用于构建符合患者自身条件的疾病模型,从而实现个体化精准治疗[1-3]。
肺芯片的核心部件是由一层渗透膜和膜两侧肺上皮细胞、血管内皮细胞组成的气液屏障[4]。渗透膜需具备一定的弹性和可渗透性,常见的材料有聚二甲基硅氧烷(PDMS)、聚碳酸酯(PC)和聚乳酸-羟基乙酸共聚物(PLGA)等高分子材料。其中,PDMS制备的多孔柔性膜是最常见的渗透膜,其厚度约为10 µm,微孔直径为8~10 µm[5-8],许多研究者利用其构建了由气压驱动的可呼吸肺芯片,可模拟细菌入侵肺泡过程[9],已被用于肺癌转移[10]和肺血栓发生机理[11]等方面的研究。但是,PDMS渗透膜的杨氏模量远大于人体肺组织[12-13],且由于其疏水性强导致细胞相容性差;此外,该材料不透水,需在膜上制备工艺繁杂的微孔阵列,以便细胞养分运输和信号交流,因此PDMS并非良好的构建材料[14]。
与上述高分子材料不同,水凝胶具有软而湿、传递性能好的特点,更加贴合体内细胞生存环境[15-19]。研究表明,相对于表面硬度大的材料,在较软的水凝胶上,间充质干细胞展现出较多的丝状伪足,细胞骨架更为分散[20-21];而且细胞对药物及外界刺激的反应也受到基底硬度影响。例如,3D水凝胶细胞培养能更加真实地反映肺癌转移中的细胞侵袭过程,可用于抗癌药物的研发[22]。然而,目前为止,尚未见到采用水凝胶薄膜构建肺芯片的报道,这是因为大多数水凝胶的机械强度差[23-25],旋涂法[26]和相界面法[27]等制得的微米级水凝胶薄膜由于缺少硬质材料的支撑常难以铺展,不能承受拉力且易溶胀变形,从而限制了其应用。
为此,本研究利用由丙烯酸酯化聚醚F127(F127-DA)与甲基丙烯酰化明胶(Gel-MA)制备的共聚水凝胶单元溶液的表面张力,在开孔的聚对苯二甲酸乙二醇酯(PET)膜上共聚制备了不会溶胀的水凝胶薄膜。该水凝胶薄膜以PET硬质膜为支撑,依靠二苯甲酮(BP)的光活性实现水凝胶与PET之间的键合,从而得到满足肺芯片构建要求的水凝胶薄膜。
2 材料与方法 2.1 材料与试剂普朗尼克F127、四甲基偶氮唑蓝(MTT)和丙烯酰氯均购自美国Sigma公司;用于微生物学的明胶购自阿拉丁(上海)有限公司;甲基丙烯酸酐购自上海麦克林生化科技有限公司;光引发剂Irgacure 2959购自德国巴斯夫公司;达尔伯克氏(DMEM)高糖培养基、胎牛血清(FBS)和磷酸盐缓冲液(PBS) 均购自美国赛默飞公司;胰酶-乙二胺四乙酸(EDTA)购自上海生物工程有限公司;人脐静脉内皮细胞(HUVEC)和人肺泡上皮细胞(HPAEpiC) 均购自上海冠导生物工程有限公司;PET膜购自上海亿伟机电五金有限公司;其余药品和试剂均为国产分析纯。
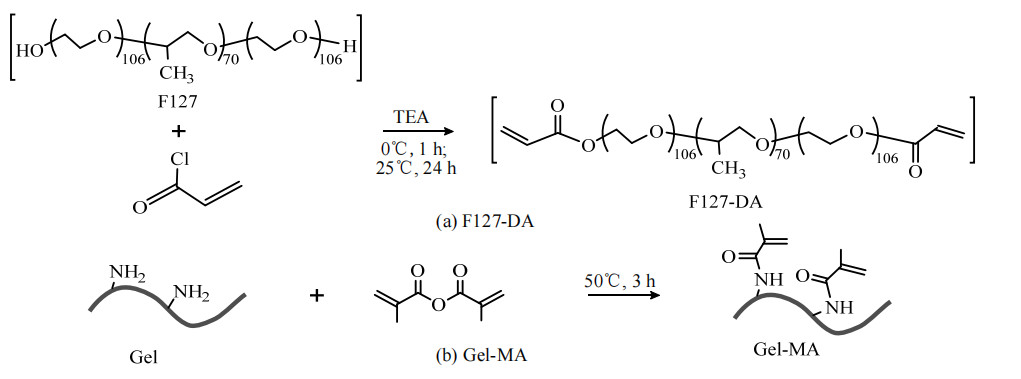
2.2 水凝胶单元及其溶液的制备F127-DA的制备:称取13 g普朗尼克F127溶于50 mL四氢呋喃,完全溶解后将体系置于0 ℃冰浴,向溶液中加入1 920 μL三乙胺(TEA),然后以1 mL·min−1的速率向体系滴加质量浓度为130 mg ·L−1的丙烯酰氯-四氢呋喃溶液15 mL,密封上述反应体系。冰浴条件下反应1 h后将反应体系升至室温,然后继续反应24 h。反应结束后高速离心去除三乙基氯化铵,上清液蒸干溶剂后用乙醚清洗残留的杂质,旋蒸去除乙醚可得到白色粉末状F127-DA[28],反应原理如图 1(a)所示。
|
图 1 F127-DA和Gel-MA合成路线图 Fig.1 Synthetic route of F127-DA and Gel-MA |
Gel-MA的制备:称取10 g明胶溶于100 mL水,于50 ℃下溶解充分后逐滴加入3 mL甲基丙烯酸酐,滴加速率为0.5 mL·min−1,在50 ℃、密封条件下反应3 h,反应结束后向体系加入5倍体积的水稀释以终止反应。将溶液装入截留分子质量8 000~14 000的透析袋中,40 ℃热水透析3 d后冻干,得到Gel-MA固体产物,反应原理如图 1(b)所示。
单元溶液的制备:称取3 g F127-DA固体溶于17 mL水,得到两者质量比为0.15的单元溶液;称取2 g Gel-MA固体溶于18 mL水,得到两者质量比为0.1的单元溶液。在上述2种单元溶液中各加入质量分数为0.4%的光引发剂Irgacure 2959。
2.3 水凝胶薄膜的制备水凝胶薄膜的制备:将开孔PET膜用含有BP质量分数为10%的丙酮溶液处理30 min,并用乙醇冲洗多余的BP溶液,烘干后浸入Gel-MA与F127-DA单元溶液体积比V(Gel-MA): V(F127-DA)=1:1的共聚水凝胶(Gel-MA/F127-DA(1/1))单元溶液中,利用溶液的表面张力在开孔处形成一层液膜,拭去多余溶液后紫外照射固化。
2.4 细胞培养将HUVEC和HPAEpiC于DMEM细胞培养液(含体积分数10%的FBS)中进行常规传代培养,培养箱温度为37 ℃,CO2体积分数为5%。选择处于对数生长期的细胞,取HUVEC和HPAEpiC的细胞液10 μL接种于水凝胶薄膜表面,细胞密度为3 000个·μL−1。置于12孔板内,缓慢添加培养基1.5 mL进行培养,每隔2 d更换培养基。
2.5 测试表征水凝胶薄膜厚度测量:水凝胶膜沿径向剪开后,贴在载玻片上。使用IX71型倒置显微镜(奥林巴斯株式会社)观察其厚度的径向分布,直径十等分固定取11个点,并利用标尺测量其厚度。
细胞活率测定:HUVEC和HPAEpiC培养至第5天后通过MTT法测定细胞活率。具体做法是:加入0.3 mg·mL−1的MTT溶液,经37 ℃温育4 h后,吸去溶液,并向其中加入HCl酸化的异丙醇,室温震荡1 h,最后,通过酶标仪将所得溶液于570 nm下测定吸光度。其中,对照组为培养皿上培养的细胞。
傅里叶变换红外光谱(FT-IR)表征:将水凝胶样品真空干燥后研碎,与KBr粉末混合压片。用IS5型傅里叶变换红外光谱仪(赛默飞世尔科技有限公司)试验,扫描波数范围为500~4 000 cm−1。
扫描电子显微镜(SEM)表征:水凝胶样品置于1~4 LD Plus型冷冻干燥机(德国Christ公司)冷冻干燥48 h,对样品表面喷金处理,使用SU-8010场发射扫描电子显微镜(日本日立公司)对水凝胶进行表面分析。
机械强度表征:拉伸试验前记录水凝胶片的截面积,并测量夹具间样品原始长度。用Zwick/Roell Z020型万能力学试验机(德国Zwick公司)测定应力~应变曲线,以断裂强度对应的应变计算杨氏模量。测定条件:温度为25 ℃、湿度为50%、拉伸速率为4 mm·min−1。
水凝胶氧气扩散系数的测定:3D打印树脂扩散池的传质面积为0.785 cm2,液池体积为3.3 mL。水凝胶膜厚度为2mm,夹在气室和液室之间。插入DO-957型溶解氧电极(上海雷磁仪器公司)后将扩散池置于密闭的环境中,通过N2吹扫获得无氧环境,避免测量误差;气室通空气,液室为经N2吹扫后不含氧气的水。测定条件为25 ℃、湿度100%。根据菲克定律计算氧气扩散系数,如式(1)所示。
| $ \frac{{{\rm{d}}m}}{{{\rm{d}}t}} = V{{ \times }}\frac{{{\rm{d}}\rho }}{{{\rm{d}}t}} = {K_{{{\rm{O}}_2}}}{{ \times }}\frac{S}{l}{{ \times }}\left( {\rho ' - \rho } \right) $ | (1) |
式中:m为氧气质量,g;t为时间,min;V为液池体积,mL;ρ为液池内氧气质量浓度,g·mL−1;ρ ′−ρ为空气和液池中的氧气质量浓度差,g·mL−1;KO2为氧气扩散系数,cm2·min−1;S为传质面积,cm2;l为水凝胶厚度,cm。
2.6 统计学分析细胞覆盖率统计:采用5点取样法,利用网格目镜统计细胞覆盖面积与视野比值,作为细胞覆盖率。所有实验重复3次,每次实验设置3个平行样。显示结果为平均值,当出现偏离原假设值的概率(P值)小于0.05时,说明对比组之间的差异具有统计学意义。
3 结果与讨论 3.1 水凝胶薄膜的制备图 2(a)为边长1 cm的正方形PET膜,利用打孔器在其中心开孔,孔的直径分别为2、3和4 mm。图 2(b)是以经BP处理的PET膜(开孔直径为4 mm、厚度为25 μm)为支架、加载水凝胶单元溶液后再紫外照射制得的水凝胶薄膜。当BP被紫外照射后,通过系间窜越迅速由单线态转变为三线态[29]。此时,BP能够夺取PET的氢原子产生表面自由基[30],引发水凝胶和PET之间的键合。

|
图 2 系列孔径的PET膜与水凝胶薄膜 Fig.2 PET films with different apertures and the hydrogel film |
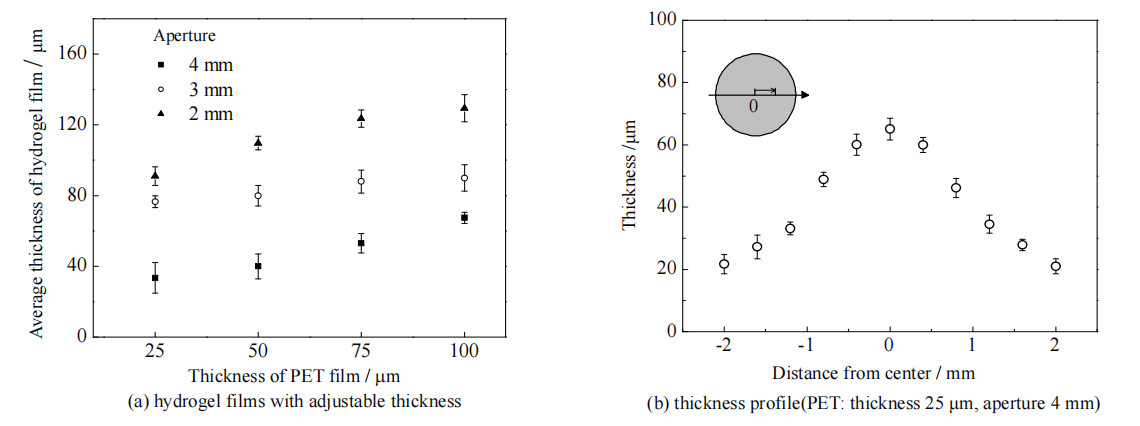
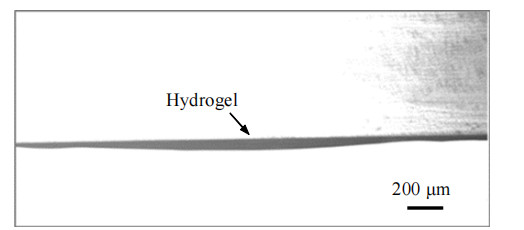
水凝胶薄膜厚度与PET膜厚度呈正相关,与开孔直径呈负相关,结果如图 3(a)所示。使用开孔直径为4 mm、厚度为25 μm的PET膜可制得平均厚度为35 μm的水凝胶薄膜。图 3(b)为以水凝胶薄膜直径为主轴、圆心为原点得到的水凝胶薄膜厚度径向分布。受重力影响,薄膜具有中间厚、边缘薄的特征,且边缘厚度接近PET膜厚。图 4为水凝胶薄膜径向剖面的显微镜照片。
|
图 3 厚度可调的水凝胶膜的制备及水凝胶膜厚度的径向分布 Fig.3 Preparation of hydrogel film with adjustable thickness and thickness profile of the hydrogel film |
|
图 4 水凝胶膜径向厚度的显微镜照片 Fig.4 Microscopic photographs of radial thickness of hydrogel film(PET: thickness 25 μm, aperture 4 mm) |
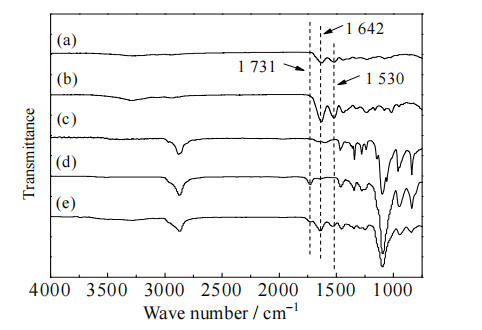
图 5为F127-DA水凝胶、Gel-MA/F127-DA(1/1)及其原料的FI-TR谱图。由图可见,F127-DA水凝胶在1 731 cm−1处出现特征吸收峰,表明F127端羟基与丙烯酰氯反应生成了酯羰基。1 642 cm−1为酰胺Ⅰ带的吸收峰,主要由C═O伸缩振动引起;1 530 cm−1附近为酰胺Ⅱ带的吸收峰,由C─N伸缩振动和N─H弯曲振动耦合引起。Gel-MA的酰胺特征峰明显强于纯明胶Gel的相应峰,表明甲基丙烯基团被接枝到了明胶分子链。
|
图 5 水凝胶及其原料的FT-IR图 Fig.5 FT-IR spectra of hydrogels and their starting materials (a) Gel (b) Gel-MA (c) F127 (d) F127-DA (e) Gel-MA/F127-DA(1/1) |
不同体积比(V(Gel-MA)/V(F127-DA)为1/3、1/2、1/1、2/1)的Gel-MA/F127-DA共聚水凝胶的SEM形貌如图 6所示。由图可见,Gel-MA/F127-DA共聚水凝胶表面呈三维多孔网状结构,孔道分布较为均匀。由于Gel-MA分子质量较低,Gel-MA添加比例增大会导致孔道变小。当Gel-MA与F127-DA的单元溶液体积比为2:1时,多孔结构几乎不存在,呈现出凹凸不平的表面。

|
图 6 不同体积比的Gel-MA/F127-DA共聚水凝胶的SEM图 Fig.6 SEM micrographs of Gel-MA/ F127-DA copolymer hydrogels with different volume ratios |
力学性能是影响水凝胶在生物医学领域应用的关键因素。图 7为不同体积比的Gel-MA/F127-DA共聚水凝胶的应力~应变曲线,表 1是共聚水凝胶的力学性能。结果表明,随Gel-MA添加比例增大,水凝胶的杨氏模量、断裂延伸率和抗张强度逐渐降低。由表 1可见,Gel-MA与F127-DA单元溶液体积比V(Gel-MA): V(F127-DA)从0 (纯F127-DA)变为2:1时,水凝胶的杨氏模量和抗张强度由23.68和26.86 kPa降至9.87和3.08 kPa,相应的断裂延伸率从119.84%降至31.18%。影响水凝胶力学强度的因素主要有3个方面:水凝胶结构、介质组成和含水量[31]。F127-DA只有端基存在丙烯基团,聚合过程中会形成长的大分子链,具有较高的韧性。而未加修饰的明胶基水凝胶力学强度低,具有软而脆的特点[32]。因此,Gel-MA/F127-DA共聚水凝胶的强度与Gel-MA添加比例呈负相关。
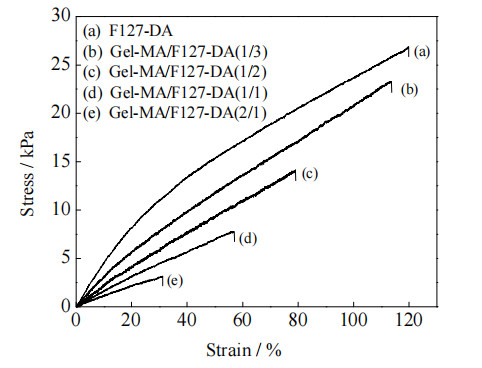
|
图 7 不同体积比的Gel-MA /F127-DA共聚水凝胶的应力~应变曲线 Fig.7 Stress-strain curves of Gel-MA/F127-DA copolymer hydrogels with different volume ratios |
|
|
表 1 不同体积比的Gel-MA /F127-DA共聚水凝胶的力学性能 Table 1 Mechanical properties of Gel-MA/F127-DA copolymer hydrogels with different volume ratios |
人肺的弹性模量随着肺部扩张程度的变化而不断改变。在正常呼吸过程中,肺的杨氏模量为12~20 kPa[33-34]。V(Gel-MA): V(F127-DA)为1:3、1:2和1:1的共聚水凝胶的杨氏模量均与其接近。而V(Gel-MA): V(F127-DA)=2:1的水凝胶杨氏模量只有9.87 kPa,强度较弱。此外,PDMS预聚体与固化剂的浓度比在10:1时,其杨氏模量约为700kPa,其硬度远超肺组织的杨氏模量[13],因此不适宜用作微流控肺芯片的构建材料。
3.4 水凝胶薄膜的细胞相容性细胞必须先在材料表面贴附,才能迁移、增殖和分化。细胞在PDMS膜表面基本不贴附,通常需要表面功能化来增强细胞相容性[35]。而水凝胶一般具有良好的细胞相容性[36],因此,本研究对Gel-MA/F127-DA共聚水凝胶的细胞相容性进行了考察。图 8是HUVEC在不同配比水凝胶薄膜表面培养3 d后在倒置显微镜下观察到的贴壁状况。由图可见,HUVEC在F127-DA水凝胶表面几乎不贴壁生长,这是因为F127的聚环氧乙烷链段具有抗细胞黏附特性[37];Gel-MA/F127-DA(1/1)的表面细胞生长状况最佳,贴壁后的细胞呈梭形。为了量化细胞在水凝胶薄膜表面的贴壁程度,对HUVEC和HPAEpiC的生长覆盖率进行了统计,结果见图 9(a)、(b)。由图可见,Gel-MA/F127-DA(1/1)共聚水凝胶的细胞覆盖率最高,且HUVEC的生长速度快于HPAEpiC。图 9(c)为HUVEC和HPAEpiC相对于培养皿上培养的细胞的活率。由图可见,细胞活率即细胞相容性,与Gel-MA添加比例呈正相关,Gel-MA/F127-DA(1/1)共聚水凝胶的细胞生长状况与细胞培养皿(对照组)接近。这是由于Gel-MA结构上具有细胞黏附位点及基质金属蛋白酶水解位点,促进细胞的生长[38],使F127-DA的抗黏附性影响降低。

|
图 8 不同体积比的Gel-MA/ F127-DA共聚水凝胶的HUVEC贴壁情况 Fig.8 Adhesion of HUVEC on Gel-MA/ F127-DA copolymer hydrogels with different volume ratios |
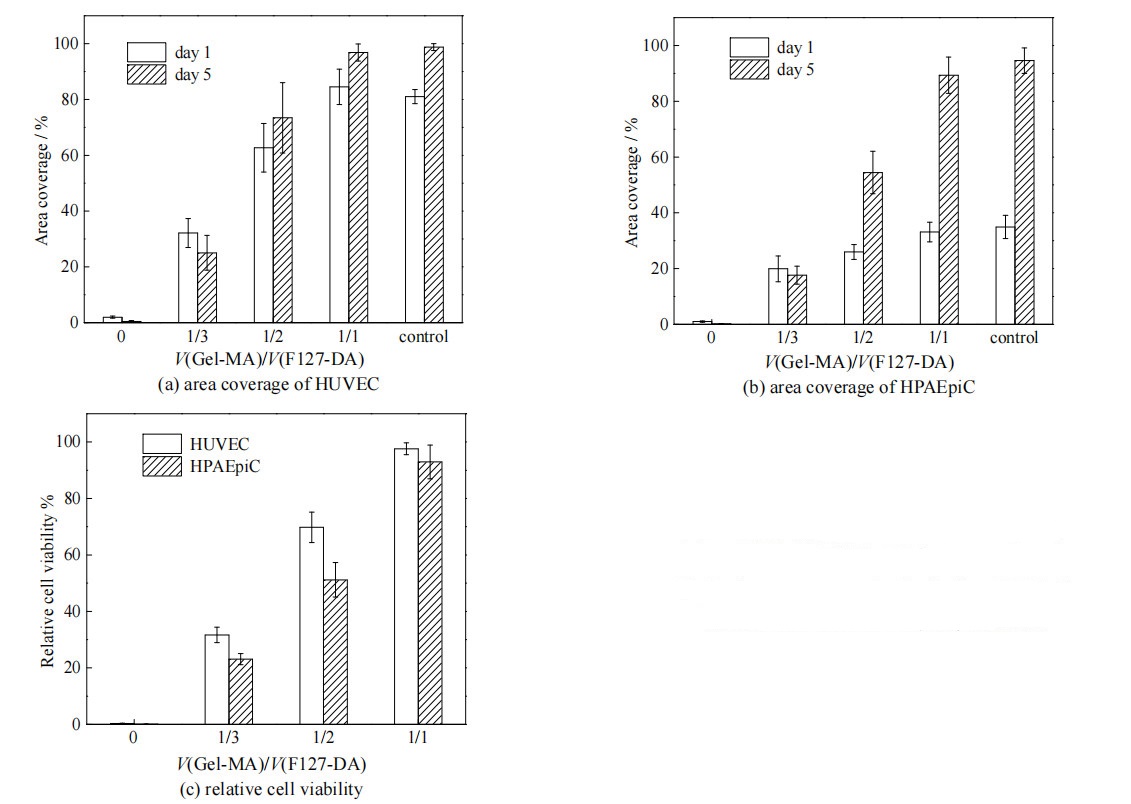
|
图 9 不同水凝胶表面HUVEC和HPAEpiC的覆盖率及活率# Fig.9 Area coverage and cell viability of HUVEC and HPAEpiC on different hydrogel surfaces |
在微流控肺芯片构建过程中,氧气传递性能关系到血管内皮细胞是否能正常呼吸[39]。利用扩散池和溶解氧电极,测得纯F127-DA和Gel-MA/F127-DA (1/1)的KO2如表 2所示。其中,Gel-MA/F127-DA(1/1) 共聚水凝胶的KO2为1.40×10−3 cm2·min−1,与纯F127-DA水凝胶的KO2相比较大,其原因在于Gel-MA的加入使F127-DA水凝胶呈现多孔结构(见图 6),从而使KO2变大。
|
|
表 2 水凝胶和肺的氧气扩散性能 Table 2 Oxygen diffusion properties of hydrogels and lung |
肺泡的KO2通常采用CO弥散来表征,文献报道的肺弥散系数Kco约为6.76 mL·(min·mmHg·L)−1,其含义为:单位肺容量下,单位时间、单位气体分压下通过弥散膜的气体体积[40-41]。基于单个肺泡是直径为0.2 mm的球的假设、且血液溶解氧过程符合亨利定律,可计算得到肺泡的KO2约为0.56×10−3 cm2·min−1。可见,F127-DA和Gel-MA/F127-DA (1/1)共聚水凝胶的KO2与肺泡的接近,说明此类水凝胶是良好的肺基质替代材料。
4 结论以开孔的PET膜为支撑,制备Gel-MA/F127-DA共聚水凝胶薄膜,其平均厚度可达35 μm,并具有多孔结构。该水凝胶薄膜具有良好的力学性能,其杨氏模量为13.55 kPa,抗张强度为7.73 kPa,断裂延伸率为57.05%;其对HUVEC和HPAEpiC细胞具有良好的相容性,且氧气传递性能良好,KO2为1.40×10−3 cm2·min−1。该水凝胶薄膜的各项性能均较为接近肺泡,为微流控肺芯片的仿生化构建提供了新的解决方案。
| [1] |
TENENBAUM-KATAN J, ARTZY-SCHNIRMAN A, FISHLER R, et al. Biomimetics of the pulmonary environment in vitro: A microfluidics perspective[J]. Biomicrofluidics, 2018, 12(4): 1-18. |
| [2] |
EVANS K V, LEE J H. Alveolar wars: The rise of in vitro models to understand human lung alveolar maintenance, regeneration, and disease[J]. Stem Cells Translational Medicine, 2020, 9(8): 867-881. DOI:10.1002/sctm.19-0433 |
| [3] |
LI K Y, YANG X Y, XUE C, et al. Biomimetic human lung-on-a-chip for modeling disease investigation[J]. Biomicrofluidics, 2019, 13(3): 1-8. |
| [4] |
ARTZY-SCHNIRMAN A, HOBI N, SCHNEIDER-DAUM N, et al. Advanced in vitro lung-on-chip platforms for inhalation assays: From prospect to pipeline[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2019, 144: 11-17. DOI:10.1016/j.ejpb.2019.09.006 |
| [5] |
WILLIAMSON A, SINGH S, FERNEKORN U, et al. The future of the patient-specific body-on-a-chip[J]. Lab On A Chip, 2013, 13(18): 3471-3480. DOI:10.1039/c3lc50237f |
| [6] |
STUCKI A O, STUCKI J D, HALL S R R, et al. A lung-on-a-chip array with an integrated bio-inspired respiration mechanism[J]. Lab On A Chip, 2015, 15(5): 1302-1310. DOI:10.1039/C4LC01252F |
| [7] |
BAPTOSTA D, Teixeira L M, BIRGANI Z T, et al. 3D alveolar in vitro model based on epithelialized biomimetically curved culture membranes[J]. Biomaterials, 2021, 266: 120436. DOI:10.1016/j.biomaterials.2020.120436 |
| [8] |
MILLER P G, CHEN C Y, WANG Y I, et al. Multiorgan microfluidic platform with breathable lung chamber for inhalation or intravenous drug screening and development[J]. Biotechnology and Bioengineering, 2020, 117(2): 1-12. |
| [9] |
HUH D, MATTHEWS B D, MAMMOTO A, et al. Reconstituting organ-level lung functions on a chip[J]. Science, 2010, 328(5986): 1662-1668. DOI:10.1126/science.1188302 |
| [10] |
HASSELL B A, GOYAL G, LEE E, et al. Human organ chip models recapitulate orthotopic lung cancer growth, therapeutic responses and tumor dormancy in vitro[J]. Cell Reports, 2017, 21(2): 508-516. DOI:10.1016/j.celrep.2017.09.043 |
| [11] |
JAIN A, BARRILE R, VANDER-MEER A D, et al. Primary human lung alveolus-on-a-chip model of intravascular thrombosis for assessment of therapeutics[J]. Clinical Pharmacology & Therapeutics, 2018, 103(2): 332-340. |
| [12] |
BURROWES K S, IRAVANI A, KANG W, et al. Integrated lung tissue mechanics one piece at a time: Computational modeling across the scales of biology[J]. Clinical Biomechanics, 2019, 66: 20-31. DOI:10.1016/j.clinbiomech.2018.01.002 |
| [13] |
汪鹏, 陈翔, 肖丽军, 等. 基于PDMS纳米粒子改性的热模压技术[J]. 功能材料与器件学报, 2009, 15(5): 441-446. WANG P, CHEN X, XIAO L J, et al. Mechanical modification of PDMS by blending with nano particles as hot embossing mold[J]. Journal of Functional Materials and Devices, 2009, 15(5): 441-446. DOI:10.3969/j.issn.1007-4252.2009.05.005 |
| [14] |
SHAHMORADI S, YAZDIAN F, TABANDEH F, et al. Controlled surface morphology and hydrophilicity of polycaprolactone toward human retinal pigment epithelium cells[J]. Materials Science and Engineering: C, 2017, 73: 300-309. DOI:10.1016/j.msec.2016.11.076 |
| [15] |
SUN H, ZHANG M, LIU M L, et al. Fabrication of double-network hydrogels with universal adhesion and superior extensibility and cytocompatibility by one-pot method[J]. Biomacromolecules, 2020, 22(6): 2777-2778. |
| [16] |
AHMED E M. Hydrogel: Preparation, characterization and applications: A review[J]. Journal of Advanced Research, 2015, 6(2): 105-121. DOI:10.1016/j.jare.2013.07.006 |
| [17] |
GRIGORYAN B, PAULSEN S J, CORBETT D C, et al. Multivascular networks and functional intravascular topologies within biocompatible hydrogels[J]. Science, 2019, 364(6439): 458-464. DOI:10.1126/science.aav9750 |
| [18] |
JAYAKUMAR A, JOSE V K, LEE J M. Hydrogels for medical and environmental applications[J]. Small Methods, 2020, 4(3): 1-19. |
| [19] |
LI Y F, KUMACHEVA E. Hydrogel microenvironments for cancer spheroid growth and drug screening[J]. Science Advances, 2018, 4(4): 1-10. |
| [20] |
PELHAM R J, WANG Y L. Cell locomotion and focal adhesions are regulated by substrate flexibility[J]. Proceedings of the National Academy of Sciences, 1997, 94(25): 13661-13665. DOI:10.1073/pnas.94.25.13661 |
| [21] |
NICOLAS A, SAFRAN S A. Limitation of cell adhesion by the elasticity of the extracellular matrix[J]. Biophysical Journal, 2006, 91(1): 61-73. DOI:10.1529/biophysj.105.077115 |
| [22] |
TAM R Y, YOCKELL-LELIEVRE J, MITH L J, et al. Rationally designed 3D hydrogels model invasive lung diseases enabling high-content drug screening[J]. Advanced Materials, 2019, 31(7): 1-9. |
| [23] |
HAQUE M A, KUROKAWA T, GONG P J. Super tough double network hydrogels and their application as biomaterials[J]. Polymer, 2012, 53(9): 1805-1822. DOI:10.1016/j.polymer.2012.03.013 |
| [24] |
ADAMS M A, KERIN A J, WISNOM M R. Sustained loading increases the compressive strength of articular cartilage[J]. Connective Tissue Research, 1998, 39(4): 245-256. DOI:10.3109/03008209809021500 |
| [25] |
ZHAO Y, NAKAJIMA T, DANIEL S, et al. Proteoglycans and glycosaminoglycans improve toughness of biocompatible double network hydrogels[J]. Advanced Materials, 2014, 26(3): 436-442. DOI:10.1002/adma.201303387 |
| [26] |
ZHENG S Y, TIAN Y, ZHANG X N, et al. Spin-coating-assisted fabrication of ultrathin physical hydrogel films with high toughness and fast response[J]. Soft Matter, 2018, 14(28): 5888-5897. DOI:10.1039/C8SM01126E |
| [27] |
SADEGHI I, YI H, ASATEKIN A. A method for manufacturing membranes with ultrathin hydrogel selective layers for protein purification: Interfacially initiated free radical polymerization (IIFRP)[J]. Chemistry of Materials, 2018, 30(4): 1265-1276. DOI:10.1021/acs.chemmater.7b04598 |
| [28] |
LI Y J, WANG Y, SHEN C, et al. Non-swellable F127-DA hydrogel with concave microwells for formation of uniform-sized vascular spheroids[J]. RSC Advances, 2020, 10(7): 44494-44502. |
| [29] |
ALLMEAR K, HULT A, RARNBY B. Surface modification of polymers. I. Vapour phase photografting with acrylic acid[J]. Polymer Chemistry, 1988, 26(8): 2099-2111. DOI:10.1002/pola.1988.080260809 |
| [30] |
杨彪, 杨万泰. 光接枝制备功能性核孔膜[J]. 膜科学与技术, 2003, 23(4): 38-44. YANG B, YANG W T. Preparation of functional track membranes by photografting polymerization[J]. Membrane Science and Technology, 2003, 23(4): 38-44. DOI:10.3969/j.issn.1007-8924.2003.04.009 |
| [31] |
李钒, 张金龙, 尹玉姬. 生物医用高强度水凝胶的研究进展[J]. 化工进展, 2012, 31(11): 2511-2534. LI F, ZHANG J L, YIN Y J. Research progress of high mechanical strength hydrogels for biomedical application[J]. Chemical Industry and Engineering Progress, 2012, 31(11): 2511-2534. DOI:10.16085/j.issn.1000-6613.2012.11.008 |
| [32] |
HE Q Y, HUANG Y, WANG S Y. Hofmeister effect-assisted one step fabrication of ductile and strong gelatin hydrogels[J]. Advanced Functional Materials, 2018, 28(5): 1-10. |
| [33] |
曾衍钧, YAGER D. 从本构方程确定人肺增量弹性模量[J]. 应用力学学报, 1988, 5(3): 85-89. ZENG Y J, YAGER D. Determining the incremental modulus of human lung from the constitutive equation[J]. Journal of Applied Mechanics, 1988, 5(3): 85-89. |
| [34] |
LUQUE T, MELO E, GARRETA E, et al. Local micromechanical properties of decellularized lung scaffolds measured with atomic force microscopy[J]. Acta Biomaterialia, 2013, 9(6): 6852-6859. DOI:10.1016/j.actbio.2013.02.044 |
| [35] |
KIDAMBI S, UDPA N, SCHROEDER S A, et al. Cell adhesion on polyelectrolyte multilayer coated polydimethylsiloxane surfaces with varying topographies[J]. Tissue Engineering, 2007, 13(8): 2105-2117. DOI:10.1089/ten.2006.0151 |
| [36] |
ZHANG Y S, KHADEMHOSSEINI A. Advances in engineering hydrogels[J]. Science, 2017, 356(6337): 1-10. |
| [37] |
MENG Q, PENG B, SHEN C. Synthesis of F127/PAA hydrogels for removal of heavy metal ions from organic wastewater[J]. Colloids and Surfaces B, Biointerfaces, 2018, 167: 176-182. DOI:10.1016/j.colsurfb.2018.04.024 |
| [38] |
ZU G Y, MEIJER M, MERGEL O, et al. 3D-printable hierarchical nanogel-GelMA composite hydrogel system[J]. Polymers, 2021, 13(15): 1-14. |
| [39] |
WILSON R L, CONNELL J P, GRANDE-ALLEN K J. Monitoring oxygen levels within large, tissue-engineered constructs using porphyin-hydrogel microparticles[J]. ACS Biomaterials Science and Engineering, 2019, 5(9): 4522-4530. |
| [40] |
卫世强, 鲁力立, 宿双宁, 等. 21天头低位卧床对肺弥散功能的影响[J]. 中国航空航天医学杂志, 2003, 3(14): 14-17. WEI S Q, LU L L, SU S N, et al. Effects of 21d head down bed-rest on pulmonary diffusion capacity[J]. Chinese Journal of Aerospace Medicine, 2003, 3(14): 14-17. |
| [41] |
STEIMLE K L, MOGENSEN M L, KARBING D S, et al. A model of ventilation of the healthy human lung[J]. Computer Methods and Programs in Biomedicine, 2011, 101(2): 144-155. |




