2. 中国科学院地理科学与资源研究所 环境修复中心,北京 100101;
3. 浙江大学 宁波理工学院 生物与化学工程学院,浙江 宁波 315100
2. Center for Environmental Remediation, Institute of Geographic Sciences and Natural Resources Research, Chinese Academy of Sciences, Beijing 100101, China;
3. School of Biological and Chemical Engineering, Ningbo Institute of Technology, Zhejiang University, Ningbo 315100, China
染料废水源于染料的生产和印染工业,这类废水成分复杂,主要以芳烃和杂环化合物为母体,并带有大量的显色基团和极性基团[1]。由于染料废水具有排放量大、高化学需氧量、高色度以及“三致”毒性等特点,已经成为威胁我国水体安全的重要因素之一[2]。目前染料废水的处理方法层出不穷,但在众多的处理方法中,吸附法以其简单、安全、低能耗等特点成为最实用的处理方法。工业上使用较多的吸附剂为活性炭,但这类吸附剂存在吸附量少、重复使用率低等缺点,限制了它的应用范围。
壳聚糖 (chitosan,CS) 是甲壳素脱乙酰化后的产物,也称几丁聚糖、脱乙酰甲壳素等,学名为β-1, 4-聚-D-氨基葡萄糖,分子式为 (C6H11NO4)n[3]。作为一种天然的碱性多糖,壳聚糖的分子链上含有大量自由的氨基和羟基,能与许多类型的染料分子保持很高的亲和性,它们之间主要通过氢键、范德华力、静电引力等相互吸附。但在实际应用中,壳聚糖作为染料吸附剂存在多种缺陷[4],导致其很难被直接用于废水中染料污染物的去除,因此需要对壳聚糖进行物理或者化学改性,以克服其不足之处[5~10]。交联改性是一种常用的壳聚糖改性方法[11~14],它可以提高壳聚糖的机械强度、酸溶性以及对染料的吸附能力。本研究采用乳液交联法制备出改性壳聚糖微球,并利用傅里叶变换红外光谱仪 (FT-IR)、场发射扫描电子显微镜 (SEM)、X射线衍射仪 (XRD)、热重分析仪 (TGA) 等手段对其进行了表征。利用静态吸附法研究了该种改性壳聚糖微球对刚果红和酸性绿50两种阴离子染料的吸附行为。
2 实验部分 2.1 试剂及仪器壳聚糖 (实验室自制,脱乙酰度>90%,粘均分子量约为6.52×105 Da)、二乙烯三胺、环氧氯丙烷、液体石蜡、Span 80、乙酸、聚乙二醇,分析纯,购自上海阿拉丁生化科技股份有限公司;刚果红、酸性绿50,分析纯,购自上海生工生物工程股份有限公司;其他试剂均为市售,分析纯。
傅里叶变换红外光谱仪 (德国Bruker Optik GmbH公司,Vertex 70),场发射扫描电子显微镜 (日本Hitachi公司,S-4700),X射线衍射仪 (荷兰PNAlytical公司,X'Pert PRO),同步热分析仪 (德国Netzsch公司,STA449 F3 DSC/DTA-TG),全自动比表面积和孔径分布分析仪 (美国康塔Quantachrome公司,Autosorb-iQ),酶标仪 (美国Molecular Devices公司,SpectraMax 190),pH计 (德国Sartorius公司,PB-10)、台式冷冻高速离心机 (美国Beckman公司,Allegra 64R),真空冷冻干燥机 (美国Labconco公司,FreeZone 2.5)。
2.2 壳聚糖的制备取一定量经粉碎、过40目筛子后的鱿鱼软骨粉末,加入料液比为1:15 (W:V) 的8%(wt) 的HCl溶液,在25 kHz超声波辅助下,60℃水浴脱钙2 h,反应结束后用去离子水洗涤至中性,于60℃下真空干燥12 h。取烘干、粉碎后的产物,加入料液比为1:10 (W:V) 的10%(wt) NaOH溶液,在80℃水浴超声脱蛋白4 h,再用去离子水洗涤至中性,于60℃下真空干燥12 h,经粉碎后得到β-甲壳素粉末。取烘干、粉碎后的β-甲壳素粉末,加入料液比为1:15 (W:V) 50%(wt) 的NaOH溶液,80℃水浴超声脱乙酰12 h,反应结束后用去离子水洗涤至中性,于60℃下真空干燥24 h,粉碎后得到壳聚糖粉末。
2.3 改性壳聚糖微球的制备将一定量的壳聚糖粉末溶解在2% (V) 乙酸溶液中,配置成3% (wt) 壳聚糖乙酸溶液。将30 mL的液体石蜡和1 mL的Span80搅拌均匀形成油相,在转速为800 r⋅min-1高速搅拌下,用注射器将10 mL的3% (wt) 壳聚糖乙酸溶液逐滴加入油相中充分混合0.5 h形成乳液。随后加入0.5 mL的苯甲醛溶液继续搅拌1 h,向其中加入50 mg聚乙二醇4000搅拌0.5 h,接着用1 mol⋅L-1 NaOH溶液将乳液体系pH值调至10,并升温至50℃。随后向体系中逐滴加入0.37 mL的环氧氯丙烷溶液,反应3 h后逐滴加入1 mL的二乙烯三胺溶液继续反应4 h。乳液交联结束后依次用乙醇、丙酮、乙醚、去离子水进行洗涤,最后在2% (V) 盐酸溶液中震荡过夜,以95%乙醇为溶剂利用索氏提取器抽提12 h得到淡黄色固体,将产物用2% (wt) 氢氧化钠溶液浸泡12 h,用去离子水洗涤后经真空冷冻干燥得到交联壳聚糖微球 (DECM)。
2.4 改性壳聚糖微球的表征将DECM粉末均匀铺设在载样台上,经过喷金以及多次抽真空后采用S-4700型场发射电子显微镜进行扫描和相片采集。
准确称取一定量的壳聚糖粉末和DECM粉末置于玻璃样管中40 ℃真空脱气3 h后用Autosorb-iQ型自动比表面积和孔径分布分析仪进行测定。
分别将CS、DECM、CR、AG50、CDECM (DECM吸附刚果红后) 和ADECM (DECM吸附酸性绿50后) 研碎成粉末,采用KBr压片法用Vertex 70型傅里叶变换红外光谱仪进行分析。
分别将干燥的壳聚糖粉末和DECM粉末均匀铺设在载样台上用X' Pert PRO型X射线衍射仪进行测试,管电压30 kV,管电流20 mA,扫描速度为6°⋅min-1,Cu靶Kα (γ= 1.5418),扫描范围5~45°。
准确称取一定量的壳聚糖粉末和DECM粉末置于小坩埚中用STA449 F3 DSC/DTA-TG型同步热分析仪进行测定,升温速率为10 K⋅min-1,温度范围50~800℃。
2.5 改性壳聚糖微球的吸附行为 2.5.1 pH值对DECM吸附阴离子染料的影响取一系列4 mL浓度均为100 mg⋅L-1的CR和AG50染料溶液,用稀HCl和NaOH溶液调节pH值2.0~10.0,分别加入2 mg的DECM,于恒温振荡器中,以温度为25℃、转速为150 r⋅min-1震荡6 h,达到吸附平衡后离心分离,取上清液用酶标仪测定其吸光值,按下式计算平衡吸附容量:
| ${{Q}_{e}}=\frac{\left( {{C}_{0}}-{{C}_{e}} \right)V}{m}$ | (1) |
式中:C0和Ce分别表示初始浓度和平衡浓度,mg⋅L-1;V表示溶液的体积,L;m表示DECM的用量,g;Qe表示平衡吸附容量,mg⋅g-1。
2.5.2 吸附动力学取4 mL浓度分别为50、100和150 mg⋅L-1的CR和AG50染料溶液,调整pH值为3.0,加入2 mg的DECM,在恒温振荡器中以温度为25℃、转速为150 r⋅min-1振荡,定时取样测定其吸光值,计算平衡吸附容量Qe。
2.5.3 吸附等温线取4 mL一系列浓度梯度的CR和AG50染料溶液,调整pH值为3,加入2 mg的DECM,在恒温振荡器中以温度为25℃、转速为150 r⋅min-1振荡,达到吸附平衡后离心分离,取上清液用酶标仪测定其吸光值,计算平衡吸附容量Qe。
2.5.4 脱附再生取4 mL浓度均为100 mg⋅L-1的CR和AG50染料溶液,调整pH值为3,加入2 mg的DECM,以温度为25℃、转速为150 r⋅min-1,振荡达到吸附平衡后离心分离,取上清液用酶标仪测定其吸光值,计算平衡吸附容量Qe。再用0.1 mol⋅L-1的NaOH溶液常温振荡解吸1 h,去离子水洗涤至中性,得到再生的DECM。用再生的DECM重复吸附-解吸循环5次,考察吸附剂的重复利用情况。
3 结果与讨论 3.1 改性壳聚糖微球的表征 3.1.1 SEM分析用S-4700型场发射扫描电子显微镜观察微球的表观形貌结果如图 1所示。乳液交联得到的改性壳聚糖微球成球性状良好,利用全自动比表面积和孔径分布分析仪测定出微球的比表面积为10.47 m2⋅g-1,较大的比表面积能为染料的吸附提供更多的活性位点,有利于吸附。

|
图 1 DECM的SEM图 Fig.1 SEM micrographs of DECM |
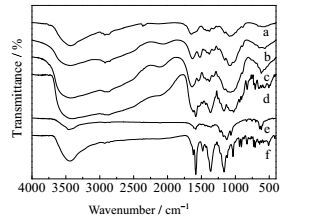
利用傅里叶变换红外光谱仪可以测量分子的振动和转动光谱进而研究分子的结构和性能。图 2分别为CS (a)、DECM (b)、CDECM (c)、ADECM (d)、CR (e) 和AG50(f) 的红外光谱图,CS的主要吸收峰为3429.74 cm-1 (O-H伸缩),2924.14 cm-1、2877.45 cm-1 (C-H伸缩),1651.15 cm-1 (酰胺I C=O伸缩),1157.43 cm-1 (C-O-C对称伸缩) 和1086.09 cm-1 (C-O伸缩)。乳液交联后DECM在1525.34 cm-1出现明显的吸收峰,该峰为N-H伸缩振动吸收峰,此外在1460.63 cm-1出现C-N-C对称伸缩振动吸收峰,这说明CS分子结构因交联引入了大量二乙烯三胺分子中的结构功能基团。CDECM与ADECM的红外光谱线中出现许多染料CR与AG50的特征吸收峰,这表明染料分子进入了改性壳聚糖微球,它们分子链之间通过各种形式相互结合,造成了基团峰的重叠与新峰出现的现象。
|
图 2 CS, DECM, CDECM, ADECM, CR和AG50的红外光谱 Fig.2 FT-IR spectra of CS, DECM, CDECM, ADECM, CR and AG50 a. CS b. DECM c. CDECM d. ADECM e. CR f. AG50 |
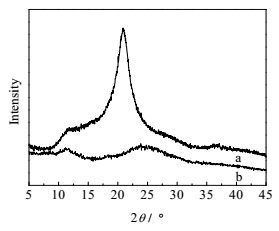
用X射线衍射仪对样品内部结晶状态进行分析。在CS分子结构中存在大量的氢键,其抑制了糖残基旋转的自由度,限制了旋转角的变化,使得CS形成了一种具有较强刚性结构的高分子长链,同时由于这种氢键的作用也使壳聚糖具有一定的结晶性。由图 3可知,壳聚糖具有两个明显的衍射峰2θ = 12°和2θ = 20.8°。相比于CS,DECM的衍射峰平而宽,这说明经过结构修饰的CS破坏了其分子结构中存在的大量氢键使晶体结构由有序走向无定型化,同时结晶度下降也使分子链排布更为疏松,暴露出了更多的活性羟基和氨基,有利于吸附。
|
图 3 CS和DECM的X射线衍射图 Fig.3 XRD patterns of CS and DECM a. CS b. DECM |
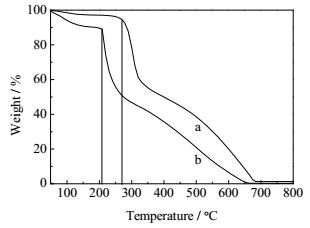
为了研究CS在改性前后热稳定性的变化,对CS和DECM进行TGA分析。图 4为CS与DECM的TGA曲线图,CS失重分为两个阶段:第一个阶段在50℃至270℃左右,质量下降约6%,可能是失去吸附的水和结晶水所致。第二阶段从270℃开始质量急剧下降直至完全分解,这是由于CS分子结构中的糖苷键发生断裂,主链降解的结果。DECM也有类似的变化,第一阶段从50℃至210℃左右,质量约下降11%,这阶段失去吸附的水和结晶水。第二阶段从210℃开始失重直至完全分解,可能涉及交联基团的分解及CS骨架的断裂。另外,DECM的热分解温度比CS低,说明通过交联引入新的基团破坏了CS本身有序的结构使其热稳定性下降更易受热分解。
|
图 4 CS与DECM的TGA曲线 Fig.4 TGA thermographs of CS and DECM a. CS b. DECM |
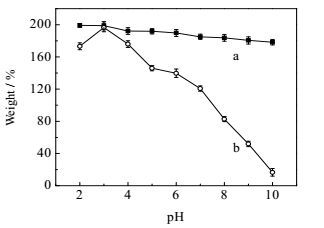
pH值是吸附材料与染料在溶液中存在形式的重要影响因素之一,同时也会影响吸附材料对染料的吸附过程。pH值对DECM吸附效果的影响如下图 5所示。由图 5可知,DECM对CR的吸附量随着pH值逐渐升高而不断减小,但仍维持在较高的水平。但DECM对AG50的吸附受pH值影响较大,在pH为3.0时达到最佳的吸附效果,之后吸附量随着pH值逐渐升高而急剧下降。在低pH值时溶液中含有大量的H+,H+与DECM上富含的-NH2质子化形成-NH3+,同时阴离子染料在溶液中易游离成离子状态,因而两者之间通过静电相互作用而发生吸附[15]。随着pH值的逐渐升高,-NH2质子化能力减弱,同时使得溶液中的OH-浓度不断增大,进而与阴离子染料形成竞争,导致染料的吸附容量降低[16]。另外,在整个pH值区间CR分子更容易与DECM通过氢键与范德华力的协同作用相互结合,使吸附量维持在较高水平[15]。为了考察DECM与两种染料的其它吸附行为,选定pH 3.0作为后续实验的pH值。
|
图 5 pH值对DECM吸附效果的影响 Fig.5 Effects of pH on DECM adsorption performance a. CR b. AG50 |
吸附动力学的分析能用于研究平衡吸附容量与吸附时间之间的关系,以及反应吸附速率的变化。图 6为两种阴离子染料在不同初始浓度下的吸附动力学曲线。由图 6可知,在吸附的初始阶段吸附量随时间的增加而急剧上升,随着时间的延长,吸附容量逐渐趋于平缓。在初始阶段吸附剂表面含有大量的活性位点,染料分子与活性位点快速结合,随着活性位点逐渐被消耗,吸附速率逐渐降低直至达到吸附平衡。为了更好地分析吸附容量随时间的变化,采用三种动力学模型对动力学曲线进行分析,包括准一级动力学模型、准二级动力学模型、粒子内扩散模型。
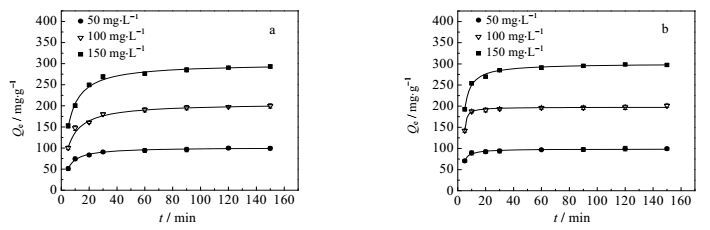
|
图 6 不同初始浓度的吸附动力学曲线 Fig.6 Adsorption kinetics profiles at different initial concentrations a. CR b. AG50 |
准一级动力学模型方程[17]:
| $\text{log}\left( {{Q}_{\text{e}}}-{{Q}_{\text{t}}} \right)=\text{log}\left( {{Q}_{\text{e}}} \right)-\frac{{{K}_{1}}}{2.303}t$ | (2) |
准二级动力学模型方程[18]:
| $\frac{t}{{{Q}_{t}}}=\frac{1}{{{K}_{2}}{{Q}_{e}}^{2}}+\frac{t}{{{Q}_{e}}}$ | (3) |
粒子内扩散模型方程[19]:
| ${{Q}_{t}}={{K}_{int}}{{t}^{1/2}}+C$ | (4) |
其中:Qe是平衡吸附容量,mg⋅g-1;Qt是t时刻吸附容量,mg⋅g-1;K1,K2分别是准一级与准二级吸附速率平衡常数,min-1,g⋅mg-1⋅min-1;Kint是内扩散吸附速率平衡常数,mg⋅g-1⋅min-1/2;C为常数变量,若C = 0,内扩散是整个吸附过程的控速步骤。
动力学参数拟合结果见表 1,与准一级和粒子内扩散模型相比,准二级动力学模型相关系数较高,R2接近于1,且曲线拟合出的平衡吸附量Qe2与实测值Qe非常接近,说明准二级动力学模型能更好的描述整个吸附过程,吸附过程受化学吸附机理的控制,这种化学吸附涉及到吸附剂与染料分子之间的电子共用或电子转移。另外从各个模型的吸附速率可以看出染料分子吸附的状态,就准二级动力学模型而言,随着初始浓度C0升高K2值逐渐减小,这是由于在低浓度下染料分子在吸附剂表面活性位点处竞争较小,吸附速率较快;在高浓度下,活性位点处竞争激烈导致吸附速率变慢[20]。在内扩散模型中,Kint值可以反映出染料分子从表面到内部吸附的状态,Kint值越大表明有越多的染料分子集中到吸附剂表面准备从外部进入吸附剂内部[21]。
| 表 1 吸附动力学参数 Table 1 Adsorption kinetics parameters |
吸附等温线可以描述吸附剂与吸附质之间相互作用的情况,从吸附等温线的形状和变化规律可以反映出两者之间作用力的强弱[22]。在两种染料的初始浓均为0~500 mg⋅L-1条件下,DECM对两种染料的吸附等温线如图 7所示。从图 7可知DECM的吸附容量随着两种染料浓度的升高而逐渐增大,对AG50的吸附效果更好,所达到的饱和吸附容量更大。
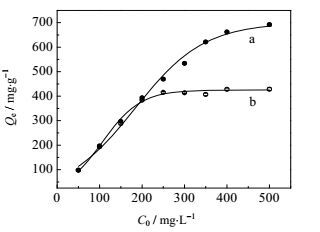
|
图 7 两种染料的吸附等温线 Fig.7 Adsorption isotherms of two dyes a.AG50 b.CR |
为了更好地描述吸附等温线的变化状态,利用Langmuir和Freundlich方程对实验数据拟合。
Langmuir方程[23]:
| $\frac{{{C}_{e}}}{{{Q}_{e}}}=\frac{1}{b{{Q}_{m}}}+\frac{{{C}_{e}}}{{{Q}_{m}}}$ | (5) |
Freundlich方程[24]:
| ${{Q}_{e}}={{K}_{F}}{{C}_{e}}^{1/n}$ | (6) |
其中:Ce为平衡浓度,mg⋅L-1;Qe为平衡吸附容量,mg⋅g-1;Qm为饱和吸附容量,mg⋅g-1;b为Langmuir吸附平衡常数,L⋅mg-1;KF为Freundlich吸附平衡常数,mg⋅g-1(L⋅mg-1)1 /n;n为常数,表示吸附强度。
吸附等温线拟合参数见表 2,可知用Langmuir模型拟合的R2更接近于1,拟合的CR和AG50最大饱和吸附容量分别为434.8 mg⋅g-1和714.3 mg⋅g-1与实际值接近。这说明吸附剂表面具有很多能量无差别的吸附位点,Langmuir模型更适合用来描述整个吸附过程。另外Langmuir等温吸附还可以用一个无量纲的平衡参数特征分离系数RL=(1+bC0)-1来分析[25]。一般地,当RL>1时,表明为非优惠吸附 (unfavorable);当RL=1时,为线性的吸附 (linear);当0<RL<1时,为优惠吸附 (favorable);当RL=0时,为不可逆的吸附 (irreversible)。由表 2计算出的RL介于0和1之间,说明DECM对两种染料CR和AG50的吸附为优惠吸附。在Freundlich模型里,参数1/n与吸附剂结合强度相关,如果1/n接近1或等于1,表明吸附剂拥有更多的均一性结合位点。相比于CR,AG50的1/n更大,说明吸附剂表面有更多适合AG50分子的均一性结合位点。
| 表 2 吸附等温线参数 Table 2 Adsorption isotherm parameters |
在染料废水处理过程中,吸附剂的循环再生性能十分关键。DECM对两种染料的循环再生性能如图 8所示。由图 8可知,可以看出经过5次的循环再生,吸附剂对染料的去除率仍然能够保持在92%以上,说明其具有较好的吸附性能以及较高的化学稳定性。
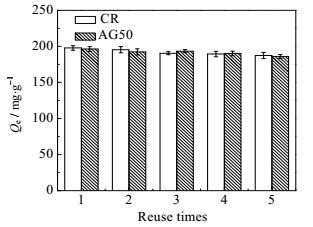
|
图 8 DECM对两种染料的循环再生 Fig.8 DECM regeneration performance in dye treatment |
通过乳液交联法制得的改性壳聚糖微球DECM对CR、AG50两种染料表现出良好的吸附活性。利用多种表征手段证实该微球具有较大的比表面积和较多的活性位点。利用静态吸附法研究了DECM的吸附行为,表明其吸附过程符合准二级动力学模型,两种染料的吸附过程符合Langmuir模型。DECM的重复使用性能良好,经过5次吸附-解吸循环操作,对染料的去除率仍然能够保持在92%以上,有望在实际染料废水处理中得以应用。
| [1] | DING Shao-lan(丁绍兰), LI Zheng-kun(李郑坤), WANG Rui(王睿). Summary of treatment of dyestuff waster(染料废水处理技术综述)[J]. Water Resources Protection(水资源保护) , 2010, 26(3): 73-78. |
| [2] | REN Nan-qi(任南琪), ZHOU Xian-qiao(周显娇), GUO Wan-xi(郭婉茜), et al. A review on treatment methods of dye wastewater(染料废水处理技术研究进展)[J]. Journal of Chemical Industry and Engineering (China)(化工学报) , 2013, 64(1): 84-94. |
| [3] | JIANG Ting-da(蒋挺大). Chitin(壳多糖)[M].Beijing(北京): China Environmental Science Press(中国环境科学出版社), 1999: 61-116. |
| [4] | Li H M, Huang D H. Microwave preparation and copper ions adsorption properties of crosslinked chitosan/ZSM molecular sieve composites[J]. Journal of Applied Polymer Science , 2013, 129(1): 86-93. DOI:10.1002/app.v129.1. |
| [5] | Wan L, Wang Y, Qian S. Study on the adsorption properties of novel crown ether crosslinked chitosan for metal ions[J]. Journal of Applied Polymer Science , 2002, 84(1): 29-34. DOI:10.1002/(ISSN)1097-4628. |
| [6] | Kannamba B, Reddy K L, AppaRao B V. Removal of Cu (Ⅱ) from aqueous solutions using chemically modified chitosan[J]. Journal of Hazardous Materials , 2010, 175(1-3): 939-948. DOI:10.1016/j.jhazmat.2009.10.098. |
| [7] | Repo E, Koivula R, Harjula R, et al. Effect of EDTA and some other interfering species on the adsorption of Co (Ⅱ) by EDTA-modified chitosan[J]. Desalination , 2013, 321(15): 93-102. |
| [8] | Wang L, Xing R, Liu S, et al. Recovery of silver (I) using a thiourea-modified chitosan resin[J]. Journal of Hazardous Materials , 2010, 180(1-3): 577-582. DOI:10.1016/j.jhazmat.2010.04.072. |
| [9] | PENG Chang-hong(彭长宏), TANG Yu-rong(唐玉蓉), WANG Yu-ting(汪玉庭), et al. Synthesis of carboxyl-containing graf ted chitosan polymer and its adsorpt ion properties for heavy metal ions(接枝羧基壳聚糖的合成及其对重金属离子的吸附性能)[J]. Chinese Journal of Enviromental Science(环境科学) , 1998, 19(8): 29-33. |
| [10] | Huang J, Xie H H, Ye H, et al. Effect of carboxyethylation degree on the adsorption capacity of Cu (Ⅱ) by N-(2-Carboxyethyl) chitosan from squid pens[J]. Carbohydrate Polymers , 2015, 138: 301-308. |
| [11] | Seko N, Tamada M, Yoshii F. Current status of adsorbent for metal ions with radiation grafting and crosslinking techniques[J]. Nuclear Instruments & Methods in Physics Research , 2005, 236(s 1-4): 21-29. |
| [12] | Vieira R S, Beppu M M. Interaction of natural and crosslinked chitosan membranes with Hg (Ⅱ) ions[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects , 2006, 279(1): 196-207. |
| [13] | Yang J M, Su W Y, Leu T L, et al. Evaluation of chitosan/PVA blended hydrogel membranes[J]. Journal of Membrane Science , 2004, 236(1): 39-51. |
| [14] | Lopes E C N, Sousa K S, Airoldi C. Chitosan-cyanuric chloride intermediary as a source to incorporate molecules-thermodynamic data of copper/biopolymer interactions[J]. Thermochimica Acta , 2009, 483(483): 21-28. |
| [15] | Du Q J, Sun J K, Li Y H. Highly enhanced adsorption of congo red onto graphene oxide/chitosan fibers by wet-chemical etching off silica nanoparticles[J]. Chemical Engineering Journal , 2014, 245(6): 99-106. |
| [16] | ZHANG Cong-lu(张聪璐), HU Xiao-min(胡筱敏), ZHAO Yan(赵研), et al. Adsorption behavior of anionic dyes onto magnetic chitosan derivatives(磁性壳聚糖衍生物对阴离子染料的吸附行为)[J]. Chinese Journal of Enviromental Science(环境科学) , 2015(1): 221-226. |
| [17] | Yuh-Shan H. Citation review of Lagergren kinetic rate equation on adsorption reactions[J]. Scientometrics , 2004, 59(1): 171-177. DOI:10.1023/B:SCIE.0000013305.99473.cf. |
| [18] | Demirbas E, Kobya M, Senturk E, et al. Adsorption kinetics for the removal of chromium Ⅲ from aqueous solutions on the activated carbonaceous prepared from agricultural wastes[J]. Water S A , 2004, 30(4): 533-539. |
| [19] | Weber W J, Morris J C. Kinetics of adsorption on carbon from solution[J]. Asce Sanitary Engineering Division Journal , 1963, 1(2): 1-2. |
| [20] | Zhang J X, Zhou Q X, Ou L L. Kinetic, isotherm, and thermodynamic studies of the adsorption of methyl orange from aqueous solution by chitosan/alumina composite[J]. Journal of chemical and engineering data , 2012, 57(2): 412-419. DOI:10.1021/je2009945. |
| [21] | Ho Y S, McKay G. Kinetic models for the Sorption of dye from aqueous solution by wood[J]. Process Safety and Environmental Protection , 1998, 76(2): 183-191. DOI:10.1205/095758298529326. |
| [22] | Yan H, Yang L Y, Yang Z, et al. Preparation of chitosan/poly (acrylic acid) magnetic composite microspheres and applicationsin the removal of copper (Ⅱ) ions from aqueous solutions[J]. Journal of Hazardous Materials , 2012, 229(229-230): 371-380. |
| [23] | Langmuir I. The adsorption of gases on plane surfaces of glass, mica and platinum[J]. Journal of the American Chemical Society , 1918, 143(9): 1361-1403. |
| [24] | Freundlich H M F. Uber die adsorption in losunge[J]. Chemical Physics , 1906, 57: 385-470. |
| [25] | Gao Y, Yue Q, Gao B, et al. Comparisons of porous, surface chemistry and adsorption properties of carbon derived from Enteromorpha prolifera activated by H4P2O7 and KOH[J]. Chemical Engineering Journal , 2013, 232(9): 582-590. |




