2. 中国科学院广州能源研究所,广东 广州 510640;
3. 广东省新能源和可再生能源研究开发与应用重点实验室,广东 广州 510640;
4. 中国地质调查局青岛海洋地质研究所,山东 青岛 266000
2. Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Guangzhou 510640, China;
3. Guangdong Key Laboratory of New and Renewable Energy Research and Development, Guangzhou 510640, China;
4. Qingdao Institute of Marine Geology, China Geological Survey, Qingdao 266000, China
沼气是一种清洁能源,是秸秆、粪便、生活污水等有机物质在一定水分、温度和厌氧条件下,经微生物发酵产生的可燃气体。沼气作为可再生的清洁能源,既可替代秸秆、柴薪等传统生物质能源,也可替代煤炭等商品能源[1, 2]。沼气的主要成分是甲烷(50%~80%),同时含有大量的CO2等杂质气体。沼气中CO2气体的存在会腐蚀气体的输运管道,降低气体燃烧热值,因此沼气利用中CO2的去除是一个必须的步骤。目前已有的CO2分离方法主要有低温分馏法、化学吸附法、物理吸收法以及膜分离法等[3]。但是在实际工业应用中,这些传统方法都各自存在不同缺点,例如重污染、大能耗、高成本以及分离容量小等。因此,有必要研究一种有别于传统方法的全新高效且经济实用的分离技术。
气体水合物是一种由水和客体分子在低温和高压条件下形成的一种非化学计量的笼型晶体化合物[4]。它的储气量非常巨大,在标准状况下,理论上1 cm3的天然气水合物可以储存大约160 cm3的气体。不同的气体分子可以与水形成不同的气体水合物,且具有不同的生成特性及相平衡数据[5],因此,利用水合物的这个特性,可以用气体水合物进行CO2气体的分离[6]。水合物法分离CO2的基本原理是利用不同水合物的生成特性控制温度、压力等外界条件,促使要分离的气体尽量地生成水合物,从而达到净化剩余气体的目的。相对于传统的化学吸附及物理吸附等气体分离方法,水合物法具有工艺简单,无污染且分离效率高等优点。目前水合物法分离气体的关键问题是如何降低水合物生成过程的操作压力以及促进水合物快速生成。常用的方法是加入促进剂,降低水合物相平衡条件,提升水合物生成速率[7]。
四丁基溴化铵(TBAB)是一种离子型表面活性剂,它本身能与水反应生成半笼型水合物,阳离子TBA+占据半笼型水合物中的一部分笼型结构。同时,作为一种季铵盐,它能显著降低水合物的相平衡条件,使得气体水合物可以在更低的压力和更高的条件下形成[8]。关于TBAB在水合物法气体分离中的应用,国内外已进行了相关的研究,目前比较多的是集中于水合物法烟气(CO2/N2)分离[9~12]及电厂燃料气(CO2/H2)的分离[13~17]。对于CH4/CO2的混合气则研究还比较少。Deschamps[18]测试了四丁基溴化铵(TBAB)添加剂体系中N2,CO2以及N2/CO2和CH4/CO2混合气水合物的相平衡数据及分解焓,Fan[19]测定了季铵盐类添加剂存在下,CO2/CH4混合气的相平衡条件,Mohammadi[20]研究了CO2/CH4混合气中加入不同浓度TBAB水溶液后的水合物生成过程,Verrett[21]研究了TBAB+CH4/CO2生成半笼型水合物的相平衡条件,测定了气体溶解度并建立了相关模型预测该混合体系的水合物相平衡数据。这些研究结果表明TBAB能显著降低混合气水合物的相平衡条件。同时,Li[22]分别研究了纯水体系,TBAB水溶液体系及离子液体1-乙基-3甲基咪唑四氟硼酸盐([BMIm]BF4)+TBAB体系中CH4/CO2混合气(摩尔比67:33) 水合物的生成过程及CO2的分离效果。结果表明,TBAB对水合物法分离CH4/CO2混合气中CO2有促进作用,当采用1200 ppm的[BMIm]BF4离子溶液与TBAB结合作为添加剂时,CO2分离效果最好,水合物反应后气相中CH4的含量最高可以达到84%。
综合来看,目前已有的少量关于TBAB添加剂体系中CH4/CO2混合气水合物的研究多集中于相平衡方面,对混合气水合物生成动力学及CO2分离效果的研究寥寥无几。因此,本文将TBAB+CH4/CO2作为研究对象,改变水合物生成条件,重点研究驱动力的不同对CH4/CO2混合气水合物生成动力学及CO2分离效果的影响。
2 实验部分 2.1 实验装置及材料实验装置主要包括气体管路、真空泵、恒温水浴和不锈钢反应釜体,装置简图如图 1所示。其中316#不锈钢反应釜体是实验装置的主体部分,反应釜内径为8 cm,内部高度为10 cm,设计容积为500 cm3,最大承受压力为15 MPa。反应釜前后各有一个透明玻璃视窗,可以在反应中随时观测反应釜内的状态。反应釜内设有Pt-100温度传感器,分别监测反应釜内气相以及液相的温度,温度压力传感器的精度为±0.1 K。反应釜内气相设有压力传感器,监测气相压力的变化,压力传感器精度为±0.01 MPa。反应釜内设有机械搅拌装置,保证水合物反应过程中的气液界面充分接触,以促进水合物的生成。
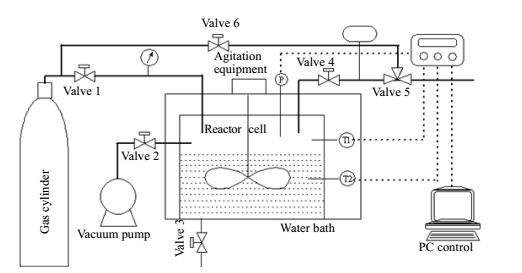
|
图 1 实验装置简图 Fig.1 Schematic diagram of the experimental setup |
实验所采用的CO2/CH4的混合气体是采用高纯CO2(99.99%)和高纯CH4(99.99%)配比而成,二者的摩尔比例为0.5/0.5,气体购自广州市谱源气体厂。四丁基溴化铵(TBAB)采购自上海润捷化学有限公司,纯度为>99.9%。所用蒸馏水为实验室自制。
2.2 实验流程首先,配制好实验所用质量浓度为40%的TBAB水溶液(该浓度下TBAB可以与水生成水合数为26的标准TBAB半笼型水合物),同时使用蒸馏水反复冲洗反应釜并自然风干。然后将反应釜与气体管路连接,打开真空泵,对反应系统抽真空约10 min。待反应釜内真空压力接近-0.1 MPa时,利用负压将TBAB水溶液吸入反应釜内,并再次对反应釜进行抽真空。然后打开进气阀门,缓慢进气,当进气压力达到实验所需压力时,停止进气,关闭阀门。为避免进气过程引起反应釜内温度的上升,进气过程应尽量保持缓慢。当反应釜内气体压力以及温度都保持恒定时,该时刻的温度压力条件为反应初始条件。此时,打开机械搅拌装置,设定搅拌速率为100 r·min-1,开始水合物生成反应。在反应的过程中,每隔一段时间就会对反应釜内气相组分进行采样然后利用气相色谱仪(GC)分析,计算此时反应釜内气相中CO2和CH4的摩尔比例。反应过程中,反应釜内气体的温度及压力值均由Agilent数据采集仪进行采集。
3 结果与讨论实验主要目的是研究相同的TBAB浓度条件下,不同的过冷度对半笼型水合物法分离CO2过程的影响。为了直观比较且比较有借鉴意义,实验中分别采用不同的气水体积比例,分别为0.54, 1和2.33。气水体积比例为反应釜中气体所占据的体积与TBAB水溶液所占据的体积比值,反应釜内体积为500 cm3,TBAB水溶液所占据的体积分别为325,250和150 mL。
为了更加贴合工业应用,本文选择一个中等压力3.2 MPa的反应压力。根据文献结果显示,添加TBAB水溶液质量浓度为40%时,CH4与CO2 (摩尔比例0.5/0.5) 的混合气水合物在3.2 MPa下对应的相平衡温度为292 K[18, 20],而纯的TBAB水合物的分解温度为284.6 K。在这个压力条件下,水合物有足够的过冷度区间,同时,在工业应用中该压力条件也能有效降低能耗。实验发现当温度低于282 K时,TBAB水溶液直接生成水合物,从而导致混合气很难参与到水合物生成过程中。因此,本研究选取282~290 K的温度区间,其对应过冷度分别为10~2 K。实验过程中固定压力条件,改变温度,研究不同的过冷度条件下水合物的生成特性。为了保证反应完全,实验进行了60 min。但水合物实际反应时间要小于60 min。为了统一说明问题,文中定义了水合物有效反应时间,即从反应开始初始时刻到每分钟压力下降的幅度(ΔP·min-1)小于0.01 MPa时持续的时间,当水合物反应持续到有效反应时间之后,反应已经基本结束。
表 1所示为不同的条件下实验结果的总结。包括反应后气体的消耗量以及单位气体消耗量,反应后气相中CH4及CO2的摩尔比例、CO2的分离系数以及反应所需要的有效时间。其中某一时刻的气体消耗量
| 表 1 实验条件及结果,P = 3.2 MPa Table 1 Experimental conditions and results, P = 3.2 MPa |
| $\Delta n_{\rm{g}}^t = \frac{{V{P_0}}}{{{Z_0}R{T_0}}} - \frac{{V{P_{\rm{t}}}}}{{{Z_t}R{T_{\rm{t}}}}}$ | (1) |
其中,V是反应釜内气体所占据的体积;P0及Pt分别代表反应初始时及t时刻反应釜内气相的压力;T0及Tt分别代表反应初始时及t时刻反应釜内气相的温度;R是气体常数,R = 8.314 J·(mol·K)-1;Z是压缩因子,可以通过Pitzer’s方程[23]来得到。
而CO2气体分离系数可以通过反应前后气相中CH4及CO2的摩尔比例计算得到。
| $\chi =\frac{{{{y}_{\text{C}{{\text{H}}_{\text{4}}}{{\text{,}}_{\text{g}}}}}}/{{{y}_{\text{C}{{\text{O}}_{\text{2}}}\text{,g}}}}\;}{{{{y}_{\text{C}{{\text{H}}_{\text{4}}}{{\text{,}}_{\text{f}}}}}}/{{{y}_{\text{C}{{\text{O}}_{\text{2}}}{{\text{,}}_{\text{f}}}}}}\;}$ | (2) |
其中,yCO2, f及yCO2, g分别为反应初始及反应结束后气相中CO2的摩尔比例,yCH4, f及yCH4, g为反应初始及反应结束后气相中CH4的摩尔比例。当χ>1时,水合物法具有一定的CO2分离效果,且CO2气体分离系数越大,CO2分离效果越好。由于本文中初始的CO2与CH4的摩尔比例为0.5/0.5,因此当CO2气体分离系数χ<1时,作者认为该方法没有CO2分离效果。
从表中的结果看,气体消耗量随着气水体积比的增加而增加,这个结果说明反应过程中气体相对过量可以促进水合物生成过程,增大混合气体的消耗量。但是,当气水体积比为2.33时,水合物反应后气相中的CH4摩尔比例要小于气水体积比为0.54和1的体系,CO2的分离效果降低。综合考虑,TBAB水溶液浓度质量浓度为40%时,0.54的气水体积比比较适宜CO2的分离,在这个条件下,温度为286 K时,CO2分离效果最好,CO2分离系数为4.43。
3.1 水合物反应过程中气体消耗量如图 2所示为不同气水比例体系中水合物反应过程中气体消耗量随时间的变化。当气水体积比例为1时,水合物反应结束后CO2/CH4混合气体消耗量要大于气体比例为0.54和2.33时的气体消耗量。同时,从不同的气水比例体系中气体消耗量的变化规律可以得出,在水合物反应开始的20 min内,水合物反应速率较大,大量的气体被消耗,混合气体消耗量快速增加。随着反应的进行,水合物反应速率不断下降,气体消耗量增加的幅度逐渐降低,反应进行到50 min左右,水合物反应基本结束,气体消耗量也不再变化。由于CO2在TBAB水溶液中的溶解度与在纯水中的溶解度很接近,本文的目的是为了研究水合物法对CO2的分离效果,水合物生成后,水合物的分离量包含水合物内CO2以及溶液中溶解的CO2,因此并未单独区分二者的分别。
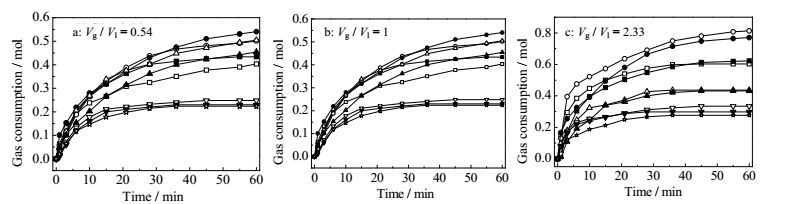
|
图 2 不同温度体系的气体消耗量 Fig.2 Gas consumption under different temperature systems □ 282 K ■ 283 K ○ 284 K ● 285 K △ 286 K ▲ 287 K ▽ 288 K ▼ 289 K ☆ 290 K |
由于实验中采用了不同体积的TBAB水溶液,对应不同的气水体积比,为方便对不同的反应体系进行统一的分析,按实验中气体的消耗量以及TBAB水溶液的体积计算每升溶液所消耗的气体量,即单位气体消耗量,以单位气体消耗量表征反应体系消耗气体的能力。单位气体消耗量越大表明该体系吸收气体的能力越强。不同温度条件下反应体系的单位气体消耗量如图 3所示。对同样的气水比例体系来说,单位气体消耗量并非随着过冷度的增加而增加,当气水比例为0.54 (TBAB水溶液过量),温度为286 K (过冷度为6 K)时,单位气体消耗量最大。当气水比例为2.33时(混合气体过量),反应温度为284 K (过冷度为8 K)时,单位气体消耗量最大。因此,在不同的气水比体系内,TBAB水溶液的单位气体消耗量并非随着过冷度的增加而增加,总是存在一个最佳的过冷度使得TBAB水溶液的单位气体消耗量最大。同时,气水比越大,同样的条件下单位气体消耗量越大。这个结果说明,气体越多,水合物反应过程中就会有越多的气体量得到消耗,反应速率会越大,从而有利于CO2的分离。
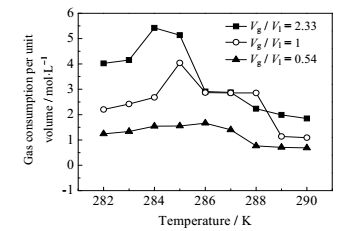
|
图 3 不同温度条件下的单位气体消耗量 Fig.3 Unit gas consumption under different temperature systems |
如图 4所示为不同气水体积比体系中,水合物反应过程气相中CO2及CH4气体组分随时间的变化规律。从图中可以看出,在不同的气水比体系中,水合反应结束后,气相中CH4的比例与过冷度有一定的关系,存在一个最佳的温度点,在这个温度条件下CO2分离效果最好。对于CO2/CH4混合气来说,过冷度越大,CO2/CH4混合气水合物的反应驱动力越高,但是,由于TBAB的存在,TBAB比较容易与水生成水合物,当温度低于284.6 K时,质量浓度为40%的TBAB水溶液就可以生成纯的TBAB半笼型水合物,阻碍混合气参与水合物生成。TBA+阳离子占据水合物笼型结构,从而会影响水合物的储气量与CO2的分离效果,因此,并非温度越低CO2分离效果越好。
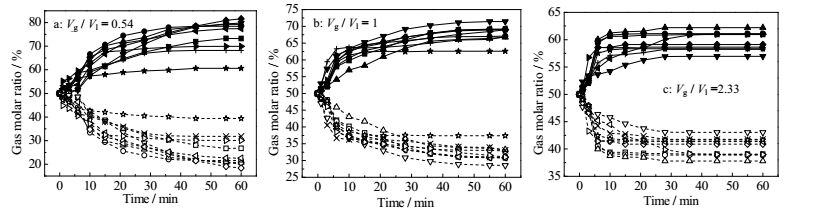
|
图 4 不同气水比例条件下,CH4/CO2气体组分比例随时间的变化 Fig.4 CO2 and CH4 gas molar ratio change as a function of time at different Vg/Vl ■ CH4, 282 K ● CH4, 283 K ▲ CH4, 284 K ▼ CH4, 285 K ◆ CH4, 286 K ◀ CH4, 287 K ▶ CH4, 288 K + CH4, 289 K ★ CH4, 290 K □ CO2, 282 K ○ CO2, 283 K △ CO2, 284 K ▽ CO2, 285 K ◇ CO2, 286 K ◁ CO2, 287 K ▷ CO2, 288 K × CO2, 289 K ☆ CO2, 290 K |
从图 4a中可以看出,当气水比例为0.54,即TBAB水溶液相对过量时,在水合物反应初期阶段,CO2及CH4组分变化比较大,当反应进行到30 min后,反应釜气相中CO2及CH4的摩尔比例基本不发生变化。这个结果说明,在这样的反应条件下,CO2分离效果在反应的前30 min内比较明显。当压力为3.2 MPa,温度为286 K,即反应体系过冷度为6 K时,反应结束后气相中CO2的摩尔比例最小,为18.41%,CH4的摩尔比例最大,为81.59%,CO2分离效果最好。在这个气水比例条件下,CO2的气体分离效果最好。当水合物反应有效时间结束后,气相中CH4和CO2的摩尔比例仍会有细微的变化,这说明气体分离的效果持续时间比较长,要大于水合物有效反应时间。但是,当有效反应时间结束后,气相中气体组分的变化已经非常小,与整个的气体组分变化比较,已经可以忽略不计。
同时,反应釜中气-水体积比对CO2及CH4的摩尔比例变化也有一定的影响作用。当气水比为2.33时,CO2气体分离过程可以在较短的时间内结束,大约为20~25 min,当气水比为1时,CO2气体分离过程结束时间大概为30~40 min,而气水比为0.54时,CO2分离过程持续时间比较长,大约到50 min左右才基本结束。这个结果说明,随着反应釜中混合气体占据的体积增加,CO2分离过程持续的时间相对缩短。当气体过量时,反应釜内的搅拌装置可以极大地促进溶液与气体之间的界面接触,TBAB水溶液参与反应的速度比较快,从而能较快的结束分离过程。
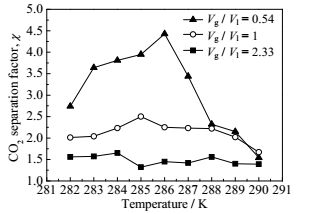
3.4 分离系数与过冷度的关系水合物法分离CO2的目的是提高CO2的分离系数,理论上来讲,过冷度的增加会同时促进CO2和CH4水合物的生成。而本次实验的目的是尽量多地使CO2参与到水合物生成过程中,同时避免CH4气体的过多消耗。图 5所示为不同温度条件下,CO2水合物的分离系数,从实验结果来看,不同的气水比例体系中,CO2分离系数与驱动力有一定的关系。当气水比例为0.54时,TBAB水溶液相对过量,同样的过冷度条件下,CO2的分离系数远大于气水比例为1和2.33时的分离系数。结合实验过程中观察得到的结果说明水合物生成过程中,TBAB水溶液并不能完全转化成致密的水合物,生成的水合物基本呈浆状,而过量的TBAB水溶液可以使尽量多的气体与水溶液接触并发生水合反应,从而消耗掉比较多的CO2,提高CO2的分离效果。
|
图 5 不同温度条件下水合物法CO2分离系数 Fig.5 CO2 separation factors under different systems |
|
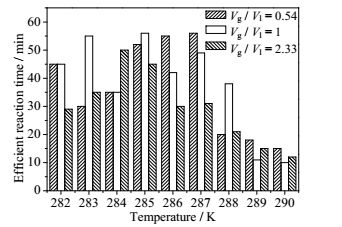
图 6 不同温度条件下水合物法分离CO2的有效反应时间 Fig.6 Effective reaction times for CO2 separation under different temperature systems |
同时,CO2的分离效果并非随着驱动力的增加而增加,存在一个最佳的过冷度,在这个过冷度条件下,CO2参与水合物生成的量最大,而CH4参与的量相对最少,从而达到最佳的CO2分离效果。结果发现,当气水比为0.54时,过冷度为6 K时,CO2的分离系数为4.43,水合物法分离CO2的效果最理想。
3.5 有效分离时间与过冷度的关系当气水比例为2.33时,反应釜中的CO2/CH4混合气相对TBAB水溶液过量,气液接触表面很快生成水合物并阻碍了气体的运移途径,气相中过量的气体并不能完全反应生成水合物,CO2得不到有效分离,CO2分离的有效反应时间相对较短。当气水比降低,即TBAB水溶液相对过量时,水合物呈浆状生成,致密度下降,气体扩散水合物反应时间持续比较长,水合物反应持续时间也相对比较久。
固定气水比例,水合物反应的有效分离时间也与过冷度有一定关系,过冷度越大说明水合物反应的驱动力越大,水合物反应越容易快速结束。综合考虑,当水合物有效反应时间越短而气体消耗量比较大同时CO2分离系数又最大时,这个条件最适合CO2的分离。
4 结论本文研究了3.2 MPa压力条件下,不同温度体系中质量浓度为40%的TBAB水溶液中CO2/CH4混合气水合物的生成过程,分析了水合物生成后气相中CH4和CO2的浓度,计算得到了不同的过冷度条件下水合物生成过程中气体消耗量及水合物法分离CO2的分离系数。结果表明,水合物生成过程及气体消耗量跟过冷度并非简单的成正比,不同的气水比例体系中,皆存在一个最佳的过冷度使得水合物气体消耗量最大。同时,当气水比例为0.54,即TBAB水溶液相对过量时,CO2分离效果要大于气水比为1和2.33的体系。在这个气水比例体系中,温度为286 K,即反应体系过冷度为6 K时,反应结束后气相中CO2的摩尔比例最小,为18.41%,CH4的摩尔比例最大,为81.59%,CO2分离系数达到4.43,CO2分离效果最佳。
符号说明:
| ng | —气体摩尔量,mol | yCH4 | —气相中CH4的摩尔比例 |
| P | —气相压力,MPa | t1 | —有效反应时间 |
| R | —气体常数,R = 8.314 J·(mol·K)-1 | χ | —CO2气体的分离系数 |
| V | —反应釜内气体所占据体积,cm3 | 下标 | |
| T | —气相温度,K | 0 | —初始时刻 |
| Z | —压缩因子 | f | —反应初始时气相 |
| △ng | —气体消耗量,mol | t | —t时刻 |
| yCO2 | —气相中CO2摩尔比例 | g | —反应结束后气相 |
| [1] | WANG Fei(王飞), CAI Ya-qing(蔡亚庆), QIU Huan-guang(仇焕广). Current status, incentives and constraints for future development of bioogas industry in China(中国沼气发展的现状、驱动及制约因素分析)[J]. Transactions of the CSAE(农业工程学报) , 2012, 28(1): 184-189. |
| [2] | ZHENG Ge(郑戈), ZHANG Quan-guo(张全国). Review on biogas upgrading technologies for producing biomethane(沼气提纯生物天然气技术研究进展)[J]. Transactions of the CSAE(农业工程学报) , 2013, 29(17): 1-8. DOI:10.3969/j.issn.1002-6819.2013.17.001. |
| [3] | Xiao W, Yao W, Jun Z, et al. Biogas and CH4 productivity by co-digesting swine manure with three crop residues as an external carbon source[J]. Bioresource Technology , 2010, 101(11): 4042-4047. DOI:10.1016/j.biortech.2010.01.052. |
| [4] | Sloan E D. Clathrate hydrates of natural gases[M].2nd ed.New York: Marcel Dekker Inc, 1998: 1-628. |
| [5] | Linga P, Kumar R N, Englezos P. Gas hydrate formation from hydrogen/carbon dioxide and nitrogen/carbon dioxide gas mixtures[J]. Chemical Engineering Science , 2007, 62(16): 4268-4276. DOI:10.1016/j.ces.2007.04.033. |
| [6] | Aaron D, Tsouris C. Separation of CO2 from flue gas:a review[J]. Separation Science Technology , 2005, 40(1-3): 321-348. DOI:10.1081/SS-200042244. |
| [7] | Wang Y H, Lang X M, Fan S S. Hydrate capture CO2 from shifted synthesis gas, flue gas and sour natural gas or biogas[J]. Journal of Energy Chemistry , 2013, 22(1): 39-47. DOI:10.1016/S2095-4956(13)60004-2. |
| [8] | Li S F, Fan S S, Wang J Q, et al. CO2 capture from binary mixture via forming hydrate with the help of tetra-n-butyl ammonium bromide[J]. Journal of Natural Gas Chemistry , 2009, 18(1): 15-20. DOI:10.1016/S1003-9953(08)60085-7. |
| [9] | Zhong D L, Englezos P. Methane separation from coal mine methane gas by tetra-n-butyl ammonium bromide semiclathrate hydrate formation[J]. Energy Fuels , 2012, 26(4): 2098-2106. DOI:10.1021/ef202007x. |
| [10] | Belandria V, Mohammadi A H, Richon D. Compositional analysis of the gas phase for the CO2+N2+tetra-n-butylammoniumbromide aqueous solution systems under hydrate stability conditions[J]. Chemical Engineering Science , 2012, 84(24): 40-47. |
| [11] | Zhong D L, Ye Y, Yang C, et al. Experimental investigation of methane separation from low-concentration coal mine gas (CH4/N2/O2) by tetra n butyl ammonium bromide semiclathrate hydrate crystallization[J]. Industrial & Engineering Chemistry Research , 2012, 51(45): 14806-14813. |
| [12] | Kim S, Kang S P, Seo Y. Semiclathrate-based CO2 capture from flue gas in the presence of tetra-n-butylammonium chloride[J]. Chemical Engineering Journal , 2015, 276(15): 205-212. |
| [13] | Li X S, Xia Z M, Chen Z Y, et al. Precombustion capture of carbon dioxide and hydrogen with a one-stage hydrate/membrane process in the presence of tetra-n-butylammonium bromide[J]. Energy Fuels , 2011, 25(3): 1302-1309. DOI:10.1021/ef101559h. |
| [14] | Kim S M, Lee J D, Lee H J, et al. Gas hydrate formation method to capture the carbon dioxide for pre-combustion process in IGCC plant[J]. Internal Journal of Hydrogen Energy , 2011, 36(1): 1115-1121. DOI:10.1016/j.ijhydene.2010.09.062. |
| [15] | Xu C G, Zhang S H, Cai J, et al. CO2(carbon dioxide) separation from CO2/H2(hydrogen) gas mixtures by gas hydrates in TBAB (tetra-n-butyl ammonium bromide) solution and Raman spectroscopic analysis[J]. Energy , 2013, 59(15): 719-725. |
| [16] | Babu P, Chin W I, Kumar R, et al. Systematic evaluation of tetra-n-butyl ammonium bromide (TBAB) for carbon dioxide capture employing the clathrate process[J]. Industrial & Engineering Chemistry Research , 2014, 53(12): 4878-4887. |
| [17] | Park S, Lee S, Lee Y, et al. CO2 Capture from simulated fuel gas mixtures using semiclathrate hydrates formed by quaternary ammonium salts[J]. Environmental Science & Technology , 2013, 47(13): 7571-7577. |
| [18] | Deschamps J, Dalmazzone D. Dissociation enthalpies and phase equilibrium for TBAB semi-clathrate hydrates of N2, CO2, N2/CO2 and CH4/CO2[J]. Journal of Thermal Analysis and Calorimetry , 2009, 98(1): 113-118. DOI:10.1007/s10973-009-0399-3. |
| [19] | Fan S S, Li Q, Nie J H, et al. Semiclathrate hydrate phase equilibrium for CO2/CH4 gas mixtures in the presence of tetra-butylammonium halide[J]. Journal of Chemical Engineering Data , 2013, 58(11): 3137-3141. DOI:10.1021/je4005933. |
| [20] | Mohammadi A H, Eslamimanesh Ali, Richon D. Semi-clathrate hydrate phase equilibrium measurements for the CO2+ H2/CH4+ tetra-n-butylammonium bromide aqueous solution system[J]. Chemical Engineering Science , 2013, 94(3): 284-290. |
| [21] | Verrett J, Renault C, Jean S, et al. Phase equilibria, solubility and modeling study of CO2/CH4+tetra-n-butylammonium bromide aqueous semi-clathrate systems[J]. Fluid Phase Equilibrium , 2015, 388(25): 160-168. |
| [22] | Li Q, Fan S S, Wang Y H, et al. CO2 removal from biogas based on hydrate formation with tetra-n-butylammonium bromide solution in the presence of 1 butyl-3-methylimidazolium tetrafluoroborate[J]. Energy Fuels , 2015, 29(5): 3143-3148. DOI:10.1021/acs.energyfuels.5b00061. |
| [23] | Smith J M, Van Ness H C, Abbott M. Introduction to chemical engineering thermodynamics[M].New York: McGraw-Hill, 2001. |




