近年来,以全球气候变化为核心的环境问题日益严重,而消减CO2等温室气体排放是当前减缓气候变化的重要途径之一。燃煤电厂烟气是CO2气体的主要排放来源。捕集这部分CO2是控制CO2排放的重要手段。燃烧前捕集技术主要应用于整体煤气化联合循环(integrated gasification combined cycle简称IGCC)发电系统中[1-3]。因其捕集设备小、工艺成本低等优势成为未来火电厂改革发展的主线。
燃烧前捕集二氧化碳的方法有化学吸收法、吸附法、膜分离法和低温分离法等。其中,吸附法具有操作条件温和、能耗低、可再生能力强、吸附速率快等优点,成为当前最具有发展前景的一种捕集CO2的方法。在吸附法中,吸附剂的选择至关重要,直接决定了CO2的捕集效果。由于IGCC中燃烧前捕集CO2的合成气温度范围为250 ~ 400 ℃[4],所以应采用中温吸附剂。其中,MgO基吸附剂具有较高的理论吸附容量,约为1.1 g·g -1,被认为是理想的中温CO2吸附剂。但是在实际应用中,MgO基吸附剂的吸附速率较慢,实际吸附容量较低,一般低于0.01 g·g -1,且循环稳定性较差,这些问题都限制了MgO基吸附剂在工业上的广泛应用[5]。为了提高MgO基吸附剂的吸附容量,研究人员采用多孔氧化铝、活性炭、介孔硅为载体的负载法[6-9],使吸附容量最大提高到0.085 g·g -1。
STEVEN等[10]发表专利报道了一种新型的双盐修饰的MgO基吸附剂,通过负载碱金属碳酸盐复盐,MgO基吸附剂吸附容量最高可达0.53 g·g -1。后续的研究发现[11-13],在提高MgO吸附容量方面,硝酸盐和碳酸盐起协同作用。此外,TAKUYA等[14]湿混、煅烧法制备(Li-Na-K)NO3修饰的MgO基吸附剂,在300 ℃、100% CO2气氛下初次吸附容量为0.275 g·g -1;ANH等[15]采用溶胶-凝胶法和超临界干燥法制备Na2CO3和NaNO3修饰的MgO基吸附剂,在325 ℃、100% CO2气氛下初次吸附容量为0.31 g·g -1,14次循环中吸附容量基本保持不变。王磊[16]采用沉淀-沉积法制备复合碱金属硝酸盐和碳酸盐修饰的MgO基吸附剂,在350 ℃、40% CO2下初次吸附容量为0.67 g·g -1,12次循环后吸附容量下降为0.52 g·g -1。分析认为,碱金属盐在高温下(350 ~ 400 ℃)呈熔融状态且容易大范围流动,导致吸附剂的循环稳定性较差。所以本文采用塔曼温度(又称泰曼温度,指的是固体晶格开始明显流动的温度,一般在固体熔点的2/3处的温度)高于碳酸镁的CaCO3作为惰性添加剂,使其可以在一定程度上起到阻隔作用,限制碱金属盐的流动;而且CaCO3呈碱性,可以促进MgO基吸附剂的CO2吸附性能。
本文分别以碱式碳酸镁和柠檬酸镁作为MgO的前驱体、采用尿素水解沉积法制备CaCO3、通过混合浸渍等方法制备一系列经CaCO3改性的、碱金属盐修饰的MgO基吸附剂,研究MgO颗粒大小以及CaCO3添加量对MgO基吸附剂的循环稳定性的作用机制。
2 实验部分 2.1 试剂碱式碳酸镁、轻质氧化镁、一水合柠檬酸、四水合硝酸钙、尿素、硝酸钾、硝酸锂、无水碳酸钾、和无水碳酸钠,以上化学试剂均为分析纯。无水甲醇,99.5% (质量分数)。以上化学试剂均采购自国药集团化学试剂有限公司。
2.2 吸附剂的制备吸附剂制备流程如图 1所示。先进行MgO前驱体的制备,CaCO3的制备并与MgO前驱体混合,煅烧后再浸渍碱金属盐。
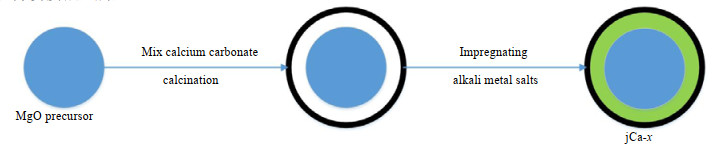
|
图 1 吸附剂制备流程示意图 Fig.1 Schematic diagram of the preparation process of adsorbents |
将轻质MgO加入去离子水中制成悬浮液,将配制好的柠檬酸溶液逐滴加入悬浮液中,50 ℃下水浴加热2 h形成溶胶,升温至80 ℃继续加热蒸干水分,放入烘箱中110 ℃下烘8 h,制备得到柠檬酸镁前驱体。碱式碳酸镁不需另外制备,采用商业碱式碳酸镁。
2.2.2 CaCO3的制备与添加将摩尔比为1:4的硝酸钙与尿素溶于去离子水中,搅拌使其充分溶解;将MgO前驱体(碱式碳酸镁或者柠檬酸镁)加入到上述溶液中超声分散10 min,将此混合液于80 ℃下搅拌,过滤洗涤,在60 ℃下烘干5~8 h;随后在马弗炉中500 ℃下煅烧2 h。
2.2.3 碱金属盐的浸渍将硝酸锂、硝酸钾、碳酸钠、碳酸钾(总碱金属盐与MgO的摩尔比为0.15,硝酸盐与碳酸盐的摩尔比为2;其中硝酸锂与硝酸钾摩尔比为0.44 : 0.56,碳酸钠与碳酸钾摩尔比为0.5:0.5)溶解于无水甲醇中,超声分散使其完全溶解;称取0.4 ~ 0.5 g上述煅烧后的固体加入溶液中,使其充分混合;水浴加热将无水甲醇蒸发;蒸干后,将白色固体置于烘箱中,80 ℃下烘干,称量所得样品并记录。
未添加CaCO3的吸附剂分别命名为jCa-0和nCa-0,j表示碱式碳酸镁为前驱体、n表示柠檬酸镁为前驱体。将添加CaCO3的质量含量分别为3%、5%、10%和20%的样品分别命名为jCa-1、jCa-2、jCa-3和jCa-4。
2.3 吸附剂的表征通过X射线衍射仪(x-ray diffraction, XRD, D/MAX-RA, Rigaku, Japan) 10~80°扫描来表征吸附剂的晶形组成;采用日本HITACHI公司生产的S-4800型扫描电子显微镜(scanning electron microscope, SEM)观察吸附剂的表观形貌、颗粒的大小等;采用日本BEL公司生产的SORP-mini II型测试仪,在液氮环境下检测CO2吸附剂的孔结构,采用多层吸附模型BET (Brunauer-Emmer-Teller)公式计算样品的比表面积,BJH (Barrett-Joyner-Halenda)公式分析样品的孔容和孔径分布。
2.4 CO2吸附性能的测试采用美国Perkin Elmer公司生产的Pyris1热重分析仪(thermo gravimetric analyzer,TGA)对制备的吸附剂进行吸附性能的测试。测试条件:1.5 ~2.0 mg的样品,首先在N2气氛下升高到400 ℃保持30 min,除去吸附剂中的水分和其他杂质;吸附时温度为350 ℃,吸附时长为60 min,气体氛围为40% CO2与60% N2混合气;脱附时温度为400 ℃,脱附时长为20 min,气体氛围为100% N2;吸脱附反复切换实现吸附剂的循环性能测试。
根据TGA实时记录的重量变化的数据,可以计算出单次吸附中吸附剂的吸附容量和吸附速率;通过比较吸附容量随着循环次数增加的变化可以用来表征吸附剂的吸附稳定性好坏。吸附容量的计算公式如下:
| ${\rm 吸附容量(g/g)= \frac{{ 吸附二氧化碳的质量(g)}}{{吸附剂的质量(g)}}}$ | (1) |
将两种前驱体煅烧后的样品进行XRD射线分析,结果如图 2所示。可以发现,碱式碳酸镁和柠檬酸镁煅烧后均主要生成MgO,分别记为MgO(1)与MgO(2)。采用如下所示的谢乐公式计算晶粒尺寸。
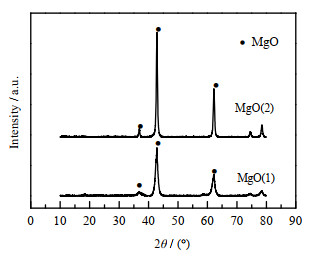
|
图 2 前驱体煅烧后的MgO的XRD谱图 Fig.2 XRD spectra of MgO after calcination of precursors |
| $D = \frac{{K\gamma }}{{B\cos \theta }}$ | (2) |
计算可知,MgO(1)的晶粒尺寸范围为8~12 nm,MgO(2)的晶粒尺寸范围为18~22 nm。由此可知,碱式碳酸镁作为前驱体煅烧得到的MgO颗粒更小。
采用热重分析仪对碱式碳酸镁和柠檬酸镁的分解温度进行测定,如图 3所示。进行对比发现,碱式碳酸镁在450 ℃下分解最快,到500 ℃左右分解完全;而柠檬酸镁在550 ℃左右分解最快,到600 ℃分解完全。可见,柠檬酸镁的分解温度更高,高温下MgO颗粒更易于发生烧结团聚,所以柠檬酸镁煅烧制得的MgO颗粒更大。
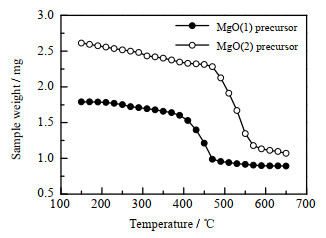
|
图 3 MgO前驱体分解温度曲线 Fig.3 Decomposition temperature curves of MgO precursors |
将两种前驱体煅烧浸渍后制备的吸附剂进行CO2吸附循环稳定性的测试,结果如图 4所示。由图可见,碱式碳酸镁制备的jCa-0吸附容量较高,但吸附稳定性较差;而柠檬酸镁制备的nCa-0吸附容量较低,但循环稳定性较好。表明前驱体的种类对吸附剂的吸附性能有一定影响。分析原因可知,jCa-0中MgO颗粒较小,其活性组分分散性较好,所以初次吸附容量较高,为0.51 g·g -1。而nCa-0中MgO颗粒较大,初次吸附容量就相对较低,为0.20 g·g -1。其次,随着循环次数的增加,两种吸附剂的CO2吸附容量均有一定的降低。经20次循环后,jCa-0吸附剂吸附容量从0.51下降到0.25 g·g -1,而nCa-0吸附剂的吸附容量从0.20下降到0.13 g·g -1。吸附容量下降的原因可能是,在循环反应的过程中,MgO颗粒逐渐团聚成大颗粒,且熔融状态的碱金属盐发生流动导致其分布不均匀,使其促进CO2吸附的效果有所降低。综合比较两者的吸附性能,虽然nCa-0在循环过程中衰减率较低,但其初始吸附容量太低,所以本文后续采用碱式碳酸镁做进一步研究。
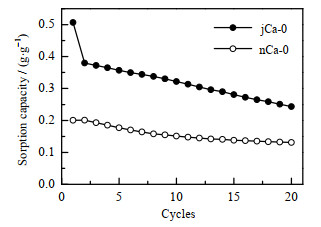
|
图 4 吸附剂的循环吸附容量与循环次数的关系图 Fig.4 Relationship between adsorption capacity and cycle numbers |
图 5为jCa-0和jCa-2 (CaCO3的质量分数为5%)浸渍碱金属盐前后的SEM图。由图 5(a)可见,MgO(1) (碱式碳酸镁煅烧后得到)呈颗粒状。由图 5(c)可见,掺杂CaCO3改性制备的吸附剂呈片状,且改性后的吸附剂颗粒间空隙较大;这表明,CaCO3的添加,提高了活性组分MgO颗粒的分散性。对比图 5(a)、(b)两图可以看出,浸渍碱金属盐后,MgO颗粒间的空隙被填充;但从图 5(d)可以看出,掺杂CaCO3改性的吸附剂颗粒间仍有较大空隙,这也有助于CO2气体的吸附、脱附,一定程度上可以提高吸附剂的吸附速率。

|
图 5 样品的SEM图 Fig.5 SEM images of samples |
图 6为jCa-2浸渍碱金属盐前后的XRD图。从图中可以观察到CaCO3的衍射峰,说明尿素水解法成功地将CaCO3添加到了MgO基吸附剂中。图中也可以观察到KNO3、Na2CO3和K2CO3的衍射峰,但是并未发现LiNO3的衍射峰,分析其原因可能是LiNO3在MgO表面上高度分散、且含量比较少,所以其衍射峰比较弱,很难检测出来。
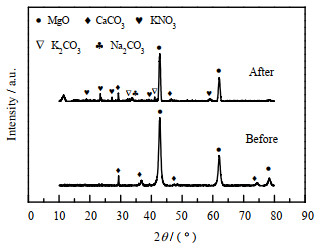
|
图 6 jCa-2浸渍前后的XRD谱图 Fig.6 XRD spectra of jCa -2 before and after impregnation |
图 7为jCa-2的能谱分析(EDS)以及元素含量图。从图中可以看出,Ca的分布较均匀,且能谱显示Ca元素的质量分数为1.72%,Mg元素为36.20%,换算得到CaCO3在吸附剂中的质量分数为4.5%,与添加值5%较为接近,说明尿素水解法可以很好的将CaCO3与MgO混合。碱金属盐通过浸渍法添加到吸附剂表面,图 7显示Na、K的分布也较为均匀,通过计算发现实际含量与添加含量相近,说明浸渍法中元素损失较少。但是由于EDS的测试原理限制,Be元素之前的元素不能被检测出来,所以添加的Li未能在EDS中显示分布和含量。
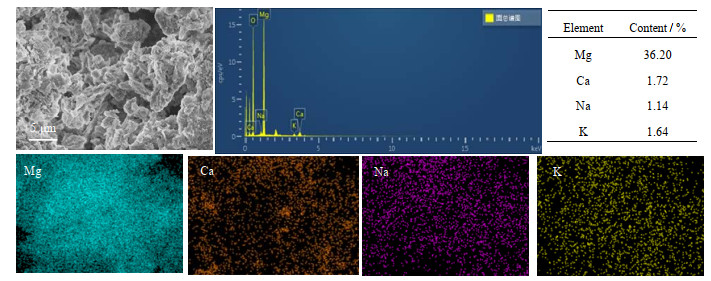
|
图 7 jCa-2的EDS以及元素含量图 Fig.7 EDS images and element contents of the jCa-2 adsorbent |
图 8表示不同CaCO3含量的吸附剂孔径分布图。可以看出,jCa-1、jCa-2和jCa-3三个样品的孔径分布基本相同,但是jCa-2和jCa-3改性吸附剂的孔体积比jCa-1改性吸附剂的大,故有利于CO2的扩散,并可以提高CO2的吸附速率;而jCa-1改性吸附剂在0 ~10 nm的孔数量较少,所以CO2扩散较慢,导致其诱导期(从通入CO2气体开始到发生反应的时间段)较长。表 1为不同CaCO3含量吸附剂的比表面积值。由表可知,CaCO3含量对吸附剂的比表面积影响不大。
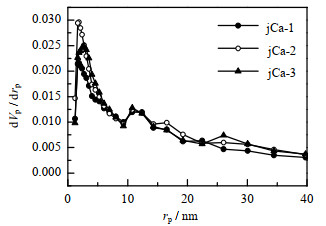
|
图 8 不同CaCO3含量的吸附剂的孔径分布图 Fig.8 Pore size distribution of adsorbents with different CaCO3 contents |
|
|
表 1 不同碳酸钙含量吸附剂的比表面积 Table 1 Specific surface areas of adsorbents with different CaCO3 contents |
添加CaCO3改性的吸附剂,其吸附容量随CaCO3含量的变化而变化,如图 9所示。由图可见,当CaCO3的质量分数为10% (jCa-3)和5%(jCa-2)时,改性后的吸附剂的吸附容量均得到一定程度的提高,吸附曲线与未改性的吸附剂相似,即它们的诱导期和快速吸附段的时间均相近。但是,当CaCO3的质量分数过高(20%,jCa-4)或者过低(3%,jCa-1)时,60 min时吸附剂的吸附容量均比未添加CaCO3改性时的吸附剂的吸附容量低。这是因为,CaCO3含量过高(20%,jCa-4)时,吸附剂的活性组分含量减少,吸附剂的快速吸附段时间较短,导致吸附剂的表观吸附容量降低;而CaCO3含量过低(3%,jCa-1)时,改性吸附剂的诱导期较长,约10 min后才进入快速吸附段,60 min内未达到其饱和吸附容量。由此可知,吸附剂的吸附容量与CaCO3含量的关系不是单纯的递增或者递减的关系。
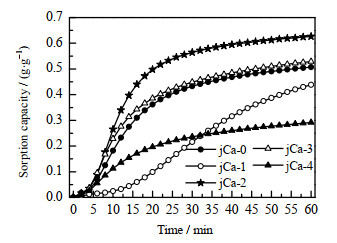
|
图 9 不同CaCO3含量的吸附剂的吸附容量曲线图 Fig.9 Adsorption capacity curves of adsorbents with different CaCO3 contents |
对图 9的吸附容量~时间曲线进行微分,得到不同CaCO3含量的吸附剂的吸附速率曲线图,如图 10所示。由图可见,jCa-4改性吸附剂吸附速率较慢,且快速吸附段时间较短,导致其吸附容量是最低的;jCa-1改性吸附剂诱导期较长,前期吸附速率较低,10 min后才进入快速吸附段,快速吸附段的时间跨度虽然较长,但吸附速率也较低,所以导致其吸附容量较低。结合图 6分析可知,主要是由于jCa-1改性吸附剂平均孔径和孔体积较小,CO2扩散速率较慢,导致其吸附速率较低。jCa-2和jCa-3改性吸附剂与jCa-0未改性吸附剂的快速吸附段时间相近,但两者由于其孔体积较大,导致其在快速吸附段的吸附速率较快,所以其吸附容量也相对较高。
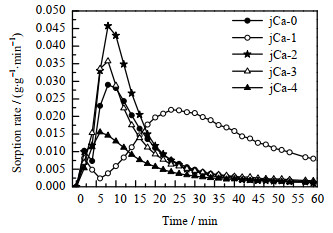
|
图 10 不同CaCO3含量的吸附剂的吸附速率曲线图 Fig.10 Adsorption rate curves of adsorbents with different CaCO3 contents |
不同CaCO3含量的吸附剂的循环稳定性如图 11所示,循环测试条件见2.4节。由图可见,添加CaCO3后改性的吸附剂在20次循环测试内的吸附容量衰减较小,说明CaCO3的添加有利于提高吸附剂的循环稳定性。但由于CaCO3是惰性组分添加剂,所以CaCO3的质量分数过高(20%,jCa-4)时,吸附剂的稳定性虽然较好,但会减少吸附剂中活性组分的含量,导致其吸附容量降低。当CaCO3的质量分数为3 % ~10 % (jCa-1、jCa-2、jCa-3)时,吸附剂的初次吸附容量和20次循环后的吸附容量均较高,说明CaCO3的添加能提高吸附剂的循环稳定性。通过对比可以发现,CaCO3的含量有一最佳值,图 11表明,当CaCO3的质量分数为5%时制备的吸附剂吸附性能最好,初次吸附容量为0.63 g·g -1,20次循环后吸附容量降为0.50 g·g -1。在相同的测试条件下,稳定性优于文献[16]中制备的吸附剂。
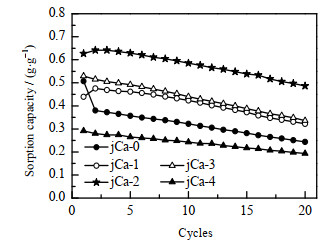
|
图 11 不同CaCO3含量的吸附剂的循环吸附容量 Fig.11 Cyclic adsorption capacity of adsorbents with different CaCO3 contents |
通过比较两种不同前驱体制备的MgO基吸附剂发现,碱式碳酸镁制备的MgO颗粒较小,吸附性能较好。采用塔曼温度高、呈碱性的CaCO3作为惰性添加剂,可以在一定程度上限制碱金属盐的高温下流动,进而提高吸附剂的循环稳定性。采用40% CO2气氛作为吸附气体、吸附温度为350 ℃、脱附温度为400 ℃,当CaCO3的质量分数为5%时,吸附剂的初次吸附容量可达到0.63 g·g -1,20次循环后吸附容量为0.50 g·g -1,体现了较好的循环稳定性。
符号说明:
|
|
| [1] |
中国电力企业联合会报告[R].北京: 中国电力企业联合会, 2006. China Electricity Council Association Report[R]. Beijing: China Electricity Council, 2006. |
| [2] |
吕璐, 李宁, 米铁, 等. 烟道气二氧化碳吸附技术的研究进展[J]. 工业安全环保, 2012, 38(12): 16-18. LV L, LI N, MI T, et al. Research progress of flue gas carbon dioxide adsorption technology[J]. Industrial Safety and Environmental Protection, 2012, 38(12): 16-18. |
| [3] |
张曦, 金红光, 高林.燃烧前捕集CO2的IGCC发电系统集成与示范研究[D].合肥: 中国科学院工程热物理研究所, 2011. ZHANG X, JIN H G, GAO L. Integration and demonstration of IGCC power generation system for CO2 capture before combustion[D]. Hefei: Institute of Engineering Thermophysics, Chinese Academy of Sciences, 2011. http://cdmd.cnki.com.cn/Article/CDMD-80135-1011153952.htm |
| [4] |
XIAO G, RANJEET S, ALAN C, et al. Advanced adsorbents based on MgO and K2CO3 for capture of CO2 at elevated temperatures[J]. International Journal of Greenhouse Gas Control, 2011, 5(4): 634-639. |
| [5] |
WANG S P, YAN S L, MA X B, et al. Recent advances in capture of carbon dioxide using alkali-metal-based oxides[J]. Energy & Environmental Science, 2011, 4(10): 3805-3819. |
| [6] |
FANG N G, FENG W, JIA Y Y, et al. Fabrication of hierarchical channel wall in AI-MCM-41 mesoporous materials to enhance their adsorptive capability:why and how?[J]. Journal of Physical Chemistry C, 2010, 114(18): 8431-8439. |
| [7] |
SEUNG J H, YONGJU B, HYUK J K, et al. Elevated temperature CO2 capture on nano-structured MgO-Al2O3 aerogel:Effect of Mg/Al molar ratio[J]. Chemical Engineering Journal, 2014, 242(15): 357-363. |
| [8] |
AAMIR H, SOUMEN D, ANSHU N. Facile synthesis of high-surface-area mesoporous MgO with excellent high-temperature CO2 adsorption potential[J]. Industrial & Engineering Chemistry Research, 2016, 55(29): 8070-8078. |
| [9] |
杨丽霞, 刘丹, 刘道胜, 等. TiO2改性的镁基中温吸附剂及其CO2吸附性能的研究[J]. 燃料化学学报, 2015, 43(12): 1498-1503. YANG L X, LIU D, LIU D S, et al. Study on TiO2-modified magnesium-based medium temperature adsorbent and its CO2 adsorption performance[J]. Journal of Fuel Chemistry and Technology, 2015, 43(12): 1498-1503. |
| [10] |
STEVEN G M, SCOTT J W, THOMAS R G, et al. Carbon dioxide adsorbents containing magnesium oxide suitable for use at high temperatures. US, 6280503B1[P]. 2001-08-28.
|
| [11] |
QIAO Y Q, WANG J Y, ZHANG Y, et al. Alkali nitrates molten salt modified commercial MgO for intermediate-temperature CO2 capture:optimization of the Li/Na/K ratio[J]. Industrial & Engineering Chemistry Research, 2017, 56(6): 1509-1517. |
| [12] |
HYEONHO J, SUNG J C, KYUNGSU N. Control of CO2 absorption capacity and kinetics by MgO-based dry sorbents promoted with carbonate and nitrate salts[J]. Journal of CO2 Utilization, 2017, 19(3): 194-201. |
| [13] |
TAKUYA H, T. ALAN H. Colloidal nanoclusters of MgO coated with alkali metal nitrates/nitrites for rapid, highcapacity CO2 capture at moderate temperature[J]. Chemistry of Materials, 2015, 27(23): 8153-8161. |
| [14] |
TAKUYA H, FRITZ S, ESAM Z. H, et al. Alkali metal nitrate-promoted high-capacity MgO adsorbents for regenerable CO2 capture at moderate temperatures[J]. Chemistry of Materials, 2015, 27(6): 1943-1949. |
| [15] |
ANH T V, KEON H, SEONGMIN J, et al. Double sodium salt-promoted mesoporous MgO sorbent with high CO2 sorption capacity at intermediate temperatures under dry and wet conditions[J]. Chemical Engineering Journal, 2016, 291(3): 161-173. |
| [16] |
王磊.碱金属盐修饰MgO基CO2吸附剂的制备及其结构-性能关系的研究[D].上海: 华东理工大学, 2017. WANG L. Preparation and structure-property relationship of alkali metal salt modified MgO-based CO2 adsorbent[D]. Shanghai: East China University of Science and Technology, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10251-1017151578.htm |




