通常,组织工程化构建体需要多孔支架材料以适应细胞生长、分化和基质分泌,从而构建组织和器官的三维构型。支架应用于组织工程必须解决生物、机械和架构以促进功能性组织的再生。而3D打印可以利用适宜的生物相容性材料,合理设计和精确控制三维多孔支架内部微结构,通过层层堆积的方式制备出互相连通且孔径尺寸和孔形貌可调的孔结构,使得支架材料满足一定的架构和力学性能,为组织工程支架材料的制备提供了先进的方法和手段[1]。
生物支架材料制备是组织工程的重要环节。一般来讲,支架材料的化学性质和物理特性,包括亲水性[2, 3]、表面电荷[4, 5]、表面显微结构[6]、自由能[7]以及特殊的表面化学基团[8]以及力学性能和拓扑结构,都能够对细胞的黏附、增殖、迁移、分化、基质合成和组织形成有着显著影响。近年来,研究者对组织工程支架内部结构,特别是支架的孔隙率、孔连通性和孔径结构,对细胞行为和组织形成的影响开展了一系列的研究探索[9]。研究发现,孔径对细胞的黏附、分化、迁移及新组织的形成起到很重要的作用[10, 11]。比如,300~500 μm的孔径结构适用于骨和软骨组织构建[12];Oh和Lien等都发现250~500 μm孔径支架促进软骨细胞的生长增殖和软骨特征基质的分泌,而孔径小于100 μm对于成软骨分化是不利的,可能是因为小孔径内细胞通常会发生去分化现象[13, 14];Domingos等研究发现孔径在250~450 μm时人MSCs细胞表现出更好的活性[15]。
3D打印的三维多孔支架可以通过控制孔径结构和孔隙率模拟组织微环境进而对细胞行为起到调控作用。Woodfield等利用3D打印技术制备孔径梯度变化的多孔支架以模拟天然关节软骨组织,促进了细胞在支架内部的非均相分布,长期体外培养后,软骨特征基质包括糖胺聚糖(GAG)和Ⅱ型胶原(COL Ⅱ)同样在梯度支架内部有着非均相分布,为关节软骨组织的体外构建研究提供了新思路[16];Moroni等也通过3D打印构建了孔径梯度变化的多孔支架,发现孔径梯度有助于提高人MSCs的特异性分化[17, 18]。
聚己内酯(Poly(ε-caprolactone),PCL)由于其优异的生物相容性和可降解性,被广泛报道基于3D打印制备的组织工程支架[19~22]。因此,本文拟利用3D打印技术打印PCL材料,通过对打印参数的设计,使之成型为具有孔结构和尺寸梯度变化的多孔支架。根据本文设计,支架由三部分组成,通过在打印过程中由上而下控制纤维间距和角度的变化实现孔结构梯度的变化,将为构建具有天然软骨组织“带状”结构支架材料奠定基础。
2 材料和方法 2.1 实验材料实验主要材料:PCL树脂粒子(Mn = 45 kDa;Sigma-Aldrich);牛关节软骨细胞(bAC)。
实验主要仪器:3D-BioPlotter和0.2 mm高温打印针头(EnvisionTec GmbH, Germany);力学测试仪器(HY-0580万能材料试验机);μ-CT(μ-CT 80,SCANCO);扫描电镜(SEM,S-3400/4800,Hi-tachi)。
2.2 实验方法 2.2.1 孔径梯度支架的设计及制备基于Solid Works三维绘图软件,对所需打印的支架结构进行设计。通过对纤维直径尺寸、同层内纤维间距以及相邻层纤维间的夹角等参数的设置,可以调控支架内部的孔结构,主要体现在孔的形态和尺寸大小。“方形”支架是组织工程中常见的支架结构,具有各相均一的方形孔结构(指孔结构投影形态为方形,相邻层间纤维夹角等于90°);本实验所设计的“菱形”支架(菱形孔结构,指孔结构投影形态为菱形,相邻层间纤维夹角小于90°)。
孔径梯度支架的制备:3D打印制备应用德国BioPlotter打印系统,是由电脑控制系统器、高温控制器、喷头控制器、样品台和高压氮气系统组成,可以实现压力、温度和方向等的精确调控。具体的打印过程和参数如下:
设置所需的打印参数:温度120℃,压力4 bar,打印规格10 mm×10 mm×0.16 mm,针头移动速率0.5 mm×s-1,打印两层之间停顿时间0.1 s,打印前对高温腔内的PCL颗粒于120℃预加热处理20 min以保证其充分熔融。打印针头的运行轨迹参数:0°-30°-60°-90°-120°-150°以获得相邻两层之间的纤维夹角为30°的逐层变化,同时维持每一层内部纤维间距为450 μm,共打印六层结构,组成支架结构的第一部分;0°-45°-90°-135°-180°-225°以获得相邻两层之间的纤维夹角为45°的逐层变化,同时维持每一层内部纤维间距为400 μm,共打印六层结构,组成支架结构的第二部分;0°-60°-120°-180°-240°-300°以获得相邻两层之间的纤维夹角为60°的逐层变化,同时维持每一层内部纤维间距为300 μm,共打印六层结构,组成支架结构的第三部分。通过这样的设计,可以获得具有三部分孔结构梯度变化的总计18层纤维堆积的支架结构,其大体三维尺寸为10 mm×10 mm×3 mm。与此同时,按照上述每一部分的设计参数(纤维夹角和纤维间距)分别打印18层纤维堆积的支架结构,获得3组内部结构均一的支架材料,作为实验对照组。
2.2.2 细胞培养及接种将细胞从牛关节软骨组织分离后,进行传代培养,待P1代bAC汇合率达80%~90%后,胰酶消化收获细胞,并以2×105 cells/50 μL/scaffold的接种密度正反面接种到预先置于24孔板中的支架上(25 μL细胞悬液接一面,静止20 min后对另一面进行接种),支架接种后转移到37℃,5% CO2的培养箱中进行1 h的预黏附,然后在每个孔中缓慢加入1 mL新鲜培养基进行培养。接种12 h在细胞完全黏附后,将支架转移至新的24孔板,培养基每3天更换一次。
2.2.3 力学性能测试将打印好的支架材料放于24孔细胞培养板中,用PBS浸泡处理过夜,然后去除PBS并于通风橱中自然晾干。每组设置3个平行样,用生物材料力学试验机对样品进行力学性能测试。测试时,选用20kN的传感器,测试速度1 mm·min-1,测得室温下形变90%时的数据,并取20%和40%两点做拟合直线,直线斜率即为得到的压缩模量,按式(1)计算。
| $ E = \frac{\sigma }{\varepsilon }\begin{array}{*{20}{c}} {}&{} \end{array}\sigma = \frac{F}{{\rm A}}\begin{array}{*{20}{c}} {}&{} \end{array}\varepsilon = \frac{{{L_0} - L}}{{{L_0}}}\begin{array}{*{20}{c}} {}&{} \end{array}{\rm A} = w \cdot d $ | (1) |
式中,E:弹性模量,MPa;σ:应力,MPa;ε:应变,%;F:力(测试可得),N;A:样品横截面积,cm2;w:样品宽度,cm;d:样品厚度,cm;L0:样品测试前长度,cm;L:样品测试后长度,cm。
2.2.4 μ-CT分析将支架材料用双面胶固定于扫描腔中,然后把扫描腔放入μ-CT仪器X射线腔中,在45 kV电压、170 μA电流和8 W的功率下进行扫描分析,分辨率设为5 μm,采集500个投影。所有投影用μ-CT 80系统软件对所获得扫描图片重建3D图像,设定适宜的阈值以使得孔和纤维材料区分开,计算支架的体积和纤维材料所覆盖的体积,按式(2)计算支架孔隙率。
| $ {\rm{Porosity}} = 1 - \frac{{{V_{{\rm{solid}}}}}}{{{V_{{\rm{total}}}}}} \times 100\% $ | (2) |
式中,Vsolid为扫描层中支架覆盖部分体积,mm3;Vtotal为整个扫描层的体积,mm3。
2.2.5 SEM观察及参数统计将支架材料放于平皿中,用锋利的手术刀将支架按照3D打印堆积的水平方向切割成均分的三部分,接着分别用导电胶将其粘在金属底座上,并喷金处理2 min,最后在SEM下观察支架材料三部分的微观形貌。用Image J软件对SEM图片进行图像分析,测量支架内纤维尺寸、纤维间距、层高和孔尺寸。对接种细胞后的3D打印PCL支架进行SEM观察,方法如下:将接种细胞的支架材料经21天培养后从孔板取出,PBS润洗2次,然后用锋利的手术刀将支架同样沿打印堆积的方向切割为均分的三部分,PBS润洗1次,接着置于2.5%(w/v)戊二醛溶液中4℃固定过夜;将固定好的支架材料用PBS润洗3次,之后用乙醇溶液梯度脱水(浓度分别为:50%,75%,90%,95%,100%×2,每次10 min)。最后将脱水处理后的支架材料置于通风橱中自然晾干,待干燥后,将支架材料用导电胶粘于金属底座上,并进行喷金处理2 min,然后在SEM下进行拍照观察。
2.2.6 CCK8检测本实验运用CCK8检测表征细胞在支架上的增殖情况。首先,吸除培养基,PBS润洗1次接种有细胞的支架材料,每孔加入500 μL CCK8试剂与培养基的混合液(CCK8:培养基= 1:10),接着将孔板置于37℃,5% CO2的培养箱中反应3 h,最后于超净工作台中吸取每孔200 μL反应液置于96孔细胞培养板中,并用酶标仪于450 nm检测波长和630 nm参比波长下测其吸光度。设置不接种细胞的支架材料作为空白对照。
2.2.7 死活染色采用Live/Dead染色方法对细胞进行死活分析。将接种细胞的支架材料经培养后从24孔细胞培养板中取出,并用PBS润洗2次,然后用锋利的手术刀将支架材料沿打印堆积的方向切割为均分的三部分,PBS再润洗1次,再分别置于24孔培养板中,每部分的样品加300 μL荧光染液(2 μL CAM和2 μL PI/1 mL PBS)。最后将样品放于37℃,5% CO2的培养箱中孵育30 min,孵育结束后用PBS润洗3次,并在激光共聚焦显微镜下观察、拍照。
2.3 统计学分析实验中数据以“平均值±标准偏差”形式表示。如无特殊说明每组实验均设置3个平行样。数据分析中采用T-test,且当P < 0.05时认为统计学上有显著性差异。
3 结果 3.1 支架的设计不同于图 1A的方形支架,图 1B为本文设计和研究的菱形支架。对图 1B所示意的具有孔结构梯度分布的支架的每一区域结构放大,如图 1B1、B2和B3分别示意。除孔结构梯度分布的支架(命名为E)外,还根据孔结构梯度分布的支架中的每一部分的设计参数(纤维夹角和纤维间距)打印了具有均相结构的18层纤维堆积的三组支架材料(具体参数分别为30°-450 μm、45°-400 μm和60°-300 μm,并分别命名为C1、C2和C3),作为实验对照组。图 1C所示意的是对支架内部结构的特征参数的定义,包括纤维间距(FG)、纤维尺寸(RW)和层高(LG)等。本文以E:梯度支架:30°-450μm+45°-400μm+60°-300μm;30°-450 μm、45°-400 μm、60°-300 μm为其三部分;C1-C3:均相支架:C1:30°-450 μm;C2:45°-400 μm;C3:60°-300 μm分别代替。

|
图 1 应用SolidWorks软件设计支架 Fig.1 Scaffold design using solidworks software (A: square homogeneous scaffold; B: rhombus gradient scaffold, B1: 30°; B2: 45°; B3: 60°; C: parameter definition, FG: fiber gap; RW: road width; LG: layer gap.) |
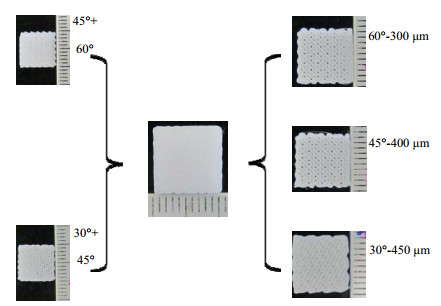
图 2中央为3D打印的孔结构梯度分布的支架,由18层纤维堆积而成,其整体外形为尺寸为10 mm×10 mm×3 mm的方形柱体。图 2中左右两侧的图片分别为梯度支架内部结构的分解图,右边是其三部分的分解图,而左边是支架内部三部分相邻交界的部位。可以看出,支架外貌和内部结构均比较规整,未见明显缺陷。
|
图 2 3D打印支架的大体形貌 Fig.2 Morphology of the 3D printed scaffolds |
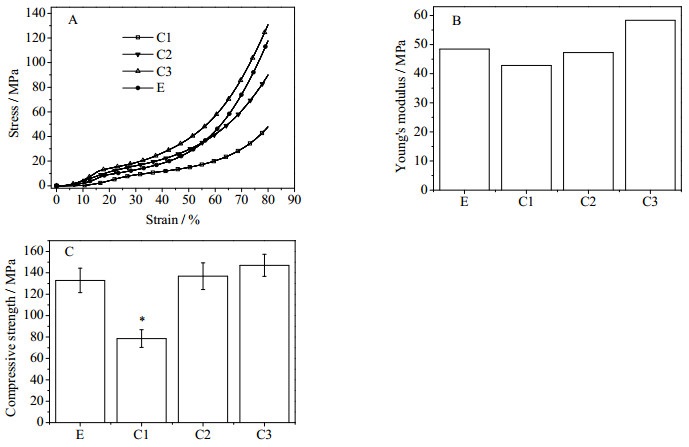
由图 3A可以看到,所有支架的应变-应力曲线均呈现相似的趋势,在20%和50%的形变处,都出现应力的拐点。对比四组材料,可以发现三组对照支架材料在相同的形变条件下,应力大小的顺序是C3 > C2 > C1,而支架E接近于C2。进一步,基于应变-应力曲线,计算杨氏模量和压缩强度,结果分别如图 3B和3C所示。可以看到,杨氏模量和压缩强度在四组支架材料之间的趋势分别为C3 > E > C2 > C1和C3 > C2 > E > C1。这可能与支架内部纤维的堆积密度有关,所设计的支架内部的纤维间距的顺序是C3 < C2 < C1,而E内部则将纤维间距平均化,从而更接近C2。这说明孔结构对于支架材料的力学性能有显著的影响,而综合了三种孔结构的支架E则能够平均其力学特征,并暗示了可以通过调节非均相支架内部的三部分比例来调节最终支架的整体力学性能。此外,所有支架材料的杨氏模量均处于40~60 MPa,这样的力学强度与天然软骨组织接近,从而能够适应软骨组织力学环境对工程化组织的力学性能要求。
|
图 3 支架的力学性能 Fig.3 Mechanical properties of the scaffolds |
通过SEM可以观察支架内部结构和纤维表面微结构。利用μ-CT扫描方法可以通过层层扫描的方式对整个支架纵向的一部分进行扫描,获得支架二维图像,然后利用软件将二维图像进行三维重建,获得立体的内部结构特征。
如图 4所示,从图A、BSEM图可以观察到支架内部具有良好的孔连通性。当放大到80倍聚焦到单个孔结构上观察时,可以更好地观察到所形成的每个菱形孔,它在平面上投影为菱形,而其立体结构是不规则的,由相邻两层中邻近的4根纤维围绕形成的三维空间结构,并且纤维表面存在均匀分布的微孔凹陷结构。从图C二维图像(上)可以看出,无论是梯度支架还是均一对照支架,均具有规整的孔结构和较好的孔隙率,并且可以清楚看到梯度支架有着非均一的孔,而均一支架具有均一的孔结构,但孔结构在不同的对照组之间因纤维间距和纤维夹角的变化而不同,证实了在梯度支架内部的确呈现出孔结构的区域变化。进一步,在重建的三维图片(下)里,可以更为直观地反映支架的内部结构。可以看出,梯度支架和对照支架的孔结构贯穿整个支架,并且孔孔相连,进一步证实整个支架具有良好的孔连通性。由μ-CT分析结果(表 1)可以看出,梯度支架比均一支架单位体积可利用表面积略高,孔隙率均在51%~57%,并且梯度支架的孔隙率相对均一支架略高。

|
图 4 支架结构特性 Fig.4 Structure properties of the scaffolds |
|
|
表 1 支架的数据分析 Table 1 Physical properties of the scaffolds |
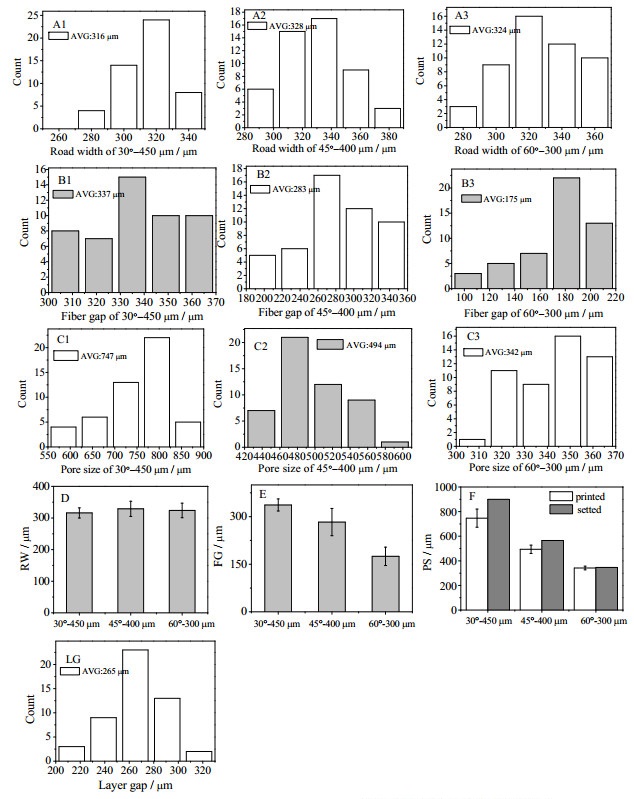
基于对支架材料表面和内部断面的SEM图片,利用Origin软件对支架材料内部纤维尺寸(RW)、纤维间距(FG)和层高(LG)进行定量测定。如图 5 A1-A3和D所示,梯度支架三部分纤维平均尺寸分别为(316±16) μm、(329±24) μm和(324±23) μm;B1-B3和E反映梯度支架三部分的纤维间距分别为(337±19) μm、(283±43) μm和(175±29) μm;纤维层高(LG) (265±23) μm;C1-C3和F反映梯度支架三部分的孔尺寸(PS)分别为(747±74) μm、(494±37) μm和(342±15) μm。可以看出,通过改变层内纤维间距和相邻层纤维夹角,可以达到改变孔尺寸大小的目的,梯度支架内部三区域中孔尺寸在342~747 μm的范围变化。进一步,根据所统计尺寸对孔体积按照式(3)进行计算,并将孔做与等体积球体换算,获得对应球体的直径尺寸,结果如表 2所示。可以看到,梯度支架孔结构尺寸相当于等价球体直径在150~250 μm变化。
| $ V = \frac{{{\rm{F}}{{\rm{G}}^2}}}{{\sin \alpha }} \times {\rm{LG}} $ | (3) |
|
图 5 孔结构梯度分布的支架结构参数 Fig.5 Structural parameters of the scaffolds with gradient pore structures (A-C: frequency histograms; A1-A3: RW; B1-B3: FG; C1-C3: pore size; D-F: printing parameters compare to setting parameters; PS: pore size; LG: layer spacing frequency histogram) |
|
|
表 2 设定支架与打印支架的孔体积对比及等值球体积换算 Table 2 Pore volume comparison between designed and printed scaffolds and results of converted equivalent ball volume |
梯度支架接种细胞并经培养21 d后,利用SEM进行观察分析支架材料上细胞形态及分布。由图 6可知,支架的三个部分均覆盖一层薄的细胞和胞外基质,并且细胞在孔结构处和纤维之间形成“桥接”现象。细胞与基质在支架三部分中形成局部网络结构,细胞与细胞,细胞与支架之间都形成生理性连接。

|
图 6 SEM观察bAC在支架上的生长情况 Fig.6 SEM micrographs of bAC growth on scaffolds |
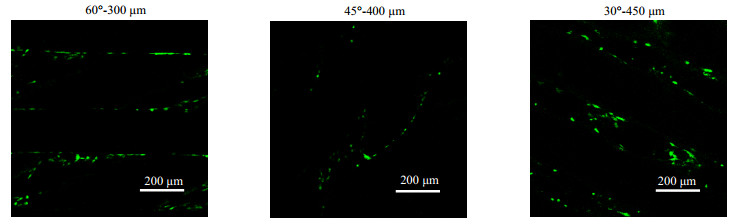
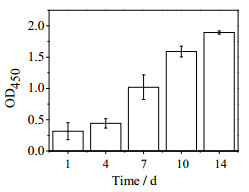
细胞增殖用CCK8检测方法进行评价,活性分析利用死活染色方法(活细胞为绿色荧光,死细胞为红色荧光)进行评价。由图 7,对培养14 d时细胞活性的观察可知,支架表面包裹着绿色荧光的活细胞,整个支架上基本无红色着色的死细胞出现,细胞依然维持有良好的活性。由图 8可知,在培养的14 d内,整个支架上细胞具有很好的增殖能力,到第14 d具有6倍增殖。
|
图 7 bAC在支架上的活性分析 Fig.7 Activity analysis results of bAC on scaffolds |
|
图 8 bAC在支架上的增殖 Fig.8 Proliferation of bAC on scaffolds |
近年来,3D打印技术的兴起加速了组织工程领域的蓬勃发展。3D打印让组织工程支架制备过程精确可控,使得通过理性设计制备支架应用于细胞培养和组织构建成为现实。通过3D打印,精确制备的支架结构特征,研究者已经开展了一系列研究工作,比如探索支架结构特征对MSCs生物学行为包括增殖和定向分化的影响,以及改善支架的力学性能、提高细胞的接种效率和空间分布等[1, 23]。关节软骨具有内在的“带状”分布的结构和组成,因此借助3D打印来设计和制备软骨组织工程支架必定会进一步优化软骨组织构建[18]。
支架材料的力学特性非常重要,不仅需要能够为细胞生长提供足够的物理支撑,而且在移植后必须承受周围组织的应力,特别是关节软骨[24]。本研究所制备支架的杨氏模量和压缩强度,分别在40~60 MPa和70~150 MPa变化,说明支架材料的力学性能随着打印参数的变化而变化,这也为通过设计打印参数调节支架力学性能提供了指导原则。重要的是,所设计制备的梯度支架材料的力学强度表现出对三层区域结构支架的平均化。天然关节软骨的杨氏模量在20 MPa左右,可承受几百MPa的压缩强度[25]。因此,所制备的梯度支架具有与天然软骨组织相匹配的力学性能,将来可用于体内移植进行软骨缺损修复。
支架的微观结构对于细胞行为有着关键的影响[26]。本研究中通过μ-CT和SEM对支架材料的内部结构进行了表征,发现所有支架均由形态规整、平行排列的纤维结构层层堆积而成。特别是,在梯度支架内部,存在区域分布的孔结构,而对应于三个区域的对照组支架为均一的结构,这说明通过设计打印过程参数可以精确控制支架内部结构。通过纤维堆积形成的多孔结构使得支架材料具有较高的可利用表面积,为细胞生长提供充分的空间,而且孔孔相连,良好的孔连通性将有利于营养和氧气等物质交换和细胞代谢扩散,是保证生物活性组织形成的关键要素。所有支架的孔隙率在51%~57%,符合文献报道的3D打印制备的PCL支架孔隙率(35%~75%)[27, 28]。
基于Image J对支架内部孔结构的数值分析,本研究还对支架内部相邻纤维所围成的空间孔结构的体积进行了估算。对于梯度支架内部的三部分而言,30°-450 μm、45°-400 μm和60°-300 μm,所对应的孔结构的空间体积逐渐减小,分别为0.067、0.037和0.016 mm3;对应三部分的孔径尺寸分别为(747±74) μm、(494±37) μm和(342±15) μm,而(340~750) μm梯度的孔径尺寸被认为适合软骨细胞表型的维持[13, 14]。
基于CCK8检测结果可知,在为期14 d的培养过程中,bAC在支架上表现出持续增殖的趋势,并且培养至第14 d时细胞活性依然良好。说明本文制备的梯度支架具有良好的生物相容性并能较好的支持细胞的生长和增殖。另外,基于细胞在支架上的SEM图片,表明bAC在梯度支架上的铺展和形态在三部分之间有所差异,细胞数量和细胞活性也呈现一定的梯度分布。基于此,我们可认为梯度支架具有指导细胞生物学行为的调控作用,对于组织工程尤其是软骨组织工程的支架材料构建具有指导意义。
5 结论综上所述,本研究利用3D打印技术制备了具有孔结构梯度分布的PCL多孔支架,具备与天然软骨组织相匹配的力学性能,内部孔结构特征具有342~747 μm的孔径梯度分布和51%~57%的孔隙率,对bAC的黏附、铺展和增殖提供了良好的3D微环境和结构支撑。其可作为软骨组织工程支架材料,为探讨构建“带状”软骨组织的可行性奠定了基础。
| [1] | Moroni L, Di L A, Lorenzo-Moldere I, et al. Tuning cell differentiation into a 3D scaffold presenting a pore shape gradient for osteochondral regeneration[J]. Advanced Healthcare Materials , 2016, 5(14): 1753-1763. DOI:10.1002/adhm.201600083. |
| [2] | Rebl H, Finke B, Schmidt J, et al. Accelerated cell-surface interlocking on plasma polymer-modified porousceramics[J]. Materials Science and Engineering:C , 2016, 69(1): 1116-1124. |
| [3] | Khang G, Lee S J, Lee Y M, et al. The effect of fluid sheer stress on endothelial cell adhesiveness to modified polyurethane surfaces[J]. Polymer-Korea , 2000, 8(4): 179-185. |
| [4] | Gandavarapu N R, Mariner P D, Schwatz M P, et al. Extracellular matrix protein dsorption to phosphate-functionalized gels from serum promotes steogenic differentiation of human mesenchymal stem cells[J]. Acta Biomaterialia , 2013, 9(1): 4525-4534. DOI:10.1016/j.actbio.2012.09.007. |
| [5] | Guo L K, Kawazue N T, Schwarta M P, et al. Osteogenic differentiation of human mesenchymal stem cells on chargeable polymer-modified surfaces[J]. Journal of Biomedical Materials Research Part A , 2008, 87(4): 903-912. |
| [6] | Ming-Tzu T, Chang Y Y, Huang H L, et al. Biological characteristics of human fetal skin fibroblasts and MG-63 human osteosarcoma cells on tantalum-doped carbon films[J]. Surface and Coatings Technology , 2014, 245: 16-21. DOI:10.1016/j.surfcoat.2014.02.025. |
| [7] | Snyder K L, Holmes H R, Mccarthy C, et al. Bioactive vapor deposited calcium-phosphate silica sol-gel particles for directing osteoblast behavior[J]. Journal of Biomedical Materials Research Part A , 2016, 104(9): 2135-2148. DOI:10.1002/jbm.a.v104.9. |
| [8] | Park J S, Chu J S, Tsou A D, et al. The effect of matrix stiffness on the differentiation of mesenchymal stem cells in response to TGF-β[J]. Biomaterials , 2011, 32(16): 3921-3930. DOI:10.1016/j.biomaterials.2011.02.019. |
| [9] | GAO Y X, Mori T, Manning S, et al. Biocompatible 3D liquid crystal elastomer cell scaffolds and foams with primary and secondary porous architecture[J]. American Chemical Society Macro Letters , 2016, 5(1): 4-9. DOI:10.1021/acsmacrolett.5b00729. |
| [10] | Bártolo P J, Almeida N A, Rezende R A, et al. Advanced processes to fabricate scaffolds for tissue engineering[M].Virtual Prototyping & Bio Manufacturing in Medical Applications, Boston: Springer, MA, 2008: 149-170. |
| [11] | Leong K F, Chua C K, Sudarmadji N, et al. Engineering functionally graded tissue engineering scaffolds[J]. Journal of the Mechanical Behavior of Biomedical Materials , 2008, 1(2): 140-152. DOI:10.1016/j.jmbbm.2007.11.002. |
| [12] | Hutmacher D W. Scaffolds in tissue engineering bone and cartilage[J]. Biomaterials , 2000, 21(24): 2529-2543. DOI:10.1016/S0142-9612(00)00121-6. |
| [13] | Oh S H, Park I K, Kin J M, et al. In vitro and in vivo characteristics of PCL scaffolds with pore size gradient fabricated by a centrifugation method[J]. Biomaterials , 2007, 28(9): 1664-1671. DOI:10.1016/j.biomaterials.2006.11.024. |
| [14] | Lien S M, Ko L Y, Huang T J. Effect of pore size on ECM secretion and cell growth in gelatin scaffold for articular cartilage tissue engineering[J]. Acta Biomaterialia , 2009, 5(2): 670-679. DOI:10.1016/j.actbio.2008.09.020. |
| [15] | Domingos M, Intranuovo F, Russo T, et al. The first systematic analysis of 3D rapid prototyped poly(ε-caprolactone) scaffolds manufactured through BioCellprinting:the effect of pore size and geometry on compressive mechanical behaviour and in vitro hMSC viability[J]. Biofabrication , 2013, 5(4): 1758-1771. |
| [16] | Woodfield T B, Van Blitterswijh C A, De W J, et al. Polymer scaffolds fabricated with pore-size gradients as a model for studying the zonal organization within tissue-engineered cartilage constructs[J]. Tissue Engineering , 2005, 11(9-10): 1297-1311. DOI:10.1089/ten.2005.11.1297. |
| [17] | Moroni L, Di L A, Ostrowska B, et al. Gradients in pore size enhance the osteogenic differentiation of human mesenchymal stromal cells in three-dimensional scaffolds[J]. Scientific Reports , 2016, 6: 22898. DOI:10.1038/srep22898. |
| [18] | Moroni L, Di L A, Szlazak K, et al. Influencing chondrogenic differentiation of human mesenchymal stromal cells in scaffolds displaying a structural gradient in pore size[J]. Acta Biomaterialia , 2016, 36: 210-219. DOI:10.1016/j.actbio.2016.03.014. |
| [19] | Domingos M, Dinucci D, Coneta S, et al. Polycaprolactone scaffolds fabricated via bioextrusion for tissue engineering applications[J]. International Journal of Biomaterials , 2009, 2009: 1-9. |
| [20] | Park S A, Lee S H, Kim W D, et al. Fabrication of porous polycaprolactone/hydroxyapatite (PCL/HA) blend scaffolds using a 3D plotting system for bone tissue engineering[J]. Bioprocess and Biosystems Engineering , 2011, 34(4): 505-513. DOI:10.1007/s00449-010-0499-2. |
| [21] | Agrawal C M, Ray R B. Biodegradable polymeric scaffolds for musculoskeletal tissue engineering[J]. Journal of Biomedical Materials Research , 2001, 55(2): 141-150. DOI:10.1002/(ISSN)1097-4636. |
| [22] | LI W J, Danielson K G, Alexandet P G, et al. Biological response of chondrocytes cultured in three-dimensional nanofibrous poly(epsilon-caprolactone) scaffolds[J]. Journal of Biomedical Materials Research Part A , 2003, 67(4): 1105-1114. |
| [23] | Sobral J M, Caridade S G, Rui A S, et al. Three-dimensional plotted scaffolds with controlled pore size gradients:effect of scaffold geometry on mechanical performance and cell seeding efficiency[J]. Acta Biomaterialia , 2011, 7(3): 1009-1018. DOI:10.1016/j.actbio.2010.11.003. |
| [24] | Armiento A R, Stoddart M J, Alini M, et al. Biomaterials for articular cartilage tissue engineering:learning from biology[J]. Acta Biomaterialia , 2017, 65: 1-20. |
| [25] | Martin R B, Burr D B, Sharkey N A. Skeletal tissue mechanics[M].New York: Springer-Verlag, 1998. |
| [26] | Camarero-Espinosa S, Rpthen-Rutishauser B, Weder C, et al. Directed cell growth in multi-zonal scaffolds for cartilage tissuee ngineering[J]. Biomaterials , 2016, 74: 42-52. DOI:10.1016/j.biomaterials.2015.09.033. |
| [27] | Park S, Kin G, Jeon Y C, et al. 3D polycaprolactone scaffolds with controlled pore structure using a rapid prototyping system[J]. Journal of Materials Science:Materials in Medicine , 2009, 20(1): 229-234. DOI:10.1007/s10856-008-3573-4. |
| [28] | Kim G H, Son J G. 3D polycarprolactone (PCL) scaffold with hierarchical structure fabricated by a piezoelectric transducer (PZT)-assisted bioplotter[J]. Applied Physics A , 2009, 94(4): 781-785. DOI:10.1007/s00339-008-4959-3. |




