2. 中北大学 能源动力工程学院,山西 太原 030051
2. School of Energy and Power Engineering, North University of China, Taiyuan 030051, China
蛋白质组学和基因组学的发展需要在分子水平上深入了解生物体的结构和功能[1-3],包括对蛋白质等生物大分子的检测和鉴定。然而,在其他成分浓度较高的情况下,具有重要生物学功能的低丰度蛋白质是很难检测到的[4]。目前常用的蛋白质专一性检测方法仍然是免疫检测分析法,如酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA),依赖于抗体和抗原之间的特异性识别检测目标分析物,即将已知的抗原或抗体包被于固相支持物上,加入酶标记抗体或抗原与吸附在固相载体上的抗原或抗体特异性结合,通过底物使酶显色来判断免疫发生的程度达到检测的目的[5]。然而依赖于单克隆抗体的酶免疫检测技术,存在抗体制备困难、生产成本高、稳定性差、环境要求苛刻、使用寿命短等问题。因此,建立一个快速、简单、特异、高通量的蛋白质等生物大分子的检测方法已成为分析检测科学的研究热点之一。分子印迹聚合物(molecular imprinted polymers, MIPs)被认为是一种很有前途的抗体替代品,MIPs与目标分子结合的过程类似于抗原和抗体的结合,与生物抗体相比,MIPs具有稳定性好、成本低、开发时间短、生产方便等优点。
2 分子印迹技术 2.1 分子印迹发展历程分子印迹的概念最早是由POLYAKOV等[6]在1931年提出的,是“用一种新的合成方法制备的二氧化硅颗粒,具有不寻常的吸附特性”。这些“不寻常的吸附特性”已经被许多聚合物所展示,这些聚合物被定义为MIPs[7]。20世纪70年代初,WULFF等[8]和KLOTZ等[9]引入了分子印迹的概念,他们提出以有机聚合物作为印迹模板,这为精确设计分子腔开辟了新视野。真正的突破是在1993年,VLATAKIS等[10]在Nature上发表了关于茶碱MIP的研究报道后,分子印迹技术(molecular imprinting technique, MIT)得以广泛关注和发展。
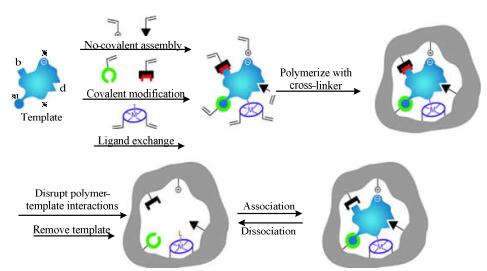
2.2 分子印迹基本原理分子印迹技术基于自然界“钥匙”和“锁”的原理,在特定的环境(溶剂体系)中,模板分子与功能单体发生相互作用形成主客体复合物,在交联剂的作用下功能单体交联聚合并围绕模板分子形成三维网络空间结构,其中模板分子通常是待识别的目标分子。随后模板分子被洗脱,结合位点暴露,三维空间形成印迹孔穴,这些孔穴在结合作用力、官能团、空间形状和大小上与目标分子高度互补。从本质上说,孔穴对模板分子具有“记忆效应”,印迹孔穴可以从复杂的混合物中重新结合目标分子(如图 1所示)。因此,MIPs具有生物抗体的两个最重要的特征——识别和结合特定目标分子的能力。
2.3 分子印迹特点分子印迹技术作为一种仿生分子识别技术,具有显著特点:(1)构象预定性:功能单体与交联剂在模板分子周围聚合形成高交联聚合物,使得官能团的取向被冻结,即使删除模板,这个方向仍然保持不变。因此,印迹孔穴再现了模板分子的大小、形状、空间结构和表面化学性质;(2)识别专一性:模板分子在经过单体、交联剂的共同作用下聚合形成的刚性空腔、功能单体的特定取向以及表面化学的优良匹配性决定了这些孔穴稍后将优先结合模板分子而不是结构类似物,从而达到类似于抗原-抗体的专一性识别作用机制。一般而言,识别位点数量越多,位点的识别性越好;(3)高度稳定性:分子印迹技术所制备的共聚物是化学合成产物,具有优良的环境耐受性、耐高温、耐酸碱和显著地机械性能;(4)高效利用率:可重复使用且寿命长、造价低廉,相比天然生物分子,无需担心失活;(5)广泛实用性:生产分子印迹不需要经过复杂的生物反应过程,可使制备效率大大提高。
分子印迹技术已广泛应用于色谱分离[11]、模拟酶催化[12]、临床药物分析[13]和萃取分离[14]等领域,并且在检测传感技术领域的应用取得了长足进展[15-16]。分子印迹聚合物不仅具有对目标物质的专一识别能力,同时具有生物敏感材料如酶、激素等所缺少的高稳定性的特点,因而分子印迹传感器是生物传感器的理想发展方向之一。
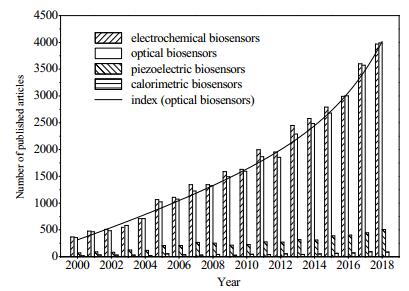
3 分子印迹光学传感器生物传感器的研究已成为近年来研究的热点,通过对2000~2018年间发表在Science Direct (Elsevier)数据库的相关文献的统计,发现科学家们对电化学生物传感器和光学生物传感器的研究最为广泛。电化学生物传感器具有灵敏度高、选择性好、响应速度快、成本低、易于操作和微型化等优点,是一种功能强大的分析检测工具[17-19],然而电极材料的选择以及标签化检测往往使电化学生物传感器达不到所需的灵敏度和检测限要求。光学生物传感器由于光学元件本身良好的绝缘屏蔽作用,具有抗干扰能力强,不受周围电磁场的扰动;不需要参考电极,探头可小型化,操作方便;可以实现遥测,并能进行实时、在线和动态检测;响应速度快,灵敏度高等优点[20-21]。近十年来,光学生物传感器的研究呈指数级增长。将光学生物传感器实时的检测技术与分子印迹高效专一的特点相结合的分子印迹光学传感器,具有高精度、高灵敏度、专一性强及快速、便捷、实时等优点,是一种可以直接检测目标物质含量的生物传感器,在多样本分析环境中特点尤其突出[22]。
|
图 2 2000~2018年生物传感器发表文献数量变化对比 Fig.2 Numbers of published biosensor literatures during 2000~2018 |
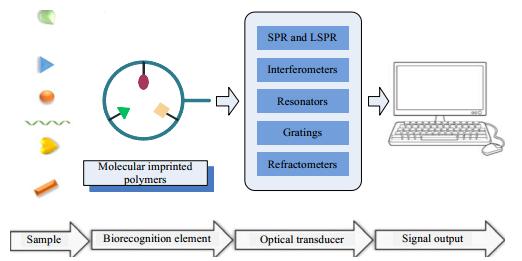
分子印迹光学传感器中,MIPs的主要任务是快速绑定目标生物分子并进行特异性识别,是传感器中的敏感识别元件;以光单元为信号转换元件,将识别的生物分子信号实时转换为光信号,在通过读取光信号数据从而实现对目标分子的快速定性定量检测,其原理示意见图 3。其中,分子印迹聚合物对目标分子的专一性识别是分子印迹光学传感器的的关键限速步骤[23-24]。目前,基于荧光(fluorescence)[25-32]、表面等离子体共振(surface plasmon resonance, SPR)[33-38]、共振光散射(resonance light scattering spectroscopy, RLS)[39]、光纤(optical fibers, OFS)[40]、电化学发光(electro-chemiluminescence, ECL)[41-46]等分子印迹生物传感器已有大量的文献报道,得益于光学传感的高灵敏度,分子印迹光学传感器对生物样本的检测极限通常可达到纳克级[29-31, 33, 41, 45]。
|
图 3 分子印迹光学传感器原理示意图 Fig.3 Schematic diagram of molecular imprinted optical biosensors |
分子印迹荧光传感器以MIP作为分子识别元件,以荧光信号为检测信号对目标物进行定性、定量检测,具有灵敏度高、选择性好、检测限低、用量少、分析时间短以及易于可视化等优点[54]。由于大多数复杂环境中的目标物质本身不具有发光性质,需通过荧光材料间接检测非荧光分析物。具有荧光团的物质可直接作为功能单体参与形成空腔,也可利用MIPs包埋荧光材料,利用目标分子与荧光材料的荧光猝灭或增强效应分析待测物质含量。近年来,基于量子点(quantum dot, QD)、有机染料、化学发光反应物质以及一些其他荧光材料的分子印迹荧光传感器的构建与应用相当广泛[55-58]。
QD作为新一代荧光发光材料,具有量子尺寸效应和介电限域效应,表现出激发波长范围宽、发射波长范围窄和斯托克斯位移大等独特的荧光性质。与传统荧光染料相比,量子点还具有光致发光性能和化学稳定性高、水分散性和荧光性能好、以及制备简单等特点[59]。QDs作为光学检测材料结合分子印迹技术,已广泛应用于多种生物样本的检测[25, 27-28, 30-32, 53]。
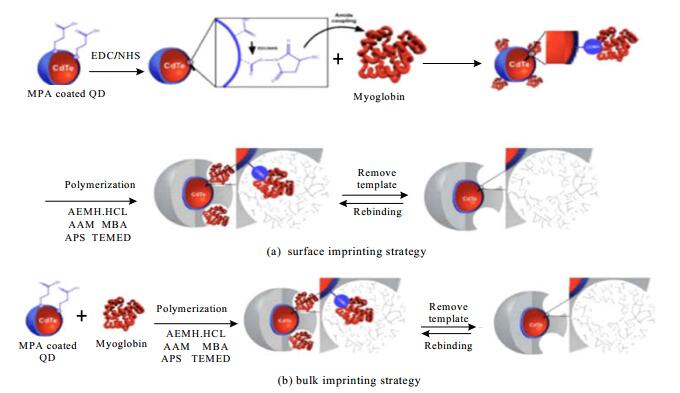
PILOTO等[25]制备了MIP-QD荧光传感器,首次尝试将MIP和QD组合用于急性心肌梗死早期诊断标记物-靶向肌红蛋白(myohemoglobin, Mb)的检测,该传感器结合了MIP的低成本、特异性识别及QD的高灵敏度。该课题组以丙烯酰胺为功能单体、N, N-双丙烯酰胺为交联剂,采用表面印迹及本体印迹两种方法在CdTe-QDs表面进行Mb分子印迹聚合物MIP-QDs的制备。采用荧光光谱法对MIP-QDs及其非印迹对应物NIP-QDs对Mb检测性能进行了研究。结果显示,在人工合成的人血清样品中,MIP-QDs在心肌梗塞标记物的检测临界值以下便可检测Mb。该MIP-QDs探针对Mb检测范围为0.304~571 pg·mL-1,检测限是0.045 pg·mL-1。所构筑的纳米MIP-QDs对Mb反应速度快、稳定性好、灵敏度高、选择性强。
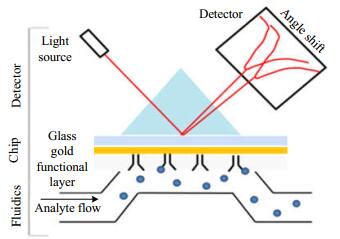
3.2 MIP-SPR传感器表面等离子共振技术是一种由光激振的金属表面电子集体震荡现象[60]。当偏振光以特定角度照射金属或其他导电材料时,在介质(通常是玻璃和液体)与金属之间的界面发生全反射,然后产生消逝波。当入射光的入射角和波长满足一定条件时,产生的消逝波与金属膜表面的等离子波发生的共振现象(如图 5所示)。由于SPR现象的发生,使反射光的能量被大幅度地消耗而发生衰减,这种衰减全反射正是SPR传感技术的理论基础。SPR传感器能对无标记的样品进行实时动态检测,具有灵敏度高等突出优点[61]。而将SPR与MIP联用的MIP-SPR传感器,不仅可以显著的提高传感器的选择性、识别性,而且可以对目标分子进行分离与富集,简化了样品的前处理过程,其应用前景十分广阔[33-38]。
OSMAN等[33]研究利用分子印迹技术制备了MIP-SPR传感器,用于人血清肌红蛋白的检测。通过在SPR传感器表面合成了肌红蛋白印迹聚(羟乙基甲基丙烯酸酯-甲基丙烯酸酯-l-色氨酸甲酯)纳米膜,用接触角测量、原子力显微镜、X射线光电子能谱和椭圆偏振仪对SPR传感器进行了表征。研究人员评估了SPR传感器在不同浓度范围的肌红蛋白溶液和急性心肌梗死患者血清中检测肌红蛋白的能力。测定SPR传感器的检测限为26.3 ng·mL-1。该方法制备的MIP-SPR传感器具有灵敏度高、选择性好、使用方便、检测限低以及实时测量能力强等优点。
3.3 MIP-RLS传感器共振光散射光谱技术自1993年由Pasternack公司开发[63-64]以来,因其灵敏度高、操作简单、检测方便等显著优点备受关注。RLS是光散射的一种特殊现象,即当一束光通过介质时,由于介质中的粒子直径远小于入射光波长,光的散射位于或接近于分子吸收带时,电子因共振而强烈吸收光的能量并产生再次散射的过程。共振光散射法已被成功应用于生化分析、药物分析、纳米材料等多个研究领域中[65-66],特别是RLS信号对蛋白质非常灵敏,目前广泛应用于蛋白质与药物小分子相互作用的研究领域[67]。为实现RLS技术的特异性检测,结合MIP制备的MIP-RLS传感器具有高选择性、高灵敏度、低成本、实用性强,操作简单,生物性能优良、兼容性好等优点,为专一性检测生物大分子提供了新的方法。
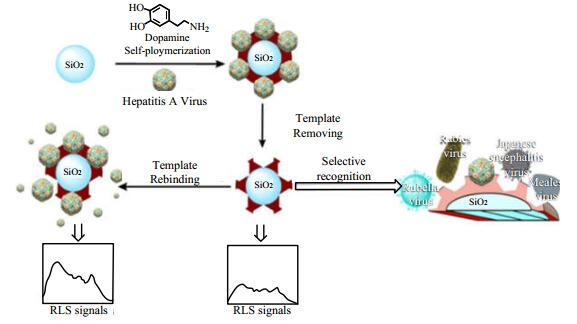
YANG等[39]基于RLS技术的优势,研制了一种基于聚多巴胺(polydopamine, PDA)包覆MIPs的新型RLS传感器,用于对甲型肝炎病毒(hepatitis A virus, HAV)的特异性识别。在SiO2纳米粒子表面,以PDA包覆的多膜病毒印迹聚合物为识别元件,通过印迹聚合物膜选择性捕获目标病毒,从而提高RLS强度,并用简易荧光分光光度计测定光强度的变化,图 6显示了病毒MIPs的制备原理及病毒的检测机理。通过对人血清中HAV检测的评价,成功确定了HAV印迹的SiO2@PDA NPs的实际分析性能,并确定检测限为8.6 pmol·L-1。该传感器已成功应用于人血清实际样品中的HAV的测定,并为解决复杂生物样品或环境样品中高敏感、高选择性的定量检测病毒提供了新的技术手段。同时,该方法成功地将RLS检测范围扩展到摩尔质量大于100万的大分子。
3.4 MIP-OFS传感器光纤是一种光的传导工具。MIP-光纤生物传感器结构主要有光源、光纤、MIPs生物敏感元件以及信号检测系统等,其中MIPs与光纤的耦合类似于光极[68]。利用光的全反射原理,当MIPs选择性识别目标分子,产生的生物化学信息调制光纤中传输光的物理特性如光的强度、振幅、相位等,再经过光探测器和解调器获得所需数据。MIP-光纤传感器有较强的选择性和很高的灵敏度,在分析过程中对真实的复杂生物样品很友好。由于光纤设计的灵活性和可用性以及探针的相对简单性,目前已有多种基于光纤的分子印迹生物传感器,包括光纤布拉格光栅(tilted fiber Bragg grating, TFBG)传感器[69]和基于有损模式共振(lossy mode resonance, LMR)的光纤传感器[52]等。
SANDRINE等[40]将MIPs和TFBG折光技术耦合成光纤,制成用于检测低分子量的芳香增强剂麦芽醇生物传感器。首先在光纤芯部刻入倾斜的光栅平面,然后通过光聚合将麦芽糖基印迹的MIPs固定在表面上的布拉格光栅上。通过对光纤传输信号的频谱分析,得到了不同介质中麦芽醇存在时的传感器响应(如图 7所示)。研究发现,该传感器在1 538 nm波长处对外界环境变化最为敏感。因此,通过检测1 538 nm波长光在纯水和被测溶液中的波长漂移量,即可判别溶液中是否存在目标分子并测得浓度。结果表明,麦芽醇检测限达到1 ng·mL-1,灵敏度为6.3×108 pm·M-1。MIPs-TFBG传感器系统可以无标签、快速、实时测量样本,并且还具有可重用性、选择性、低成本、易操作和可遥控等优点。

|
图 7 应用于TFBG纳米传感器的分子印迹技术的原理图[40] Fig.7 Schematic diagram of the molecular imprinting technique for TFBG nanosensor application [40] |
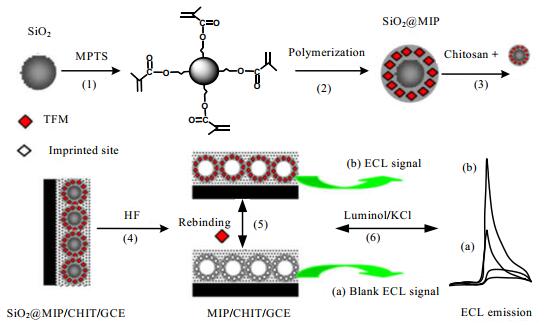
MIP-ECL传感器是将电化学发光技术与分子印迹技术相结合的分析检测技术。由于结合了ECL的灵敏性、可控性及MIP的特异识别性,MIP-ECL具有通用性的光学装置、良好的控制以及具有灵敏度高、线性范围宽、检测限低等优点引起了关注[70-71]。LI等[41]采用表面单分子定向技术,在3-甲基丙烯基丙基三甲氧基硅烷改性二氧化硅颗粒表面制备了核-壳印迹纳米粒子。他们将核-壳印迹纳米颗粒/壳聚糖复合膜沉积在裸露的玻碳电极表面,采用氢氟酸蚀刻法去除复合膜上的硅核制备ECL用以检测甲基噻吩磺隆(如图 8所示)。所得到的ECL传感器线性范围为5.0×10-10~1×10-7 mol·L-1,甲基噻吩磺隆的检测限为0.32 nmol·L-1。MIP-ECL传感器具有灵敏度高、速度快、特异性强、稳定性好等优点。
|
图 8 MIP/CHIT/GC电极表面ECL传感器系统示意图[41] Fig.8 Schematic diagram of the ECL sensor system at the MIP/CHIT/GC electrode surface [41] |
在过去的几年里,分子印迹光学生物传感器在生物大分子检测领域得到了长足的发展,其检测类型(机理)及检测能力总结如表 1所示。
|
|
表 1 光学分子印迹传感器应用发展实例总结 Table 1 Summary of application and development of optical molecular imprinted sensors |
分子印迹光学生物传感器的检测从小分子开始,目前已经扩展到生物大分子,如蛋白质、多糖、病毒甚至整个细胞。然而,由于模板分子的大小及结构不同,分子印迹传感器对目标分子检测的选择性和敏感性仍然存在很大的差异。生物大分子如蛋白质,由于尺寸大、稳定性有限、结构复杂、传质慢以及过于柔性的表面结构,使其利用印迹传感器检测仍然是一个巨大的挑战[72]。得益于纳米新材料的应用,磁性纳米颗粒、纳米线、二氧化硅纳米颗粒、碳纳米管和量子点都是合成生物大分子印迹聚合物薄层的优良载体材料[73],克服了生物大分子印迹的局限性。这些纳米载体具有较大的比表面积,增加了对生物大分子的有效印迹位点。而印迹薄层缓解了大分子质量传输速度慢的问题,提高了分子印迹光学生物传感器对目标生物大分子的选择性和敏感性。随着分子印迹技术的发展,人们正在积极探索将其最终应用于痕量大分子检测,这对生物学领域、医学检测与诊断领域具有非常深刻的意义[74-76]。
目前,分子印迹光学生物传感器进一步研究和创新的挑战在于(1)光学检测原理还不十分明确,如何将化学或生物信号转换成光学信号并进行放大还需进行更深入的研究,以期实现更高的检测效率;(2) MIPs与光学载体的耦合方式是决定传感性能的主要因素,但目前还没有相关的系统研究;(3)生物样本的检测对传感器的高通量、高重复性性能有较高要求,而关于这方面的研究还鲜有报道。
由于分子印迹光学传感器具有小型化和便携化等优点可以使检测更具有时效性,在医学、制药、环境、食品等领域应用前景十分广阔。文献中虽然有许多成功的MIP在光学传感器中的应用,然而只有很少的例子涉及真实的生物样品,包括在复杂环境中检测目标蛋白质等生物大分子。未来的发展方向包括如何在真实生物环境和复杂基质中增强特定的分子亲和力、开发具有多路复用能力的多感官MIPs-光学传感器,并提高其实际应用的灵敏度、选择性和重现性。此外,更低的成本和更好地从实验室转化为大规模生产对商业化也很重要。
随着分子印迹技术及光学检测技术的发展,分子印迹光学生物传感器将会更加完善与成熟。
| [1] |
GIORIA S, URBAN P, HAJDUCH M, et al. Proteomics study of silver nanoparticles on Caco-2 cells[J]. Toxicology in Vitro, 2018, 50: 347-372. DOI:10.1016/j.tiv.2018.03.015 |
| [2] |
QUINN S W, DEEPAK K G, SMITH J G, et al. Accelerating biomarker discovery through electronic health records, automated biobanking, and proteomics[J]. Journal of the American College of Cardiology, 2019, 73(17): 2195-2205. DOI:10.1016/j.jacc.2019.01.074 |
| [3] |
TAKIYA C S, MONTGOMERY R, MAMEDOVA L K, et al. Proteomic analysis reveals greater abundance of complement and inflammatory proteins in subcutaneous adipose tissue from postpartum cows treated with sodium salicylate[J]. Journal of Proteomics, 2019, 204: 103399. DOI:10.1016/j.jprot.2019.103399 |
| [4] |
WHITCOMBE M J. Molecularly imprinted polymers smart hydrogel crystal gardens[J]. Nature Chemistry, 2011, 3(9): 657-658. DOI:10.1038/nchem.1125 |
| [5] |
BASILE A J, AO J N, HORIUCHI K, et al. Performance of InBios ZIKV Detect™ 2.0 IgM Capture ELISA in two reference laboratories compared to the original ZIKV Detect™ IgM Capture ELISA[J]. Journal of Virological Methods, 201, 271: 113671. |
| [6] |
POLYAKOV M V. Adsorption properties and structure of silica gel[J]. Zhurnal Fizicheskoi Khimii, 1931, 2: 799-805. |
| [7] |
ALEXANDER C, ANDERSSON H S, ANDERSSON L I, et al. Molecular imprinting science and technology: A survey of the literature for the years up to and including 2003[J]. Journal of Molecular Recognition, 2006, 19(2): 106-180. DOI:10.1002/jmr.760 |
| [8] |
WULFF G, SARHAN A. The use of polymers with enzyme-analogous structures for resolution of racemates[J]. Angewandte Chemie, 1972, 11: 341-344. |
| [9] |
TAKAGISH T, KLOTZ I M. Macromolecule-small molecule interactions: Introduction of additional binding sites in polyethyleneimine by disulfide cross-linkages[J]. Biopolymers, 1972, 11(2): 483-491. DOI:10.1002/bip.1972.360110213 |
| [10] |
VLATAKI G, ANDERSSON L I, MULLER, et al. Drug assay using antibody mimics made by molecular imprinting[J]. Nature, 1993, 361(6413): 645-647. DOI:10.1038/361645a0 |
| [11] |
ZHANG K, ZHOU T C, KETTISEN K, et al. Chromatographic separation of hemoglobin variants using robust molecularly imprinted polymers[J]. Talanta, 2019, 199: 27-31. DOI:10.1016/j.talanta.2019.01.125 |
| [12] |
ZHANG C, CUI H Y, HAN Y F, et al. Development of a biomimetic enzyme-linked immunosorbent assay based on molecularly imprinted polymers on paper for the detection of carbaryl[J]. Food Chemistry, 2018, 240(17): 893-897. |
| [13] |
KARAMI P, BAGHERI H, Mohammad J A, et al. Dual-modality impedimetric immunosensor for early detection of prostate-specific antigen and myoglobin markers based on antibody-molecularly imprinted polymer[J]. Talanta, 2019, 202: 111-122. DOI:10.1016/j.talanta.2019.04.061 |
| [14] |
ZHAO C J, MA X H, LI J P. An insulin molecularly imprinted electrochemical sensor based on epitope imprinting[J]. Chinese Journal of Analytical Chemistry, 2017, 45(9): 1360-1366. DOI:10.1016/S1872-2040(17)61039-9 |
| [15] |
ZHANG Q, BERG D, MUGO S M. Molecularly imprinted carbon based electrodes for tetrahydrocannabinol sensing[J]. Inorganic Chemistry Communications, 2019, 107: 107459. DOI:10.1016/j.inoche.2019.107459 |
| [16] |
TURIEL E, ESTEBAN A M. Molecularly imprinted polymers-based microextraction techniques[J]. TrAC Trends in Analytical Chemistry, 2019, 118: 574-586. DOI:10.1016/j.trac.2019.06.016 |
| [17] |
王彤彤, 倪青青, 黄志凌, 等. 分子印迹电化学传感器测定大气中的羟基自由基[J]. 分析化学, 2018, 46(6): 889-895. WANG T T, NI Q Q, HUANG Z L, et al. Determination of hydroxyl radical in atmosphere by molecularly imprinted electrochemical sensor[J]. Chinese Journal of Analytical Chemistry, 2018, 46(6): 889-895. |
| [18] |
利健文, 韦寿莲, 江杰涛. 氨基脲分子印迹电化学传感器的制备及应用[J]. 分析化学, 2016, 44(1): 103-109. LI J W, WEI S L, JIANG J T. Preparation and application of semicarbazide electrochemical sensor based on molecularly imprinting technique[J]. Chinese Journal of Analytical Chemistry, 2016, 44(1): 103-109. |
| [19] |
张燕, 郑晶, 王娟, 等. 盐酸阿霉素分子印迹传感器的制备及识别特性[J]. 高等学校化学学报, 2016, 37(5): 860-866. ZHANG Y, ZHENG J, WANG J, et al. Preparation and properties of doxorubicin hydrochloride sensor based on molecularly imprinted polymer[J]. Chemical Journal of Chinese Universities, 2016, 37(5): 860-866. |
| [20] |
ZHAO H Y, BOYD L F, SCHUCK P. Measuring protein interactions by optical biosensors[J]. Current Protocols in Protein Science, 2017, 88(1): 20.2.1-20.2.25. DOI:10.1002/cpps.31 |
| [21] |
ALTINTAS, ZEYNEP. Optical biosensors and applications to drug discovery for cancer cases[M]. Manhattan: John Wiley & Sons, Ltd, 2018: 327-348.
|
| [22] |
AHMAD O S, BEDWELL T S, ESEN C, et al. Molecularly imprinted polymers in electrochemical and optical sensors[J]. Trends in Biotechnology, 2019, 37(3): 294-309. DOI:10.1016/j.tibtech.2018.08.009 |
| [23] |
DINC M, BASAN H, HUMMEL T, et al. Selective binding of inhibitor-assisted surface-imprinted core/shell microbeads in protein mixtures[J]. Chemistry Select, 2018, 3(16): 4277-4282. |
| [24] |
ZAHEDI P, ZIAEE M, ABDOUSS M, et al. Biomacromolecule templatebased molecularly imprinted polymers with an emphasis on their synthesis strategies: A review[J]. Polymers for Advanced Technologies, 2016, 27(9): 1124-1142. DOI:10.1002/pat.3754 |
| [25] |
PILOTO A M, RIBEIRO D S M, RIBEIRO D S M, et al. Plastic antibodies tailored on quantum dots for an optical detection of myoglobin down to the femtomolar range[J]. Scientific Reports, 2018, 8: 4944-4954. DOI:10.1038/s41598-018-23271-z |
| [26] |
HUANG J, TONG J X, LUO J, et al. Green synthesis of water-compatible fluorescent molecularly imprinted polymeric nanoparticles for efficient detection of paracetamol[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(8): 9760-9770. |
| [27] |
MEHRZAD S M, FARIDBOD F, DEZFULI A S, et al. A novel metronidazole fluorescent nanosensor based on graphene quantum dots embedded silica molecularly imprinted polymer[J]. Biosensors and Bioelectronics, 2017, 92: 618-623. DOI:10.1016/j.bios.2016.10.047 |
| [28] |
ZHANG X, YANG S, JIANG R, et al. Fluorescent molecularly imprinted membranes as biosensor for the detection of target protein[J]. Sensors and Actuators, B: Chemical, 2018, b254(Jan): 1078-1086. |
| [29] |
TANG Y W, GAO Z Y, WANG S, et al. Upconversion particles coated with molecularly imprinted polymers as fluorescence probe for detection of clenbuterol[J]. Biosensors and Bioelectronics, 2015, 71: 44-50. DOI:10.1016/j.bios.2015.04.005 |
| [30] |
YAN Y J, HE X W, LI W Y, et al. Nitrogen-doped graphene quantum dotslabeled epitope imprinted polymer with double templates via the metal chelation for specific recognition of cytochrome c[J]. Biosensors and Bioelectronics, 2017, 91: 253-261. DOI:10.1016/j.bios.2016.12.040 |
| [31] |
WANG X Y, YU J L, LI J H, et al. Quantum dots based imprinting fluorescent nanosensor for the selective and sensitive detection of phycocyanin: A general imprinting strategy toward proteins[J]. Sensors and Actuators, B: Chemical, 2018, b 255(pt.1): 268-274. |
| [32] |
LIU X Y, LIU Q R, KONG F, et al. Molecularly imprinted fluorescent probe based on hydrophobic CdSe/ZnS quantum dots for the detection of methamidophos in fruit and vegetables[J]. Advances in Polymer Technology, 2018, 37(6): 1790-1796. DOI:10.1002/adv.21838 |
| [33] |
OSMAN B, UZUN L, BESIRLI N, et al. Microcontact imprinted surface plasmon resonance sensor for myoglobin detection[J]. Materials Science and Engineering C, 2013, 33(7): 3609-3614. DOI:10.1016/j.msec.2013.04.041 |
| [34] |
ALTINTAS Z, GUERREIRO A, PILETSKY S A, et al. Nano-MIP based optical sensor for pharmaceuticals monitoring[J]. Sensors and Actuators, B: Chemical, 2015, 213(1): 305-313. |
| [35] |
ALTINTAS Z, FRANCE B, ORTIZ J O, et al. Computationally modelled receptors for drug monitoring using an optical based biomimetic SPR sensor[J]. Sensors and Actuators, B: Chemical, 2016, 224: 726-737. DOI:10.1016/j.snb.2015.10.075 |
| [36] |
SHARMA S, GUPTA B D. An efficient and selective sensing of creatinine based on fiber optic SPR technique exploiting the advantages of molecular imprinting technique [C]// In Optical Sensing and Detection V. International Society for Optics and Photonics, Strasboury: SPIE Photonics Europe, 2018: p.106801T.
|
| [37] |
PRIMO E N, KOGAN M J, VERDEJO H E, et al. Label-free graphene oxide-based surface plasmon resonance immunosensor for the quantification of galectin-3, a novel cardiac biomarker[J]. ACS Applied Materials & Interfaces, 2018, 10(28): 23501-23508. |
| [38] |
AYANKOJO A G, REUT J, OPIK A, et al. Hybrid molecularly imprinted polymer for amoxicillin detection[J]. Biosensors and Bioelectronics, 2018, 118: 102-107. DOI:10.1016/j.bios.2018.07.042 |
| [39] |
YANG B, GONG H, CHEN C Y, et al. A virus resonance light scattering sensor based on mussel-inspired molecularly imprinted polymers for high sensitive and high selective detection of Hepatitis A virus[J]. Biosensors and Bioelectronics, 2017, 87: 679-685. DOI:10.1016/j.bios.2016.08.087 |
| [40] |
SANDRINE L, ANATOLI I, JACQUES A. Molecular imprinted polymer-coated optical fiber sensor for the identification of low molecular weight molecules[J]. Talanta, 2014, 128(1): 401-407. |
| [41] |
LI H F, XIE C G, FU X C. Electrochemiluminescence sensor for sulfonylurea herbicide with molecular imprinting core-shell nanoparticles/chitosan composite film modified glassy carbon electrode[J]. Sensors and Actuators, B: Chemical, 2013, 181(7): 858-866. |
| [42] |
LI S H, LI J P, LIN Q Y, et al. A molecularly imprinted sensor based on an electrochemiluminescent membrane for ultratrace doxycycline determination[J]. Analyst, 2015, 140: 4702-4707. DOI:10.1039/C5AN00416K |
| [43] |
BABAMIRIA B, SALIMIA A, HALLAJ R. A molecularly imprinted electro-chemiluminescence sensor for ultrasensitive HIV-1 gene detection using EuS nanocrystals as luminophore[J]. Biosensors and Bioelectronics, 2018, 117: 332-339. DOI:10.1016/j.bios.2018.06.003 |
| [44] |
JIN X C, FANG G Z, PAN M F, et al. A molecularly imprinted electro-chemiluminescence sensor based on upconversion nanoparticles enhanced by electrodeposited rGO for selective and ultrasensitive detection of clenbuterol[J]. Biosensors and Bioelectronics, 2018, 102: 357-364. DOI:10.1016/j.bios.2017.11.016 |
| [45] |
BABAMIRI B, SALIMIA A, HALLAJ R, et al. Nickel nanoclusters as a novel emitter for molecularly imprinted electrochemiluminescence based sensor toward nanomolar detection of creatinine[J]. Biosensors and Bioelectronics, 2018, 107: 272-279. DOI:10.1016/j.bios.2018.02.022 |
| [46] |
FENG X B, GAN N, ZHOU J, et al. A novel dual-template molecularly imprinted electrochemiluminescence immunosensor array using Ru(bpy)32+-Silica@Poly-L-lysine-Au composite nanoparticles as labels for near-simultaneous detection of tumor markers[J]. Electrochimica Acta, 2014, 139(1): 127-136. |
| [47] |
DUAN H M, LI L L, WANG X J, et al. A sensitive and selective chemiluminescence sensor for the determination of dopamine based on silanized magnetic graphene oxide-molecularly imprinted polymer[J]. Spectrochimica Acta, Part A, 2015, 139(1): 374-379. |
| [48] |
LI D M, HE Q H, HE Y H, et al. Molecular imprinting sensor based on quantum weak measurement[J]. Biosensors and Bioelectronics, 2017, 94: 328-334. DOI:10.1016/j.bios.2017.03.021 |
| [49] |
DUAN H M, LI L L, WANG X J, et al. Biorecognition and highly sensitive determination of ribonuclease A with chemiluminescence sensor based on Fe3O4/multi-walled carbon nanotubes/ SiO2-surface molecular imprinting polymer[J]. RSC Advances, 2015, 5(24): 18850-18857. DOI:10.1039/C4RA16878J |
| [50] |
WEBER P, RIEGGERV B R, NIEDERGALLC K, et al. Nano-MIP based sensor for penicillin G: Sensitive layer and analytical validation[J]. Sensors and Actuators, B: Chemical, 2018, 267(8): 26-33. |
| [51] |
DILTEMIZ S E, USLU O. A reflectometric interferometric nanosensor for sarcosine[J]. Biotechnology Progress, 2015, 31(1): 55-61. DOI:10.1002/btpr.1955 |
| [52] |
USHA S P, SHRIVASTAV A M, GUPTA B D. A contemporary approach for design and characterization of fiber-optic-cortisol sensor tailoring LMR and ZnO/PPY molecularly imprinted film[J]. Biosensors and Bioelectronics, 2017, 87: 178-186. DOI:10.1016/j.bios.2016.08.040 |
| [53] |
WEI X, ZHOU Z P, HAO T F, et al. Highly-controllable imprinted polymer nanoshell at the surface of silica nanoparticles based room-temperature phosphorescence probe for detection of 2, 4-dichlorophenol[J]. Analytica Chimica Acta, 2015, 870(1): 83-91. |
| [54] |
YANG Q, LI J H, WANG X Y, et al. Strategies of molecular imprinting-based fluorescence sensors for chemical and biological analysis[J]. Biosensors and Bioelectronics, 2018, 112: 54-71. DOI:10.1016/j.bios.2018.04.028 |
| [55] |
NIE Y X, LIU Y, SU X G, et al. Nitrogen-rich quantum dots-based fluorescence molecularly imprinted paper strip for p-nitroaniline detection[J]. Talanta, 2018, 184: 339-344. |
| [56] |
SHARIATI R, REZAEI B, JAMEI H R, et al. Application of coated green source carbon dots with silica molecularly imprinted polymers as a fluorescence probe for selective and sensitive determination of phenobarbital[J]. Talanta, 2019, 194: 143-149. DOI:10.1016/j.talanta.2018.09.069 |
| [57] |
LIU X Q, WANG T, WANG W J, et al. A tailored molecular imprinting ratiometric fluorescent sensor based on red/blue carbon dots for ultrasensitive tetracycline detection[J]. Journal of Industrial and Engineering Chemistry, 2019, 72: 100-106. DOI:10.1016/j.jiec.2018.12.007 |
| [58] |
LI S H, LI J P, MA X H, et al. Molecularly imprinted electroluminescence switch sensor with a dual recognition effect for determination of ultra-trace levels of cobalt (Ⅱ)[J]. Biosensors and Bioelectronics, 2019, 139: 111321. DOI:10.1016/j.bios.2019.111321 |
| [59] |
LI C H, LI Y, ZHOU T L, et al. Ultrasonic synthesis of Mn-doped CsPbCl3 quantum dots (QDs) with enhanced photoluminescence[J]. Optical Materials, 2019, 94: 41-46. DOI:10.1016/j.optmat.2019.04.053 |
| [60] |
王海明, 钱凯先. 表面等离子共振技术在生物分子互作研究中的应用[J]. 浙江大学学报(工学版), 2003, 37(3): 354-357. WANG H M, QIAN K X. Principle of surface plasmon resonance biosensor technology and its application in biomolecular interacting analysis[J]. Journal of Zhejiang University (Engineering Science), 2003, 37(3): 354-357. DOI:10.3785/j.issn.1008-973X.2003.03.021 |
| [61] |
CAKIR O, BAKHSHPOUR M, YILMAZ F, et al. Novel QCM and SPR sensors based on molecular imprinting for highly sensitive and selective detection of 2, 4-dichlorophenoxyacetic acid in apple samples[J]. Materials Science & Engineering C, 2019, 102(9): 438-491. |
| [62] |
DAMBORSKY P, SVITEL J, KATRLIK J. Optical biosensors[J]. Essays in Biochemistry, 2016, 60(1): 91-100. DOI:10.1042/EBC20150010 |
| [63] |
PASTERNACK R F, BUSTAMANTE C, COLLINGS P J, et al. Porphyrin assemblies on DNA as studied by a resonance light-scattering technique[J]. Journal of the American Chemical Society, 1993, 115(13): 5393-5399. DOI:10.1021/ja00066a006 |
| [64] |
PASTERNACK R F, COLLINGS P J. Resonance light scattering: A new technique for studying chromophore aggregation[J]. Science, 1995, 269(5226): 935-939. DOI:10.1126/science.7638615 |
| [65] |
YAN S G, DENG D Y, SONG H J, et al. Facile synthesis of CuS nanosheets probe for resonance light scattering and visual detecting L-cysteine[J]. Sensors and Actuators, B: Chemical, 2017, 243: 873-881. DOI:10.1016/j.snb.2016.12.019 |
| [66] |
LV S F, CHEN F, CHEN C Y, et al. Anovel CdTe quantum dots probe amplified resonance light scattering signals to detect microRNA-122[J]. Talanta, 2017, 165: 659-663. DOI:10.1016/j.talanta.2017.01.020 |
| [67] |
POURREZA N, GHOMI M. Hydrogel based aptasensor for thrombin sensing by resonance rayleigh scattering[J]. Analytica Chimica Acta, 2019, 1079: 180-191. DOI:10.1016/j.aca.2019.06.049 |
| [68] |
DING X P, WANG W, FU L C. Classification and application principles of optical-fiber transducer[J]. Spectroscopy and Spectral Analysis, 2006, 26(6): 1176-1178. |
| [69] |
REN G F, LI T Y, HU Z C, et al. Research on new FBG soil pressure sensor and its application in engineering[J]. Optik, 2019, 185: 759-771. DOI:10.1016/j.ijleo.2019.03.019 |
| [70] |
RICHTER M M. Electrochemiluminescence (ECL)[J]. Chemical Reviews, 2004, 104(6): 3003-3036. DOI:10.1021/cr020373d |
| [71] |
李素萍, 关怀民, 徐国宝, 等. 分子印迹电化学发光分析[J]. 分析化学, 2015, 43(2): 294-299. LI S P, GUAN H M, XU G B, et al. Molecular imprinting electrochemiluminescence analysis[J]. Chinese Journal of Analytical Chemistry, 2015, 43(2): 294-299. |
| [72] |
ZAHEDI P, ZIAEE M, ABDOUSS M, et al. Biomacromolecule templatebased molecularly imprinted polymers with an emphasis on their synthesis strategies: A review, polym[J]. Polymers for Advanced Technologies, 2016, 27(9): 1124-1142. DOI:10.1002/pat.3754 |
| [73] |
吕婉茹, 管萍, 胡小玲, 等. 胸腺五肽分子印迹聚合物磁性微球的制备及吸附性能研究[J]. 高校化学工程学报, 2015, 29(3): 677-682. LYU W R, GUAN P, HU X L, et al. Preparation and adsorption performance of thymopentin molecularly imprinted polymer-coated magnetic microspheres[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(3): 677-682. DOI:10.3969/j.issn.1003-9015.2015.03.026 |
| [74] |
BEAUCHEMIN N, ARABZADEH A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis[J]. Cancer and Metastasis Reviews, 2013, 32(3/4): 643-671. |
| [75] |
WANG D F, LI Y Y, LIN Z Y, et al. Surface-enhanced electrochemiluminescence of Ru@SiO2 for ultrasensitive detection of carcinoembryonic antigen[J]. Analytical Chemistry, 2015, 87(12): 5966-5972. DOI:10.1021/acs.analchem.5b01038 |
| [76] |
WU L, QU X G. Cancer biomarker detection: Recent achievements and challenges[J]. Chemical Society Reviews, 2015, 44(10): 2963-2997. DOI:10.1039/C4CS00370E |