甲苯二氨基甲酸甲酯(toluene dicarbamate,TDC)属于氨基甲酸酯类化合物,该类化合物可用作杀虫剂、除草剂、杀菌剂等[1],尤其TDC是非光气法合成甲苯二异氰酸酯(toluene diisocyanate, TDI)的中间体,而TDI是生产聚氨酯的重要原料之一。近年来,聚氨酯制品被应用到各行各业,具有极高的生产价值[2]。传统的TDI生产采用光气法,该工艺存在原料光气剧毒、副产物氯化氢易腐蚀设备、产品中残余氯难以去除等缺点[3]。目前,非光气路线合成TDI已成为国内外学者关注的焦点,各种非光气法合成TDI均有大量文献报道[4-7]。其中碳酸酯法是以绿色化学品碳酸二甲酯(dimethyl carbonate, DMC)替代光气与甲苯二胺(toluene diamine, TDA)反应合成TDC,再经TDC分解得到TDI。该过程仅有甲醇副产物,它是甲醇氧化羰基化合成DMC的原料;若与DMC合成工艺相结合,可构成“零排放”的绿色合成工艺,符合化学工业向洁净化工发展的趋势。
乙酸锌是DMC与胺类化合物反应合成氨基甲酸酯类化合物的较优催化剂[2, 7-8],同样也是DMC与TDA反应合成TDC的高效催化剂[7, 9-10]。但乙酸锌催化该类反应时,因与反应过程的副产物甲醇反应生成氧化锌而失活。所以,人们期待一种既易与产物分离,又具有高催化活性,还能重复使用的含乙酸锌催化剂。离子液体因其较强的溶解力、较低的蒸气压以及在有机合成中表现出的较高催化活性,被广泛应用于催化有机合成反应。目前,尚未见关于含乙酸锌离子液体催化TDA与DMC反应合成TDC的研究文献,但有以离子液体为催化剂,合成芳香族氨基甲酸酯类化合物的研究报道,如以[HO3S-(CH2)4-mim]Cl-0.7ZnCl2为催化剂合成氨基甲酸酯[11-12]、以[PEmim]Cl-PbCl2催化合成N-甲基-N-苯基氨基甲酸酯[13]、以[Bmim]PF6-Zn(OAc)2催化苯胺与DMC反应合成N-甲基-N-苯基氨基甲酸酯[14],上述离子液体均在合成氨基甲酸酯类反应中表现出较高的催化活性。
本工作对含乙酸锌离子液体的合成与表征、对TDA与DMC合成TDC反应的催化性能及反应机理进行研究,以期为乙酸锌离子液体催化DMC与胺类化合物的反应提供参考。
2 实验部分 2.1 原料与试剂2, 4-TDA:国药集团化学试剂公司;DMC:天津大茂化学试剂厂;N-甲基咪唑、氯代正丁烷:上海阿拉丁试剂有限公司;1, 4-丁烷磺内酯:天津市希恩思生化科技有限公司;乙酸乙酯、乙醇、乙酸钾、二水乙酸锌:天津市风船化学试剂科技有限公司;1-(2-氯乙基)哌啶盐酸盐:百灵威化学技术有限公司。上述试剂均为分析纯。将二水乙酸锌于110 ℃真空干燥6 h,得到无水乙酸锌。
2.2 实验方法 2.2.1 离子液体的制备(1) [HO3S-(CH2)4-mim]Cl-0.5Zn(OAc)2的制备[11-12]
将定量的N-甲基咪唑和1, 4-丁烷磺内酯加入三口烧瓶,50 ℃反应6 h,然后用乙酸乙酯洗涤、蒸发,70 ℃真空干燥7 h,得到白色固体1-甲基-3-(丁基-4-磺酸)咪唑盐。室温下,向盛有1-甲基-3-(丁基-4-磺酸)咪唑盐的烧瓶中滴加等物质的量的浓盐酸(质量分数为36%~38%),升至80 ℃,反应3 h,然后通过用乙酸乙酯洗涤、蒸发、真空干燥,得到黄绿色透明离子液体[HO3S-(CH2)4-mim]Cl。取一定量[HO3S-(CH2)4-mim]Cl于三口烧瓶,搅拌下逐渐加入Zn(OAc)2,升至100 ℃,反应4 h,得到橘红色黏稠透明的离子液体[HO3S-(CH2)4-mim]Cl-0.5Zn(OAc)2。
(2) [PEmim]Cl-0.5Zn(OAc)2的制备[13, 15]
将等物质的量的N-甲基咪唑和1-(2-氯乙基)哌啶盐酸盐加入三口烧瓶,再加适量乙醇溶剂,在80 ℃反应12 h。然后,蒸发除去溶剂,再用二氯甲烷洗涤后,70 ℃下真空干燥8 h,得白色固体[PEmim]Cl·HCl。将[PEmim]Cl·HCl溶于乙醇与水(等体积)的混合液,用与[PEmim]Cl·HCl等物质的量的NaOH中和HCl,搅拌后蒸发,二氯甲烷洗涤,在70 ℃真空干燥8 h,得到浅黄色油状离子液体[PEmim]Cl。将[PEmim]Cl与Zn(OAc)2混合,在120 ℃反应2 h,反应完成后冷却,得到深棕色黏稠的离子液体[PEmim]Cl-0.5Zn(OAc)2。
(3) [Bmim]OAc-0.5Zn(OAc)2的制备[14]
将定量的N-甲基咪唑加入三口烧瓶,常温搅拌,缓慢加入与N-甲基咪唑的物质的量比为1:1.2的氯代正丁烷,在80 ℃,冷凝回流反应12 h后,经乙酸乙酯洗涤、蒸发、真空干燥得到[Bmim]Cl。将定量的[Bmim]Cl和乙酸钾加入三口烧瓶,再加入适量甲醇溶剂,升至40 ℃,反应10 h。反应结束后,经过滤、蒸发、洗涤、真空干燥得到[Bmim]OAc。取定量[Bmim]OAc和无水乙酸锌于三口烧瓶,在要求温度下反应一定时间,得到黄棕色澄清透明的[Bmim]OAc-0.5Zn(OAc)2离子液体。
2.2.2 TDC的合成TDA与DMC合成TDC反应如下式所示:
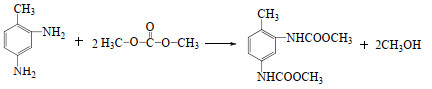
|
合成TDC反应在100 mL高压釜中进行。操作步骤:反应釜中加入定量的TDA、DMC和催化剂,加热搅拌,升至要求的反应温度后计时,反应一定时间后结束反应。降温后取出反应液,用于液相色谱定量分析。
2.3 表征与分析采用VECTOR22型傅里叶变换红外光谱(Fourier transform infrared spectrometry, FTIR)仪对样品进行基团和结构分析。仪器分辨率为4 cm−1;扫描速度为0.2 cm⋅s−1;扫描10次;波数范围为4 000~400 cm−1。试样的制备方法:固体样品采用KBr压片法;液体样品采用液膜法。
采用Avance 400型核磁共振仪对离子液体中氢所处化学环境进行氢核磁共振(H nuclear magnetic resonance,1H-NMR)分析。照射频率为400 MHz,溶剂为D2O,基准物质为四甲基硅烷(TMS)。
采用Waters515型高效液相色谱仪对TDC定量分析。2487型紫外检测器,波长254 nm,色谱柱为Kromasil C-18(φ4.6 mm×150 mm),甲醇与水(等体积)的混合液作为流动相,体积流量为0.4 mL⋅min−1。以TDA为基准,计算TDC收率YTDC如下式所示:
| $ Y_{\mathrm{TDC}}=\frac{\text { 实际生成TDC物质的量 }}{\text { 理论生成 } \mathrm{TDC} \text { 物质的量 }} \times 100 \% $ |
[HO3S-(CH2)4-mim]Cl-0.7ZnCl2[11-12]、[PEmim]Cl-PbCl2[13]以及[Bmim]PF6-Zn(OAc)2[14]对合成氨基甲酸酯反应的催化效果较好。因此,本工作合成[HO3S-(CH2)4-mim]Cl-0.5Zn(OAc)2、[PEmim]Cl-0.5Zn(OAc)2以及[Bmim]OAc-0.5Zn(OAc)2 3种含乙酸锌离子液体,用于催化合成TDC反应,其对TDC收率的影响如表 1所示。表注中n为物质的量,m为质量。
|
|
表 1 不同离子液体对TDC收率的影响 Table 1 Effect of different ionic liquids on TDC yield |
由表 1可见,[Bmim]OAc-0.5Zn(OAc)2催化该反应时,3种不同温度下TDC收率均比其他2种催化剂的高;150 ℃时,TDC收率达到85.38%,再升高反应温度,TDC收率略有下降,这可能与温度升高副反应增加有关。可见,[Bmim]OAc-0.5Zn(OAc)2是合成TDC反应的较好催化剂;反应温度在130~170 ℃时,催化性能较好,TDC收率较高。
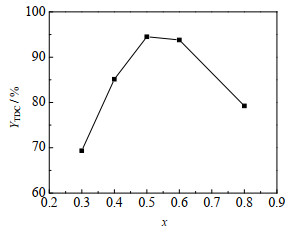
3.1.2 [Bmim]OAc-xZn(OAc)2的催化性能在80 ℃下反应3 h,合成不同x(x为Zn(OAc)2与[Bmim]OAc的物质的量比)的离子液体[Bmim]OAc-xZn(OAc)2,分别用于催化合成TDC反应,其对TDC收率的影响如图 1所示。由图 1可知,随着x增大,TDC收率先增大后减小,当x为0.5时,TDC收率达到最大,为94.50%,说明[Bmim]OAc-0.5Zn(OAc)2催化性能好。这可能是由于TDA与DMC反应合成TDC既可被碱催化又可被酸催化,是一种酸碱催化反应,[Bmim]OAc显碱性,Zn(OAc)2显酸性,而Zn(OAc)2与[Bmim]OAc的物质的量比决定了酸性位和碱性位的比例,并影响催化效果。
|
图 1 不同[Bmim]OAc-xZn(OAc)2对TDC收率的影响 Fig.1 Effect of different [Bmim]OAc-xZn (OAc)2 on TDC yield Reaction conditions: n(TDA): n(DMC)=1:30, m(TDA): m(Zn(OAc)2)=1:0.29, 160 ℃, 6 h |
(1) FTIR表征
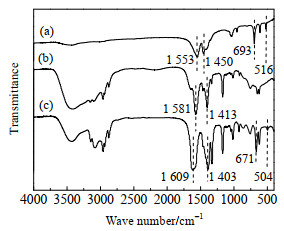
在n([Bmim]OAc): n(Zn(OAc)2)=1:0.5、80 ℃反应3 h,制备了[Bmim]OAc-0.5Zn(OAc)2离子液体,并分别对Zn(OAc)2、[Bmim]OAc及[Bmim]OAc-0.5(Zn(OAc)2进行FTIR表征,结果如图 2所示。
|
图 2 Zn(OAc)2、[Bmim]OAc及[Bmim]OAc-0.5Zn(OAc)2的红外谱图
Fig.2 FTIR spectra of Zn(OAc)2, [Bmim]OAc and [Bmim]OAc-0.5Zn(OAc)2
(a) Zn(OAc)2 (b) [Bmim]OAc (c) [Bmim]OAc-0.5Zn(OAc)2 |
由图 2(a)可以看出,Zn(OAc)2中─COO─的2个伸缩振动峰的出峰位置在1 553和1 450 cm−1处,符合相关文献报道[16];2个伸缩振动峰的间距是103 cm−1,说明Zn(OAc)2是双齿配位结构[17]。由图 2(b)可以看出,[Bmim]OAc中─COO─的伸缩振动峰的出峰位置分别在1 581和1 413 cm−1,2个峰间距为168 cm−1,符合文献[18]报道,说明成功合成了离子液体[Bmim]OAc。由图 2(c)可以看出,[Bmim]OAc-0.5Zn(OAc)2中阴离子羧酸根─COO─的2个伸缩振动峰的出峰位置分别在1 609和1 403 cm−1,说明Zn(OAc)2和[Bmim]OAc结合后,─COO─的2个伸缩振动峰的出峰位置发生了变化,第1个峰发生蓝移至1 609 cm−1,第2个峰发生红移至1 403 cm−1,2个峰间距变为206 cm−1,是单齿配位结构[19];表明Zn(OAc)2和[Bmim]OAc结合后,羧酸根─COO─和Zn2+之间为单齿型配位(如图 3所示)。推测[Bmim]OAc-0.5Zn(OAc)2含有此配位结构的原因是乙酸锌中的乙酸根与咪唑环上的C2位的氢形成了氢键(如图 3所示)。
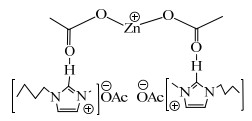
|
图 3 [Bmim]OAc-0.5Zn(OAc)2的结构式 Fig.3 Structural formula of [Bmim]OAc-0.5Zn(OAc)2 |
由图 2(a)还可以看出,纯Zn(OAc)2中Zn─O键在693和516 cm−1处出现尖峰,2个峰的间距为177 cm−1。图 2 (c)表明,[Bmim]OAc-0.5Zn(OAc)2中Zn─O键在671和504 cm−1处出现尖峰,2个峰间距为167 cm−1,说明Zn(OAc)2和[Bmim]OAc作用后,Zn─O键的2个峰发生红移,且2个峰间距减小,但Zn─O键2个伸缩振动峰的出峰位置均在正常范围内[20]。出现红移的原因可能是Zn(OAc)2与[Bmim]OAc作用后,Zn─O键长变短,键能变大,作用力变强,使得形成的[Bmim]OAc-0.5Zn(OAc)2离子液体更稳定。
由上述FTIR分析可知,由Zn(OAc)2与[Bmim]OAc合成了离子液体[Bmim]OAc-0.5Zn(OAc)2,且合成的离子液体中Zn ─O键更稳定。
(2) 1H-NMR表征
对[Bmim]OAc-0.5Zn(OAc)2进行1H-NMR表征,见图 4。图 4中,化学位移δ=4.71处为溶剂峰[21];此外,主要有9个氢信号峰,氢质子总数为24。δ=0.74(t,3H,CH3)为C1连接的H,1.15(m,2H,CH2)为C2连接的H,1.69(s,3H,CH3)为C9连接的H,1.76(m,2H,CH2)为C3连接的H,3.72(s,3H,CH3)为C8连接的H,4.02(t,2H,CH2)为C4连接的H,7.27(d,1H,CH)为C6连接的H,7.32(d,1H,CH)为C7连接的H,8.56(s,1H,CH)为C5连接的H(其中,m是多重峰,t是三重峰,d是双峰,s是单峰)。[Bmim]OAc-0.5Zn(OAc)2的氢信号位置如图 5所示。
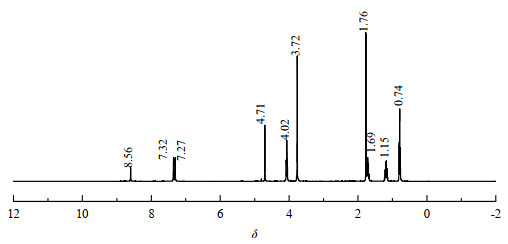
|
图 4 [Bmim]OAc-0.5Zn(OAc)2的氢核磁谱图 Fig.4 1H-NMR spectrum of [Bmim]OAc-0.5Zn(OAc)2 |
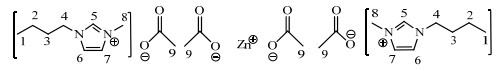
|
图 5 [Bmim]OAc-0.5Zn(OAc)2的氢信号位置示意图 Fig.5 Schematic diagram of hydrogen signal position of [Bmim]OAc-0.5Zn(OAc)2 |
由FTIR与1H-NMR分析可知,合成的[Bmim]OAc-0.5Zn(OAc)2中乙酸锌为单齿配位结构,Zn─O键更稳定;1H-NMR谱图中没有杂峰,与[Bmim]OAc-0.5Zn(OAc)2结构式相符,[Bmim]OAc-0.5Zn(OAc)2离子液体纯度较高。
3.2 [Bmim]OAc-0.5Zn(OAc)2的合成条件对其催化性能的影响(1) [Bmim]OAc-0.5Zn(OAc)2的合成温度对TDC收率的影响
[Bmim]OAc与Zn(OAc)2在不同反应温度下(反应时间均为3 h)合成[Bmim]OAc-0.5Zn(OAc)2。不同温度合成的[Bmim]OAc-0.5Zn(OAc)2对TDC收率的影响如图 6所示。由图 6可知,随着[Bmim]OAc-0.5Zn(OAc)2合成温度的升高,TDC的收率增加;当合成温度为80 ℃时,TDC收率达94.50%;再升高合成温度,TDC收率基本不变。这是因为[Bmim]OAc与Zn(OAc)2合成[Bmim]OAc-0.5Zn(OAc)2,主要是通过咪唑环的C2氢与Zn(OAc)2的羰基氧形成氢键[14]。温度较低时,合成速率较慢,氢键形成缓慢,[Bmim]OAc-0.5Zn(OAc)2的合成不充分;随着温度升高,合成速率加快,能形成更多氢键,[Bmim]OAc-0.5Zn(OAc)2合成更充分;温度继续升高,TDC收率稍有下降但变化不大,是因为形成氢键是放热反应,温度太高,对形成氢键不利。所以,合成[Bmim]OAc-0.5Zn(OAc)2的较好温度为80 ℃。
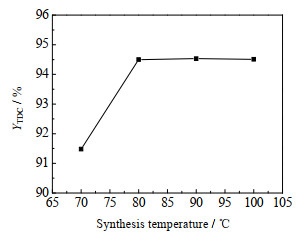
|
图 6 [Bmim]OAc-0.5Zn(OAc)2的合成温度对TDC收率的影响 Fig.6 Effect of synthesis temperature of [Bmim]OAc-0.5Zn(OAc)2 on TDC yield Reaction conditions: n(TDA): n(DMC)=1:30, m(TDA): m([Bmim]OAc-0.5Zn(OAc)2)=1:0.95, 160 ℃, 6 h |
(2) [Bmim]OAc-0.5Zn(OAc)2的合成时间对TDC收率的影响
[Bmim]OAc-0.5Zn(OAc)2的合成时间(温度均为80 ℃)对TDC收率的影响如图 7所示。由图可知,随着合成时间延长,TDC的收率增加。合成时间为3 h时,TDC收率达94.50%。但继续延长时间,TDC收率基本不再变化。原因是时间较短时,反应不充分,使得参与合成的Zn(OAc)2较少,Zn(OAc)2与[Bmim]OAc的物质的量比达不到0.5,导致其催化性能低,TDC的收率低;随着时间的延长,参与合成的Zn(OAc)2增多,能达到较适宜的酸碱位比,催化性能增强,TDC收率提高;若时间继续延长,[Bmim]OAc与Zn(OAc)2已充分反应,催化性能不变,TDC收率不变。从TDC收率的变化趋势及用时长短考虑,合成[Bmim]OAc-0.5Zn(OAc)2的较适宜时间为3 h。
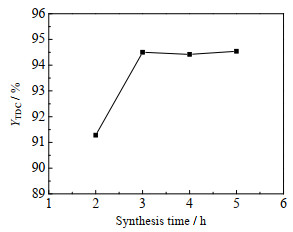
|
图 7 [Bmim]OAc-0.5Zn(OAc)2的合成时间对TDC收率的影响 Fig.7 Effect of synthesis time of [Bmim]OAc-0.5Zn(OAc)2 on TDC yield Reaction conditions: n(TDA): n(DMC)=1:30, m(TDA): m([Bmim]OAc-0.5Zn(OAc)2)=1:0.95, 160 ℃, 6 h |
综上可知,在较低反应温度、较短反应时间,所制备[Bmim]OAc-0.5Zn(OAc)2的催化活性较低;在80 ℃下反应3 h,可制备具有较高催化活性的离子液体[Bmim]OAc-0.5Zn(OAc)2;若进一步升高合成温度、延长合成时间,对[Bmim]OAc-0.5Zn(OAc)2的催化活性影响不大。
3.3 [Bmim]OAc-0.5Zn(OAc)2催化合成TDC反应条件优化(1) 反应温度对TDC收率的影响
反应温度对TDC收率的影响见图 8。由图可见,低温时,随着反应温度升高,TDC收率增加;160 ℃时,TDC收率达最高,为94.50%;随后再升高反应温度,TDC收率下降。这是因为低温时,升高温度,反应速率加快,TDC收率增加;但温度太高时,副反应增加,TDC进一步反应生成聚脲[22],造成TDC收率下降。因此,[Bmim]OAc-0.5Zn(OAc)2催化合成TDC的较适宜温度为160 ℃。
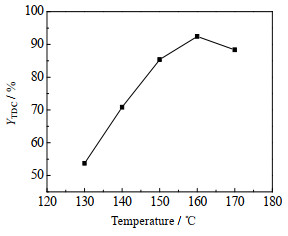
|
图 8 反应温度对TDC收率的影响 Fig.8 Effect of reaction temperature on TDC yield Reaction conditions: n(TDA): n(DMC)=1:30, m(TDA): m([Bmim]OAc-0.5Zn(OAc)2)=1:0.95, 6 h |
(2) 反应时间对TDC收率的影响
反应时间对TDC收率的影响见图 9。由图可见,随着反应时间延长,TDC收率增加;反应6 h时,TDC收率达到94.50%;再继续延长时间,TDC收率没有明显升高。从反应周期和经济性考虑,选择反应时间为6 h。
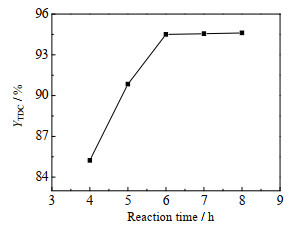
|
图 9 反应时间对TDC收率的影响 Fig.9 Effect of reaction time on TDC yield Reaction conditions: n(TDA): n(DMC)=1:30, m (TDA): m([Bmim]OAc-0.5Zn(OAc)2)=1:0.95, 160 ℃ |
(3) 催化剂用量对TDC收率的影响
[Bmim]OAc-0.5Zn(OAc)2用量对TDC收率的影响见图 10。由图可知,随着[Bmim]OAc-0.5Zn(OAc)2用量增加,TDC收率增大;当m(TDA): m([Bmim]OAc-0.5Zn(OAc)2)=1:0.95时,TDC收率达94.50%;随后再增加[Bmim]OAc-0.5Zn(OAc)2用量,TDC收率下降。是因为催化剂用量少时,反应速度慢,TDC收率较低;催化剂用量太大时导致副反应增加,使TDC收率降低[7]。
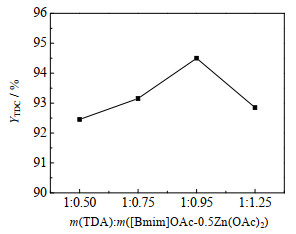
|
图 10 催化剂用量对TDC收率的影响 Fig.10 Effect of catalyst dosage on TDC yield Reaction conditions: n(TDA): n(DMC)=1:30, 160 ℃, 6 h |
(4) 物料配比对TDC收率的影响
TDA与DMC的物质的量比对TDC收率的影响见图 11。由图可知,随着DMC用量增加,TDC收率增大;当n(TDA): n(DMC)=1:30时,TDC收率为94.50%;继续增大DMC用量,TDC收率增加的趋势变缓。从经济性考虑,选择物质的量比n(TDA): n(DMC)=1:30。
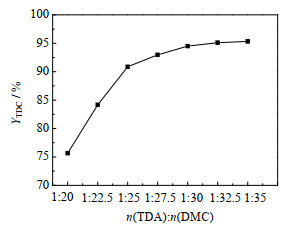
|
图 11 物料配比对TDC收率的影响 Fig.11 Effect of reactant ratio on TDC yield Reaction conditions: m(TDA): m([Bmim]OAc-0.5Zn(OAc)2)=1:0.95, 160 ℃, 6 h |
由上述优化结果可知,[Bmim]OAc-0.5Zn(OAc)2催化合成TDC的较优反应条件为:n(TDA): n(DMC)=1:30,m(TDA): m([Bmim]OAc-0.5Zn(OAc)2)=1:0.95,160 ℃,反应6 h。该条件下,TDC收率为94.50%。虽然进一步延长反应时间、增大DMC用量可进一步提高TDC收率,但升高趋势不大。
3.4 [Bmim]OAc-0.5Zn(OAc)2催化合成TDC反应机理目前,未见关于[Bmim]OAc-0.5Zn(OAc)2催化合成TDC反应机理的文献报道。在此借助FTIR表征及实验验证,分析该反应机理。
3.4.1 [Bmim]OAc-0.5Zn(OAc)2与DMC的作用机理分析 3.4.1.1 [Bmim]OAc-0.5Zn(OAc)2与DMC作用前后的FTIR表征分别对如下(a)~(c)所示[Bmim]OAc-0.5Zn(OAc)2样品进行FTIR表征,结果如图 12所示。
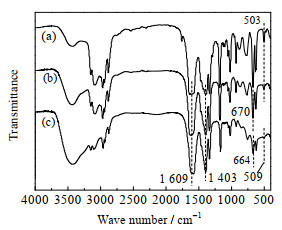
|
图 12 不同条件处理的[Bmim]OAc-0.5Zn(OAc)2的红外谱图
Fig.12 FTIR spectra of [Bmim]OAc-0.5Zn(OAc)2 under different conditions
(a) [Bmim]OAc-0.5Zn(OAc)2 (b) [Bmim]OAc-0.5Zn(OAc)2, room temperature (c) [Bmim]OAc-0.5Zn(OAc)2, 160 ℃, 2 h |
(a) 新鲜[Bmim]OAc-0.5Zn(OAc)2。
(b) [Bmim]OAc-0.5Zn(OAc)2与DMC按质量比1:23(较优反应条件)混合,室温放置6 h后蒸发,[Bmim]OAc-0.5Zn(OAc)2做FTIR表征。
(c) 按(b)中所示物料配比,将[Bmim]OAc-0.5Zn(OAc)2及DMC加入反应釜,160 ℃下处理2 h,降温后蒸发,[Bmim]OAc-0.5Zn(OAc)2做FTIR表征。
图 12(a)、(b)、(c)在1 609和1 403 cm−1处均有2个尖峰,是[Bmim]OAc-0.5Zn(OAc)2中乙酸锌单齿配位结构的2个伸缩振动峰[19],说明在160 ℃的反应条件处理后,催化剂的单齿配位结构没变。图 12(a)、(b)在670和503 cm−1处的尖峰为Zn─O键的伸缩振动峰[23]。而由图 12(c)可知,经160 ℃处理后,Zn─O键在670 cm−1处的峰红移至664 cm−1,503 cm−1处的峰蓝移至509 cm−1;推测是[Bmim]OAc-0.5Zn(OAc)2与DMC发生了化学作用,[Bmim]OAc-0.5Zn(OAc)2的Zn2+上连接了新基团,使[Bmim]OAc-0.5Zn(OAc)2中Zn─O键型发生了变化,而室温放置的(b)并无此变化。
3.4.1.2 [Bmim]OAc-0.5Zn(OAc)2与DMC作用前后DMC的FTIR表征分别对如下(a)~(c)所示的DMC样品进行FTIR表征,结果如图 13所示。
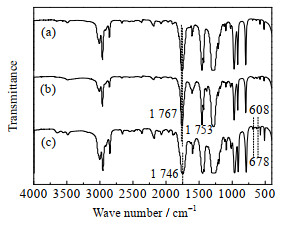
|
图 13 不同条件处理的DMC的红外谱图
Fig.13 FTIR spectra of DMC samples under different conditions
(a) DMC (b) DMC, room temperature (c) DMC, 160 ℃, 2 h |
(a) 纯DMC;
(b) [Bmim]OAc-0.5Zn(OAc)2与DMC按质量比1:23(较优反应条件)混合,室温放置6 h后减压蒸馏,得到的DMC做FTIR表征;
(c) 按(b)中所示物料配比,将[Bmim]OAc-0.5Zn(OAc)2及DMC加入反应釜,160 ℃下处理2 h,降温后减压蒸馏,得到的DMC做FTIR表征。
由图 13(a)、(b)可知:纯DMC和室温处理的DMC谱图中,在1 767和1 753 cm−1处均有2个尖峰,是DMC羰基的伸缩振动峰[24]。但160 ℃处理的DMC(图 13(c))在1 746 cm−1处出现了羰基的伸缩振动峰,与图 13(a)、(b)相比,DMC中羰基与酯基C─O形成的共轭结构所产生的裂分消失且发生了红移,推测可能是[Bmim]OAc-0.5Zn(OAc)2中的Zn2+与DMC中的羰基氧相互作用,使羰基上共用电子对向氧方向偏移,降低了羰基的振动频率,破坏了羰基与酯基的共轭结构。图 13(c)中678和608 cm−1处有2个小峰出现,推测是Zn─O键的伸缩振动峰[23]。
综上可知,[Bmim]OAc-0.5Zn(OAc)2与DMC在160 ℃处理后,DMC的羰基氧与Zn2+作用形成了新的配合物,而室温处理无此变化。
3.4.1.3 [Bmim]OAc-0.5Zn(OAc)2与DMC的作用机理依据上述FTIR分析及图 3结构式,推测[Bmim]OAc-0.5Zn(OAc)2与DMC的作用机理如图 14所示:
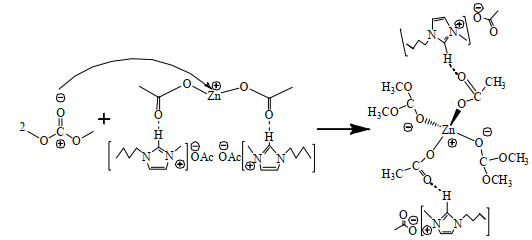
|
图 14 [Bmim]OAc-0.5Zn(OAc)2与DMC的作用机理 Fig.14 Interreaction mechanism of [Bmim]OAc-0.5Zn(OAc)2 with DMC |
加热条件下,分子运动速率加快,促进了[Bmim]OAc-0.5Zn(OAc)2中单齿配位的Zn2+与DMC中羰基上显负电氧的配位,形成Zn─O配位键,生成新的配位化合物。
3.4.2 [Bmim]OAc-0.5Zn(OAc)2与TDA的作用机理分析为分析[Bmim]OAc-0.5Zn(OAc)2与TDA的作用机理,对[Bmim]OAc-0.5Zn(OAc)2与TDA作用前后进行FTIR表征。
3.4.2.1 [Bmim]OAc-0.5Zn(OAc)2与TDA作用前后的FTIR表征分别对如下(a)~(d)所示的[Bmim]OAc-0.5Zn(OAc)2、TDA及其混合物进行FTIR表征,结果如图 15所示。
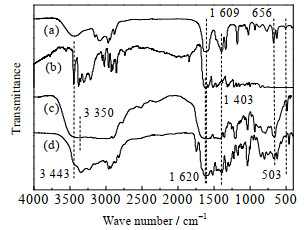
|
图 15 TDA、[Bmim]OAc-0.5Zn(OAc)2及其混合物的红外谱图
Fig.15 FTIR spectra of TDA, [Bmim]OAc-0.5Zn(OAc)2 and their mixtures
(a) [Bmim]OAc-0.5Zn(OAc)2 (b) TDA (c) m(TDA): m([Bmim]OAc-0.5Zn(OAc)2)=1:0.95, room temperature (d) m(TDA): m([Bmim]OAc-0.5Zn(OAc)2)=1:0.95, 160 ℃, 2 h |
(a) 新鲜[Bmim]OAc-0.5Zn(OAc)2;
(b) 纯TDA;
(c) TDA与[Bmim]OAc-0.5Zn(OAc)2按质量比1:0.95混合,室温研磨均匀后放置6 h,混合物做FTIR表征;
(d) 按(c)中的比例将[Bmim]OAc-0.5Zn(OAc)2与TDA加入反应釜,160 ℃处理2 h(N2保护),然后混合物做FTIR表征。
由图 15(b)可知,在3 443、1 620 cm−1处出现了TDA中氨基的伸缩振动峰[23-24];室温处理后(图 15(c)),3 443 cm−1处氨基的伸缩振动峰明显变宽,是因为[Bmim]OAc-0.5Zn(OAc)2与TDA混合后,3 443 cm−1处峰重叠,且此离子液体为亲水型,研磨放置过程中吸收空气中水分,3 350 cm−1处为水分子O─H的特征吸收峰,水在离子液体中形成氢键,使O─H特征吸收峰伸缩振动频率降低,吸收强度增大,谱带变宽,影响了氨基吸收峰;160 ℃处理后(图 15(d)),3 443 cm−1处氨基的吸收峰减弱,推测是[Bmim]OAc-0.5Zn(OAc)2中乙酸根与TDA中的氨基形成了氢键(N─H…O),使氨基的振动频率降低,吸收强度增大,谱带变宽[24]。
不同温度处理的混合物的谱图 15(c)、(d)中,乙酸锌单齿型配位结构的伸缩振动峰在1 609、1 403 cm−1处出现[19],Zn─O键的出峰位置在656、503 cm−1处[20],均在对应位置附近,几乎没有变化。
由上述分析可知,[Bmim]OAc-0.5Zn(OAc)2与TDA经160 ℃处理后,乙酸根与TDA的氨基形成了氢键(N─H…O),TDA与[Bmim]OAc-0.5Zn(OAc)2均没有发生键的断裂。
3.4.2.2 [Bmim]OAc-0.5Zn(OAc)2与TDA的作用机理通过对图 15的分析,推测[Bmim]OAc-0.5Zn(OAc)2与TDA的作用机理为:在加热状态下,分子运动加快,促进了TDA中的氨基与离子液体中[Bmim]OAc的乙酸根之间氢键(N—H…O)的形成,活化了TDA,进而可以促进TDA对[Bmim]OAc-0.5Zn(OAc)2与DMC形成的配合物中羰基碳的攻击,加快反应的进行。作用机理如图 16所示。苯胺与DMC反应合成苯氨基甲酸酯是与本研究类似的反应,Zhang等[13]曾对[PEmim]PbCl3催化该反应进行模拟计算,结果表明,催化剂的碱性位是通过形成氢键活化苯胺,活化的苯胺进攻被催化剂酸性位活化的DMC,促进了反应的进行。
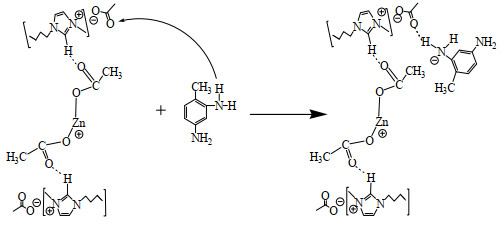
|
图 16 [Bmim]OAc-0.5Zn(OAc)2与TDA的作用机理 Fig.16 Interreaction mechanism of [Bmim]OAc-0.5Zn(OAc)2 with TDA |
由上述[Bmim]OAc-0.5Zn(OAc)2分别与反应物作用的结果可知,[Bmim]OAc-0.5Zn(OAc)2与TDA之间没有新配合物的生成;[Bmim]OAc-0.5Zn(OAc)2与DMC作用后形成了新配合物,此配合物可能是合成TDC反应的活性中间体。为此,进行实验予以确认。
将[Bmim]OAc-0.5Zn(OAc)2与DMC按质量比1:23加入反应釜,160 ℃加热2 h后冷却至室温;再将TDA与DMC按物质的量比1:30加入TDA,升温至160 ℃、反应4 h停止反应。对所得产物做红外光谱表征,如图 17所示。无论是峰形还是出峰位置,图 17与文献[23]中TDC标准品谱图几乎一致,说明按上述步骤所得产物即为TDC。经定量分析,产物收率为94.28%。而在相同物料配比、相同温度和反应时间下,正常操作合成TDC的收率为94.50% (3.3节)。2种操作所得TDC收率基本相同,说明[Bmim]OAc-0.5Zn(OAc)2与DMC作用形成的新配合物为合成TDC反应的活性中间体。
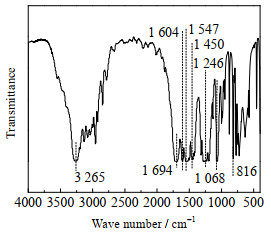
|
图 17 反应产物的红外谱图 Fig.17 IR spectrum of reaction product |
综上可知,[Bmim]OAc-0.5Zn(OAc)2同时具有酸性位和碱性位,其催化合成TDC,是酸性位Zn2+与DMC形成配位化合物,与碱性位乙酸根活化了氨基的TDA发生的甲氧羰基化过程。反应机理如图 18所示:
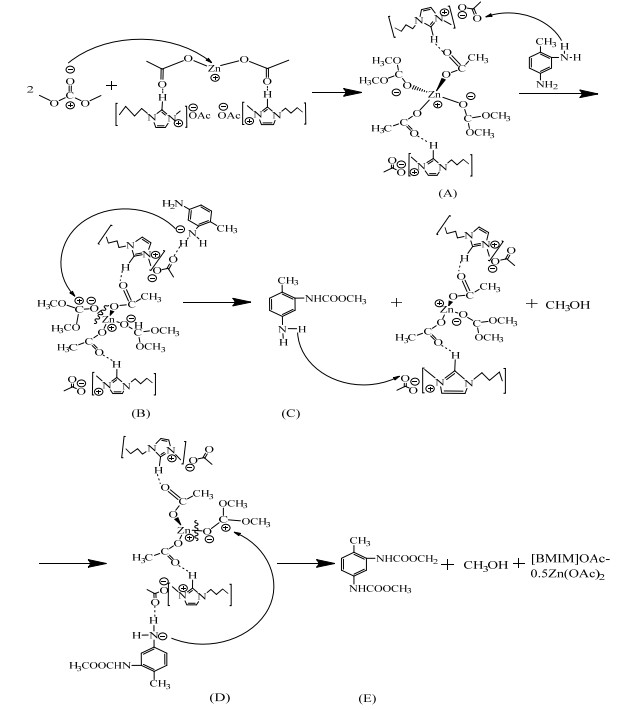
|
图 18 [Bmim]OAc-0.5Zn(OAc)2催化合成TDC反应机理 Fig.18 Reaction mechanism of TDC synthesis catalyzed by [Bmim]OAc-0.5Zn(OAc)2 |
(1) [Bmim]OAc-0.5Zn(OAc)2的酸性位Zn2+与DMC中的羰基氧作用形成新配合物(A),使DMC中的羰基碳带更多正电荷,活化了羰基碳,增加了DMC的亲电性。
(2) [Bmim]OAc-0.5Zn(OAc)2的碱性位乙酸根与TDA的氨基作用形成氢键(N─H…O,图 18中(B)),使氨基上氮带有更多负电荷,活化了TDA,增加了TDA的亲核性。
(3) TDA中带有负电荷的氮进攻新配合物中带正电荷的羰基碳,配合物中的Zn─O键断裂,生成中间产物单氨基甲酸甲酯(C)和甲醇。
(4) (C)中另一个氨基再与碱性位乙酸根作用形成氢键(如(D)所示),进而继续进攻新配合物中的羰基碳,最终生成产物(E)(即TDC),同时[Bmim]OAc-0.5Zn(OAc)2恢复到原来的结构。
上述机理中,[Bmim]OAc-0.5Zn(OAc)2具有酸碱协同催化作用,[Bmim]OAc-0.5Zn(OAc)2与DMC作用形成新配合物是催化反应的关键。
4 结论(1) [HO3S-(CH2)4-mim]Cl-0.5Zn(OAc)2、[PEmim]Cl-0.5Zn(OAc)2以及[Bmim]OAc-0.5Zn(OAc)2 3种离子液体中,[Bmim]OAc-0.5Zn(OAc)2对合成TDC具有较高催化活性。
在Zn(OAc)2与[Bmim]OAc物质的量比不同的[Bmim]OAc-xZn(OAc)2中,[Bmim]OAc-0.5Zn(OAc)2催化活性好,TDC收率较高。FTIR和1H-NMR分析表明,[Bmim]OAc-0.5Zn(OAc)2中乙酸锌为单齿配位结构。
(2) 在80 ℃下反应3 h,所合成[Bmim]OAc-0.5Zn(OAc)2的催化活性高。合成TDC的较优反应条件为:n(TDA): n(DMC)=1:30,m(TDA): m([Bmim]OAc-0.5Zn(OAc)2)=1:0.95,160 ℃,反应6 h;该条件下,TDC收率达94.50%。
(3) 借助FTIR表征及实验验证,推测了反应机理。表明[Bmim]OAc-0.5Zn(OAc)2具有酸碱协同催化作用,其酸性位(Zn2+)与DMC羰基上的氧进行配位,活化了羰基碳原子;而碱性位(乙酸根)与TDA上氨基形成氢键,活化了TDA;被活化的TDA作为亲核试剂进攻配合物中的羰基碳,从而完成亲核取代反应生成TDC。[Bmim]OAc-0.5Zn(OAc)2与DMC作用形成新配合物是催化反应的关键。
| [1] |
张晓鹏, 荆唤芝, 彭惟于, 等. 硒催化羰基化合成苯氨基甲酸酯和二苯甲烷二氨基甲酸酯[J]. 有机化学, 2017, 37(2): 411-417. ZHANG X P, JING H Z, PENG W Y, et al. Selenium-catalyzed carbonylation to phenylcarbamates and methylene diphenyl dicarbamates[J]. Chinese Journal of Organic Chemistry, 2017, 37(2): 411-417. |
| [2] |
彭向聪, 王志苗, 李红芹, 等. 溶剂热浸渍法制备高稳定性Zn(OAc)2/SiO2催化剂及其催化合成苯氨基甲酸甲酯[J]. 化工进展, 2019, 38(3): 1396-1402. PENG X C, WANG Z M, LI H Q, et al. Preparation of Zn(OAc)2/SiO2 catalyst with better stability prepared by solvothermal impregnation method and its application in methyl N-phenyl carbamate[J]. Chemical Industry and Engineering Progress, 2019, 38(3): 1396-1402. |
| [3] |
WANG P X, LIU S M, DENG Y Q. Important green chemistry and catalysis: Non-phosgene syntheses of isocyanates-thermal cracking way[J]. Chinese Journal of Chemistry, 2017, 35(6): 821-835. DOI:10.1002/cjoc.201600745 |
| [4] |
PISANU T, STEVEN S. Carbamate synthesis on Pd/C catalysts: Gas-solid versus slurry processes[J]. Industrial & Engineering Chemistry Research, 2004, 43(5): 1192-1199. |
| [5] |
SHI F, DENG Y Q, SIMA T L, et al. A novel PdCl2/ZrO2-SO42− catalyst for synthesis of carbamates by oxidative carbonylation of amines[J]. Journal of Catalysis, 2001, 203(3): 525-528. |
| [6] |
耿艳楼, 方鸿刚, 安华良, 等. 尿素法合成甲苯-2, 4-二氨基甲酸正丙酯反应[J]. 石油学报(石油加工), 2013, 29(3): 85-91. GENG Y L, FANG H G, AN H L, et al. Synthesis of dipropyl toluene-2, 4-dicarbamate via urea route[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2013, 29(3): 85-91. |
| [7] |
WANG G R, MA D, JIA X Q, et al. In situ preparation of nanometer-scale zinc oxide from zinc acetate in the reaction for the synthesis of dimethyl toluene dicarbamate and its catalytic decomposition performance[J]. Industrial & Engineering Chemistry Research, 2016, 55(29): 8011-8017. |
| [8] |
张莉娜, 刘大伟, 李枫, 等. 负载型Zn(OAc) 2催化合成1, 6-六亚甲基二氨基甲酸甲酯[J]. 精细化工, 2016, 33(1): 109-116. ZHANG L N, LIU D W, LI F, et al. Synthesis of dimethylhexane-1, 6-dicarbamate over supported zinc acetate catalyst[J]. Fine Chemicals, 2016, 33(1): 109-116. |
| [9] |
TOSHIHIDE B, AKANE K, TATSUYA Y, et al. Catalytic methoxycarbonylation of aromatic diamines with dimethyl carbonate to their dicarbamate using zinc acetate[J]. Catalysis Letters, 2002, 82(3/4): 193-197. DOI:10.1023/A:1020566928295 |
| [10] |
王延吉, 王桂荣, 贾晓强, 等. 利用甲苯二胺和碳酸二甲酯制备甲苯二异氰酸酯的工艺: CN, 201410148796.5 [P]. 2015-06-10. WANG Y J, WANG G R, JIA X Q, et al. Preparation of toluene diisocyanate from toluene diamine and dimethyl carbonate: CN, 201410148796.5 [P]. 2015-06-10. |
| [11] |
ZHOU H C, SHI F, TIAN X, et al. Synthesis of carbamates from aliphatic amines and dimethyl carbonate catalyzed by acid functional ionic liquids[J]. Journal of Molecular Catalysis A: Chemical, 2007, 271(1/2): 89-92. |
| [12] |
康丽娟. 新型Bronsted-Lewis双酸性离子液体的合成、表征及应用[D]. 天津: 河北工业大学, 2012. KANG L J. Synthesis, characterization and application of novel Bronsted-Lewis acidic ionic liquids [D]. Tianjin: Hebei University of Technology, 2012. |
| [13] |
ZHANG L F, YANG Y, XUE Y R, et al. Experimental and theoretical investigation of reaction of aniline with dimethyl carbonate catalyzed by acid–base bifunctional ionic liquids[J]. Catalysis Today, 2010, 158(3/4): 279-285. |
| [14] |
ZHAO X Q, KANG L J, WANG N, et al. Synthesis of methyl N-phenyl carbamate catalyzed by ionic liquid-promoted zinc acetate[J]. Industrial & Engineering Chemistry Research, 2012, 51(35): 11335-11340. |
| [15] |
孔云环. 新型酸-碱双功能离子液体的制备、表征及催化正戊醛自缩合反应性能[D]. 天津: 河北工业大学, 2018. KONG Y H. Preparation and characterization of novel acid-base bifunctional ionic liquids and their catalytic performance for n-valeraldehyde self-condensation [D]. Tianjin: Hebei University of Technology, 2018. |
| [16] |
荆煦瑛, 陈式棣, 么恩云. 红外光谱实用指南[M]. 天津: 科学技术出版社, 1992. JING X Y, CHEN S D, YAO E Y. Practical guide of infrared spectrum[M]. Tianjin: Science and Technology Press, 1992. |
| [17] |
中本一雄. 无机和配位化合物的红外和拉曼光谱[M]. 黄德如, 汪仁庆, 译. 北京: 化学工业出版社, 1991. KAZUO N. Infrared and Raman spectra of inorganic and coordination compound [M]. HUANG D R, WANG R Q. trans. Beijing: Chemical Industry Press, 1991. |
| [18] |
LIU F S, LI L, YU S T, et al. Methanolysis of polycarbonate catalysed by ionic liquid [Bmim][Ac][J]. Journal of Hazardous Materials, 2011, 189(1/2): 249-254. |
| [19] |
翁诗甫. 傅里叶变换红外光谱仪[M]. 北京: 化学工业出版社, 2005. WENG S F. Fourier transform infrared spectrometer[M]. Beijing: Chemical Industry Press, 2005. |
| [20] |
MORRISON R T, BOYD R N. 有机化学[M]. 复旦大学有机化学教研室译. 北京: 科学出版社, 1992. MORRISON R T, BOYD R N. Organic chemistry [M]. Organic Chemistry Teaching Groups of Fudan University, trans. Beijing: Science Press, 1992. |
| [21] |
闫美芳, 谭强强, 刘展, 等. 无磷非氮型绿色阻垢分散剂的合成及性能研究[J]. 高校化学工程学报, 2021, 35(1): 83-91. YAN M F, TAN Q Q, LIU Z, et al. Synthesis and properties of phosphorus-free and non-nitrogen green scale inhibitor and dispersant[J]. Journal of Chemical Engineering of Chinese Universities, 2021, 35(1): 83-91. |
| [22] |
王胜平. 用碳酸二甲酯代替光气合成甲苯二异氰酸酯—甲苯二氨基甲酸甲酯合成[D]. 天津: 河北工业大学, 2000. WANG S P. Synthesis of toluene diisocyanate with dimethyl carbonate instead of phosgene—the synthesis of toluene dicarbamate [D]. Tianjin: Hebei University of Technology, 2000. |
| [23] |
马丹, 王桂荣, 王延吉, 等. 利用红外光谱分析乙酸锌催化合成2, 4-甲苯二氨基甲酸甲酯的反应机理[J]. 光谱学与光谱分析, 2009, 29(2): 331-335. MA D, WANG G R, WANG Y J, et al. Application of IR spectrum to the research on mechanism of synthesis of 2, 4-toluene dicarbamate catalyzed by zinc acetate[J]. Spectroscopy and Spectral Analysis, 2009, 29(2): 331-335. |
| [24] |
孟令芝, 龚淑玲, 何永炳. 有机波谱分析[M]. 3版. 武汉: 武汉大学出版社, 2009. MENG L Z, GONG S L, HE Y B. Organic spectral analysis[M]. 3rd ed. Wuhan: Wuhan University Press, 2009. |




