2. 南京工业大学 材料化学工程国家重点实验室, 江苏 南京 210009
2. State Key Laboratory of Materials-Oriented Chemical Engineering, Nanjing Tech University, Nanjing 210009, China
羧酸酯催化加氢制双醇是一条绿色清洁的原子经济反应路线,其关键是加氢催化剂的研究与开发。近年来,作为传统的化工原料或能源,乙醇和异丙醇因在各个领域内的广泛应用,需求量迅猛增加[1~3],其产能远低于表观消费量,且生产多以消耗石油资源为代价,存在原料来源短缺、生产成本高等缺点[4~6]。鉴于此,开发利用其它资源合成乙醇及异丙醇具有重要的战略和经济意义。利用醋酸异丙酯催化加氢同时制备乙醇和异丙醇,不仅符合原子经济性反应原则,同时原料醋酸异丙酯可通过醋酸与丙烯直接加成酯化而得[7],从而间接缓解醋酸产能严重过剩的问题。目前,对其它羧酸酯加氢反应的催化剂、工艺条件研究报道较多[8~12],其中部分体系的反应动力学也有了深入的分析,如Cu/SiO2催化剂下草酸二甲酯加氢合成乙二醇的动力学研究等[13]。尽管如此,针对醋酸异丙酯催化加氢制备乙醇和异丙醇反应的报道很少,其机理和动力学研究更是未见报道。
通过前期对催化剂的制备、筛选及工艺条件的优化研究,筛选出了20Cu-8ZnO/SiO2-5K2O催化剂,该催化剂下醋酸异丙酯的转化率可达到99%左右,乙醇和异丙醇的收率分别达到95% 和94%以上,且反应条件温和、工艺清洁,具有工业化应用前景。因此本文采用该催化剂,进行醋酸异丙酯加氢制备乙醇和异丙醇的反应动力学研究。借助气相色谱和气质联用仪分析得到的产物组成及含量分布,深入剖析醋酸异丙酯催化加氢的反应机理,提出该复杂体系的反应网络;利用三段控温的固定床反应器,在消除内、外扩散阻力的条件下,进行醋酸异丙酯加氢本征动力学数据测定;结合实验结果,在合理简化反应网络的基础上建立本征动力学模型,采用Matlab软件拟合出该模型中的相关参数,并进行模型适定性检验,为今后工业反应器的设计、放大奠定动力学基础。
2 实验部分 2.1 主要试剂及仪器醋酸异丙酯,纯度为99.0%,国药集团化学试剂有限公司;H2,纯度为99.99%,南京三乐气体有限公司;20Cu- 8ZnO/SiO2-5K2O催化剂,自制。
LC-100型高压恒流泵,南京科捷分析仪器厂;SP-6890型气相色谱仪,山东鲁能瑞虹化工仪器有限公司;气质联用(GC-MS) 分析仪,南京大学现代分析中心。
2.2 实验装置与流程醋酸异丙酯催化加氢反应动力学实验在三段控温的固定床反应器上进行,反应器高度650 mm,内径20 mm。在反应管的下端与上端分别填装一定质量的石英砂,将一定量的催化剂与相同粒径的石英砂以质量比1:10稀释均匀后填装于反应管的中段。反应装置如图 1所示。
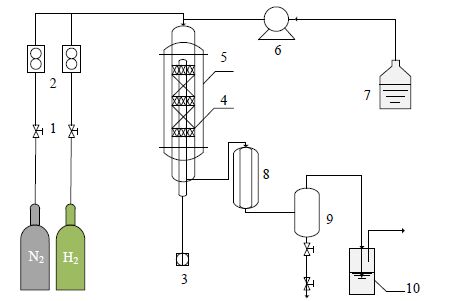
|
图 1 醋酸异丙酯催化加氢实验流程图 Fig.1 Setup for isopropyl acetate hydrogenation 1. check valve 2. mass flowmeter 3. thermocouple 4. tubular reactor 5. heating furnace 6. high pressure constant flow pump 7. material storage tank 8. condenser 9. gas liquid separator 10. absorption bottle |
反应时,原料醋酸异丙酯由高压恒流泵打入预热器,经质量流量计计量后的H2与醋酸异丙酯混合,进入反应器上段预热汽化后在催化剂表面进行加氢反应,反应产物经冷凝器冷凝后进入气液分离器,收集液体产物进行色谱分析。
2.3 动力学数据测定 2.3.1 内、外扩散影响的消除实验在280℃ 的高温下,控制催化剂用量和醋酸异丙酯进料流量不变,依次考察氢酯摩尔比为20、25、30、40和50时醋酸异丙酯的转化率的变化,得到外扩散阻力消除的条件;通过用不同粒径的催化剂,在恒定气体线速度下,测定催化剂粒径分别为0.45~0.90 mm,0.30~0.45 mm,0.21~0.3 mm及0.16~0.21 mm时醋酸异丙酯的转化率的变化,得到内扩散阻力消除的条件。
2.3.2 本征动力学数据的测定在消除了内、外扩散影响的前提下测定该反应动力学数据。实验条件:氢酯进料摩尔比分别为30、40、50和60;反应温度分别为250、260、270和280℃;醋酸异丙酯进料流量分别为0、0.04、0.05、0.06、0.08、0.10、0.15和0.20 mL⋅min-1。
2.4 分析方法实验得到的产物经SP-6890型气相色谱仪分析,色谱柱为SE-30型高效毛细管色谱柱(规格0.25 mm×30 m×0.5 μm),选取环己烷作为内标物进行定量分析,计算醋酸异丙酯转化率和产物收率。具体分析条件:色谱柱温度:75℃;检测器温度:200℃;汽化室温度:260℃;载气:99.99% N2;载气压力:0.06 MPa;氢气压力:0.05 MPa;柱前压 (N2):0.05 MPa。
醋酸异丙酯的转化率(x1)和乙醇的收率(Y3)计算方法如下:
| ${{x}_{1}}=\frac{已转化的醋酸异丙酯的质量}{投入的醋酸异丙酯的总质量}\times \text{100 }\!\!%\!\!\text{ }$ |
| ${{Y}_{3}}=\frac{生成乙醇所消耗的醋酸异丙酯的质量}{醋酸异丙酯的总质量}\times \text{100 }\!\!%\!\!\text{ }$ |
自行研发的20Cu-8ZnO/SiO2-5K2O催化剂,活性组分是Cu,助催化剂ZnO的存在可显著提高CuO在载体SiO2上的分散度,还可以阻止SiO2将Cu活性中心表面覆盖,向C=O键提供额外的吸附点,从而有利于加氢反应的进行[14];K2O的存在可降低催化剂表面的酸性,抑制酸性条件下乙醇和异丙醇的各脱水反应及乙醇与乙酸酯化生成乙酸乙酯的反应。
醋酸异丙酯催化加氢是一种典型的气固相催化反应,在催化剂作用下,反应气体在催化剂的表面上发生吸附、表面反应、脱附等表面反应过程。通入H2活化催化剂后,催化剂表面的CuO被还原为Cu0 和Cu+,其中,起活性作用的是Cu0,但适量Cu+ 的存在可以在一定程度上起到稳定基团的作用[15]。反应时,氢分子首先经过ZnO的吸附,进而再迁移到邻近的活性位Cu元素上[14],在Cu0活性位上发生解离吸附,生成的吸附态氢原子分别与醋酸异丙酯的一个乙酰基和一个异丙氧基发生加氢反应,从而生成乙醇和异丙醇。推测醋酸异丙酯催化加氢的反应机理,如图 2所示,其中第(1)步是还原步骤,第(2)步是反应步骤。
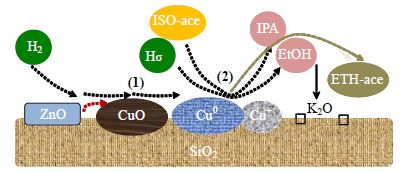
|
图 2 催化剂表面的反应机理图 Fig.2 Mechanism of the reaction happened on the surface of the catalyst ISO-ace (醋酸异丙酯); IPA (异丙醇); EtOH (乙醇); ETH-ace (乙酸乙酯) |
从宏观角度来看,醋酸异丙酯催化加氢反应是一个复杂的反应体系,除了主反应外,还存在多个副反应。将反应产物通过气相色谱并结合气质联用仪分析,发现产物中除未反应完的原料醋酸异丙酯和主产物乙醇、异丙醇外,还包含乙酸乙酯乙醚、异丙醚、乙基异丙基醚、2-戊醇和2-己醇等组分。
主反应:醋酸异丙酯加氢生成乙醇和异丙醇。
副反应:
Step1: 酯交换反应:醋酸异丙酯与乙醇酯交换生成乙酸乙酯和异丙醇;
Step2~6 脱水反应:分别为2分子乙醇脱水生成乙醚,2分子的异丙醇脱水生成异丙醚或2-己醇,1分子的乙醇和1分子的异丙醇脱水生成乙基异丙基醚或2-戊醇;
Step7 水解反应:醋酸异丙酯水解生成乙酸和异丙醇;
Step8 酯化反应:乙酸和乙醇酯化生成乙酸乙酯;
Step9 还原反应:乙酸加氢还原为乙醇;
Step10 加氢反应:乙酸乙酯加氢生成乙醇。
其中酯交换反应①为最显著的副反应,因为是原料醋酸异丙酯与主产物之一的乙醇发生反应,反应物浓度高,生成速率快,因此产物中有较多的乙酸乙酯生成;②~⑥是生成的目的产物乙醇和异丙醇发生的多个脱水反应,酸性催化剂有利于脱水反应,因此要降低催化剂的酸性,以尽量避免脱水反应,从而提高主产物的选择性。水的来源一方面是原料夹带较少量的水分,另一方面是通过上述脱水反应而得;形成的水与醋酸异丙酯水解生成乙酸和异丙醇;在酸性条件下乙酸与乙醇易发生酯化反应生成乙酸乙酯。由实验结果可知乙酸乙酯作为副产物,在醋酸异丙酯低转化率时含量较高,随着转化率提高,乙酸乙酯的含量显著降低,这是因为乙酸乙酯进一步催化加氢生成了乙醇,此外,乙酸也可在氢气存在下加氢还原生成乙醇。由此提出醋酸异丙酯加氢体系的反应网络,如图 3所示。
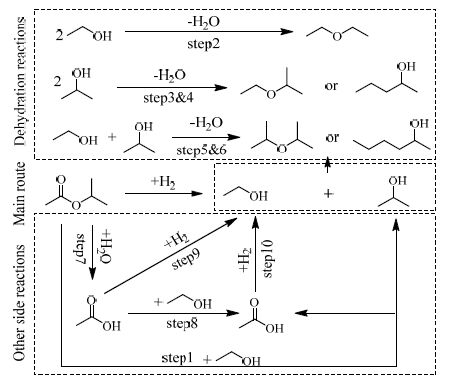
|
图 3 醋酸异丙酯加氢体系反应网络图 Fig.3 Reaction networks of isopropyl acetate hydrogenation |
混合气体的总质量流速取决于醋酸异丙酯进料流量以及醋酸异丙酯与氢气的进料摩尔比。当醋酸异丙酯进料流量一定时,原料氢酯比越小,则总的质量流速越小、醋酸异丙酯浓度越高,越不容易消除外扩散[16]。因此,控制进料速度恒定,提高氢酯摩尔比,即提高总质量流速,此时若转化率不随氢酯比改变,则表明总质量流速的改变不影响转化率,此时认为外扩散阻力已消除。实验在5.0 MPa,280℃温度下,控制催化剂用量和醋酸异丙酯进料流量(0.04 mL⋅min-1)不变,考察氢酯摩尔比的改变对醋酸异丙酯转化率的影响,结果如图 4所示。由图 4可知,当氢酯摩尔比大于30后,继续提高氢酯比对醋酸异丙酯转化率几乎没有影响,因此可认为本实验中进料氢酯摩尔比大于30时,催化剂的外扩散阻力已消除。
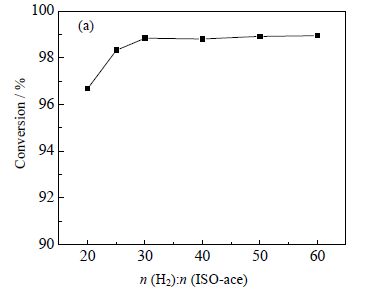
|
图 4 氢酯摩尔比对醋酸异丙酯转化率的影响 Fig.4 Effects of n (H2):n (ISO-ace) on isopropylacetate conversion |
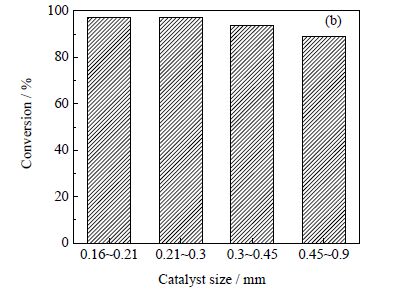
选择氢酯比为30,在相同实验条件下(温度280℃,压力5 MPa,醋酸异丙酯进样量0.04 mL⋅min-1)考察不同催化剂粒径对醋酸异丙酯转化率的影响,结果如图 5所示。由图 5可知,随着催化剂颗粒粒径的增大,醋酸异丙酯的转化率逐渐减小。其中,当催化剂粒径从0.21~0.30 mm减小到0.16~0.21 mm时,醋酸异丙酯的转化率仅增加了0.05%,表明催化剂粒径小于0.30 mm时,可不考虑内扩散的影响。催化剂过细容易造成流失,因此在动力学实验中均采用粒径为0.21~0.30 mm的催化剂。
|
图 5 催化剂粒径对醋酸异丙酯转化率的影响 Fig.5 Effects of catalyst size on isopropyl acetate conversion |
通过实验数据的测定与分析,发现除乙醇和异丙醇两个主产物外,乙酸乙酯的生成量也较高,尤其在温度较低的情况下更为严重;副产物2-戊醇和2-己醇的生成量均在1.5%(wt)以下,其它副产物的量均低于0.5%(wt),可忽略不计。为了动力学模型不过于复杂,副产物2-戊醇和2-己醇也忽略不计。由此,对反应网络进行合理的简化,简化后的反应网络由以下三个反应构成:
| $\text{C}{{\text{H}}_{3}}\text{COOCH}{{\left( \text{C}{{\text{H}}_{3}} \right)}_{2}}+2{{\text{H}}_{2}}\to \text{C}{{\text{H}}_{3}}\text{C}{{\text{H}}_{2}}\text{OH}+\text{C}{{\text{H}}_{3}}\text{CHOHC}{{\text{H}}_{3}}$ | (1) |
| $\text{C}{{\text{H}}_{\text{3}}}\text{COOCH}{{\left( \text{C}{{\text{H}}_{\text{3}}} \right)}_{\text{2}}}\text{+}{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH}\Leftrightarrow \text{C}{{\text{H}}_{\text{3}}}\text{COO}{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{+C}{{\text{H}}_{\text{3}}}\text{CHOHC}{{\text{H}}_{\text{3}}}$ | (2) |
| $\text{C}{{\text{H}}_{\text{3}}}\text{COO}{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{+2}{{\text{H}}_{\text{2}}}\to 2\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{2}}\text{OH}$ | (3) |
由反应方程式(1)~(3) 可知,除醋酸异丙酯加氢的主反应外,反应体系中还包括醋酸异丙酯与乙醇的酯交换反应以及乙酸乙酯与氢气的进一步加氢生成乙醇的反应;但该反应网络中独立的化学反应只有两个(式(2)与式(3)相加即为式(1))。将上述两个独立反应方程式 (1)和(2)表示为如下形式:
| $\text{A+2}{{\text{H}}_{\text{2}}}\xrightarrow{{{k}_{\text{1}}}}\text{R+Q}$ | (4) |
| $\text{A+R}\xrightarrow{{{k}_{2}}}\text{D+Q}$ | (5) |
假设A(醋酸异丙酯)为组分1,H2 为组分2,R(乙醇)为组分3,Q(异丙醇)为组分4,D(乙酸乙酯)为组分5;同时假设:反应 (4) 对醋酸异丙酯的反应级数为 α1,对 H2 的反应级数为 α2;反应 (5) 对醋酸异丙酯的反应级数为 β1,对乙醇的反应级数为 β2。
由于进料氢酯比较高,H2组分大大过量,反应过程中H2分压的变化可忽略不计,故模型中不计参数 α2。
醋酸异丙酯总的消耗速率和乙醇总的生成速率分别为:
| $-{{R}_{A}}=-{{r}_{A1}}-{{r}_{A2}}={{k}_{1}}p_{A}^{{{\alpha }_{1}}}+{{k}_{2}}p_{A}^{{{\beta }_{1}}}p_{R}^{{{\beta }_{2}}}={{R}_{Q}}$ | (6) |
| ${{R}_{R}}={{r}_{R1}}-{{r}_{R2}}={{k}_{1}}p_{A}^{{{\alpha }_{1}}}-{{k}_{2}}p_{A}^{{{\beta }_{1}}}p_{R}^{{{\beta }_{2}}}$ | (7) |
式(6)~(7)中:k1与k2分别为反应(4)和反应(5)的反应速率常数;pA与pR分别为组分1和3的分压。此外,反应过程中异丙醇的生成速率与醋酸异丙酯的消耗速率相等,以醋酸异丙酯和乙醇为关键组分,其它三个组分为非关键组分。引入两个反应的反应进度为:ζ1、ζ2,将其它组分的摩尔流量用关键组分摩尔流量表示。那么:F1 = F10-ζ1-ζ2,F2 = F20-2ζ1,F 3 = ζ1-ζ2,F 4 = ζ1+ζ2,F 5 = ζ2 (F10 = FA0,即醋酸异丙酯的初始流量,F20 = α FA0,即氢气的初始流量,α为氢酯摩尔比)。通过这5个等式可以推出:F 2 = F20 - F10 + F 1 - F 3,F4 = F10 - F1,F 5 = 0.5·(F10 - F1 - F3),5个组分的总流量为:
| $\sum\limits_{i=1}^{5}{{{F}_{i}}}={{F}_{20}}+0.5\cdot ({{F}_{10}}+{{F}_{1}}-{{F}_{3}})$ | (8) |
各组分的分压可以通过
| ${{p}_{A}}=p\frac{2{{F}_{1}}}{2{{F}_{20}}+{{F}_{10}}+{{F}_{1}}-{{F}_{3}}}=p\frac{2(1-{{x}_{1}})}{2\alpha +2-{{x}_{1}}-{{Y}_{3}}}$ | (9) |
| ${{p}_{R}}=p\frac{2{{F}_{3}}}{2{{F}_{20}}+{{F}_{10}}+{{F}_{1}}-{{F}_{3}}}=p\frac{2{{Y}_{3}}}{2\alpha +2-{{x}_{1}}-{{Y}_{3}}}$ | (10) |
将式(9)~(10) 代入式(6)~(7) 并以微分方程的形式表达如下:
| $\begin{align} & -{{R}_{A}}=-\frac{d({{x}_{1}})}{d(W/{{F}_{10}})}={{k}_{1}}{{(p\frac{2(1-{{x}_{1}})}{2\alpha +2-{{x}_{1}}-{{Y}_{3}}})}^{{{\alpha }_{1}}}}+ \\ & {{k}_{2}}{{(p\frac{2(1-{{x}_{1}})}{2\alpha +2-{{x}_{1}}-{{Y}_{3}}})}^{{{\beta }_{1}}}}p\frac{2{{Y}_{3}}}{2\alpha +2-{{x}_{1}}-{{Y}_{3}}}{{}^{{{\beta }_{2}}}} \\ \end{align}$ | (11) |
| $\begin{align} & {{R}_{R}}=\frac{d({{Y}_{3}})}{d(W/{{F}_{10}})}={{k}_{1}}{{(p\frac{2(1-{{x}_{1}})}{2\alpha +2-{{x}_{1}}-{{Y}_{3}}})}^{{{\alpha }_{1}}}}- \\ & {{k}_{2}}{{(p\frac{2(1-{{x}_{1}})}{2\alpha +2-{{x}_{1}}-{{Y}_{3}}})}^{{{\beta }_{1}}}}p\frac{2{{Y}_{3}}}{2\alpha +2-{{x}_{1}}-{{Y}_{3}}}{{}^{{{\beta }_{2}}}} \\ \end{align}$ | (12) |
式 (11)~(12) 分别是关于醋酸异丙酯转化率和乙醇的收率对质量空时的微分方程,以醋酸异丙酯的转化率、乙醇的收率的实验测定值与模型计算值的残差平方和最小为目标函数,采用Matlab软件中的最小二乘法的lsqnonlin法为优化方法进行估值[17],拟合得到模型中的各个参数。根据Arrhenius方程,反应速率常数ki = ki0exp (-E/(RT)),其中ki0为各反应速率常数的指前因子;Ei为各步反应的活化能;Matlab拟合得到各参数,结果见表 1。
| 表 1 指前因子、活化能和反应级数 Table 1 Activation energies, pre-exponential factors and reaction orders |
由表 1可看出:两反应的活化能均在一个合理数值范围(10~60 kJ⋅mol-1),从两个活化能的比较可知,相对于醋酸异丙酯加氢反应,第二步酯交换反应更容易进行,这就可以解释为何低温时生成了更多的乙酸乙酯,随着反应温度的提高,乙酸乙酯进一步加氢生成了乙醇,因此在较高温度下乙酸乙酯生成量低,与实验数据吻合。此外,各反应级数均在0~3,数值合理,说明上述各动力学参数的物理意义是正确的。
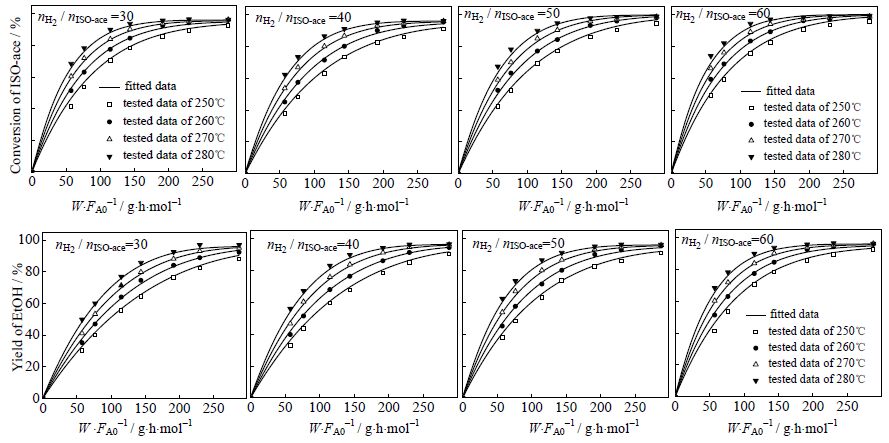
3.4.3 动力学模型检验将得到的动力学参数值代入式 (11)~(12) 中,采用ODE45解微分方程得到醋酸异丙酯的转化率和乙醇的收率,其计算值和实验值的比较见图 6。由图 6可知,醋酸异丙酯的转化率和乙醇的收率随质量空时的变化拟合值与实验值相对误差小,吻合良好。
|
图 6 实验测定值与拟合值的比较 (a) 醋酸异丙酯转化率随质量空时的变化 (b) 乙醇收率随质量空时的变化 Fig.6 Comparison of experimental data and predicted values (a) conversion of isopropyl acetate as a function of the space-time changes of quality (b) Yield of ethanol as a function of the space-time changes of quality |
通过数学统计方法,以参数ρ2、F、Ft的综合分析对动力学模型进行检验,判别模型的优劣。由于动力学模型是非线性的,故采用适用于非线性模型的统计方法进行检验。一般认为,当决定性指标(ρ2)大于0.9,统计量(F)大于10 F0.05时,模型高度适定。该模型统计检验表如表 2所示。由表 2可以看出,统计量(F)为8141.5,远大于10 F0.05,因此该模型是高度适定的[18]。因此,在所研究的温度、氢酯进料摩尔比下该模型是高度适定的,能较好地描述醋酸异丙酯加氢反应的动力学规律。
| 表 2 统计检验表 Table 2 Analysis of error statistics |
(1) 采用自行开发的20Cu-8ZnO/SiO2-5K2O催化剂,分析了催化剂各组分的作用,提出了醋酸异丙酯加氢制备乙醇和异丙醇的反应机理。通过对醋酸异丙酯加氢复杂反应体系中各主副反应的分析,提出了反应网络;其中,醋酸异丙酯与乙醇发生酯交换生成乙酸乙酯的反应和乙酸乙酯进一步加氢生成乙醇的反应为主要的副反应,为动力学模型的建立奠定了基础。
(2) 在三段控温的固定床反应器内,研究了醋酸异丙酯加氢反应的本征动力学,当催化剂粒径≤ 0.30 mm,氢酯摩尔进料比 ≥ 30的条件下可以消除催化剂的内外扩散阻力的影响。
(3) 在反应温度 250~280℃,氢酯进料摩尔比 30~60 的条件下测定了醋酸异丙酯加氢反应的动力学数据。采用 Matlab 软件中的非线性最小二乘法进行了拟合,估算出了该模型的参数,得到了醋酸异丙酯的消耗速率与乙醇的生成速率分别为:
| $\begin{align} & -{{R}_{\text{1}}}\text{=830}\text{.15 exp(}-\text{40}\text{.91/}RT\text{)}{{p}_{\text{1}}}^{\text{0}\text{.82}}\text{+} \\ & \text{1685 exp(}-\text{30}\text{.21/}RT\text{)}{{p}_{\text{1}}}^{\text{2}\text{.73}}{{p}_{\text{3}}}^{\text{0}\text{.38}}(mol\cdot {{g}^{-1}}\cdot {{h}^{-1}}) \\ \end{align}$ | (13) |
| $\begin{align} & {{R}_{\text{3}}}\text{=830}\text{.15 exp(}-\text{40}\text{.91/}RT\text{)}{{p}_{\text{1}}}^{\text{0}\text{.82}}- \\ & \text{1685 exp(}-\text{30}\text{.21/}RT\text{)}{{p}_{\text{1}}}^{\text{2}\text{.73}}{{p}_{\text{3}}}^{\text{0}\text{.38}}(mol\cdot {{g}^{-1}}\cdot {{h}^{-1}}) \\ \end{align}$ | (14) |
并进行了模型显著性检验,结果表明该动力学模型对醋酸异丙酯加氢制备乙醇和异丙醇高度适定的。
符号说明:
| 表 Table |
| [1] | San X, Zhang Y, Shen W . New synthesis method of ethanol from dimethyl ether with a synergic effect between the zeolite catalyst and metallic catalyst[J]. Energy & Fuels , 2009, 23 (5) : 2843-2844 |
| [2] | ZHANG Song-hong(张颂红), YAO Ke-jian(姚克俭), YAO Di(姚笛) . Compound solvent selection and experimental research of isopropyl alcohol-water extractive distillation(异丙醇-水萃取精馏的复合溶剂选择和实验研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2008, 22 (3) : 407-411 |
| [3] | Liu Y, Feist S D, Jones C M . Isopropyl alcohol dehydration by hot gas pressure swing adsorption:experiments, simulations, and implementation[J]. Industrial & Engineering Chemistry Research , 2014, 53 (20) : 8599-8607 |
| [4] | Talebnia F, Karakashev D, Angelidaki I . Production of bioethanol from wheat straw:an overview on pretreatment, hydrolysis and fermentation[J]. Bioresource Technology , 2010, 101 (13) : 4744-4753 DOI:10.1016/j.biortech.2009.11.080 |
| [5] | Shrestha P, Rasmussen M, Khanal S K . Solid-substrate fermentation of corn fiber by phanerochaete chrysosporium and subsequent fermentation of hydrolysate into ethanol[J]. Journal of Agricultural and Food Chemistry , 2008, 56 (11) : 3918-3924 DOI:10.1021/jf0728404 |
| [6] | Arifin S, Chien I . Combined preconcentrator/recovery column design for isopropyl alcohol dehydration process[J]. Industrial & Engineering Chemistry Research , 2007, 46 (8) : 2535-2543 |
| [7] | WEN Bin(文彬), WU Xiao-ju(伍小驹) . The research progress of isopropyl acetate synthesis(乙酸异丙酯合成研究进展)[J]. Fine Chemical Lntermediates(精细化工中间体) , 2002, 32 (3) : 7-8 |
| [8] | Wen C, Cui Y, Chen X . Reaction temperature controlled selective hydrogenation of dimethyl oxalate to methyl glycolate and ethylene glycol over copper-hydroxyapatite catalysts[J]. Applied Catalysis B:Environmental , 2015, 162 : 483-493 DOI:10.1016/j.apcatb.2014.07.023 |
| [9] | Kuriyama W, Matsumoto T, Ogata O . Catalytic hydrogenation of esters. development of an efficient catalyst and processes for synthesising (R)-1,2-propanediol and 2-(l-menthoxy) ethano[J]. Organic Process Research & Development , 2012, 16 (1) : 166-171 |
| [10] | Spasyuk D, Gusev D G . Acceptorless dehydrogenative coupling of ethanol and hydrogenation of esters and imines[J]. Organometallics , 2012, 31 (15) : 5239-5242 DOI:10.1021/om300670r |
| [11] | Zhu Y, Zhu Y, Ding G . Highly selective synthesis of ethylene glycol and ethanol via hydrogenation of dimethyl oxalate on Cu catalysts:influence of support[J]. Applied Catalysis A:General , 2013, 468 : 296-304 DOI:10.1016/j.apcata.2013.09.019 |
| [12] | Zhu Y, Shi X W L . Hydrogenation of ethyl acetate to ethanol over bimetallic Cu-Zn/SiO2 catalysts prepared by means of coprecipitation[J]. Bulletin of the Korean Chemical Society , 2014, 35 (1) : 141-146 DOI:10.5012/bkcs.2014.35.1.141 |
| [13] | Li S, Wang Y, Zhang J . Kinetics study of hydrogenation of dimethyl oxalate over Cu/SiO2 catalyst[J]. Industrial & Engineering Chemistry Research , 2015, 54 (4) : 1243-1250 |
| [14] | Yuan P, Liu Z, Zhang W . Cu-Zn/Al2O3 catalyst for the hydrogenation of esters to alcohols[J]. Chinese Journal of Catalysis , 2010, 31 (7) : 769-775 DOI:10.1016/S1872-2067(09)60087-5 |
| [15] | Gong J, Yue H, Zhao Y . Synthesis of ethanol via syngas on Cu/SiO2 catalysts with balanced Cu0-Cu+ sites[J]. Journal of the American Chemical Society , 2012, 134 (34) : 13922-13925 DOI:10.1021/ja3034153 |
| [16] | Perego C, Peratello S . Experimental methods in catalytic kinetics[J]. Catalysis Today , 1999, 52 (2) : 133-145 |
| [17] | HUANG Hua-jiang(黄华江) . Practical chemical computer simulation-MATLAB application in chemical engineering(实用化工计算机模拟-MATLAB在化学工程中的应用)[M]. Beijing (北京): Chemical Industry Press(化学工业出版社), 2004 . |
| [18] | YUAN Zhi-fa(袁志发), SONG Shi-de(宋世德) . Multivariate statistical analysis(多元统计分析)[M]. Beijing (北京): Science Press(科学出版社), 2009 . |




