喜树碱(camptothecin,CPT)及其衍生物是一种具有高效且广谱的抗肿瘤药物,用于治疗结直肠癌、肝癌、肺癌等多种癌症。但是CPT疏水性强、半衰期短以及对正常组织具有毒性(尤其是肠毒性)等问题限制了其临床应用[1]。已经上市或正在进行临床研究的喜树碱类递送系统(如Onivide,NK-012,XMT-1001,Pegamotecan[2-6]),对延长药物循环时间、提升药代动力学特征效果明显,但是对非特异性全身释放、刺激响应性释放慢的问题改善甚微。因此,开发一种高选择性、程序性可控释放的喜树碱药物递送系统具有重大意义。
近年来,触发式自释放(self-immolative)前药由于独特的刺激响应性以及可控降解的特性,受到越来越多的关注[7]。触发式自降解体系通常通过分子内的反应,如1, 4-消除、1, 6-消除或环化消除启动解聚过程和药物释放[8-9]。肿瘤组织内异常的微环境,如酸性pH、缺氧、过表达的酶以及高水平的活性氧、谷胱甘肽和5'-三磷酸腺苷可以作为触发因素,引发构筑单元快速解聚,实现治疗剂在肿瘤部位的可控释放[10-14]。这种可控且快速的释药方式可以提高药物对肿瘤的毒性[15-17]。但是,目前的触发式自降解体系结构复杂,需要多步合成步骤[18-19],且降解产物中含有对正常细胞有毒性的醌甲基、邻苯二甲醛等化合物[7],这些缺点阻碍了触发式自降解前药在生物医学材料的进一步应用。
分子内碱催化水解是酯和酰胺键发生酶促水解的一种常见机制[20]。Zhou等[21]报道了一种氨基催化分子内水解的树枝状大分子药物递送系统,树枝状大分子外围氨基增加会导致连接CPT的酯键断裂从而加速CPT的释放。受此启发,本研究猜想该现象是否能够应用于梳状聚合物分子内水解的调控,利用邻近侧链氨基调控药物的释放。
开环易位聚合(ring opening metathesis polymerization,ROMP)是一种条件温和、高效可控的聚合方式[22-24]。目前常用的聚合单体为降冰片烯基单体,该类单体易于合成,转化效率高,聚合产物分布窄[25-26],是可控聚合的一种理想选择。本研究以降冰片烯二酸酐(cis-5-norbornene-endo-2, 3-dicarboxylic,NB)为原料,合成了4种降冰片烯基单体:NB-CPT作为活性药物链,聚乙二醇(polyethylene glycol,PEG)单体(NB-PEG)作为亲水链,N-叔丁氧羰基[N-(tert-butoxycarbonyl),Boc]保护的氨基单体(NB-EDA-Boc和NB-DAB-Boc)作为氨基调控链,通过ROMP合成了一系列不同氨基链结构和数目的梳状聚合物,进而考察氨基链对CPT断裂的影响。本研究还设计合成了一种新型的弱酸触发式自水解聚合物,利用对氨基保护基团的选择,可实现对邻近药物链释放的控制。
2 实验部分 2.1 主要仪器和试剂三氟乙酸(trifluoroacetic acid,TFA)、NB、6-氨基己酸(6-amino-hexanoic acid,HA)、3-氨基丙酸(β-alanine,PA)、氯化亚砜、N-(叔丁氧羰基)-1, 2-乙二胺(N-tert-butoxycarbonyl-ethylenediamine,N-Boc-EDA)、N-叔丁氧羰基-1, 4-丁二胺(N-(tert-butoxycarbonyl)- 1, 4-diamino-butane,N-Boc-DAB)、六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷(benzotriazol-1-yl- oxytripyrrolidino-phosphonium hexafluorophosphate,PyBop)、N, N-二异丙基乙胺(N, N-diisopropylethylamine,DIPEA)、乙烯基乙醚、丁二酸酐(succinic anhydride,SA)、四氢化邻苯二甲酸酐(tetrahydrophthalic anhydride, DCA)、2, 3-二甲基马来酸酐(2, 3-dimethylmaleic anhydride,DM)购于安耐吉试剂,Grubbs三代催化剂(Grubbs 3)购于Sigma-Aldrich,聚乙二醇单甲醚400 (mPEG400)购于TCI试剂网,喜树碱(CPT,98%)购自浙江海正股份有限公司。除注明外,本研究使用的其他化学试剂均购于国药集团化学试剂。核磁共振氢谱(1H-NMR)由Bruker ARX400核磁共振谱仪(德国Bruker)检测。聚合物的分子量及分布由Wyatt GPC/SEC-MALS凝胶渗透色谱仪(gel permeation chromatography,GPC) (Wyatt)检测。释放实验由Agilent 1260高效液相色谱仪(high performance liquid chromatography,HPLC) (Agilent)检测。
2.2 NB-PA的合成NB-PA的合成参照文献[27]的方法,具体如下:称取NB (5.0 g,30.5 mmol)和PA (7.2 g,30.6 mmol)溶解在150 mL甲苯中,溶液在120 ℃下回流20 h,旋蒸得到纯白色结晶状固体粗产物。将固体粗产物溶于40 mL乙酸乙酯,用饱和NaHCO3溶液洗涤3遍,水相用二氯甲烷(dichloromethane,DCM)洗2遍,用2 mol⋅L−1 HCl将pH调节到2,酸化之后水相析出白色沉淀,用50 mL三氯甲烷萃取3遍,有机相经无水硫酸镁干燥后浓缩,真空干燥得到白色固体5.6 g(产率94 %)。1H-NMR (400 MHz, CDCl3)化学位移δ:6.29 (t, J = 1.7 Hz, 2H), 3.53~3.40 (m, 2H), 3.34~3.20 (m, 2H), 2.68 (d, J = 1.0 Hz, 2H), 2.35 (t, J = 7.4 Hz, 2H), 1.67 (dd, J = 15.3, 7.6 Hz, 4H), 1.57 (dd, J = 15.2, 7.7 Hz, 1H), 1.52 (d, J = 9.9 Hz, 1H), 1.41~1.30 (m, 2H), 1.22 (d, J = 9.8 Hz, 1H)。
2.3 NB-CPT的合成CPT-NH2参照文献[21]合成得到。称取CPT-NH2 (2.0 g, 3.75 mmol)、NB-PA (1.0 g, 4.25 mmol)和PyBop (6.0 g, 11.5 mmol)混合于200 mL DCM,将5 mL DIPEA缓慢滴加到溶液中,室温搅拌过夜。将反应液用2 mol⋅L−1 HCl洗涤3次,饱和NaHCO3溶液洗3次,饱和NaCl溶液洗涤1次,有机相经无水硫酸镁干燥。浓缩后得到的粗产品,过硅胶柱纯化,得到淡黄色固体2.0 g (产率75%)。1H-NMR (400 MHz, CDCl3) δ: 8.44 (s, 1H), 8.29 (d, J = 8.5 Hz, 1H), 7.95 (d, J = 8.1 Hz, 1H), 7.85 (t, J = 7.3 Hz, 1H), 7.68 (t, J = 7.4 Hz, 1H), 7.37 (s, 1H), 6.51 (s, 1H), 6.18 (ddd, J = 15.0, 5.3, 3.1 Hz, 2H), 5.65 (d, J = 17.2 Hz, 1H), 5.39 (d, J = 17.2 Hz, 1H), 5.30 (d, J = 6.6 Hz, 3H), 4.47 (dd, J = 18.5, 6.4 Hz, 1H), 4.12~4.04 (m, 1H), 3.76~3.66 (m, 2H), 3.16 (s, 2H), 2.55 (dd, J = 12.1, 4.8 Hz, 4H), 2.31~2.22 (m, 1H), 2.22~2.12 (m, 1H), 1.40 (d, J = 9.9 Hz, 1H), 1.14 (d, J = 9.9 Hz, 1H), 0.99 (t, J = 7.4 Hz, 3H)。
2.4 NB-HA的合成取NB (5.0 g, 30.5 mmol)和HA (4.0 g, 30.6 mmol)溶解在150 mL甲苯中,后续反应、纯化步骤与NB-PA类似,最终得到白色固体4.4 g(产率88%)。1H-NMR (400 MHz, CDCl3) δ:6.29 (s, 2H), 4.27~4.16 (m, 2H), 3.77~3.63 (m, 29H), 3.55 (dd, J = 5.7, 3.6 Hz, 2H), 3.48~3.43 (m, 2H), 3.38 (s, 3H), 3.27 (s, 2H), 2.68 (s, 2H), 2.33 (t, J = 7.5 Hz, 2H), 1.65 (dd, J = 15.3, 7.6 Hz, 2H), 1.58 (dd, J = 15.5, 7.9 Hz, 2H), 1.52 (d, J = 9.9 Hz, 1H), 1.33 (dt, J = 15.4, 7.6 Hz, 2H), 1.22 (d, J = 9.9 Hz, 1H)。
2.5 NB-PEG的合成取NB-HA (3.48 g, 14.8 mmol)溶解在30 mL DCM中,冰浴条件下逐滴加入氯化亚砜(2.2 mL, 29.6 mmol),并滴加1滴无水N, N-二甲基甲酰胺(N, N-dimethylformamide, DMF)促溶,室温搅拌过夜。旋蒸得到结晶状白色固体物质。取mPEG (5.7 g, 14.0 mmol),加入20 mL甲苯,在120 ℃下回流10 h,以完全去除mPEG中的水,密封待用。向上一步得到的白色固体中加入100 mL无水四氢呋喃(tetrahydrofuran, THF)、19 mL无水三乙胺和除水mPEG,室温搅拌过夜,旋蒸溶剂,用DCM溶解。有机相用2 mol⋅L−1 HCl洗2遍,饱和NaHCO3洗涤2遍,无水硫酸镁干燥后浓缩,放置于真空干燥箱干燥,得到无色液体约2.0 g(命名为NB-PEG)(产率57%)。1H-NMR (400 MHz, CDCl3) δ:6.29 (s, 2H), 4.27~4.16 (m, 2H), 3.77~3.63 (m, 32H), 3.55 (dd, J = 5.7, 3.6 Hz, 2H), 3.48 ~3.43 (m, 2H), 3.38 (s, 3H), 3.27 (s, 2H), 2.68 (s, 2H), 2.33 (t, J = 7.5 Hz, 2H), 1.65 (dd, J = 15.3, 7.6 Hz, 2H), 1.58 (dd, J = 15.5, 7.9 Hz, 2H), 1.52 (d, J = 9.9 Hz, 1H), 1.33 (dt, J = 15.4, 7.6 Hz, 2H), 1.22 (d, J = 9.9 Hz, 1H)。
2.6 NB-EDA-Boc的合成称取NB (1.72 g, 10.5 mmol)和N-Boc-EDA (2.0 g, 10.6 mmol)溶解在150 mL甲苯中,120 ℃回流。减压浓缩得到白色固体。加入DCM溶解,用2 mol⋅L−1 HCl溶液洗涤3遍,NaCl溶液洗涤3遍,有机相经无水硫酸镁干燥,旋蒸得到粗产品。用甲醇重结晶,得到白色晶体2.8 g (命名为NB-EDA-Boc)(产率80%)。1H-NMR (400 MHz, CDCl3) δ:6.29 (t, J = 1.7 Hz, 2H), 4.78 (s, 0H), 3.68~3.57 (m, 1H), 3.34 (d, J = 4.2 Hz, 1H), 3.29~3.25 (m, 1H), 2.70 (s, 1H), 1.51 (d, J = 9.9 Hz, 1H), 1.41 (s, 5H), 1.25 (d, J = 9.7 Hz, 1H)。
2.7 NB-DAB-Boc的合成称取NB (1.72 g, 10.5 mmol)和N-Boc-DAB (2.2 g, 11.2 mmol),用上述方法得到2 g白色固体(命名为NB-DAB-Boc) (产率95%)。1H-NMR (400 MHz, CDCl3) δ:6.29 (s, 2H), 3.48 (t, J = 7.2 Hz, 1H), 3.27 (s, 1H), 3.13 (s, 1H), 2.68 (s, 1H), 1.63~1.46 (m, 3H), 1.43 (s, 5H), 1.21 (d, J = 9.8 Hz, 1H)。
2.8 聚合物PEGn-Em-CPT2和PEGn-Dm-CPT2的合成通过调控单体的投料比,用ROMP合成不同比例的聚合物,接着用TFA脱去Boc基团,得到聚合物P(NB-PEG)n-P(NB-EDA)m-P(NB-CPT)2 (简称为PEGn-Em-CPT2)和P(NB-PEG)n-P(NB-DAB)m-P(NB-CPT)2 (简称为PEGn-Dm-CPT2),m和n表示聚合度。以PEG18-E5-CPT2的合成为例描述合成过程。称取NB-EDA-Boc (20 mg, 0.097 mmol)、NB-CPT (24.2 mg, 0.039 mmol)和NB-PEG (240 mg, 0.35 mmol)溶解于1 mL的干燥DMF中,用氮气鼓泡除氧后,加入Grubbs 3 (16 mg, 0.019 mmol)。在室温下反应2 h。加入0.2 mL乙烯基乙醚终止反应。反应液用体积比为1:1的乙醚和正己烷的混合液沉淀2次,得到黏稠状液体。未脱保护的产物用凝胶渗透色谱仪检测分子量分布。将得到的聚合物溶解于DMF中,滴加等体积的TFA脱保护,室温搅拌过夜。乙醚沉淀后得到淡黄色黏稠状液体,真空干燥过夜。
2.9 聚合物PEG-E/R-CPT的合成选取PEG12-E20-CPT2进行下一步修饰。称取PEG12-E20-CPT2 10 mg,溶解于2 mL DCM中,加入500 mg的SA以及1滴DIPEA,搅拌过夜。通过茚三酮法检测到氨基完全反应即可终止反应。用冰乙醚中沉淀,得白色沉淀12 mg,产率90%。用同样的方法制备氨基被DCA或DM保护的聚合物。聚合物命名为PEG-E/R-CPT,其中R为SA、DCA或DM。
2.10 PEGn-Em-CPT2和PEGn-Dm-CPT2的体外释放实验将PEGn-Em-CPT2和PEGn-Dm-CPT2分别用含有Tween 80 (体积分数为1%)的磷酸缓冲盐溶液(phosphate buffer saline,PBS) (pH = 7.4)配制成1 mg⋅mL−1的溶液,于37 ℃摇床中振荡孵育。在不同时间取样后用HPLC检测,流动相:甲醇和水的体积比为6:4,流速为1 mL⋅min−1,检测波长为360 nm。
2.11 PEG-E/R-CPT的体外释放实验将PEG-E/R-CPT分别用含有Tween 80 (体积分数为1%) 的PBS (pH=7.4或6.5)配制成1 mg⋅mL−1的溶液,于37 ℃摇床中振荡孵育。检测方法与上述实验类似。
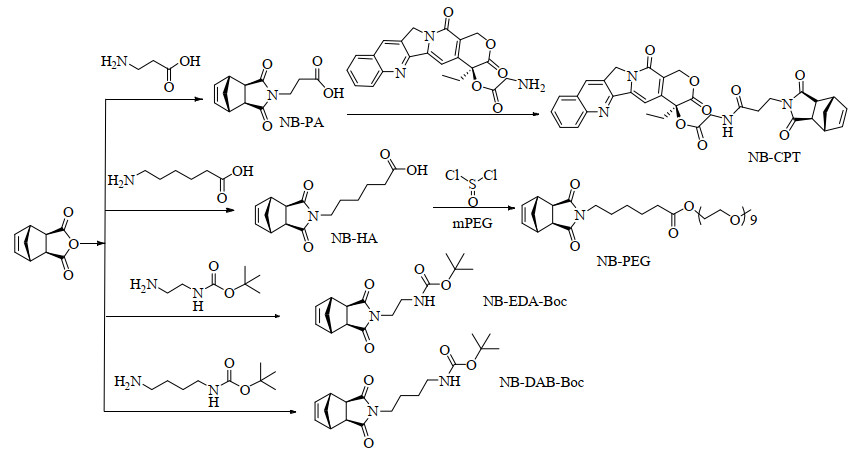
3 结果与讨论 3.1 单体的合成与表征本研究所用的4种单体NB-CPT、NB-PEG、NB-EDA-Boc和NB-DAB-Boc均以NB为起始原料,与相应化合物反应所得,合成路线如图 1所示。
|
图 1 本研究的单体的合成路线 Fig.1 Synthetic scheme of the monomers used in this study |
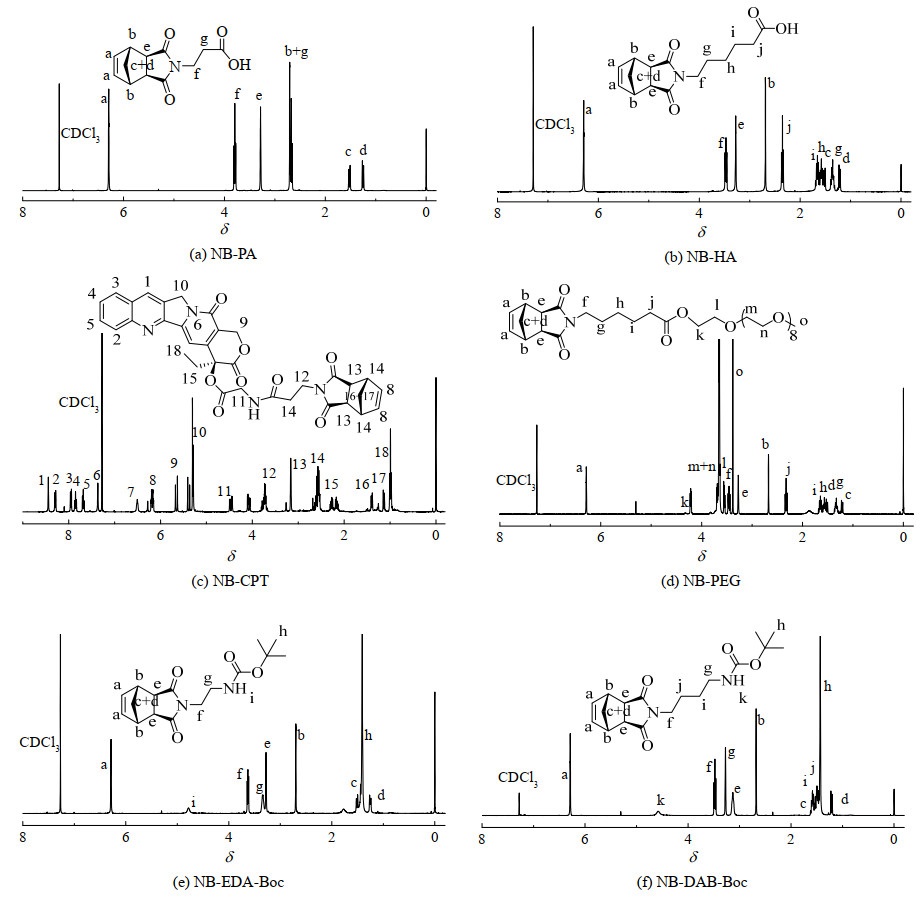
NB-PA和NB-HA的合成参照文献[27]的方法合成,具体方法为:NB与PA (或HA)在甲苯高温回流条件下反应得到,反应结束后溶解于乙酸乙酯中,通过NaHCO3溶液碱洗和DCM洗涤,去除反应体系中的剩余反应物。再溶解于水,调节pH到酸性,将带羧基的产物从水中析出,进而通过三氯甲烷萃取得到纯的产物。产物的1H-NMR如图 2(a)和2(b)所示,氘代试剂为CDCl3。δ=6.29处为降冰片烯双键的特征峰,积分为2,所有聚合单体均含有该特征峰。NB-PA与CPT-NH2反应得到NB-CPT (图 2(c))。NB-HA经二氯亚砜活化后,与mPEG400的羟基反应,得到NB-PEG (图 2(d))。含有氨基的单体NB-EDA-Boc和NB-DAB-Boc分别由NB与N-Boc-乙二胺、NB与N-Boc-丁二胺在甲苯回流中反应得到,产物的1H-NMR如图 2(e)和图 2(f)所示。1H-NMR中可观察到δ=6.29处的降冰片烯双键特征峰和δ=1.4处的Boc特征峰,各氢归属位置和积分正确,可见单体结构的准确性。
|
图 2 聚合单体的1H-NMR图谱 Fig.2 1H-NMR spectra of the monomers |
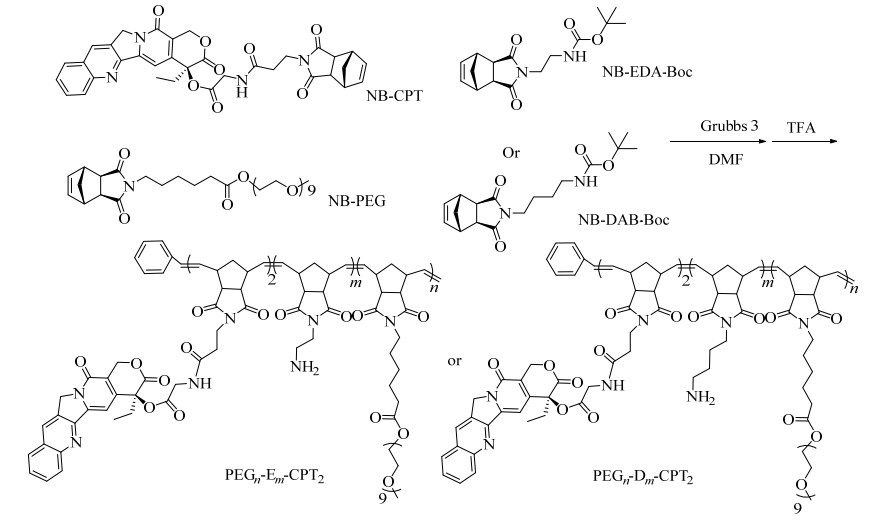
研究表明裸露氨基会催化CPT-NH2中酯键的断裂,从而加速CPT的释放,同时裸露的氨基也能催化以CPT为核的聚赖氨酸树枝状大分子的药物释放,并且释放曲线与氨基结构和数量相关[21]。为了探究聚合物侧链氨基结构的长短是否会对聚合物上CPT的释放速度产生影响,本研究设计合成了2种Boc保护的氨基单体(NB-EDA-Boc和NB-DAB-Boc)。氨基单体与NB-PEG、NB-CPT在Grubbs 3的作用下,通过ROMP合成一系列不同单体比例的梳状共聚物,接着用TFA脱去聚合物的Boc保护基(见图 3),得到梳状共聚物PEGn-Em-CPT2和PEGn-Dm-CPT2。
|
图 3 PEGn-Em-CPT2/PEGn-Dm-CPT2的合成路线 Fig.3 Synthetic scheme of PEGn-Em-CPT2/PEGn-Dm-CPT2 |
|
图 4 不同聚合度的聚合物的GPC表征 Fig.4 GPC spectra of protected PEGn-Em-CPT2/PEGn-Dm-CPT2 polymers at varying polymerization degrees |
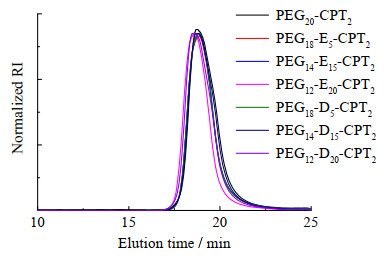
由于2种氨基单体的烷基链的长度不同,为了保证CPT的释放不受聚合物分子量的影响,本研究固定NB-CPT的聚合度为2,通过调控NB-PEG和氨基单体的投料比使得最终的聚合物分子量接近。通过GPC表征(见图 4,图中RI为折光率),所得的7种聚合物的出峰时间非常接近,表明聚合物的分子量接近、聚合可控。7种聚合物的分子质量分布均较窄,多分散系数(polydispersity index, PDI)在1.08~1.13(见表 1),可见聚合物的分子质量Mw分布较均匀。上述聚合物用TFA脱保护后,得到链长和数量不同的氨基侧链。该聚合物前药相比原药CPT,具有良好的亲水性,PEG端可以改善小分子的循环能力,有望提高CPT的生物利用度。
|
|
表 1 PEGn-Em-CPT2和PEGn-Dm-CPT2聚合物表征 Table 1 Characterization of PEGn-Em-CPT2 and PEGn-Dm-CPT2 polymers used in this study |
为验证聚合物上的侧链氨基是否可以加速聚合物上CPT的释放,同时考察氨基侧链结构对CPT释放速率的影响,利用HPLC检测聚合物前药在pH 7.4条件下的CPT释放行为,以PEG14-E15-CPT2的释放为例,如图 5所示,随着时间延长,HPLC谱图上保留时间为5.5 min处的CPT峰逐渐增强,表明在pH 7.4的溶液中,PEG14-E15-CPT2会逐渐释放出CPT。
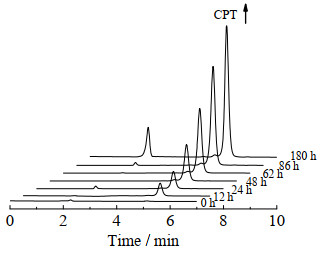
|
图 5 PEG14-E15-CPT2在pH 7.4 PBS中的HPLC色谱图 Fig.5 Representative HPLC spectra of PEG14-E15-CPT2 at pH 7.4 PBS |
进一步对比了氨基链数目对CPT释放的影响,如图 6所示,当聚合物中氨基链数少于或等于5时,聚合物上CPT的累计释放量均低于10%;随着氨基链数量增加,CPT释放明显加快,PEG14-E15-CPT2和PEG12-E20-CPT2在180 h的释放量分别达到76% 和89%,PEG14-D15-CPT2和PEG12-D20-CPT2在相同时间内释放量达到52% 和62%,表明对于同种结构的聚合物前药,CPT的释放速率与氨基链的数量呈现正相关的关系,即通过改变聚合物侧链氨基数可以调控CPT的释放速率,PEGn-Em-CPT2可以调控CPT释放量从10% 近线性增加到89%,PEGn-Dm-CPT2可以调控CPT释放量从10% 近线性增加到62%。此外,在具有相同氨基链数量的情况下,短链氨基(乙二胺,E)比长链氨基(丁二胺,D)的催化效率更高。其中在180 h内,PEG12-E20-CPT2和PEG12-D20-CPT2之间的CPT释放量差别可以达到27%,PEG14-E15-CPT2和PEG14-D15-CPT2之间的CPT释放量差别为24%,而氨基链数为5的聚合物释放没有差异。
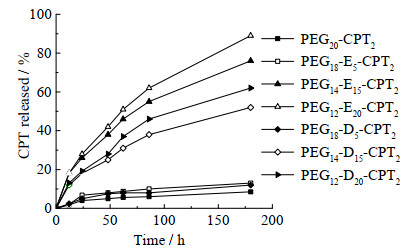
|
图 6 PEGn-Em-CPT2/PEGn-Dm-CPT2在pH 7.4 PBS中的释放动力学 Fig.6 CPT release kinetics of PEGn-Em-CPT2 and PEGn-Dm-CPT2 polymers at pH 7.4 PBS |
因此,本研究发现邻近侧链氨基可以催化分子内水解,且短链氨基具有更高效的催化自水解能力,通过调节梳状共聚物的氨基链数量和长短可以调控CPT的释放速率。
3.4 酸响应聚合物PEG-E/R-CPT的合成与体外释放为了进一步证实氨基对CPT释放的催化作用,本研究采用不同酸酐对氨基进行酰胺化,获得了不同酸敏感性能的β-羧酸酰胺结构。特定结构的β-羧酸酰胺在中性或碱性条件下稳定,但在酸性条件下会迅速水解,并暴露出氨基[21, 29-30]。将聚合物侧链氨基修饰上不同的β-羧酸酰胺,可以遮蔽聚合物的氨基,减少CPT在血液中的释放,同时利用β-羧酸酰胺的酸不稳定性,可以在酸性的肿瘤微环境或溶酶体中水解而裸露氨基,进而促进CPT在肿瘤中的释放。另一方面,带正电的载体在体内应用中有很多局限性,包括循环时间短、易引起溶血和细胞毒性等[31]。表面PEG化和酰胺化可以遮蔽正电性,减少以上问题的产生,延长血液循环时间,有望在体内应用。
实验选用释放速率最快的PEG12-E20-CPT2聚合物做进一步的修饰。合成方法如图 7所示,脱保护的PEG12-E20-CPT2分别与过量的丁二酸酐(SA)、四氢化邻苯二甲酸酐(DCA)或2, 3-二甲基马来酸酐(DM)在碱性条件下反应,得到了3种β-羧酸酰胺化的聚合物PEG-E/R-CPT。
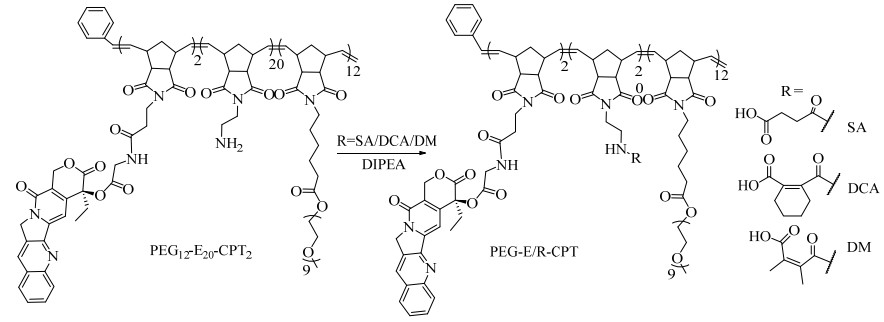
|
图 7 PEG-E/R-CPT的合成路线 Fig.7 Synthetic scheme of PEG-E/R-CPT polymers, R = SA, DCA, or DM |
对合成的酰胺化聚合物的药物释放特性进行了研究。如图 8所示,总体上,相比未修饰的PEG12-E20-CPT2,经过修饰后的PEG-E/R-CPT在pH 7.4的条件下释放CPT的速率明显下降,说明氨基保护可以减缓CPT自释放。在pH 6.5的条件下,3种聚合物的释放顺序为PEG-E/DM-CPT > PEG-E/DCA-CPT > PEG-E/SA-CPT,其中PEG-E/SA-CPT在200 h的释放比例仅有4%。根据课题组之前的研究[21],3种β-羧酸酰胺在pH 6.5下的断裂速率为DM > DCA > SA,其中SA在pH 6.5下不断裂。这与3种聚合物的释放快慢相一致,进一步证明氨基的暴露可以催化CPT水解,同时还说明通过控制β-羧酸酰胺的酸不稳定特性,可以调控CPT的释放速率。
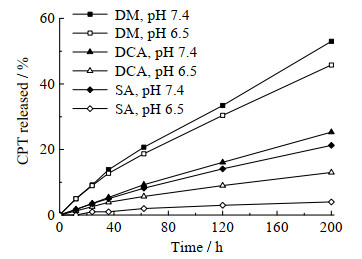
|
图 8 PEG-E/R-CPT在不同pH的PBS中的释放动力学 Fig.8 Release behaviors of PEG-E/R-CPT in different pH PBS solutions R = SA, DCA, or DM |
研究构建了一种触发式自降解CPT聚合物前药系统,并利用邻近侧链氨基催化分子内水解控制药物的释放。该系统可通过对氨基链长短、数量和保护基团的修饰,实现对CPT自释放的精准调控,有望应用于药物控释和递送领域。
| [1] |
BOTELLA P, RIVERO-BUCETA E. Safe approaches for camptothecin delivery: Structural analogues and nanomedicines[J]. Journal of Controlled Release, 2017, 247: 28-54. DOI:10.1016/j.jconrel.2016.12.023 |
| [2] |
PASSERO F C, JR. , GRAPSA D, SYRIGOS K N, et al. The safety and efficacy of Onivyde (irinotecan liposome injection) for the treatment of metastatic pancreatic cancer following gemcitabine-based therapy[J]. Expert Review of Anticancer Therapy, 2016, 16(7): 697-703. DOI:10.1080/14737140.2016.1192471 |
| [3] |
MATSUMURA Y. Preclinical and clinical studies of NK012, an SN-38-incorporating polymeric micelles, which is designed based on EPR effect[J]. Advanced Drug Delivery Reviews, 2011, 63(3): 184-192. DOI:10.1016/j.addr.2010.05.008 |
| [4] |
BURRIS H A, INFANTE J R, ANTHONY GRECO F, et al. A phase I dose escalation study of NK012, an SN-38 incorporating macromolecular polymeric micelle[J]. Cancer Chemotherapy and Pharmacology, 2016, 77(5): 1079-1086. DOI:10.1007/s00280-016-2986-x |
| [5] |
YURKOVETSKIY A V, FRAM R J. XMT-1001, a novel polymeric camptothecin pro-drug in clinical development for patients with advanced cancer[J]. Advanced Drug Delivery Reviews, 2009, 61(13): 1193-1202. DOI:10.1016/j.addr.2009.01.007 |
| [6] |
SCOTT L C, YAO J C, BENSON A B, et al. A phase II study of pegylated-camptothecin (pegamotecan) in the treatment of locally advanced and metastatic gastric and gastro-oesophageal junction adenocarcinoma[J]. Cancer Chemotherapy and Pharmacology, 2009, 63(2): 363-370. DOI:10.1007/s00280-008-0746-2 |
| [7] |
GONZAGA R V, DO NASCIMENTO L A, SANTOS S S, et al. Perspectives about self-immolative drug delivery systems[J]. Journal of Pharmaceutical Sciences, 2020, 109(11): 3262-3281. DOI:10.1016/j.xphs.2020.08.014 |
| [8] |
PETERSON G I, LARSEN M B, BOYDSTON A J. Controlled depolymerization: stimuli-responsive self-immolative polymers[J]. Macromolecules, 2012, 45(18): 7317-7328. DOI:10.1021/ma300817v |
| [9] |
ALOUANE A, LABRUERE R, LE SAUX T, et al. Self-immolative spacers: Kinetic aspects, structure-property relationships, and applications[J]. Angewandte Chemie International Edition, 2015, 54(26): 7492-7509. DOI:10.1002/anie.201500088 |
| [10] |
KIM H, BROOKS A D, DILAURO A M, et al. Poly(carboxypyrrole)s that depolymerize from head to tail in the solid state in response to specific applied signals[J]. Journal of the American Chemical Society, 2020, 142(20): 9447-9452. DOI:10.1021/jacs.0c02774 |
| [11] |
ZHANG P, GAO D, AN K, et al. A programmable polymer library that enables the construction of stimuli-responsive nanocarriers containing logic gates[J]. Nature Chemistry, 2020, 12(4): 381-390. DOI:10.1038/s41557-020-0426-3 |
| [12] |
MENG X, GAO M, DENG J, et al. Self-immolative micellar drug delivery: The linker matters[J]. Nano Research, 2018, 11(12): 6177-6189. DOI:10.1007/s12274-018-2134-5 |
| [13] |
PORUBSKY M, GURSKA S, STANKOVA J, et al. AminoBODIPY conjugates for targeted drug delivery systems and real-time monitoring of drug release[J]. Molecular Pharmaceutics, 2021, 18(6): 2385-2396. DOI:10.1021/acs.molpharmaceut.1c00219 |
| [14] |
徐昌活, 周泉, 祝鼎成, 等. 基于门舒特金反应的酶触发自降解高分子载体及其在基因输送中的应用[J]. 高分子学报, 2017(6): 937-945. XU C H, ZHOU Q, ZHU D C, et al. Esterase-activated self-immolative polymeric vector based on Menschutkin reaction for gene delivery[J]. Acta Polymerica Sinica, 2017(6): 937-945. |
| [15] |
DAL CORSO A, BORLANDELLI V, CORNO C, et al. Fast cyclization of a proline-derived self-immolative spacer improves the efficacy of carbamate prodrugs[J]. Angewandte Chemie International Edition, 2020, 59(10): 4176-4181. DOI:10.1002/anie.201916394 |
| [16] |
LEGIGAN T, CLARHAUT J, TRANOY-OPALINSKI I, et al. The first generation of beta-galactosidase-responsive prodrugs designed for the selective treatment of solid tumors in prodrug monotherapy[J]. Angewandte Chemie International Edition, 2012, 51(46): 11606-11610. DOI:10.1002/anie.201204935 |
| [17] |
ZHANG Y, YIN Q, YIN L, et al. Chain-shattering polymeric therapeutics with on-demand drug-release capability[J]. Angewandte Chemie International Edition, 2013, 52(25): 6435-6439. DOI:10.1002/anie.201300497 |
| [18] |
LIU G, WANG X, HU J, et al. Self-immolative polymersomes for high-efficiency triggered release and programmed enzymatic reactions[J]. Journal of the American Chemical Society, 2014, 136(20): 7492-7497. DOI:10.1021/ja5030832 |
| [19] |
WANG Z, WU H, LIU P, et al. A self-immolative prodrug nanosystem capable of releasing a drug and a NIR reporter for in vivo imaging and therapy[J]. Biomaterials, 2017, 139: 139-150. DOI:10.1016/j.biomaterials.2017.06.002 |
| [20] |
FIFE T H, SINGH R, BEMBI R. Intramolecular general base catalyzed ester hydrolysis. The hydrolysis of 2-aminobenzoate esters[J]. Journal of Organic Chemistry, 2002, 67(10): 3179-3183. DOI:10.1021/jo0103017 |
| [21] |
ZHOU Z X, MA X P, MURPHY C J, et al. Molecularly precise dendrimer-drug conjugates with tunable drug release for cancer therapy[J]. Angewandte Chemie International Edition, 2014, 53(41): 10949-10955. DOI:10.1002/anie.201406442 |
| [22] |
SU J K, JIN Z, ZHANG R, et al. Tuning the reactivity of cyclopropenes from living ring-opening metathesis polymerization (ROMP) to single-addition and alternating ROMP[J]. Angewandte Chemie International Edition, 2019, 58(49): 17771-17776. DOI:10.1002/anie.201909688 |
| [23] |
BARTHER D, MOATSOU D. Ring-opening metathesis polymerization of norbornene-based monomers obtained via the passerini three component reaction[J]. Macromolecular Rapid Communications, 2021, 42(9): e2100027. DOI:10.1002/marc.202100027 |
| [24] |
GUTEKUNST W R, HAWKER C J. A General approach to sequence-controlled polymers using macrocyclic ring opening metathesis polymerization[J]. Journal of the American Chemical Society, 2015, 137(25): 8038-8041. DOI:10.1021/jacs.5b04940 |
| [25] |
VARLAS S, FOSTER J C, O'REILLY R K. Ring-opening metathesis polymerization-induced self-assembly (ROMPISA)[J]. Chemical Communications, 2019, 55(62): 9066-9071. DOI:10.1039/C9CC04445K |
| [26] |
KAMMEYER J K, BLUM A P, ADAMIAK L, et al. Polymerization of protecting-group-free peptides via ROMP[J]. Polymer Chemistry, 2013, 4(14): 3929-3933. DOI:10.1039/c3py00526g |
| [27] |
LEITGEB A, WAPPEL J, SLUGOVC C. The ROMP toolbox upgraded[J]. Polymer, 2010, 51(14): 2927-2946. DOI:10.1016/j.polymer.2010.05.002 |
| [28] |
BRAY F, FERLAY J, SOE RJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. Ca-a Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [29] |
SHEN Y, ZHOU Z, SUI M, et al. Charge-reversal polyamidoamine dendrimer for cascade nuclear drug delivery[J]. Nanomedicine: Nanotechnology, Biology, and Medicine, 2010, 5(8): 1205-1217. |
| [30] |
XU P, VAN KIRK E A, ZHAN Y, et al. Targeted charge-reversal nanoparticles for nuclear drug delivery[J]. Angewandte Chemie International Edition, 2007, 46(26): 4999-5002. DOI:10.1002/anie.200605254 |
| [31] |
DUNCAN R, IZZO L. Dendrimer biocompatibility and toxicity[J]. Advanced Drug Delivery Reviews, 2005, 57(15): 2215-2237. DOI:10.1016/j.addr.2005.09.019 |




