纺织行业作为最耗水的工业之一,其排放的含盐染料废水造成了严重的环境问题[1-2],纺织染色过程中仅有85%的着色物质被固定在布料上,而其余15%的染料则从染浴中作为废水排放[3],因此大量含有各种有毒染料的纺织工业废物进入水体,对水生生物的生长和水质构成巨大的威胁。这些染料分子由于结构复杂、毒性不可忽略、生物降解性差等原因造成了严重的环境问题,而且染料废水会诱致肿瘤、癌症和过敏反应等一系列的危害身体健康的病症[4]。
印染废水色度的去除及其中有机物的降解已经成为一个亟待解决的环境难题,目前用于处理这类废水的方法有物理方法[5]、化学方法[6]以及生物手段[7],但是物理和化学方法只能将这些污染物转移,且会造成二次污染物的产生,生物手段对于高色度、有机物含量高的印染废水基本上没有效果。等离子体技术因其效率高、工艺简单、不会产生二次污染等技术特点被认为是最有前途的污水处理手段之一。其中,介质阻挡放电(DBD)是常用的方法[8],具有大量的能促进有机物降解的高能电子,紫外线辐射能[9]、活性自由基[10-11] (·OH、·O)、O3[12]和H2O2[13]分子。
实验采取氩气作为放电气体,在常温常压下降膜介质阻挡反应器对甲基橙溶液进行研究,考察输入功率、放电气体的流速、溶液的处理体积、初始浓度、初始pH值、初始电导率对甲基橙溶液的降解率和过程的能量效率的影响,同时探讨甲基橙在降膜介质放电等离子体作用下的反应机理。
2 实验材料及方法 2.1 实验原料实验中采用分析纯的甲基橙作为目标污染物,氩气的纯度为99.99%,所用试剂都为分析纯。
2.2 实验装置及设定参数反应装置中包括供气系统、等离子体反应系统、溶液循环系统及分析检测系统。为了增大高能电子、活性粒子和溶液的接触面积,设计了图 1中的降膜介质阻挡反应器,其主体部分是石英管(长340 mm,内径290 mm,壁厚1.5 mm),既充当阻挡介质层,也作为反应容器,外部包裹铝箔作为外电极,长度200 mm。内电极(直径10 mm,厚度5 mm的空心不锈钢管),与高压电源的高压端相接,放电间距为6 mm。该降膜反应器的优点是增大气液相的接触面积、提高传质效率,活性粒子可直接从气相进入到液膜中,增加了其与有机物分子的碰撞机会,有机物降解效率高。反应器制作工艺简单,可连续或间歇操作,高效安全。
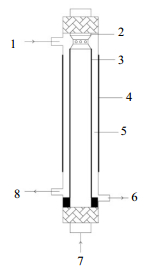
|
图 1 降膜介质阻挡等离子反应器 Fig.1 Schematic diagram of the dielectric barrier discharge falling liquid film reactor 1. gas inlet 2. inner electrode 3. water film 4. outer electrode 5. gas gap 6. water outlet 7. water inlet 8. gas outlet |
CTP-2000K等离子电源,SY-931质量流量计,YZ15蠕动泵,L5S紫外分光光度计,FE28-pH计,DDS-11C电导率仪,DR1010-COD检测仪。
2.4 分析测试方法甲基橙浓度的检测使用紫外可见分光光度仪在465 nm条件下测量其吸光度,根据朗伯-比尔定律,得到甲基橙溶液的浓度。甲基橙的降解率(DR)计算公式如式(1)所示。
| $ {\rm{DR}}(\% ) = \frac{{{C_0} - C}}{{{C_0}}} \times 100\% $ | (1) |
过氧化氢(H2O2)浓度用钛盐分光光度法测量[14-15],在酸性介质中,H2O2和钛离子(Ti4+)反应生成橙色络合物,该络合物在411 nm处有最佳吸光度,且满足朗伯-比尔定律,络合物的吸光度与H2O2的浓度关系如式(2)所示。等离子体降解甲基橙溶液的能量效率(EY)计算式如(3)所示。
| $ {Y_{411}} = 0.01482{C_1} + 0.04478 $ | (2) |
| $ {\rm{EY}} = \frac{{CV{\rm{DR}}}}{{100PT}} $ | (3) |
输入功率不仅影响等离子体化学反应过程,且会影响放电过程的稳定性[16]。输入功率对甲基橙降解的影响如图 2,随着放电时间延长及输入功率的增加,甲基橙的降解率逐渐增加,能量效率下降。输入功率为60 W时,处理30 min时甲基橙(MO)的降解率为88.7%,能量效率为0.665 g·(kW·h)-1,输入功率逐渐增大到80 W,降解率提高至95.9%,同时能量效率降至0.539 g·(kW·h)-1。输入功率从66 W增加到72.5 W,降解率有很大程度的提高,继续增加到80 W,降解率的增幅变小,能量密度的下降幅度增大。虽然功率增加有利于甲基橙的降解,但是能量消耗增大。综合考虑降解率和能量效率,选择最佳的输入功率为72.5 W,在该功率下既能保持放电的安全平稳运行,也能在较高的能量效率下获得较高的降解率。
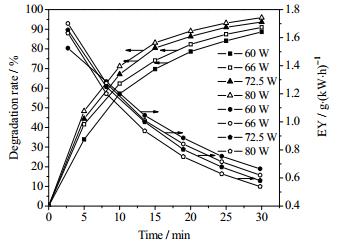
|
图 2 输入功率对甲基橙溶液的降解率和能量效率的影响 Fig.2 Effects of input power on degradation rate and EY of methyl orange (initial concentration: 150 mg·L-1; volume of solution: 150 mL; gas velocity: 300 mL·min-1) |
由图 3可以看出气体流量对甲基橙降解的影响。气体流量为100 mL·min-1时,甲基橙的降解率最低,处理30 min,降解率仅为77.5%,该气体流量下放电区间的气体量较少,放电不稳定,故甲基橙的降解率很低。当气体流量增大为200 mL·min-1时,甲基橙的降解率有明显的增加,30 min后可达到92.1%。气体流量持续增加到300 mL·min-1,甲基橙的降解率为93.7%,得到最佳处理效果。再继续增加至400 mL·min-1,甲基橙的降解率有下降。气体流量低于300 mL·min-1时,增加气速能够增大放电产生的活性粒子浓度,同时可增大气体和液膜的湍流程度,有助活性粒子向液膜内扩散。但气体流量增大至400 mL·min-1,气体在反应器内的停留时间变短,活性粒子还没来得及进入液膜就被气体带出反应器,故活性粒子的利用率下降,甲基橙的降解率降低,因此选择最佳气体流量为300 mL·min-1。
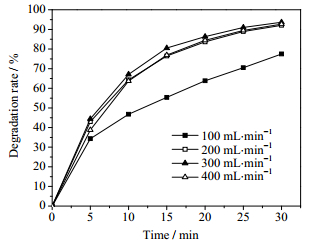
|
图 3 气体流量对甲基橙溶液降解率的影响 Fig.3 Effects of gas velocity on methyl orange degradation rate (input power: 72.5 W; initial concentration: 150 mg·L-1; volume of solution: 150 mL) |
如图 4所示,随着初始浓度的增加,甲基橙的降解率逐渐下降,而能量效率升高。初始浓度为150 mg·L-1的甲基橙溶液反应30 min后,降解率达到93.7%,而300 mg·L-1甲基橙溶液在处理30 min后的降解率低于80%,能量效率却高达1.010 g·(kW·h)-1。其原因在于体系内的甲基橙以及甲基橙降解产生的中间物分子都会和体系内活性粒子反应,当输入功率等其他条件一定时,体系内产生的活性粒子数量是一定的,甲基橙浓度越高,溶液中甲基橙分子的数量越多,甲基橙分子与活性粒子碰撞的数量越多,被降解的甲基橙分子的总量增加,故能量效率增加,但随着初始浓度的增加,每个甲基橙分子与活性粒子碰撞发生降解的机率就减小了,导致甲基橙的降解率下降。
|
图 4 初始浓度对甲基橙溶液的降解率和能量效率的影响 Fig.4 Effects of initial concentration on degradation rate and EY of methyl orange (input power: 72.5 W; gas velocity: 300 mg·L-1; volume of solution: 150 mL) |
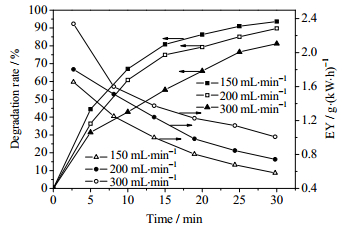
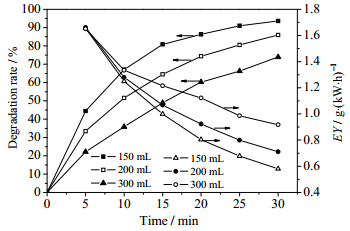
由图 5可以看出,随着溶液体积的增加,甲基橙的降解率逐渐下降,但能量效率逐渐升高。在相同条件下处理30 min,处理量150 mL时,降解率为93.7%,能量效率为0.581 g·(kW·h)-1,处理量增加至300 mL时,降解率为73.9%,但能量效率增至0.918 g·(kW·h)-1。在其他条件一定时,放电区间产生活性粒子的量是恒定的,处理量增大会导致在单位时间内溶液内的有机物分子与活性粒子的接触反应的次数减少,故降解率明显降低。同时,处理量增加会使单位时间参与反应的甲基橙分子的绝对数量值增大,单位时间内参加反应的甲基橙分子数量增加,故能量效率会变大。通过对比图 4和图 5可知,300 mL 150 mg·L-1与150 mL 300 mg·L-1甲基橙溶液在同样输入功率和气体流量下处理30 min,其降解率与能量效率分别为73.9%、0.918 g·(kW·h)-1,81.2%、1.010 g·(kW·h)-1,可见高浓度溶液处理效果优于高体积溶液的处理效果,这也说明对于降膜介质阻挡放电反应器来说,溶液初始浓度对于甲基橙降解的影响要强于处理量的影响。
|
图 5 溶液的体积对甲基橙降解率和能量效率的影响 Fig.5 Effects of volume on degradation rate and EY of methyl orange (input power: 72.5 W; gas velocity: 300 mg·L-1; initial concentration: 150 mg·L-1) |
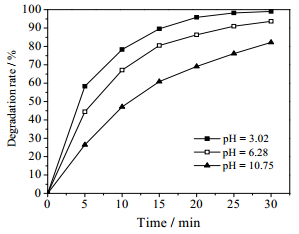
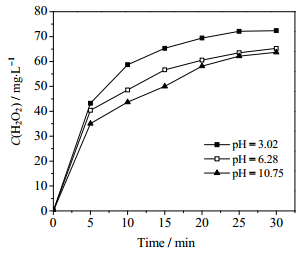
为了探究溶液的酸碱性对于甲基橙降解的影响,将甲基橙溶液分别配制为pH值为10.75、6.28和3.02进行相关实验。由图 6可以看出,甲基橙在酸性条件下的降解效果最好,溶液的pH为3.02时,降解率高达99.1%;碱性条件效果最差,溶液pH值增加到10.75时,降解率降至82.2%。主要原因是甲基橙分子结构会受pH值的影响,pH值大于4.4,甲基橙以偶氮形式存在,当pH值降低到3.1时,偶氮结构转化为对醌式结构如(4)所示;同时,活性自由基·OH (2.8 V)在碱性条件下不稳定容易分解成·O (2.4 V),如方程式(5)所示。体系内自由基的氧化势的减小,氧化有机物分子的能力变弱,造成降解率减小。体系内的活性粒子主要是·OH,而·OH的重组是形成过氧化氢的重要来源之一,如反应式(6)所示,所以H2O2的数量在一定程度上可以反映出液相中羟基自由基数量的多少。如图 7所示,不同初始pH值的甲基橙溶液在降解过程中产生的H2O2含量不同,主要表现为pH值越大的体系内产生H2O2的量越少,这与甲基橙的降解率的变化规律相同,进一步证实了不同pH值的甲基橙溶液降解率出现差异的原因。因此,酸性条件最适合甲基橙的降解。
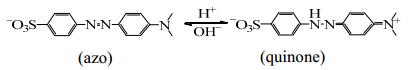
|
(4) |
| $ {\rm{OH + O}}{{\rm{H}}^ - } \to \cdot {\rm{O + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (5) |
| $ \cdot {\rm{OH + }} \cdot {\rm{OH}} \to {{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} $ | (6) |
|
图 6 初始pH值对甲基橙降解的影响 Fig.6 Effects of initial pH on methyl orange degradation rate (input power: 72.5 W; initial concentration: 150 mg·L-1; gas velocity: 300 mg·L-1; volume of solution: 150 mL) |
|
图 7 不同初始pH值条件下液相中产生的过氧化氢的浓度 Fig.7 Profiles of hydrogen peroxide concentration in aqueous solution treated with different initial pH values (input power: 72.5 W; gas velocity: 300 mg·L-1; initial concentration: 150 mg·L-1; volume of solution: 150 mL) |
采用氯化钠调节甲基橙溶液初始电导率,研究溶液初始电导率对于甲基橙降解的影响。由图 8可知,随溶液的电导率提高,甲基橙的降解率逐渐降低。溶液的初始电导率为32.4 μS·cm-1,放电30 min甲基橙的降解率为93.7 %;电导率增加到402和1260 μS·cm-1时,甲基橙的降解率分别下降到85.5%和78%。溶液的电导率影响放电强度及活性粒子的产量[17-18]。当溶液中电导率较高时,电荷不容易在介质表面聚集,放电强度变弱,放电细丝减少,故产生活性粒子的数量会变少。Jang等[19]用密闭循环反应器降解高电导率的甲基橙溶液时,检测液相生成的O3和H2O2的量均降低,甲基橙的降解率也降低。溶液中的氯离子也是一种较弱的自由基消除剂,它能与·OH反应生成氧化电势稍低[20-22]的ClOH-·和Cl2-·,如式(7)~(9)所示。因此,NaCl的引入增大了活性粒子失活的几率,这双重作用都导致甲基橙降解率降低。
| $ \cdot{\rm{OH + C}}{{\rm{l}}^{\rm{ - }}} \to {\rm{ClO}}{{\rm{H}}^{\rm{ - }}}{\rm{\cdot}} $ | (7) |
| $ {\rm{ClO}}{{\rm{H}}^{\rm{ - }}}{\rm{\cdot + }}{{\rm{H}}^{\rm{ + }}} \to {{\rm{H}}_{\rm{2}}}{\rm{O + Cl\cdot}} $ | (8) |
| $ {\rm{C}}{{\rm{l}}^{\rm{ - }}}{\rm{ + Cl\cdot}} \to {\rm{C}}{{\rm{l}}_{\rm{2}}}^{\rm{ - }} $ | (9) |

|
图 8 初始电导率对甲基橙降解率的影响 Fig.8 Effects of initial conductivity on methyl orange degradation rate (input power: 72.5 W; initial concentration: 150 mg·L-1; volume of solution: 150 mL; gas velocity: 300 mg·L-1) |
甲基橙属于偶氮染料,主要发色基团为-N=N-,水溶液成弱酸性,根据键能理论,化学反应的发生主要是旧键的断裂和新键形成的过程,分子键能越小,化学键越不稳定,旧键容易断裂或者新键容易形成。甲基橙分子中的CH3-N(CH3)C6H5 (70.8 kcal·mol-1)和C6H5NH-CH3 (71.4 kcal·mol-1)的键能都较低,容易被活性基团攻击断键。降解甲基橙过程产生的中间体主要用LC-MS分析。根据LC-MS检测结果和键能理论,分析甲基橙降解中间产物,从而提出如图 9所示的甲基橙降解的可能路径。过程分为:断键氧化、开环反应和深度氧化三个阶段[23]。其中,断键氧化有两个阶段,首先是在高能电子及氩原子亚稳态(Ar*)通过潘宁电离[24]的作用下发生的脱氢、脱甲基反应,甲基橙分子的初步降解实际上是通过逐步脱氢、脱甲基的过程,紧接着是在羟基自由基以及氢自由基作用进行的初步氧化反应。产物g和f是被·H和高能电子攻击依次脱掉甲基所形成的,可被自由基氧化成偶氮苯和磺酸基苯。产物i和h是在羟基自由基和脱甲基化作用下生成的,在自由基作用下产物h容易脱掉苯环形成d[25]。苯环间的N=N键能119.7 kcal·mol-1,最难断键,但在放电的过程中溶液的pH值会不断降低,甲基橙分子会由偶氮结构变成蒽醌结构即N=N转变成容易降解的N-N键。开环氧化即苯环和带短支链的苯环在高能电子、Ar*、·H以及·OH的攻击下打开苯环进一步被氧化。此过程需要的能量较高,且反应比较复杂,产物b就是苯环被打开后,碳原子被氧化成羰基形成的。深度氧化的过程即将开环氧化形成的稳定产物在·H、·OH、H2O2的作用下进一步氧化矿化,生成CO2、H2O和无机盐的过程。综上所述,甲基橙的降解经过了脱甲基、脱氢的断键和羟基自由基的初步氧化作用,开环氧化和深度氧化的过程,在以上这些过程中·H、·OH、Ar*、高能电子都发挥了重要作用。
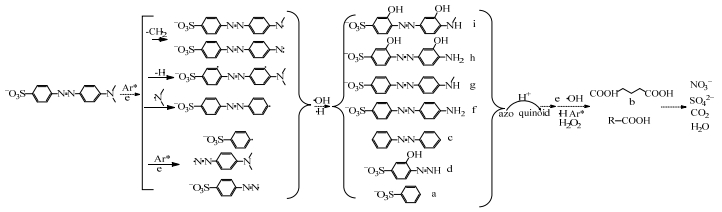
|
图 9 甲基橙溶液的降解机理 Fig.9 Proposed degradation mechanism of methyl orange under non-thermal plasma treatments |
(1) 研究表明,较高的输入功率能提高降解率,但会降低能量效率;需综合甲基橙降解率和能量效率,选用合适的输入功率。放电气体的流速也存在适宜的区间;随着溶液体积、初始浓度的增加,甲基橙降解率均下降而能量效率升高。本研究的适宜工艺参数是:输入功率72.5 W,气体流量300 mL·min-1,初始浓度150 mg·L-1,处理体积150 mL,甲基橙降解率和能量效率分别为93.7%和0.581 g·(kW·h)-1。
(2) 甲基橙溶液初始pH通过改变甲基橙的分子结构及体系的活性自由基(·OH)的数量来影响甲基橙的降解率,酸性条件下对醌式结构的甲基橙比碱性条件下的偶氮式结构容易降解,且碱性条件下·OH易转化为氧化势较低的·O,氧化能力下降,降解率下降。甲基橙溶液的电导率升高会影响介质阻挡放电的强度和稳定性,溶液中离子加速了活性粒子的失活,降解率降低。
(3) 通过对降解甲基橙的产物分析,提出甲基橙降解主要是高能电子、Ar*和活性粒子(·OH、·H)共同作用的结果,经过断键、开环和深度氧化三个阶段最终氧化成CO2、水、无机盐等。
符号说明:
| C0 | — 甲基橙溶液的初始浓度,mg·L-1 | P | — 输出功率,W |
| C | — 甲基橙溶液降解后的浓度,mg·L-1 | T | — 放电处理时间,min |
| C1 | — 反应液中H2O2的浓度,mg·L-1 | V | — 处理体积,mL |
| DR | — 甲基橙溶液在处理时间为T时的降解率,% | Y411 | — 络合物在411 nm处的吸光度 |
| EY | — 等离子体降解甲基橙的能量效率,g·(kW·h)-1 |
| [1] | Chidambaram T, Oren Y, Noel M. Fouling of nanofiltration membranes by dyes during brine recovery from textile dye bath wastewater[J]. Chemical Engineering Journal, 2015, 262: 156-168. DOI:10.1016/j.cej.2014.09.062. |
| [2] | SUN Tian(孙甜), ZHAO Bin-xia(赵彬侠), WANG Qi(王琪), et al. Preparation of Fe-Zr-pillared Montmorillonite and its application in catalytic wet hydrogen peroxide oxidation dyeing wastewater(铁锆柱撑蒙脱土的制备及其催化湿式过氧化氢氧化染料废水的研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2014, 28(3): 659-664. DOI:10.3969/j.issn.1003-9015.2014.03.035. |
| [3] | Liang B, Yao Q, Cheng H, et al. Enhanced degradation of azo dye alizarin yellow R in a combined process of iron-carbon micro electrolysis and aerobic bio-contact oxidation[J]. Environmental Science & Pollution Research International, 2012, 20(2): 1385-1391. |
| [4] | Wu Z, Zhong H, Yuan X, et al. Adsorptive removal of methylene blue by rhamnolipid-functionalized graphene oxide from wastewater[J]. Water Research, 2014, 67: 330-344. DOI:10.1016/j.watres.2014.09.026. |
| [5] | Ong Y K, Li F Y, Sun S P, et al. Nanofiltration hollow fiber membranes for textile wastewater treatment:lab-scale and pilot-scale studies[J]. Chemical Engineering Science, 2014, 114(30): 51-57. |
| [6] | Patil B N, Naik D B, Shrivastava V S. Photocatalytic degradation of hazardous Ponceau-S dye from industrial wastewater using nanosized niobium pentoxide with carbon[J]. Desalination, 2011, 269(1-3): 276-283. DOI:10.1016/j.desal.2010.11.014. |
| [7] | Pakshirajan K, Kheria S. Continuous treatment of coloured industry wastewater using immobilized Phanero chaetechrysosporium in a rotating biological contactor reactor[J]. Journal of Environmental Management, 2012, 101(4): 118-123. |
| [8] | WANG Bao-wei(王保伟), DONG Bo(董博), LIU Zhen(刘震), et al. Degradation of organic pollutants in wastewater with non-equilibrium plasma(非平衡等离子体降解废水中有机污染物研究进展)[J]. Environmental Engineering(环境工程), 2015, 9(10): 4613-4622. DOI:10.12030/j.cjee.20151001. |
| [9] | Chen J, Xie Z, Tang J, et al. Oxidation of toluene by dielectric barrier discharge with photo-catalytic electrode[J]. Chemical Engineering Journal, 2016, 284: 166-173. DOI:10.1016/j.cej.2015.09.006. |
| [10] | Yuan D L, Tang S F, Qi J B, et al. Comparison of hydroxyl radicals generation during granular activated carbon regeneration in DBD reactor driven by bipolar pulse power and alternating current power[J]. Vacuum, 2017, 143: 87-94. DOI:10.1016/j.vacuum.2017.06.003. |
| [11] | DONG Xiao-yu(董晓宇), LIU Ting-ting(刘婷婷), WANG Xiao(王萧), et al. Analysis of atmospheric cold plasma activity factor and its effect on klebsiella cell membrane(大气压冷等离子体活性因子分析及其对克雷伯氏菌细胞膜影响)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报), 2016, 30(4): 878-885. DOI:10.3969/j.issn.1003-9015.2016.04.020. |
| [12] | Wang J, Sun Y, Jiang H, et al. Removal of caffeine from water by combining dielectric barrier discharge (DBD) plasma with goethite[J]. Journal of Saudi Chemical Society, 2016, 21(5): 545-557. |
| [13] | Yu Z, Sun Y, Zhang G, et al. Degradation of DEET in aqueous solution by water falling film dielectric barrier discharge:effect of three operating modes and analysis of the mechanism and degradation pathway[J]. Chemical Engineering Journal, 2017, 317: 90-102. DOI:10.1016/j.cej.2017.02.068. |
| [14] | Eisenberg G. Colorimetric determination of hydrogen peroxide[J]. Industrial & Engineering Chemistry Analytical Edition, 1943, 15(5): 327-328. |
| [15] | LIU Xiao-wei(刘小为), CHEN Zhong-lin(陈忠林), SHEN Ji-min(沈吉敏), et al. Determination of low concentration H2O2 in O3/H2O2 system by titanium sulfate photometric method(硫酸钛光度法测定O3/H2O2体系中低浓度H2O2)[J]. China Water and Wastewater(中国给水排水), 2010, 26(16): 126-129. |
| [16] | Rueangjitt N, Sreethawong T, Chavadej S, et al. Plasma-catalytic reforming of methane in AC microsized gliding arc discharge:effects of input power, reactor thickness, and catalyst existence[J]. Chemical Engineering Journal, 2009, 155(3): 874-880. DOI:10.1016/j.cej.2009.10.009. |
| [17] | Shih K Y, Locke B R. Optical and electrical diagnostics of the effects of conductivity on liquid phase electrical discharge[J]. IEEE Transactions on Plasma Science, 2011, 39(3): 883-892. DOI:10.1109/TPS.2010.2098052. |
| [18] | Wang B W, Dong B, Xu M, et al. Degradation of methylene blue using double-chamber dielectric barrier discharge reactor in different gas atmosphere[J]. Chemical Engineering Science, 2017, 168(4): 90-100. |
| [19] | Jiang B, Zheng J T, Liu Q, et al. Degradation of azo dye using non-thermal plasma advanced oxidation process in a circulatory airtight reactor system[J]. Chemical Engineering Journal, 2012, 204-206(18): 32-39. |
| [20] | Yang Y, Pignatello J J, Ma J, et al. Comparison of halide impacts on the efficiency of contaminant degradation by sulfate and hydroxyl radical-based advanced oxidation processes (AOPs)[J]. Environmental Science & Technology, 2014, 48(4): 2344-2351. |
| [21] | Kiwi J, Lopez A, Nadtochenko V. Mechanism and kinetics of the OH-radical intervention during Fenton oxidation in the presence of a significant amount of radical scavenger (Cl-)[J]. Environmental Science & Technology, 2000, 34(11): 2162-2168. |
| [22] | Wang B W, Xu M, Chi C M, et al. Degradation of methyl orange using dielectric barrier discharge water falling film reactor[J]. Journal of Advanced Oxidation Technologies (JAOT), 2017, 20(2): 20170021. |
| [23] | Huang F M, Chen L, Wang H L, et al. Degradation of methyl orange by atmospheric DBD plasma:analysis of the degradation effects and degradation path[J]. Journal of Electrostatics, 2012, 70(1): 43-47. DOI:10.1016/j.elstat.2011.10.001. |
| [24] | LUO Hai-yun(罗海云), RAN Jun-xia(冉俊霞), WANG Xin-xin(王新新). Comparison of dielectric barrier discharge characteristics of different inert gases at atmospheric pressure(大气压不同惰性气体介质阻挡放电特性的比较)[J]. High Voltage Engineering(高电压技术), 2012, 38(5): 1070-1077. |
| [25] | Baiocchi C, Brussino M C, Pramauro E, et al. Characterization of methyl orange and its photocatalytic degradation products by HPLC/UV-VIS diode array and atmospheric pressure ionization quadrupole ion trap mass spectrometry[J]. International Journal of Mass Spectrometry, 2002, 214(2): 247-256. DOI:10.1016/S1387-3806(01)00590-5. |




