2. 昆明理工大学 省部共建复杂有色金属资源清洁利用国家重点实验室,云南 昆明 650093
2. State Key Laboratory of Complex Nonferrous Metal Resources Clean Utilization, Kunming University of Science and Technology, Kunming 650093, China
开发利用可再生能源,是解决能源短缺问题的重要途径之一[1, 2]。然而,利用可再生能源发电时,由于受到季节、气候、环境和日照时间等多种因素的限制,发出的电能具有间歇性和不稳定性。将数量巨大的可再生电能直接接入电网,会对电网产生冲击,严重时可导致电网瘫痪。因此,开发可再生电能储存技术,成为新能源利用研究领域亟待解决的重大科学问题[3~5]。
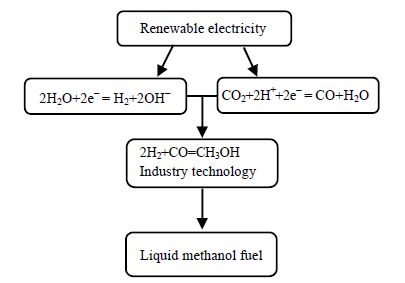
本文拟采用H2O和CO2为原料储存可再生电能,研究思路如图 1所示:首先,将可再生能源转化为电能,电解H2O制H2,电解CO2制CO,然后用工业制甲醇的传统方法,将CO氢化还原为甲醇。通过这种途径,可以将可再生电能转为化学能储存在液态甲醇燃料中。由于电解H2O制H2和CO氢化还原制甲醇技术都是成熟的工业技术[6],因此,利用图 1所示的技术途径制备甲醇,需要解决的核心关键问题,是将CO2连续高效地电还原为CO。早期CO2电还原研究主要集中在水溶液中进行[7~16],这项技术没有实现工业化应用,原因在于:①CO2是非极性分子,在水溶液中溶解度很小[17],导致CO2电还原效率很低;②在水溶液中,电极表面会发生中毒现象[18, 19],电解一段时间后,电流效率迅速降低。为了解决上述问题,本文拟在有机电解液中电还原CO2。
|
图 1 以H2O、CO2 和可再生电能为基本要素合成甲醇燃料 Fig.1 Methanol synthesis using H2O, CO2 and renewable electricity |
N-甲基吡咯烷酮是一种常用的电化学溶剂[20],也是一种重要的CO2吸收剂,具有化学性质稳定、电化学窗口宽、挥发性低、介电常数大等优点,四丁基高氯酸铵是一种常用的支持电解质,具有化学性质稳定,电导率较大的优点。基于以上原因,本文拟在N-甲基吡咯烷酮/四丁基高氯酸铵溶液中,用电化学催化还原的方法将CO2转化为CO。为达此目的,本文设计了一种新型双室隔膜电解池,采用水为阳极反应物,在N-甲基吡咯烷酮/四丁基高氯酸铵阴极电解液中,将CO2电还原为CO。
2 实验部分 2.1 实验仪器与材料电化学工作站(CHI660e,上海辰华仪器厂),气相色谱仪(GC-4000A,北京东西电子有限公司),气相色谱柱(5A分子筛,兰州化学物理研究所),液相色谱仪(依利特RI-201H,大连依利特分析仪器有限公司),真空干燥箱(BPZ-6033,上海一恒科学仪器有限公司)。
N-甲基吡咯烷酮(分析纯,天津市科密欧化学试剂有限公司),四丁基高氯酸铵(分析纯,浙江肯特化工有限公司),四丁基碘化铵(分析纯,国药集团化学试剂有限公司),碘(分析纯,国药集团化学试剂有限公司),离子交换膜(Nafion 117,杜邦公司),二氧化碳(纯度≥99.99%,昆明梅塞尔气体产品有限公司),氦气(纯度≥99.99%,昆明梅塞尔气体产品有限公司),氩气(纯度≥99.99%,昆明梅塞尔气体产品有限公司),氮气(纯度≥99.99%,昆明梅塞尔气体产品有限公司)。实验所用蒸馏水均为二次水。
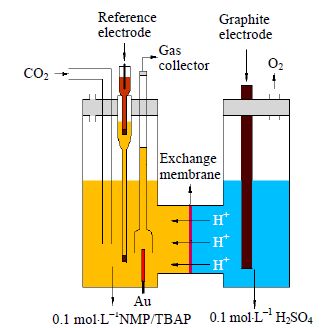
2.2 电化学反应装置的设计与工作原理本文设计的电化学反应装置其结构如图 2所示:用离子交换膜将电解槽分隔成阴极室和阳极室,阳极室中注入 0.1 mol⋅L-1 稀硫酸,阴极室中注入 0.1 mol⋅L-1 N-甲基吡咯烷酮/四丁基高氯酸铵溶液,工作电极为1 cm ×1 cm 的金片(纯度>99.99%),对电极为石墨棒(纯度>99.9%),参比电极为I-/I3-电极[21],参比电极的构成方法为:用阴极电解液配制0.05 mol⋅L-1碘和0.1 mol⋅L-1四丁基碘化铵的混合溶液,注入参比电极,将铂丝插入其中,然后将参比电极插入盐桥,盐桥中的溶液与阴极电解液相同,参比电极和盐桥的末端均为多孔聚四氟乙烯[22]。
|
图 2 电化学反应装置 Fig.2 Structure of the electrochemical reaction cell for CO2 reduction |
实验前用Al2O3粉末将Au电极在用二次水湿润的麂皮上抛光,经超声处理、琥珀酸浸泡后,用二次水冲洗干净。石墨棒先用砂纸打磨再超声,然后用二次水冲洗干净。电化学实验之前,先往阴极电解液中通入30 min Ar 以除去溶解氧,再通入CO2 30 min,保证电解液中的CO2溶解度达饱和。然后进行循环伏安测试、恒电位电解。恒电位电解时,对阴极气体产物进行收集,用注射器将气体产物打入气相色谱仪检测气体产物,电解 2 h 后,检测液相产物。实验后用扫描电镜对Au电极表面进行检测。
在阴极电解液中通入CO2达饱和后,进行电解,电化学反应原理为:H2O在阳极上发生氧化反应,生成O2和H+,H+扩散进入阴极室,与CO2在Au电极上发生还原反应,生成CO和H2O。电极反应方程式为:
阳极反应:$2{H_2}O + 4{e^ - } = {O_2} + 4{H^ + }$
阴极反应:$C{O_2} + 2{e^ - } + 2{H^ + } = CO + {H_2}O$
阴极副反应: $2{H^ + } + {\rm{2}}{{\rm{e}}^ - } = {H_2}$
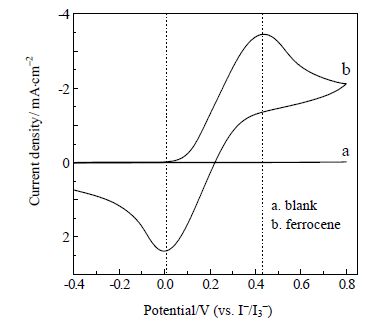
3 实验结果与讨论 3.1 参比电极校正方法在N-甲基吡咯烷酮/四丁基高氯酸铵溶液中,为了准确报道电极电位值,本文采用3 mmol⋅L-1二茂铁[23~25]为内标,测定循环伏安曲线,结果如图 3所示。
|
图 3 NMP/TBAP 溶液中循环伏安测试曲线 Fig.3 Cyclic voltammograms measured in the NMP/TBAP solution |
当阴极电解液中不含二茂铁时,在扫描范围内未出现氧化还原峰(图 3a),当在上述溶液中加入二茂铁时,出现一对可逆性较好的氧化还原峰(图 3b),半波电位为+0.22 V。以下测试数据均采用二茂铁为内标校正后的电位进行数据报道[26]。
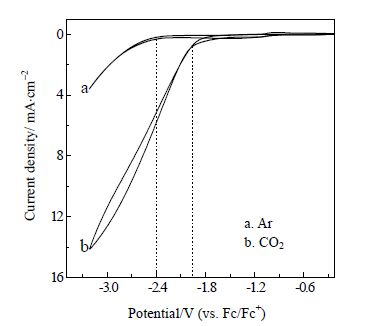
3.2 循环伏安曲线分析在N-甲基吡咯烷酮/四丁基高氯酸铵阴极电解液中,通入Ar以除去溶液中的溶解氧,然后通入CO2达饱和,分别测定循环伏安曲线,结果如图 4所示。
|
图 4 CO2 在Au 电极上发生电还原反应的循环伏安曲线 Fig.4 Cyclic voltammograms of CO2 reduction on Au electrode |
从图 4a可以看出,当电解液中未通入CO2时,在0~ -2.48 V,没有出现还原电流,而当扫描电位低于 -2.48 V时,出现还原电流,且随电位降低,还原电流明显增大,说明电解液发生了还原变质,阴极电化学窗口为 -2.48 V。当电解液中通入CO2达饱和时,测得还原电位为 -1.93 V(图 4b),说明CO2发生了电化学还原反应。
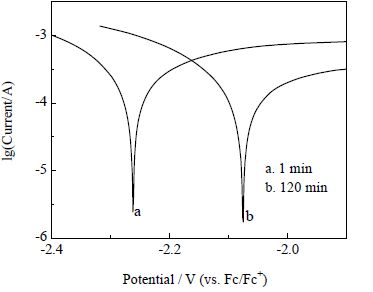
3.3 塔菲尔曲线分析本文在阴极电解液中,分别测定了刚开始反应时和反应2 h后的塔菲尔曲线,结果如图 5所示,根据塔菲尔公式[27]:
|
图 5 CO2 在Au 电极上发生电还原反应的塔菲尔曲线 Fig.5 Tafel curves for CO2 reduction on Au electrode |
| $\begin{array}{l} \eta = a + b\lg \left| i \right|\\ a = - \frac{{RT}}{{n\alpha F}}\ln {i_0},b = \frac{{2.3RT}}{{n\alpha F}} \end{array}$ |
结合实验结果(图 5),本文求得CO2电化学还原反应动力学参数如表 1所示。其中η为过电位,a和b为塔菲尔常数,i 为电流密度,i0为交换电流,R为气体常数,T为绝对温度,n 为电子转移数,α为传递系数,F为法拉第常数,Rct为电荷转移电阻,计算公式为[28]:
| ${R_{ct}} = \frac{{RT}}{{nF{i_{_0}}}}$ |
从图 5可以看出,反应开始时,平衡电位为 -2.26 V;反应2 h 后,平衡电位降为 -2.08 V,原因在于:还原反应刚进行时,电极表面只有CO2发生反应,生成CO和H2O,由于CO2发生电还原反应需要很高的过电位,平衡电位较高;反应过程中,阴极电解液中H2O含量不断增多,电解H2O生成H2的电位低于电解CO2生成CO的电位,所以平衡电位降低。从表 1可以看出,电解反应进行之前,测得交换电流为2.1135×10-4 A⋅cm-2,电荷转移电阻60.7389 Ω⋅cm-2;反应2 h 后,交换电流降低为1.2957×10-4 A⋅cm-2,电荷转移电阻增加为99.0751 Ω⋅cm-2,说明反应更难进行,原因在于:反应刚开始时,Au电极表面是光滑的,CO2电还原容易发生,随着电解的进行,生成的CO附着在Au电极表面,导致电子转移电阻增大,析出H2和CO的难度增大。
| 表 1 CO2 在 Au 电极上发生电还原反应时的动力学参数 Table 1 Dynamics parameters for CO2 reduction on Au electrode |
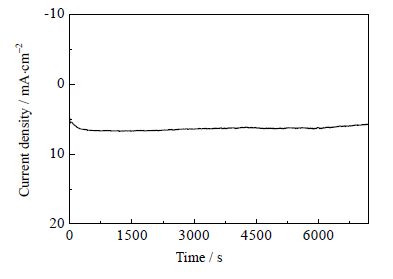
在CO2饱和阴极电解液中,测定了恒电位电解曲线,结果如图 6所示。为了防止电解液发生还原变质,采用的电极电位为-2.40 V(图 4)。从图 6可以看出,经2 h 电解后,阴极电流密度没有发生明显降低,稳定在6.6 mA⋅cm-2左右。
|
图 6 CO2在Au 电极上发生电还原反应的恒电位电解曲线 Fig.6 A potentiostatic electrolysis curve for CO2 reduction on Au electrode |
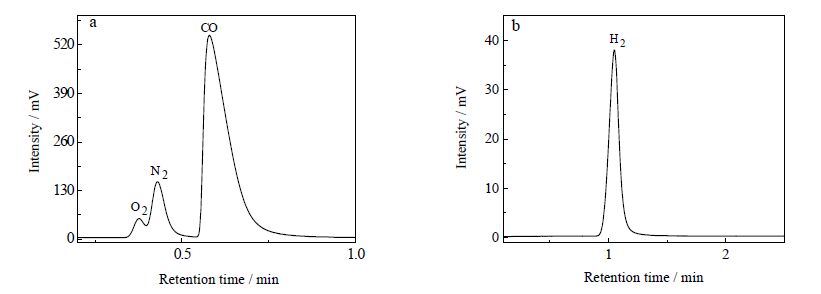
电解反应过程中,将阴极气相反应产物收集起来,用注射器抽取样品,注入到气相色谱仪,以He为载气检测CO,以N2为载气检测H2,载气流速为25 mL⋅min-1,热导池温度为110℃,柱温箱温度为130℃,汽化室温度为130℃,测得结果如图 7所示。可以看出,CO2电还原反应生成的主要气相产物为CO(图 7a),由于阴极电解液中反应生成H2O,H2O在阴极发生电还原反应,导致阴极表面产生副产物H2(图 7b)。电解2 h 后,抽取阴极电解液,注入到液相色谱仪检测液相产物,色谱柱为C18,流动相为0.1 mol⋅L-1磷酸二氢钾,流速为1.0 mL⋅min-1,进样量为20 μL,柱温为室温,结果未检测出其他产物。
|
图 7 CO2 在金电极上发生电还原反应的气相产物色谱图 Fig.7 Gas chromatogram of gaseous products during CO2 reduction on Au electrode |
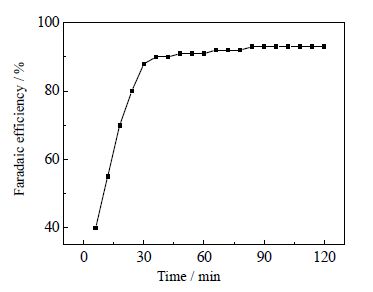
电流效率随时间的变化曲线如图 8所示,计算电流效率的公式为[29, 30]:
|
图 8 CO2 在 Au 电极上的电流效率随时间的变化曲线 Fig.8 Time-dependence of Faradaic efficiencies of CO2 reduction on Au electrode |
| $\eta = \frac{{2nF}}{Q}$ |
其中η为电流效率,n为生成CO的摩尔数,F为法拉第常数,Q为通过的电量。
从图 8可以看出,当电解反应刚开始进行时,测得CO的电流效率较低,为40%。这是因为生成的CO部分溶解在有机电解液中,无法用注射器收集,导致测得的电流效率低于实际效率。随着反应进行,电流效率逐步增加,40 min后,电流效率达到90%左右,并稳定在这一数值直到反应结束。
3.5 SEM结果分析电解反应过程中,电极表面是否中毒,是决定CO2电还原反应能否持续进行的关键。早期CO2电还原研究大多集中在KHCO3水溶液中进行,研究结果表明,电解反应过程中,电极表面有附着物生成(图 9(a)),导致电极中毒[18, 19],电流效率大幅度下降,电解反应无法持续进行。

|
图 9 电解2 h 后Au 电极的扫描电镜图 Fig.9 SEM micrographs of Au electrode after 2 h of electrolysis |
在N-甲基吡咯烷酮/四丁基高氯酸铵溶液中,CO2电还原反应2 h 后,SEM测试结果,Au电极表面无附着物生成(图 9b),电极未发生中毒,反应能持续进行(图 6)。由于电极中毒是影响CO2电还原技术走向工业化应用的制约因素,因此,在N-甲基吡咯烷酮/四丁基高氯酸铵溶液中电还原CO2,具有广阔的工业化应用前景。
4 电极反应机理分析根据文献报道[31],在非水体系电解液中,CO2的电还原反应机理为图 10所示:首先是CO2吸附在Au电极的表面,得到一个电子后,生成CO2·-自由基,生成的CO2·-自由基进而与CO2发生反应,生成加合物CO2-CO2·-,该加合物得到一个电子后,生成CO和CO32-。反应生成的CO32-与从阳极室迁移过来的H+反应生成CO2和H2O。
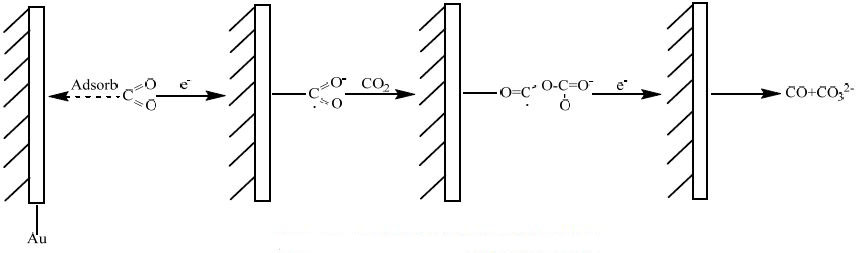
|
图 10 CO2 在非水体系电解液中的电还原反应机理 Fig.10 Reaction mechanism of CO2 reduction in nonaqueous solutions |
本文设计了一种新型双室电解池,可以在N-甲基吡咯烷酮/四丁基高氯酸铵溶液中,将CO2连续高效地电还原为CO,电流密度最高可达6.6 mA⋅cm-2,电流效率达到93%左右。由于N-甲基吡咯烷酮溶解CO2能力强,化学性质稳定、电化学窗口宽、挥发性低、无毒、介电常数大,而且在CO2电解反应过程中,电极表面无附着物生成,电极不会出现中毒现象,因此在工业化应用领域具有广阔的应用前景。
| [1] | Cai X S . Advanced technology of electrical engineering and energy[J]. Advanced Technology of Electrical Engineering and Energy , 2005, 24 (1) : 64-75 |
| [2] | Juan M C, Leopoldo G F, Jan T B . Power-electronic systems for the grid integration of renewable energy sources:A survey[J]. Ieee Transactions on Industrial Electronics , 2006, 53 (4) : 1002-1016 DOI:10.1109/TIE.2006.878356 |
| [3] | HAO Liang(郝亮), ZHU Jia-jia(朱佳佳), DING Bing(丁兵) . Research progress of material and technology for electrochemical energy storage(电化学储能材料与技术研究进展)[J]. Journal of Nanjing University of Aeronautics and Astronautics(南京航空航天大学学报) , 2015, 47 (5) : 650-658 |
| [4] | Silvija L, Kamen S . Renewable energy sources and pricing of electrical power[J]. Journal of Energy and Power Engineering , 2014, 8 (5) : 896-901 |
| [5] | Marc B, Hamidreza Z, Anthony S . Energy storage for mitigating the variability of renewable electricity sources:An updated review[J]. Energy for Sustainable Development , 2010, 14 (4) : 302-314 DOI:10.1016/j.esd.2010.09.007 |
| [6] | Devin T W, Paul J A K . Prospects of CO2 utilization via direct heterogeneous electrochemical reduction[J]. The Journal of Physical Chemistry Letters , 2010, 1 (24) : 3451-3458 DOI:10.1021/jz1012627 |
| [7] | Gupta N, Gattrell M, Macdougall B . Calculation for the cathode surface concentrations in the electrochemical reduction of CO2 in KHCO3 solutions[J]. Journal of Applied Electrochemistry , 2006, 36 (2) : 161-172 DOI:10.1007/s10800-005-9058-y |
| [8] | Hidetomo N, Shoichiro I, Yoshiyuki O . Electrochemical reduction of carbon dioxide at various metal electrode in aqueous potassium hydrogen carbon solution[J]. Bulletin of the Chemical Society of Japan , 1990, 63 (9) : 2459-2462 DOI:10.1246/bcsj.63.2459 |
| [9] | Mehmed Z E, Steven J K, Moyses Araujo C . Functional role of pyridinium during aqueous electrochemical reduction of CO2 on Pt[J]. The Journal of Physical Chemistry Letters , 2013, 4 : 745-748 DOI:10.1021/jz400183z |
| [10] | Jitaru M, Lowy D A, Toma B C . Oniciu. Electrochemical reduction of carbon dioxide on at metallic cathodes[J]. Journal of Applied Electrochemistry , 1997, 27 (8) : 875-889 DOI:10.1023/A:1018441316386 |
| [11] | George A O, Surya Prakash G K, Alain G . Anthropogenic chemical carbon cycle for a sustainable future[J]. Journal of the American Chemical Society , 2011, 133 : 12881-12898 DOI:10.1021/ja202642y |
| [12] | Gattrell M, Gupta N, Co A . A review of the aqueous electrochemical reduction of CO2 to hydrocarbons at copper[J]. Journal of Electroanalytical Chemistry , 2006, 594 (1) : 1-19 DOI:10.1016/j.jelechem.2006.05.013 |
| [13] | Devin T W, Eryn C F, Paul J A K . Microfluidic reactor for the electrochemical reduction of carbon dioxide:The effect of pH[J]. Electrochemical and Solid-State Letters , 2010, 13 (9) : B109-B111 DOI:10.1149/1.3456590 |
| [14] | Narayanan S R, Haines B, Soler J . rochemical conversion of carbon dioxide to formate in alkaline polymer electrolyte membrane cells[J]. Journal of the Electrochemical Society , 2011, 158 (2) : A167-A173 DOI:10.1149/1.3526312 |
| [15] | Yoshio H, Hidetoshi W, Toshio T . Electrocatalytic process of CO selectivity in electrochemical reduction of CO2 at metal electrodes in aqueous media[J]. Electrochimica Acta , 1994, 39 (11) : 1833-1839 |
| [16] | Yoshio H . Electrochemical CO2 reduction on metal electrodes[J]. Modern Aspects of Electrochemistry , 2008, 42 : 89-101 |
| [17] | TANG Wei-hua(汤卫华), JIANG Ya-xiong(蒋亚雄), BA Jun-zhou(巴俊洲) . Review of electrochemical reduction of CO2 at metal electrodes(金属电极电还原CO2的研究进展)[J]. Ship Science and Technology(舰船科学技术) , 2009, 31 (1) : 33-37 |
| [18] | WANG Xiao-chun(王晓春), YANG Dong-wei(杨冬伟), LI Lu(李露) . Deactivation of Ag electrode in the electrochemical reduction of CO2 in aqueous solution(二氧化碳在银电极上发生电还原反应时的电极失活原因)[J]. Chemical Industry and Engineering Progress(化工进展) , 2014, 33 : 286-292 |
| [19] | WANG Qin(王琴), WANG Xiao-chun(王晓春), YANG Dong-wei(杨冬伟) . Deactivation mechanism of Au electrode in electrochemical reduction of CO2(Au电极上CO2电还原过程中电极失活原因)[J]. Chemical Reaction Engineering Technology(化学反应工程与工艺) , 2015, 31 (4) : 352-358 |
| [20] | Briony M S P, Robert A W D . The influence of electrolyte identity upon the electro-reduction of CO2[J]. Journal of Electroanalytical Chemistry , 2014, 730 (9) : 48-58 |
| [21] | Shi J, Shi F, Song N . A novel electrolysis cell for CO2 reduction to CO in ionic liquid/organic solvent electrolyte[J]. Journal of Power Sources , 2014, 259 (4) : 50-53 |
| [22] | Coetzee J F, Gardner C W . Teflon double-junction reference electrode for use in organic solvents[J]. Analytical Chemistry , 1982, 54 (14) : 2625-2626 DOI:10.1021/ac00251a058 |
| [23] | LU Qi(芦齐), QIAO Qing-dong(乔庆东) . The electrolytic synthesis and application of ferrocene(二茂铁的电解合成及应用)[J]. Chemistry and Adhesion(化学与粘合) , 2011, 33 (4) : 45-48 |
| [24] | GUO Hong-xu(郭鸿旭), ZOU Xue-zhen(邹雪珍), HUANG Zun-xing(黄尊行) . Ferrocene and its derivatives with multi-applications(应用前景广阔的二茂铁及其衍生物)[J]. Journal of Fuzhou University (Natural Science Edition)((福州大学学报(自科学报))) , 2002, 30 (5) : 597-603 |
| [25] | SUN Xue-jun(孙学军), YU Zhang-yu(郁章玉), DING Yang-jun(丁养军) . New method of preparation of ferrocene(二茂铁合成新方法的研究)[J]. Fine Chemicals(精细化工) , 2000, 17 (10) : 604-606 |
| [26] | Gritzner G, Kuta J . Recommendations on reporting electrode potentials in nonaqueous solvents[J]. Pure and Applied Chemistry , 1984, 56 (4) : 461-466 |
| [27] | TENG Dao-zhao(藤岛昭) . Electrochemical method(中化马测定方法)[M]. Beijing(北京): Peking University Press(北京大学出版社), 1995 : 139 -140. |
| [28] | Allen J Bard, Larry R F . Electrochemical methods-fundamentals and applications (电北学方法原理和应用)[M]. Beijing (北京): Chemical Industry Press (化学工业出版社), 2012 : 71 -72. |
| [29] | Charles D, Paul L R, John B K . Design of an electrochemical cell making syngas (CO+H2) from CO2 and H2O reduction at room temperature[J]. Journal of the Chemical Society , 2008, 155 (1) : B42-B49 |
| [30] | Weimer T, Schaber K, Specht M . Methanol from atmospheric carbon dioxide:a liquid zero emission fuel for the future[J]. Energy Conversion and Management , 1996, 37 : 1351-1356 DOI:10.1016/0196-8904(95)00345-2 |
| [31] | Armando G, Abdirisak A I, Maria-Gabriella S . Mechanism of the electrochemical reduction of carbon dioxide at inert electrodes in media of low proton availability[J]. Journal of the Chemical Society, Faraday Transactions , 1996, 92 (20) : 3963-3968 DOI:10.1039/FT9969203963 |




