液滴微流控技术(Microfluidics)是在微通道内利用不混溶流体生成和操控单分散微液滴的技术,具有生成的液滴体积小、粒径易控制且单分散性高等优点,广泛应用于微反应器[1]、药物传输[2]、细胞分选[3]等领域。根据微通道结构的不同,液滴微流控装置可以分为3类:T型(T-junction)、流动聚焦型(flow-focusing)、同轴流动型(co-flow)[4]。与T型结构和同轴结构相比,流动聚焦型结构将液滴限制在通道中心处,避免液滴与壁面发生剪切,液滴生成过程形态更加稳定,因此在液滴微流控的研究中应用最为广泛。
聚焦型微流控装置(MFFD)最早由Anna和Dreyfus设计[5-6]并成功制备了油包水(W/O)型液滴,分散相流体在微通道交叉处受到连续相的挤压和剪切,导致分散相流体失稳断裂形成液滴。Takeuchi等[7]采用圆形管道得到粒径偏差小于5% 的微米级液滴。Ong等[8]改进了传统十字交叉结构,在通道交叉处设计了一个圆形孔,生成的液滴直径更小、频率更高。根据装置制备材料的不同,MFFD分为两类:一类是二维微通道(microchannel):利用聚二甲基硅氧烷(PDMS)、聚甲基丙烯酸甲酯(PMMA)或聚碳酸酯(PC)等材料通过软光刻、热压法、等离子体刻蚀、激光加工、模塑法等方法加工得到微流控装置[9];因为PDMS材料具有价格低廉、制备简单、透光性好[10-11]等优点,是制备微流控装置最常用的材料之一。另一类是毛细玻璃管(glass microcapillarie)[12]:通过毛细管拉丝嵌套来实现,不需要加工设备,但是对装置的精度和清洁性要求较高,实验过程中容易造成毛细管堵塞。
微通道中存在3种流型:挤压(squeezing)、滴落(dripping)和喷射(jetting)。Cubaud等[13]研究了流型和分散相与连续相的流速比即体积流量比(qVd / qVc)的关系,发现喷射流型与qVd / qVc有关,滴落流型与毛细管数(Ca)有关。Ward等[14]研究发现qVd / qVc和分散相与连续相入口压力比(pd/pc)对液滴尺寸的影响非常显著。Dietrich等[15]研究了十字通道角度θ对液滴形状和尺寸的影响,还发现液滴尺寸与流体动力黏度η(Pa⋅s)和表面张力σ(N⋅m−1)也有关。丁奕文等[16]利用流体体积法(VOF)模拟了乳液形成过程,发现在液滴生成过程中σ和黏性力占据主导地位,通道角度对流型影响显著。Liu等[17]利用Lattice-Boltzmann模型模拟了Ca、qVd / qVc和通道几何结构对液滴流型转变、尺寸和形貌的影响。
聚焦型微流控在合成功能微球领域具有巨大优势,可以得到多孔、核壳和Janus等多种颗粒,但单个微流控装置产量低,进行集成放大研究,提高微粒产量也是研究重点之一。一般采取流体分配通道与液滴制备单元并联方式[18]实现液滴的大规模生产。Nisisako等[19]环形布置聚焦型微通道提高了液滴产率,Li等[20]并联流动聚焦装置得到四重微流体液滴发生器,生成不同尺寸的高单分散液滴。
本文从流动聚焦型液滴微流控技术出发,对实验和数值模拟、功能性微球制备和集成放大研究进行了详细综述,为后续制备新型功能性微球和提高微球产量提供参考。
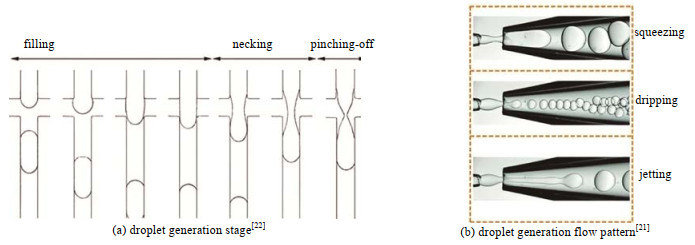
2 实验研究进展微通道中的液滴是在黏性力、惯性力和表面张力的共同作用下形成的,与流体的Ca、韦伯数We、qVd / qVc、分散相与连续相的动力黏度比ηd/ηc、分散相与连续相的密度比ρd/ρc和通道几何形状等多种因素有关,但微通道中的液滴成型主要有以下3种流型:挤压、滴落和喷射[21],尽管3种流型的流动工况各有不同,但液滴生成过程均包括填充(filling)、颈缩(necking)和断裂(pinching-off)阶段。填充阶段,分散相与连续相在通道连接处交汇,不断阻碍连续相的流动,当压力达到临界值时开始发生颈缩,分散相不断汇入,使得液滴颈部变细并断裂形成液滴。液滴生成的3个阶段和3种流型分别如图 1(a)和(b)所示。qVd / qVc、通道宽高比、ηd/ηc和Ca对微通道内液滴生成有显著影响,调节Ca可以产生挤压、滴落和喷射3种流型,分别可以生成不同尺寸和分散性的液滴[22]。Fu等[23]研究了滴落和喷射2种流型条件下液滴的形成过程,并构建了以Ca和We为坐标的流型图。
|
图 1 液滴生成阶段与液滴生成流型 Fig.1 Schematic diagram of droplet generation stages and droplet flow pattern |
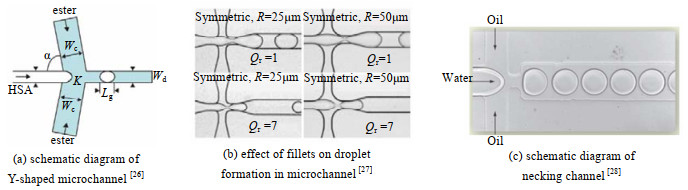
液滴尺寸很大程度取决于两相的物理性质和流动工况,即η、σ和流速qVi,qVi为分散相或连续相的体积流量,在高We和高Ca的条件下产生的液滴尺寸更小[24]。Yu等[25]定量研究了θ对液滴生成流型、两相界面形状和液滴长度的影响,发现θ对挤压和滴落流型之间的转换以及挤压流型下液滴尺寸的影响最为显著。如图 2(a)所示,图中Wd,Wc分别为分散相,连续相通道宽度,Lg为液滴长度,HAS为该研究中的分散相流体。在Y型结构中,液滴尺寸由矩形通道的最小尺寸决定,并且与qVd / qVc呈线性关系[26]。Gulati等[27]研究发现通道交汇处的圆角对液滴大小有显著影响(图 2(b),1/Qr=qVd / qVc),圆角半径R越大,液滴直径越大;连续相流量增加会使得液滴断裂位置向装置靠近分散相入口的方向移动。Joanicot等[28]在十字交叉下游增加了颈缩段(图 2(c)),使得液滴制备过程的稳定性得到提高。
|
图 2 不同几何结构的通道的液滴生成实验 Fig.2 Experiments of droplet formation in channels with different geometric structures |
液滴生成过程包括填充、颈缩和断裂3个阶段,目前实验研究主要集中在流速比、通道几何结构等对液滴生成流型的影响以及液滴尺寸和频率的影响,通过改变分散相与连续相流速比可实现对液滴直径的调控。
3 数值模拟微通道中液滴生成过程与多种作用力有关,仅通过实验无法充分研究液滴的生成过程,因此需要数值模拟对液滴生成进行辅助研究。常用的数值模拟方法有水平集法(LS)、VOF法和格子-波尔茨曼法(LB)。此外,相场法、界面跟踪法和耦合LS、VOF的CLSVOF方法也有很多应用。
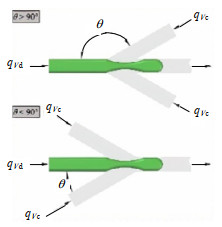
Yu等[29]利用VOF法研究了θ对液滴尺寸和频率的影响(见图 3),当Ca恒定时,qVd / qVc增加时,流型从挤压变为滴落,导致液滴直径变小,生成频率增加;当θ>90°时上述规律更加显著。Chekifi等[30]基于VOF方法研究了Ca、通道几何结构、表面张力和壁面接触角对液滴生成的影响,发现Ca是影响液滴直径和生成频率的主要因素,Ca的增加导致液滴生成频率增大、直径变小。
Han等[31]采用LS法成功预测了液滴的生成过程,包括填充、颈缩和断裂3个阶段,与文献[22]结果一致。并研究了qVd/qVc、连续相动力黏度ηc(Pa·s)和σ对液滴生成的影响,结果表明当qVd / qVc增加、ηc减小或者σ增加时均会使液滴直径增加,生成频率降低。Ibrahim等[32]建立了三维聚焦型装置模型,并利用实验与LS法模拟相结合,研究了qVd/qVc对液滴直径和液滴之间间距的影响,当qVd / qVc减小时液滴直径减小,液滴间距减小至最低值后增大,且实验结果与模拟之间的匹配性良好。Mottaghi等[33]使用LS方法研究了流动聚焦通道中液滴直径的影响因素,并通过混合人工神经网络(ANN)和模糊推理系统(FIS)相结合的自适应神经模糊推理系统(ANFIS)预测液滴直径,研究影响液滴直径的参数,该系统以Ca、雷诺数Re、qVd/ qVc和ηd/ηc为输入,液滴直径为输出,决定系数r2达0.92。
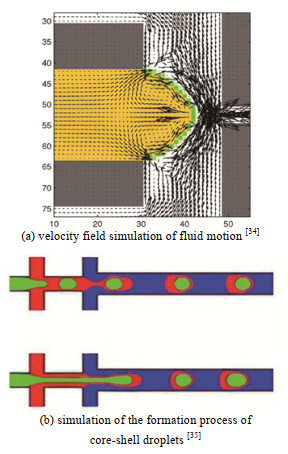
如图 4(a)所示,Dupin等[34]结合LB法和多相/多组分模型,研究在低Re和低Ca下流体的流动模型,运动过程中液滴内部出现对称形状的涡,与实验的定性研究结果相一致。如图 4(b)所示,Askari等[35]利用改进的LB法模拟了十字交叉通道内2种核壳型液滴的生成过程(一步法和两步法),研究了内流速以及内外相黏度对液滴形成的影响。当两步法生成液滴时,内相流速对内部流速射流分离点的影响显著,当一步法生成液滴时内外相的黏度对液滴断裂位置的影响更显著。并发现核壳厚度可以通过改变内部流速来调控。
|
图 4 流体速度场模拟和核壳型液滴生成过程模拟 Fig.4 Simulation of fluid velocity field and core-shell droplet generation process |
Sontti等[36]利用CLSVOF法确定三维微流控聚焦装置中的液滴形成及其状态转变,该方法结合LS和VOF的计算方法,可以精准捕捉到液滴运动过程中的液膜厚度,研究液膜厚度对液滴内部流体速度的影响,并研究了ηd/ηc、σ和qVd/qVc对液滴生成的影响。提出了根据Ca值确定液滴无量纲长度的公式,当Ca较低和qVd/qVc较高时液滴呈滴落状态,低qVd/qVc时呈喷射状态。采用液滴变形指数(DI)定量表示液滴的形状,喷射流型时一般形成近球形液滴,滴落流型下获得塞装液滴。绘制了Ca为0.006~0.072的连续相体系下的流型图,对单尺寸液滴的产生和体积调控具有重要影响。Carneiro等[37]使用CLSVOF方法在十字交叉微通道内研究了黏性液滴的生成过程,包括滴落和喷射2种流动状态,并研究了表面活性剂对传质和界面变化的作用,建立了不添加表面活性剂时的液-液两相流中的液滴尺寸经验公式。
Soroor等[38]使用相场法在2D聚焦型通道中模拟了液滴的生成过程,研究了qVd/qVc从0.25到1.05,17个不同的比值条件下液滴生成频率和流型转换,实验与模拟结果差小于11%,可以很好地预测液滴的生成过程。Borgogna等[39]利用欧拉/拉格朗日组合方法在低Re(1~150)下研究了三维聚焦装置中扩散物质的混合过程,发现流体的运动状态取决于Re和qVd/qVc。当qVd/qVc较低时,Re增加导致流体从聚焦直线形状变为多分支形状;当qVd/qVc一定时,混合效率与Re存在非线性关系,流体扩散过程的横截面尺寸减小,混合效率提高。
目前聚焦型微通道内的数值模拟研究集中在分散相和连续相之间的速度比等参数和微通道几何结构对液滴直径和生成频率的影响,表 1是聚焦型微通道模拟方法及研究对象,为微流控芯片几何结构的设计提供参考和指导。
|
|
表 1 聚焦型微通道模拟方法及对象 Table 1 Simulation methods and objects of flow-focused microchannels |
功能性微球材料具有表面功能化、结构可控等优点,可以应用于催化、吸附、载药等多个领域。根据微球结构不同,可以分成多孔结构微球、核壳型微球和各向异性颗粒。利用液滴微流控技术制备微球试剂消耗量少,且微球单分散性高,粒径容易控制,相对传统微球制备方法,优势明显。
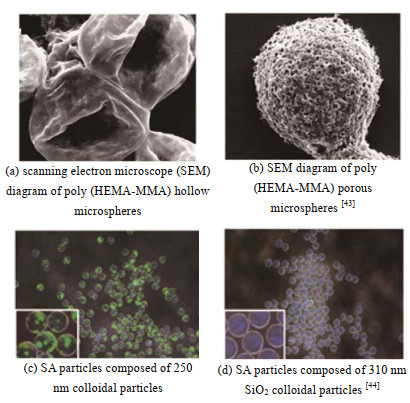
4.1 多孔结构微球多孔结构微球内部富含孔道,孔隙率大、密度低、比表面积高、渗透性高,在吸附和催化领域应用广泛。Zhang等[43]以聚甲基丙烯酸羟乙酯-甲基丙烯酸甲酯,(聚HEMA-MMA)为分散相,引入不同的引发剂和致孔剂制备得到中空及多孔结构的聚HEMA-MMA微球(见图 5(a)和(b))。Teshima等[44]利用MFFD制备了可以呈现不同颜色的微球(SA):亚微米级别的SiO2胶体颗粒和磁铁矿(Fe3O4)胶体颗粒混合后为分散相,十六烷为连续相。调节SiO2的添加量和粒径来控制SA的平均粒径和色调(见图 5(c)和(d)),改变Fe3O4添加量可以控制SA色彩的饱和度,是一种可应用于颜料和试剂的新型环保着色材料。
|
图 5 多孔结构微球 Fig.5 Images of porous microspheres |
Liu等[45]以理化性质不同的阿托伐他汀(AVA)和塞来昔布(CEL)为目标药物,利用毛细管聚焦装置制备得到具有多级pH响应特性的多药物负载微球(PSi-AVA@MFHF-CEL),药物在低pH值时不释放,pH较高时释放增强。微球可精准控制药物在肠道区域的释放,用于结肠癌的预防治疗。Wang等[46]利用MFFD和官能团修饰技术成功合成聚乙烯亚胺壳聚糖(PEI-CS)生物吸附剂,对Cu2+的吸附能力达146 mg⋅g−1,吸附性能提升了3倍,且具有优异的吸附选择性和可再生性。Ruszczak等[47]在PDMS装置中制备了含抗生素的W/O型液滴,发现液滴之间抗生素的扩散速率与药物浓度和液滴间距有关。Trossbach等[48]在微通道的入口和出口处施加负压来驱动流体生成W/O液滴,该液滴制备装置可以在非专业微流控实验室中使用微流控技术,同时与液滴接触的各组件可以进行杀菌并且能够在无菌环境中使用,因此可以应用于生命科学领域。
4.2 核壳结构微球核壳结构由内核和外壳2部分组成,一般由2种及以上材料构成,外壳保护内核不受环境影响并增加了微球的机械强度和化学性能[49],广泛应用于药物传递领域。Gong等[50]在PDMS装置中制备得到具有良好的磁响应性的核壳结构微球,微球内相为阿司匹林水溶液,外壳为添加Fe3O4颗粒的壳聚糖溶液,通过改变外加磁场强度、频率和时间来控制微球内部阿司匹林的释放率。Li等[51]利用多级聚焦型微流控装置制得药物为内核,含磁性纳米颗粒的聚合物为核壳的微胶囊(见图 6(a))。当磁性颗粒远程感应到加热时,聚N-异丙基丙烯酰胺(Poly(n-isopropylacrylamide),聚(PNIPAM))受热收缩,核壳结构内形成微间隙和通道,释放内相中的药物。当感应不到加热时,微胶囊复原,药物释放停止。Huang等[52]在双同轴毛细管微流控装置中合成了具有核壳结构的球形和子弹状藻酸盐微胶囊,胶囊内部包封α-生育酚来研究胶囊的药物释放性能,发现子弹状微胶囊的药物释放速度更快。Jeyhani等[53]将毛细玻璃管嵌入PDMS聚焦型微通道中制作出混合微流控装置,并利用该装置生成了基于聚乙二醇(PEG)和葡聚糖(DEX)的双重和三重全水乳液。

|
图 6 核壳结构微球 Fig.6 Images of core-shell microspheres |
Vericella等[54]利用聚焦型毛细管装置制备了渗透性高、微胶囊化的二氧化碳吸收剂(MECS),胶囊内部包裹着吸收CO2的碳酸钾或碳酸钠水溶液,壳采用可光聚合的有机硅,外部流体是添加稳定剂和表面活性剂的水溶液。吸收过程中,CO2扩散进入胶囊内部,与碳酸盐水溶液反应,内核变为碳酸氢盐。加热反应后的微胶囊可以实现MECS再生,碳酸氢盐释放出的CO2经压缩后储存利用。Ekanem等[55]利用玻璃毛细管构建了并流/逆流聚焦结构微流控装置,制备的水包油包水(W/O/W)微乳液采取溶剂蒸发法生成可生物降解的合成聚合物微胶囊,通过调控内相的流速可以产生单核液滴(见图 6(b))和双核液滴(见图 6(c))。微胶囊可被用作培养酵母的生物反应器,当微胶囊在高渗透压溶液中,胶囊破裂释放出内部封存的酵母细胞。
4.3 各向异性颗粒各向异性颗粒是指形状不对称或物理化学性质随方向变化的颗粒[56],分为非球形颗粒、Janus颗粒(Janus particle)、patchy颗粒(patchy particle)和多组分颗粒(multicompartment particle)[57-59],其中Janus颗粒指微球表面或整体性质不同的轴对称颗粒[60],是研究最广泛的各向异性颗粒。
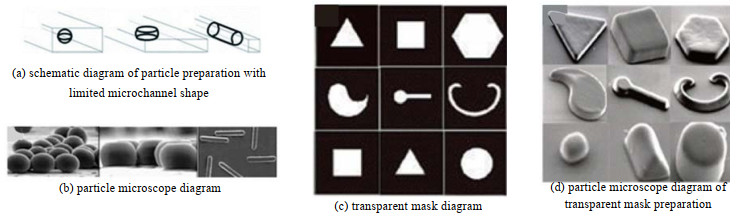
通过微通道制备非球形颗粒有2种方法,1) 将剪切形成的液滴限制在固定形状的微通道中,当液滴体积超过微通道可以容纳液滴的最大体积后,液滴变成圆盘状或杆状,凝固后得到非球形微粒[61-62],如图 7(a)和(b)所示;2)使用特定形状的光掩膜作为微粒形成的模板,液滴流经掩膜时,光化学作用使液滴聚合形成微粒(见图 7(c)和(d)),该方法相对于第一种方法,可以形成液滴形状更加复杂的微粒[63]。Gao等[64]以PEG为蛋白质表面活性剂制备了纵横比在1.0~3.4的非球形液滴,发现液滴形状的稳定时间取决于PEG的表面覆盖率。
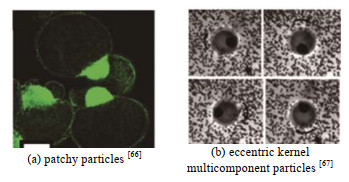
Lone等[66]以PNIPAM、螺吩恶嗪和D-π-A型荧光染料的混合物(PNIPAM-SPO-荧光物质)为分散相,得到表面附着光敏材料的patchy颗粒(见图 8(a))。Chen等[67]以添加磁流体的苯乙烯为内核、丙烯酰胺水凝胶为外壳制备得到具有磁响应特性的偏心内核多组分颗粒,可以作为探针,测量外部旋转流场的温度变化(见图 8(b))。
|
图 8 Patchy颗粒和偏心内核多组分颗粒 Fig.8 Images of patchy particles and eccentric kernel multicomponent particles |
Nie等[68]基于聚焦型微流控芯片制备了Janus颗粒,2种不相溶的单体(M1、M2)在通道中缓慢相遇后作为分散相,在连续相剪切作用下形成包含2种单体的液滴,经过固化形成Janus颗粒,通过调控2种单体的流速比(qVM1/qVM2)得到如图 9(a)所示的球形和眼球形状微球。该方法制备Janus微球条件苛刻,2种流体的σ必须稳定不受时间、位置影响。Chen等[69]改进了上述制备方法,利用2种性质截然相反的不混溶流体制备得到凸轮形状的亲水-亲有机的Janus颗粒(见图 9(b)),颗粒相对尺寸由液体流速控制。利用2种不相溶的流体作为分散相还可以制备颗粒性质对比明显的两半Janus颗粒,例如光学折射率和溶胀性。该制备方法将液滴微流控技术与颗粒形态、结构相结合,制备的凸轮颗粒可应用于吸收、输送和传递各种化学物质以及稳定不混溶流体界面等。Hwang等[70]在聚焦型毛细管装置中制备了温度响应的蜡基Janus微球,增强了W/O和水包油(O/W)乳液的稳定性。可用作分散系统(如Pickering乳液)的新型胶体稳定剂[71]。Lan等[72]利用植物衍生材料制备了高天然性的两亲性Janus颗粒,为医药、化妆品和可持续涂料等工业的绿色发展提供参考。

|
图 9 眼睛形Janus液滴和凸轮形Janus颗粒 Fig.9 Eye-shaped and cam-shaped Janus particles |
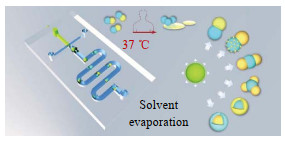
Ghosh等[73]使用PDMS和硅晶片搭建了十字聚焦微流控流动聚焦装置,制备了雪人形Janus水凝胶颗粒。分散相为聚(PNIPAM)溶液,氟化油为连续相,两相流体在交叉处剪切形成聚(PNIPAM)乳液,乳液内部的水在氮气氛围中蒸发得到Janus乳液,经过紫外线照射后得到Janus颗粒。因形状和密度不同,该颗粒同时具有几何各向异性和化学各向异性,具有热响应行为并形成自组装结构。Sun等[74]以紫杉醇溶于聚乳酸-共乙醇酸(PLGA)和甘油三酯脂质的混合溶液为分散相,聚乙烯醇(PVA)溶液为连续相,制备得到Janus微粒。如图 10所示,该微粒具有一个聚合物腔和一个脂质腔,且可以通过调节腔室之间的比例得到Janus-patchy、多室triple、quad或核壳型微粒。因甘油三酯脂质在37 ℃时融化,超过40%的紫杉醇将在3 min内被释放,剩余的药物可持续释放7天,可以实现药物的快速和持续释放相结合。
|
图 10 Janus微粒制备与结构变化示意图[74] Fig.10 Schematic diagram of Janus particle preparation and structure variation [74] |
利用MFFD制备的微球包括多孔结构微球、核壳结构微球以及各向异性颗粒,克服了传统微球制备技术粒径单分散性差等缺陷,在催化、吸附、载药等领域应用广泛。目前微流控技术制备的液滴主要基于水油体系,其中油相大部分为有机溶剂,对生物和环境的危害较大。近年来,利用微流控技术在水性两相系统中制备水包水(W/W)型液滴、微囊受到关注,但两相之间的界面张力较接近,生成液滴难度增加。目前在生物医学、食品、化妆品等领域中,利用高天然性的绿色材料制备微球具有重要意义。因为MFFD的微球制备效率低,难以满足工业发展需要,因此需要研究微通道的集成放大提高微球产量。
5 集成放大研究微流控装置的集成化放大是大量制备单分散液滴的关键,放大装置内部的流量分配至关重要。为了生成分散性良好的液滴,需保证分散相与连续相在各个通道中的流量基本一致。根据通道结构形状不同,可以分为梯形、花瓣形以及环形3种结构,表 2为聚焦型微通道集成化放大方法总结。
|
|
表 2 聚焦型微通道集成化放大方法总结 Table 2 Summary of flow-focused microchannel integrated amplification methods |
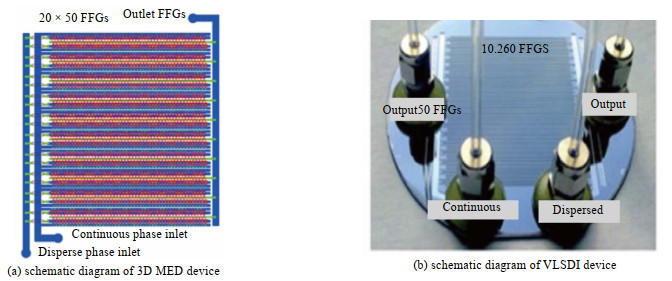
以梯形几何形状作为流体分配通道的液滴制备放大装置称作梯形分布结构,该梯形设计产生的流体流动阻力可忽略不计[83]。梯形分布结构中流体流动通道按照二维矩阵排列,横向主干通道为流体分配通道和液滴收集通道,纵向分支通道为液滴制备单元。为减小梯形结构对液滴粒径偏差的影响,主干通道的流阻Rc要远小于分支通道的流阻Ru,Romanowsky等[84]推导出了梯形结构微通道的集成放大准则为:2N(Rc/Ru)<0.01,N为液滴制备单元个数。基于梯形分布结构,Jeong等[75]开发了双面压印法,制造了一种可以大规模生产W/O乳液液滴的装置3D MED(见图 11(a)),装置内部的流动聚焦通道达到1 000个,生产效率可达到1.5 L⋅h−1,每小时可产生300亿个直径为45 μm的液滴,且液滴直径的粒径偏差仅6.6%。Yadavali等[78]将玻璃封装在硅晶片中,制备了包含10 260个聚焦型液滴发生器的装置VLSDI(见图 11(b)),利用该装置每小时可生成超过万亿个十六烷液滴,液滴直径为23 μm,其颗粒的粒径偏差小于3%。Chung等[85]提出了一种并行化高纵横比矩形结构的高通量液滴发生器,可以快速且均匀地生成直径小于45 μm的液滴,粒径偏差小于3%,有希望应用于单分散功能材料的大规模生产中。
|
图 11 梯形分布结构示意图 Fig.11 Schematic diagram of trapezoidal distribution structure |
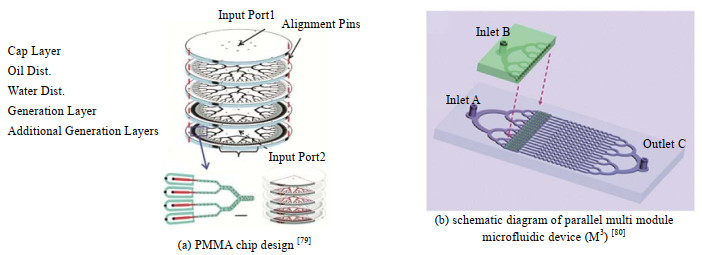
树形结构的微通道呈对称分布,两相流体从入口流入通道,经过m次二分叉后,得到2m个分支通道,随后进入液滴制备单元生成液滴。Conchouso等[79]利用PMMA材料制备了堆叠三维微流控芯片(见图 12(a)),由盖层、油水分配网络和2个液滴制备层构成,油相从顶部进入,水相从底部进入,居中分布,液滴制备单元共享输入和输出。该装置的分散相产率达1 L⋅h−1,制备的乳液的粒径偏差为6%。Li等[80]利用图 12(b)所示的平行多模块微流控装置(M3)制备了生产率达50 g⋅h−1的聚(PNIPAM)微凝胶颗粒,由8个独立的制备模块构成,每个模块中含16个液滴发生器,耦合128个流动聚焦液滴发生器,制备的颗粒平均直径为141 μm,粒径偏差小于5%。Liu等[86]在包含8个液滴制备单元的微流控装置中分别以DEX和PEG溶液为分散相和连续相,生成W/W型液滴,每个液滴制备单元制备的液滴粒径偏差均低于3%。
|
图 12 树形(花瓣形)放大结构示意图 Fig.12 Schematic diagram of tree (petal) enlarged structure |
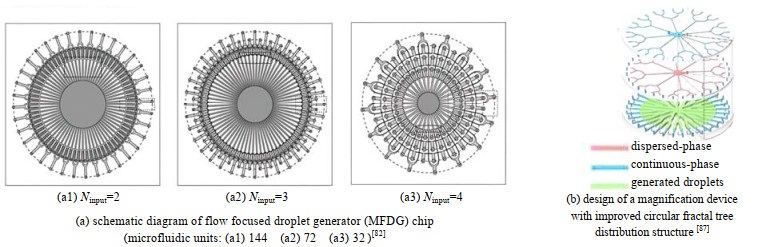
Nisisako等[82]制作的微流控放大装置由144个流动聚焦液滴发生器的芯片和2个支撑模块组成(见图 13(a1)),分散相体积流量为180.0 mL⋅h−1时制备的油包水液滴的平均直径达90.7 μm,粒径偏差为2.2%。并设计了可以制备Janus颗粒和三重液滴的MFDG装置(见图 13(a2)、(a3))。Yi等[87]以PMMA为材料设计了梯形分布与树形分布相结合的改进环状分形树分布结构(见图 13(b)),与梯形分布结构和树形分布结构对比,改进后的结构制备的液滴单分散性更高,流体分配更均匀。制备了平均粒径为598.1 μm,粒径偏差为2.58% 的γ-Al2O3颗粒,微粒产率可达500 g每天。
|
图 13 环形对称分布结构示意图 Fig.13 Schematic diagram of ring-symmetric distribution structure |
微通道的集成放大有梯形、树形和环形对称分布3种结构,制备得到的液滴粒径偏差在3%~6%。梯形结构的微流控芯片集成度高、空间利用率高,但存在压力损失大、通道间结构互相干扰、流体分配不均匀等问题。树形分配结构呈对称分布,但通道的制造加工误差会逐渐累加,显著降低流体分配效果。目前流体分配通道的设计主要基于等效假设和简化推导,不同结构通道的流体分配效果未经实验或数值模拟验证。微通道集成放大装置有堆叠[79]和同层[75]2种实现方式,堆叠型装置的液滴制备单元与流体分配单元相互独立,分散相和连续相分成若干通道后在液滴制备单元中形成液滴,同层型装置一般为梯形分布结构,装置中可设计大量液滴制备单元。但2种装置的制造难度都较大,装置密封要求高,因此开发更高精度的微通道制造技术对微通道的集成放大研究至关重要。
6 结论利用聚焦型微流控装置制备液滴的过程更加稳定,在功能性微球的制备中发展潜力巨大。与传统液滴制备方法相比,该方法制备的液滴单分散性高,粒径易于控制。目前,通过实验和数值模拟方法研究通道中液滴直径和生成频率的影响因素,但单个微通道颗粒产量低,该技术的大规模工业应用必须进行微通道的集成放大研究。综合现有MFFD的研究进展,得出以下结论:
(1) MFFD有二维微通道和毛细玻璃管2种,实验和数值模拟研究集中在液滴成型方面:qVd / qVc、ηd/ηc和通道几何结构对液滴直径和生成频率的影响;但流体之间的界面张力和壁面润湿特性等因素对微通道内流场和液滴流型转化的研究较为缺失。
(2) MFFD广泛应用于制备多孔、核壳和各向异性结构微球,研究微球尺寸、形貌、结构和单分散性的调控因素,但对液滴生成过程中的液相流动规律、界面反应机理研究较少。
(3) 微通道的集成放大研究提高了微球的制备能力,利用梯形、树形和环形对称分布3种结构将微球产量提高至1.5 L以上,但目前放大装置中的流体分配过程主要通过理论和实验来研究,微球制备过程中通道的流体分配均匀性无法通过实验验证。
MFFD的制造误差对液滴粒径均匀性影响巨大,通过微通道制备的液滴需要二次操作才能得到机械化学性质优异的微球,微球尺寸和形貌的调控机制较为单一,发展精度更高的微通道制备技术对功能性微球制备的研究具有重要意义。
| [1] |
HUANG Z Y, WANG L, YANG C H, et al. A versatile optofluidic microreactor for artificial photosynthesis induced coenzyme regeneration and l-glutamate synthesis[J]. Lab on a Chip, 2022, 22(15): 2878-2885. DOI:10.1039/D2LC00398H |
| [2] |
JARADAT E, WEAVER E, MEZIANE A, et al. Microfluidic paclitaxel-loaded lipid nanoparticle formulations for chemotherapy[J]. International Journal of Pharmaceutics, 2022, 628: 122320. DOI:10.1016/j.ijpharm.2022.122320 |
| [3] |
LYU Y K, YUAN X F, GLIDLE A, et al. Automated Raman based cell sorting with 3D microfluidics[J]. Lab on a Chip, 2020, 20(22): 4235-4245. DOI:10.1039/D0LC00679C |
| [4] |
COLLINS D J, NEILD A, DEMELLO A, et al. The Poisson distribution and beyond: Methods for microfluidic droplet production and single cell encapsulation[J]. Lab on a Chip, 2015, 15(17): 3439-3459. DOI:10.1039/C5LC00614G |
| [5] |
ANNA S L, BONTOUX N, STONE H A. Formation of dispersions using "flow focusing" in microchannels[J]. Applied Physics Letters, 2003, 82(3): 364-366. DOI:10.1063/1.1537519 |
| [6] |
DREYFUS R, TABELING P, WILLAIME H. Ordered and disordered patterns in two-phase flows in microchannels[J]. Physical Review Letters, 2003, 90(14): 144505. DOI:10.1103/PhysRevLett.90.144505 |
| [7] |
TAKEUCHI S, GARSTECKI P, WEIBEL D B, et al. An axisymmetric flow-focusing microfluidic device[J]. Advanced Materials, 2005, 17(8): 1067-1072. DOI:10.1002/adma.200401738 |
| [8] |
ONG W L, HUA J S, ZHANG B L, et al. Experimental and computational analysis of droplet formation in a high-performance flow-focusing geometry[J]. Sensors and Actuators A: Physical, 2007, 138(1): 203-212. DOI:10.1016/j.sna.2007.04.053 |
| [9] |
ABATE A R, LEE D, DO T, et al. Glass coating for PDMS microfluidic channels by sol-gel methods[J]. Lab on a Chip, 2008, 8(4): 516-518. DOI:10.1039/b800001h |
| [10] |
CESARIA M, ARIMA V, RELLA S, et al. [18F]F-DOPA synthesis by poly(dimethylsiloxane)-based platforms: Thermal aging protocol to reduce chemicals-induced damage[J]. Sensors and Actuators B: Chemical, 2018, 254: 143-152. DOI:10.1016/j.snb.2017.07.063 |
| [11] |
XUE C D, CHEN X D, LI Y J, et al. Breakup dynamics of semi-dilute polymer solutions in a microfluidic flow-focusing device[J]. Micromachines, 2020, 11(4): 406. DOI:10.3390/mi11040406 |
| [12] |
SUN B J, SHUM H C, HOLTZE C, et al. Microfluidic melt emulsification for encapsulation and release of actives[J]. ACS Applied Materials & Interfaces, 2010, 2(12): 3411-3416. |
| [13] |
CUBAUD T, MASON T G. Capillary threads and viscous droplets in square microchannels[J]. Physics of Fluids, 2008, 20(5): 053302. DOI:10.1063/1.2911716 |
| [14] |
WARD T, FAIVRE M, ABKARIAN M, et al. Microfluidic flow focusing: Drop size and scaling in pressure versus flow-rate-driven pumping[J]. Electrophoresis, 2005, 26(19): 3716-3724. DOI:10.1002/elps.200500173 |
| [15] |
DIETRICH N, PONCIN S, MIDOUX N, et al. Bubble formation dynamics in various flow-focusing microdevices[J]. Langmuir, 2008, 24(24): 13904-13911. DOI:10.1021/la802008k |
| [16] |
丁奕文, 刘向东, 张程宾. 十字型微通道中乳液流变行为的数值模拟[J]. 化工进展, 2017, 36(增刊1): 43-50. DING Y W, LIU X D, ZHANG C B. Numerical simulation of emulsion droplet formation in cross-junction microfluidic channels[J]. Chemical Industry and Engineering Progress, 2017, 36(Suppl.1): 43-50. |
| [17] |
LIU H H, ZHANG Y H. Droplet formation in microfluidic cross-junctions[J]. Physics of Fluids, 2011, 23(8): 082101. DOI:10.1063/1.3615643 |
| [18] |
SHEN Q Y, ZHANG C, TAHIR M F, et al. Numbering-up strategies of micro-chemical process: Uniformity of distribution of multiphase flow in parallel microchannels[J]. Chemical Engineering and Processing-Process Intensification, 2018, 132: 148-159. DOI:10.1016/j.cep.2018.09.002 |
| [19] |
NISISAKO T, TORII T. Microfluidic large-scale integration on a chip for mass production of monodisperse droplets and particles[J]. Lab on a Chip, 2008, 8(2): 287-293. DOI:10.1039/B713141K |
| [20] |
LI W, YOUNG E W K, SEO M, et al. Simultaneous generation of droplets with different dimensions in parallel integrated microfluidic droplet generators[J]. Soft Matter, 2008, 4(2): 258-262. DOI:10.1039/B712917C |
| [21] |
ZHU P A, WANG L Q. Passive and active droplet generation with microfluidics: A review[J]. Lab on a Chip, 2017, 17(1): 34-75. DOI:10.1039/C6LC01018K |
| [22] |
CHEN X M, GLAWDEL T, CUI N W, et al. Model of droplet generation in flow focusing generators operating in the squeezing regime[J]. Microfluidics and Nanofluidics, 2015, 18(5/6): 1341-1353. |
| [23] |
FU T T, WU Y N, MA Y G, et al. Droplet formation and breakup dynamics in microfluidic flow-focusing devices: From dripping to jetting[J]. Chemical Engineering Science, 2012, 84: 207-217. DOI:10.1016/j.ces.2012.08.039 |
| [24] |
COSTA A L R, GOMES A, CUNHA R L. Studies of droplets formation regime and actual flow rate of liquid-liquid flows in flow-focusing microfluidic devices[J]. Experimental Thermal and Fluid Science, 2017, 85: 167-175. DOI:10.1016/j.expthermflusci.2017.03.003 |
| [25] |
YU W, LIU X D, LI B, et al. Experiment and prediction of droplet formation in microfluidic cross-junctions with different bifurcation angles[J]. International Journal of Multiphase Flow, 2022, 149: 103973. DOI:10.1016/j.ijmultiphaseflow.2022.103973 |
| [26] |
HE P Y, BARTHES-BIESEL D, LECLERC E. Flow of two immiscible liquids with low viscosity in Y shaped microfluidic systems: Effect of geometry[J]. Microfluidics and Nanofluidics, 2010, 9(2/3): 293-301. |
| [27] |
GULATI S, VIJAYAKUMAR K, GOOD W W, et al. Microdroplet formation in rounded flow-focusing junctions[J]. Microfluidics and Nanofluidics, 2016, 20(1): 2. DOI:10.1007/s10404-015-1680-3 |
| [28] |
JOANICOT M, AJDARI A. Droplet control for microfluidics[J]. Science, 2005, 309(5736): 887-888. DOI:10.1126/science.1112615 |
| [29] |
YU W, LIU X D, ZHAO Y J, et al. Droplet generation hydrodynamics in the microfluidic cross-junction with different junction angles[J]. Chemical Engineering Science, 2019, 203: 259-284. DOI:10.1016/j.ces.2019.03.082 |
| [30] |
CHEKIFI T, DENNAI B, KHELFAOUI R. Numerical simulation of droplet breakup, splitting and sorting in a microfluidic device[J]. Fluid Dynamics and Materials Processing, 2015, 11(3): 205-220. |
| [31] |
HAN W B, CHEN X Y, WU Z L, et al. Three-dimensional numerical simulation of droplet formation in a microfluidic flow-focusing device[J]. Journal of the Brazilian Society of Mechanical Sciences and Engineering, 2019, 41(6): 265. DOI:10.1007/s40430-019-1767-y |
| [32] |
IBRAHIM A M, PADOVANI J I, HOWE R T, et al. Modeling of droplet generation in a microfluidic flow-focusing junction for droplet size control[J]. Micromachines, 2021, 12(6): 590. DOI:10.3390/mi12060590 |
| [33] |
MOTTAGHI S, NAZARI M, FATTAHI S M, et al. Droplet size prediction in a microfluidic flow focusing device using an adaptive network based fuzzy inference system[J]. Biomedical Microdevices, 2021, 22(3): 61. |
| [34] |
DUPIN M M, HALLIDAY I, CARE C M. Simulation of a microfluidic flow-focusing device[J]. Physical Review E, 2006, 73(5): 055701. DOI:10.1103/PhysRevE.73.055701 |
| [35] |
ASKARI A H, SHAMS M, SULLIVAN P E. Numerical simulation of double emulsion formation in cross-junctional flow-focusing microfluidic device using Lattice Boltzmann method[J]. Journal of Dispersion Science and Technology, 2019, 40(10): 1451-1460. DOI:10.1080/01932691.2018.1518141 |
| [36] |
SONTTI S G, ATTA A. Numerical insights on controlled droplet formation in a microfluidic flow-focusing device[J]. Industrial & Engineering Chemistry Research, 2020, 59(9): 3702-3716. |
| [37] |
CARNEIRO J, CAMPOS J B L M, MIRANDA J M. High viscosity polymeric fluid droplet formation in a flow focusing microfluidic device-Experimental and numerical study[J]. Chemical Engineering Science, 2019, 195: 442-454. DOI:10.1016/j.ces.2018.09.042 |
| [38] |
SOROOR M, TARGHI M Z, TABATABAEI S A. Numerical and experimental investigation of a flow focusing droplet-based microfluidic device[J]. European Journal of Mechanics B-Fluids, 2021, 89: 289-300. DOI:10.1016/j.euromechflu.2021.06.013 |
| [39] |
BORGOGNA A, MURMURA M A, ANNESINI M C, et al. Inertia-driven enhancement of mixing efficiency in microfluidic cross-junctions: A combined Eulerian/Lagrangian approach[J]. Microfluidics and Nanofluidics, 2018, 22(2): 20. DOI:10.1007/s10404-018-2041-9 |
| [40] |
TRIVEDI V, DOSHI A, KURUP G K, et al. A modular approach for the generation, storage, mixing, and detection of droplet libraries for high throughput screening[J]. Lab on a Chip, 2010, 10(18): 2433-2442. |
| [41] |
LAN W J, LI S W, WANG Y J, et al. CFD simulation of droplet formation in microchannels by a modified level set method[J]. Industrial & Engineering Chemistry Research, 2014, 53(12): 4913-4921. |
| [42] |
LI Y H, JAIN M, MA Y T, et al. Control of the breakup process of viscous droplets by an external electric field inside a microfluidic device[J]. Soft Matter, 2015, 11(19): 3884-3899. DOI:10.1039/C5SM00252D |
| [43] |
ZHANG H, JU X J, XIE R, et al. A microfluidic approach to fabricate monodisperse hollow or porous poly(HEMA-MMA) microspheres using single emulsions as templates[J]. Journal of Colloid and Interface Science, 2009, 336(1): 235-243. DOI:10.1016/j.jcis.2009.03.070 |
| [44] |
TESHIMA M, SEKI T, KAWANO R, et al. Preparation of structurally colored, monodisperse spherical assemblies composed of black and white colloidal particles using a micro-flow-focusing device[J]. Journal of Materials Chemistry C, 2015, 3(4): 769-777. DOI:10.1039/C4TC01929F |
| [45] |
LIU D F, ZHANG H B, HERRANZ-BLANCO B, et al. Microfluidic assembly of monodisperse multistage pH-responsive polymer/porous silicon composites for precisely controlled multi-drug delivery[J]. Small, 2014, 10(10): 2029-2038. DOI:10.1002/smll.201303740 |
| [46] |
WANG B J, ZHU Y, BAI Z S, et al. Functionalized chitosan biosorbents with ultra-high performance, mechanical strength and tunable selectivity for heavy metals in wastewater treatment[J]. Chemical Engineering Journal, 2017, 325: 350-359. DOI:10.1016/j.cej.2017.05.065 |
| [47] |
RUSZCZAK A, JANKOWSKI P, VASANTHAM S K, et al. Physicochemical properties predict retention of antibiotics in water-in-oil droplets[J]. Analytical Chemistry, 2023, 95(2): 1574-1581. |
| [48] |
TROSSBACH M, DE LUCAS SANZ M, SEASHORE-LUDLOW B, et al. A portable, negative-pressure actuated, dynamically tunable microfluidic droplet generator[J]. Micromachines, 2022, 13(11): 1823. DOI:10.3390/mi13111823 |
| [49] |
张民, 张正炜, 张艳红. 液滴微流控技术制备功能型微球的研究进展[J]. 高校化学工程学报, 2020, 34(5): 1102-1112. ZHANG M, ZHANG Z W, ZHANG Y H. Research progress on functional microsphere preparation by droplet microfluidic technology[J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(5): 1102-1112. DOI:10.3969/j.issn.1003-9015.2020.05.002 |
| [50] |
GONG X Q, PENG S L, WEN W J, et al. Design and fabrication of magnetically functionalized core/shell microspheres for smart drug delivery[J]. Advanced Functional Materials, 2009, 19(2): 292-297. DOI:10.1002/adfm.200801315 |
| [51] |
LI X, IWAI K, PIRMORADI F N, et al. Controlled drug delivery via remotely heated core-shell magnetic microcapsules: 18th International Conference on Solid-State Sensors, Actuators and Microsystems (TRANSDUCERS) [C]. Anchorage: IEEE, 2015.
|
| [52] |
HUANG L Y, WU K, HE X H, et al. One-Step microfluidic synthesis of spherical and bullet-like alginate microcapsules with a core-shell structure[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2021, 608: 125612. DOI:10.1016/j.colsurfa.2020.125612 |
| [53] |
JEYHANI M, THEVAKUMARAN R, ABBASI N, et al. Microfluidic generation of all-aqueous double and triple emulsions[J]. Small, 2020, 16(7): 1906565. DOI:10.1002/smll.201906565 |
| [54] |
VERICELLA J J, BAKER S E, STOLAROFF J K, et al. Encapsulated liquid sorbents for carbon dioxide capture[J]. Nature Communications, 2015, 6(1): 6124. DOI:10.1038/ncomms7124 |
| [55] |
EKANEM E E, ZHANG Z L, VLADISAVLJEVIC G T. Facile microfluidic production of composite polymer core-shell microcapsules and crescent-shaped microparticles[J]. Journal of Colloid and Interface Science, 2017, 498: 387-394. DOI:10.1016/j.jcis.2017.03.067 |
| [56] |
LEE K J, YOON J, LAHANN J. Recent advances with anisotropic particles[J]. Current Opinion in Colloid & Interface Science, 2011, 16(3): 195-202. |
| [57] |
DU J Z, O'REILLY R K. Anisotropic particles with patchy, multicompartment and Janus architectures: preparation and application[J]. Chemical Society Reviews, 2011, 40(5): 2402-2416. DOI:10.1039/c0cs00216j |
| [58] |
PENG Z L, HUANG J X, GUO Z G. Anisotropic Janus materials: From micro-/nanostructures to applications[J]. Nanoscale, 2021, 13(45): 18839-18864. DOI:10.1039/D1NR05499F |
| [59] |
LIU Z, MCCLEMENTS D J, SHI A M, et al. Janus particles: A review of their applications in food and medicine[J]. Critical Reviews in Food Science and Nutrition, 2023, 63(29): 10093-10104. DOI:10.1080/10408398.2022.2067831 |
| [60] |
WURM F, KILBINGER A F M. Polymeric Janus particles[J]. Angewandte Chemie International Edition, 2009, 48(45): 8412-8421. DOI:10.1002/anie.200901735 |
| [61] |
XU S Q, NIE Z H, SEO M, et al. Generation of monodisperse particles by using microfluidics: Control over size, shape, and composition[J]. Angewandte Chemie International Edition, 2005, 44(5): 724-728. DOI:10.1002/anie.200462226 |
| [62] |
DENDUKURI D, TSOI K, HATTON T A, et al. Controlled synthesis of nonspherical microparticles using microfluidics[J]. Langmuir, 2005, 21(6): 2113-2116. DOI:10.1021/la047368k |
| [63] |
DENDUKURI D, PREGIBON D C, COLLINS J, et al. Continuous-flow lithography for high-throughput microparticle synthesis[J]. Nature Materials, 2006, 5(5): 365-369. DOI:10.1038/nmat1617 |
| [64] |
GAO Y, ZHAO C X, SAINSBURY F. Droplet shape control using microfluidics and designer biosurfactants[J]. Journal of Colloid and Interface Science, 2021, 584: 528-538. DOI:10.1016/j.jcis.2020.09.126 |
| [65] |
WANG J M, LI Y, WANG X Y, et al. Droplet microfluidics for the production of microparticles and nanoparticles[J]. Micromachines, 2017, 8(1): 22. DOI:10.3390/mi8010022 |
| [66] |
LONE S, KIM S H, NAM S W, et al. Microfluidic synthesis of Janus particles by UV-directed phase separation[J]. Chemical Communications, 2011, 47(9): 2634-2636. DOI:10.1039/c0cc04517a |
| [67] |
CHEN C H, ABATE A R, LEE D, et al. Microfluidic assembly of magnetic hydrogel particles with uniformly anisotropic structure[J]. Advanced Materials, 2009, 21(31): 3201-3204. DOI:10.1002/adma.200900499 |
| [68] |
NIE Z H, LI W, SEO M, et al. Janus and ternary particles generated by microfluidic synthesis: Design, synthesis, and self-assembly[J]. Journal of the American Chemical Society, 2006, 128(29): 9408-9412. DOI:10.1021/ja060882n |
| [69] |
CHEN C H, SHAH R K, ABATE A R, et al. Janus particles templated from double emulsion droplets generated using microfluidics[J]. Langmuir, 2009, 25(8): 4320-4323. DOI:10.1021/la900240y |
| [70] |
HWANG Y H, JEON K, RYU S A, et al. Temperature-responsive Janus particles as microsurfactants for on-demand coalescence of emulsions[J]. Small, 2020, 16(49): 2005159. DOI:10.1002/smll.202005159 |
| [71] |
SCHROEN K, BERTON-CARABIN C, RENARD D, et al. Droplet microfluidics for food and nutrition applications[J]. Micromachines, 2021, 12(8): 863. DOI:10.3390/mi12080863 |
| [72] |
LAN Y, WU J Y, HAN S H, et al. Scalable synthesis of Janus particles with high naturality[J]. ACS Sustainable Chemistry & Engineering, 2020, 8(48): 17680-17686. |
| [73] |
GHOSH S, SCHURTENBERGER P. Microfluidic production of snowman-shaped Janus hydrogel particles[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2019, 573: 205-210. |
| [74] |
SUN X T, GUO R, WANG D N, et al. Microfluidic preparation of polymer-lipid Janus microparticles with staged drug release property[J]. Journal of Colloid and Interface Science, 2019, 553: 631-638. DOI:10.1016/j.jcis.2019.06.069 |
| [75] |
JEONG H H, YELLESWARAPU V R, YADAVALI S, et al. Kilo-scale droplet generation in three-dimensional monolithic elastomer device (3D MED)[J]. Lab on a Chip, 2015, 15(23): 4387-4392. DOI:10.1039/C5LC01025J |
| [76] |
JEONG H H, YADAVALI S, ISSADORE D, et al. Liter-scale production of uniform gas bubbles via parallelization of flow-focusing generators[J]. Lab on a Chip, 2017, 17(15): 2667-2673. DOI:10.1039/C7LC00295E |
| [77] |
FEMMER T, JANS A, ESWEIN R, et al. High-throughput generation of emulsions and microgels in parallelized microfluidic drop-makers prepared by rapid prototyping[J]. Acs Applied Materials & Interfaces, 2015, 7(23): 12635-12638. |
| [78] |
YADAVALI S, JEONG H H, LEE D, et al. Silicon and glass very large scale microfluidic droplet integration for terascale generation of polymer microparticles[J]. Nature Communications, 2018, 9(1): 1222. DOI:10.1038/s41467-018-03515-2 |
| [79] |
CONCHOUSO D, CASTRO D, KHAN S A, et al. Three-dimensional parallelization of microfluidic droplet generators for a litre per hour volume production of single emulsions[J]. Lab on a Chip, 2014, 14(16): 3011-3020. DOI:10.1039/C4LC00379A |
| [80] |
LI W, GREENER J, VOICU D, et al. Multiple modular microfluidic (M-3) reactors for the synthesis of polymer particles[J]. Lab on a Chip, 2009, 9(18): 2715-2721. DOI:10.1039/b906626h |
| [81] |
BARDIN D, KENDALL M R, DAYTON P A, et al. Parallel generation of uniform fine droplets at hundreds of kilohertz in a flow-focusing module[J]. Biomicrofluidics, 2013, 7(3): 034112. DOI:10.1063/1.4811276 |
| [82] |
NISISAKO T, ANDO T, HATSUZAWA T. High-volume production of single and compound emulsions in a microfluidic parallelization arrangement coupled with coaxial annular world-to-chip interfaces[J]. Lab on a Chip, 2012, 12(18): 3426-3435. DOI:10.1039/c2lc40245a |
| [83] |
MULUNEH M, ISSADORE D. Hybrid soft-lithography/laser machined microchips for the parallel generation of droplets[J]. Lab on a Chip, 2013, 13(24): 4750-4754. DOI:10.1039/c3lc50979f |
| [84] |
ROMANOWSKY M B, ABATE A R, ROTEM A, et al. High throughput production of single core double emulsions in a parallelized microfluidic device[J]. Lab on a Chip, 2012, 12(4): 802-807. DOI:10.1039/c2lc21033a |
| [85] |
CHUNG C H Y, CUI B B, SONG R Y, et al. Scalable production of monodisperse functional microspheres by multilayer parallelization of high aspect ratio microfluidic channels[J]. Micromachines, 2019, 10(9): 592. DOI:10.3390/mi10090592 |
| [86] |
LIU H T, WANG H, WEI W B, et al. A microfluidic strategy for controllable generation of water-in-water droplets as biocompatible microcarriers[J]. Small, 2018, 14(36): 1801095. DOI:10.1002/smll.201801095 |
| [87] |
YI H L, LU S L, WU J J, et al. Parallelized microfluidic droplet generators with improved ladder-tree distributors for production of monodisperse γ-Al2O3 microspheres[J]. Particuology, 2022, 62: 47-54. DOI:10.1016/j.partic.2021.08.002 |