全球化石燃料的大量燃烧导致排放到大气中的二氧化碳急剧增加[1-2],加剧温室效应,造成大规模的自然灾害[3]。由于二氧化碳(CO2)占温室气体排放总量的80% 以上,因此CO2减排引起研究者们的高度关注[2-4]。
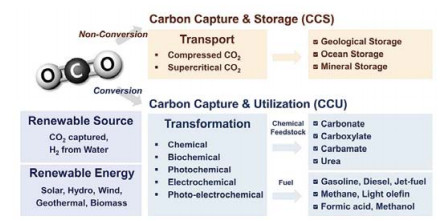
减少CO2排放主要依靠如图 1所示的2种途径:(Ⅰ)碳捕获和封存(carbon capture and storage,CCS)和(Ⅱ)CO2利用(carbon capture and utilization,CCU)。虽然CCS技术在减少二氧化碳排放方面可行,但它需要在靠近CO2排放来源处进行CO2封存,或者将捕获的CO2运输到储存地,这降低了该过程的效率。相比较而言,CCU被认为是替代CCS的一种可行方案,通过电化学、热催化、光化学、生化等方法,可以将二氧化碳转化为具有商业价值的产品,例如一氧化碳、甲烷、甲醇和碳氢化合物[5~7]。
|
图 1 二氧化碳捕获储存(CCS)以及二氧化碳捕获利(CCU)途径[7] Fig.1 Carbon capture and storage (CCS) and carbon capture and utilization (CCU) options[7] |
CO2甲烷化反应(CO2+4H2 → CH4+2H2O,焓变ΔH = −165.0 kJ·mol−1)[5]可以利用大气中大量的CO2,生成清洁能源甲烷来满足人类的能源需求。因此,CO2甲烷化反应被认为是一种利用CO2的有效途径[8]。
根据热力学研究,CO2甲烷化反应是一个放热反应。该反应在25至400 ℃的低温范围内是有利的,但动力学限制了它的工业应用[9]。因此,CO2在低温下加氢生成甲烷必须采用高效催化剂来实现[10-11]。因此,本综述分别从CO2甲烷化反应机理和热力学研究、影响CO2甲烷化催化剂活性、选择性和反应稳定性几方面介绍了适用于CO2甲烷化反应的催化剂的研究进展。
2 CO2甲烷化反应机理和热力学研究CO2甲烷化的反应机理主要有以下2种:1) CO2首先被解离成反应中间体(CO(ads)),之后CO(ads)被直接解离或H辅助CO(ads)解离生成CH4[12];2) RWGS途径。CO2首先与载体表面羟基反应生成碳酸氢盐,然后在金属粒子附近(很可能在金属/载体界面上)形成甲酸盐,进而与吸附的H快速反应生成吸附CO,其中只有一部分CO与吸附H反应,最终生成CH4。另一部分非活性CO物种,主要以双羰基形式存在,吸附在低配位活性金属上[13]。尽管CO2甲烷化反应比较简单,但其反应机理仍未明确,有待进一步研究。其中通过热力学方法是研究CO2甲烷化反应机理的方法之一。
Hussain等[14]研究了不同温度下CO2甲烷化及其副反应的平衡常数ln K、吉布斯自由能变ΔG、熵变ΔS和ΔH等热力学参数(见表 1)。表中t为温度,p为压力。研究结果表明,CO2甲烷化反应(1)、CO2还原反应(2)、Boudouard反应(7)、CO甲烷化反应(9)和CO还原反应(11)的ln K为正值,而ΔG和ΔH为负值,表明这些反应具有很强的自发性并且是放热反应,是CO2甲烷化反应过程中最可能和最主要的反应。而逆水煤气变换反应(4)、甲烷干重整反应(6)和CH4裂解反应(8)的ln K值为负,而ΔG和ΔH为正值,表明这些反应在低温条件下是吸热反应并且是不自发的。随着反应温度升高,一些副反应开始发生。例如CH4裂解(8)。且在450~500 ℃,可以发生CO2加氢反应(5)和CO加氢制乙烷反应(12)。但反应温度超过500 ℃后,上述反应都会减弱。
|
|
表 1 CO2甲烷化反应及其副反应的热力学参数(t = 25 ℃, p = 105 Pa)[14] Table 1 Thermodynamic parameters of CO2 methanation and its side reactions(t = 25 ℃, p = 105 Pa)[14] |
基于上述研究结果,可以发现CO2甲烷化其实是一个复杂的反应过程。因此,为了在CO2甲烷化反应过程中获得较高的CO2转化率与CH4选择性,必须对反应条件进行优化。根据Le Chatelier原理,通过改变不同的反应参数(如温度t、原料气中H2与CO2物质的量比n(H2)/n(CO2)和压力p)来调控CO2甲烷化反应性能。研究表明,在反应温度低于600 ℃的条件下,由于CO2甲烷化是放热反应,CO2转化率随着温度的升高而降低,但随着压力的增加而增加。当CO2甲烷化反应压力为105 Pa且反应温度超过600 ℃时,由于逆水煤气反应在600 ℃以上逐渐占主导地位,CO2转化率会逐渐增加,从而消耗了CO2。反应温度在400 ℃以下时,产物甲烷选择性基本稳定在100%,但是当反应温度高于400 ℃时,可以观察到甲烷选择性随着反应温度的升高而逐渐降低[15]。
Miguel等[16]研究了n(H2)/n(CO2)的影响。在给定的压力条件下,CO2转化率随着温度的升高而降低,但随着n(H2)/n(CO2)的增加而增加。他们进一步发现,除了在低压和n(H2)/n(CO2) = 2时,CH4选择性随着温度和n(H2)/n(CO2)的增加而增加。当n(H2)/n(CO2)=4时,除了在低压和高温条件下通过吸热的逆水煤气变换反应生成少量CO外(CO产率YCO < 1%),CH4选择性几乎可以达到100%。除了CO和CH4以外,固体碳(焦炭)也有可能生成,并且低n(H2)/n(CO2)和较低的反应温度有利于碳的形成。因此,采用n(H2)/n(CO2) = 4对CO2甲烷化反应是最有利的。综上所述,虽然CO2甲烷化是涉及多个影响甲烷总收率竞争副反应的复杂过程,且其机理尚存在争议。但现有的研究结果表明,通过适当改变CO2甲烷化反应参数(例如:t ≤ 400 ℃,n(H2)/n(CO2) = 4),可以优化CO2甲烷化反应性能。
3 影响CO2甲烷化催化剂活性、选择性的因素 3.1 金属活性中心类型的影响 3.1.1 单金属催化剂甲烷化催化剂常用的金属组分主要有Ni,Fe,Co,Ru,Rh[17-23]。Ru基催化剂是甲烷化反应活性较高的催化剂之一。例如:Roldan等[18]制备了掺氮碳纳米纤维负载型Ru催化剂,可在CO2甲烷化反应过程中储存大量的CO(ads),进而具有较高的甲烷产率和稳定性。Sun等[19]制备的Ru/rod-CeO2-MgO催化剂具有较好的Ru纳米颗粒分散度和较强的金属-载体相互作用,且其CO2甲烷化反应过程不需要通过碳酸盐中间体释放气相CO2,因此具有较高的CO2甲烷化反应性能。Rh也是常用于CO2甲烷化反应的贵金属。Cao等[20]制备了具有不同晶相的Rh/TiO2催化剂,他们发现具有P25晶型的1% Rh/p-TiO2催化剂的CH4选择性最高。Franken等[21]以Na-13X分子筛为载体制备的Fe基催化剂(Fe质量分数为1% 的Fe/13X)中Fe物种主要以八面体配位的形式分散并以低聚形式存在,使得该类型催化剂具有较高的水热稳定性,在反应过程中既不会形成更大的Fe聚集体,也不会形成Fe3C晶相,所以具有较高的CH4选择性。Nguyen等[22]选择了Co作为CO2甲烷化反应的活性金属,并采用共沉淀法制备了不同温度焙烧的Co0.1Ce0.9Ox催化剂。研究结果表明,Co0.1Ce0.9Ox催化剂中强化学吸附的CO2量随焙烧温度的升高而减少,因此低温焙烧的Co0.1Ce0.9Ox(300) 催化剂的CO2甲烷化反应活性最高。与上述Ru、Rh、Co和Fe基催化剂相比,Ni基催化剂的CO2甲烷化反应活性低于Ru和Fe基催化剂,但是高于Co和Rh基催化剂(Ru > Fe > Ni > Co > Rh),但是其CH4选择性最高(Ni > Rh > Co > Fe > Ru)[23]。表 2综述了上述5种活性金属在CO2甲烷化反应中的优缺点。综合考虑催化剂价格、反应活性和反应选择性,Ni基催化剂是CO2甲烷化反应最常用的催化剂。
|
|
表 2 不同活性金属在CO2甲烷化反应中的优缺点 Table 2 Advantages and disadvantages of various active metals for CO2 methanation |
在CO2甲烷化反应中双金属催化剂的反应性能通常优于相应的单金属催化剂[24-25]。因此,金属Ni通常与其他活性金属结合以制备双金属催化剂。例如:与Ni基催化剂相比,Ni-Fe催化剂具有更高的CO2甲烷化反应活性。Pandey等[26]的实验结果表明,当催化剂中金属质量分数为75% Ni和25% Fe时,反应活性最佳。与仅以Ni为活性中心的催化剂相比,Ni-Fe催化剂能形成提高反应性能的合金相(如Ni3Fe)。同时,还原后的Ni-Fe催化剂上存在Fe3O4物种,Fe3O4对碳酸盐具有较强的吸附能力,这也为提高反应性能提供了有力支持。Co是另一种常用于制备Ni基CO2甲烷化催化剂的助剂。Guo等[27]制备了几种不同Co、Ni物质的量比的Ni-Co/SiO2催化剂。他们发现,采用更高的钴助剂量可提高催化剂的反应活性,并且当Co、Ni物质的量比为0.4时的催化剂反应性能最佳。Liu等[28]制备了具有有序介孔结构的Ni-Co/Al2O3催化剂。实验结果表明,添加Co物种能显著提高催化剂的化学吸附H2量,所制备的10N3COMA催化剂(NiO的质量分数为10%,Co3O4的质量分数为3%)在400 ℃时CO2转化率达到78%,CH4选择性为99%。同时,多孔有序结构的限域效应使催化剂在500 ℃反应中具有较好的抗烧结性能。Le等[29]采用共浸渍法制备了Ni-X(X = Mn、Ce、Zr、Mg、K、Zn、V)/Al@Al2O3催化剂,考察了不同金属助剂对反应性能的影响规律。研究结果表明,Mn、Ce、Mg、V和Zr助剂通过改善Ni分散性来提高催化剂的甲烷化反应活性,其中Mn促进作用最为显著。但是添加K或Zn助剂可导致催化剂Ni活性位和碱性位数量减少,从而对CO2甲烷化反应性能产生负面影响。上述研究结果表明,添加Fe、Co、Mn等过渡金属助剂能够通过提高金属Ni分散性、增强对碳酸盐的吸附能力或提高化学吸附H2量等途径改善Ni基催化剂CO2甲烷化反应性能。
Ru是适用于CO2甲烷化反应中活性最高的金属。同时,研究发现Ru能显著提高Ni催化剂的还原性,改善金属Ni分散性,从而提高甲烷化反应活性[30]。例如,Bustinza等[31]制备了整体式低Ru含量的双金属Ni-Ru催化剂。他们将Ni和Ru前驱体均匀分散在Al2O3涂层上,对比了2种不同金属浸渍顺序的催化剂,发现先浸渍Ni再浸渍Ru的催化剂活性较高,该催化剂活性中心主要由粒径为2~4 nm Ni颗粒组成。与其他催化剂相比,这种纳米结构使钝化后的催化剂具有最高密度的中等强度碱性位点和最高的Ni氧化度,从而提高了甲烷化反应性能。Swalus等[32]研究发现,Rh质量分数为1% 的催化剂(1% Rh/γ-Al2O3)对CO2的吸附能力强,而Ni质量分数为1% 的催化剂(1 % Ni/AC)能吸附大量H2。将1% Rh/γ-Al2O3和1% Ni/AC催化剂进行机械混合后,活性氢物种能从1% Ni/AC催化剂向1% Rh/γ-Al2O3迁移。这种氢物种不仅可以与CO2反应生成甲烷,还可以使Rh颗粒保持还原状态。因此,通过简单机械混合将催化剂组合在一起,即可增加催化剂的CO2转化率和甲烷选择性。基于上述分析,除了提高催化剂的还原性和分散性以外,助剂还能通过促进H2溢流的方式提高CO2甲烷化催化剂的反应性能。
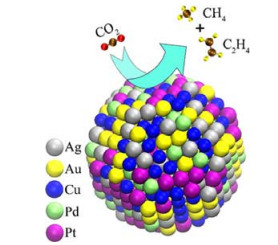
3.1.3 高熵合金催化剂与传统负载型金属催化剂相比,高熵合金催化剂因为多种金属间的相互作用及其他特殊性能近年来被应用于CO2甲烷化反应中[33-37]。与传统合金不同,高熵合金由多个主要金属元素组成[34]。Yeh等[33]假设,以接近等原子比存在的多个金属元素将增加混合的构型熵,其量足以克服化合物形成的焓,从而阻止潜在金属间化合物的形成。由此他们得到了高熵合金(high entropy alloys,HEAs)这一类有5种或5种以上金属元素组成,且金属含量相对较高。在高熵合金催化应用领域,Mori等[34]发现,在TiO2载体表面,贵金属(Ru或Rh)表面所生成的具有高还原潜力的氢物种可溢流到非贵金属(Ni或Cu)处并将其还原,借助TiO2载体上这种氢溢流效应和耦合的质子/电子转移驱动作用,在400 ℃低温条件下就能够合成圆锥形CoNiCuRuPd HEAs纳米粒子,并在CO2加氢反应中表现出较高的活性和优异的稳定性。然而,目前在传统催化剂载体上如何制备纳米尺寸的HEAs仍然具有挑战性。除传统热催化之外,高熵合金催化剂在电催化CO2转化反应上也有应用[35]。Nellaiappan等[35]制备了AuAgPtPd-Cu高熵合金(见图 2),并发现该材料在高效电化学还原CO2中具有前所未有的催化活性。虽然催化剂中存在多种元素,但其电催化活性主要还是因为Cu2+/Cu0的存在,其他金属只起到协同作用。在低电压(−0.3 V RHE(可逆氢电极))反应条件下,CO2到气体烃产品可达到100% 转化率,从而突出了HEAs材料的独特性。
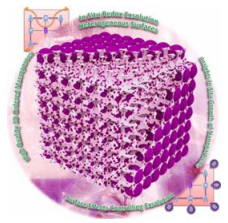
3.1.4 溶出型金属催化剂除高熵合金外,溶出型金属材料(纳米尺寸的金属粒子在还原条件下或施加适当的电位后,可以从晶格中溶出到表面)由于具有良好的电子导电性、结构稳定性等特点而被应用于二氧化碳催化转化过程中[36-37]。Arandiyan等[36]使用外溶法在三维有序大孔(3DOM)铝酸镧钙钛矿催化剂(Rh-Ni/LAO)上设计并制备了高效的Rh-Ni合金(图 3)。他们发现,Ni-Rh纳米粒子高度分散在多孔钙钛矿的外表面和内表面。由于三维多孔材料的限域效应、金属-载体相互作用和Ni-Rh合金效应的综合优势提高了该催化剂的CO2甲烷化反应活性和稳定性。同时,Ni-Rh/LAO催化剂表面富含的吸附氧物种和碱性中心对CO2的强吸附起到了重要作用,从而提高了催化剂的CO2甲烷化反应活性。Thalinger等[37]采用Ni-La0.6Sr0.4FeO3-δ(lanthanum strontium ferrite, LSF)和Ni-SrTi0.7Fe0.3O3-δ(strontium titanium ferrite, STF)2个复合Ni-钙钛矿材料为催化剂,对CO2/CO甲烷化反应中的金属-载体相互作用及其影响进行了研究。研究结果表明,在LSF载体上,LSF载体更容易被还原,因此Ni-LSF催化剂的Ni-Fe合金化程度更高。而与Ni/Al2O3催化剂相比,其催化活性较差。相比之下,STF载体还原性较差,Ni-Fe合金化程度较低,而与Ni/Al2O3催化剂相比,其催化性能相似。
|
图 3 催化剂从ABO3钙钛矿结构中原位出溶的示意图[36] Fig.3 Schematic diagram of in situ exsolution of the catalyst from an ABO3 perovskite structure[36] |
综上所述,相较于传统单金属与双金属催化剂,高熵合金和溶出型金属催化剂利用多种金属间、金属-载体间相互作用、三维多孔材料的限域效应以及对CO2更强的吸附能力等性质在热催化以及电催化CO2甲烷化领域均具有优异的反应性能,是未来CO2甲烷化催化剂的研究方向之一。
3.2 金属粒子尺寸和载体效应多相催化反应中活性金属粒子的尺寸对金属粒子的电子和几何结构起着关键作用[38]。Wang等[39]采用固定Ni负载量的方法,考察了粒径为3.5~7.5 nm内金属Ni粒子尺寸对CO2甲烷化反应的影响。研究结果表明,减小金属Ni粒子尺寸增加了缺陷位,有利于CO2吸附和活化,从而提高了CO2向CH4的转化率,同时能抑制CO副产物的生成。因此,较小的金属Ni粒子表现出更高的CO2甲烷化反应活性,而较大的金属Ni粒子更容易形成CO副产物。Liu等[40]研究表明更小的Ni颗粒可以提供更多的活性中心和更大的H2吸附容量。上述研究结果说明减小金属Ni粒子尺寸有利于提高催化剂的CO2转化率和CH4选择性,因此开发具有较小Ni0粒子的催化剂是提高CO2甲烷化反应性能的重要研究方向。
在另一方面,对于CO2甲烷化反应最常用的负载型Ni基催化剂,载体对催化剂结构、CO2吸附和活化、甲烷化反应机理及其失活过程都具有影响[41]。Riani等[42]认为根据酸碱性质和助剂分布情况优化催化剂载体是开发高选择性CO2甲烷化催化剂的基础。因此,他们在载体中添加La2O3来制备Ni基催化剂。对于Ni/SiO2-Al2O3催化剂,由于在Al2O3载体中添加Si元素可导致其CO2甲烷化活性低于Ni/γ-Al2O3催化剂。而在SiO2-Al2O3载体的基础上进一步添加La2O3助剂可调整其表面酸碱性,且添加SiO2可抑制钙钛矿相的形成以稳定载体形貌,从而允许负载较高含量的La2O3以更好地调控催化剂酸-碱性质,其中含37% La2O3的催化剂具有较高的甲烷化反应活性。Pandey等[43]比较了不同金属氧化物载体(Nb2O5、Al2O3、SiO2、ZrO2、TiO2)对Ni-Fe催化剂活性的影响。实验结果表明,以Al2O3为载体制备的催化剂因其对CO2的吸附能力最强,所以活性最高。Espino等[44]对所制备的Ni/ZrO2,Ni/Mg(Al)O和Ni/SiO2进行了CO2甲烷化反应性能评价,发现Ni/ZrO2催化剂由于在低温下具有更多的氧空位,因此对CO2甲烷化反应具有最高的活性和选择性。
4 影响催化剂稳定性的因素虽然Ni基催化剂在CO甲烷化反应中通常由于积炭较为严重而导致失活,但在CO2甲烷化反应中导致失活的主要原因并不是催化剂积炭[41],而是催化剂中毒和金属粒子烧结[45-47]。
4.1 催化剂中毒反应原料气中的硫杂质是导致Ni基甲烷化催化剂快速且不可逆失活的一个主要原因。Agrawal等[46]通过俄歇电子能谱(AES)表明,硫中毒后的Ni/Al2O3催化剂的电子性质与无硫中毒的Ni/Al2O3催化剂相比没有变化。Wolf等[47]对新鲜和硫中毒的Ni/Al2O3催化剂进行了分析,他们发现硫中毒主要是几何效应(阻断反应活性位),而不是电子效应,从而验证了Agrawal等人的观点。Czekaj等[48]通过密度泛函理论计算表明,不同的含硫物种(例如:COS,H2S,OHOCS或SHOCO)能稳定吸附在Ni和氧化铝载体上。而Alarcón等[49]发现含CeO2的Ni/Al2O3催化剂具有较好的抗H2S中毒能力,这主要是通过形成Ce2O2S晶相以限制硫化镍的形成。
4.2 金属粒子烧结Renda等[50]在制备CO2甲烷化Ni基催化剂时,选用缓慢热解、CO2活化后得到的活化生物炭作为载体。他们的实验结果表明,生物炭本身并没有参与甲烷化反应,但是由于Ni粒子烧结导致了催化剂失活。在另一方面,CeO2对载体的改性是提高催化剂性能的关键。他们发现催化剂的失活程度顺序依次为BCNi > BCNiCe10 = BCNiCe30 > BCNiCe50,表明加入CeO2能够有效提高催化剂的反应稳定性。这是因为添加CeO2不仅可以促进CO2活化来提高催化剂反应性能,而且可以通过增加Ni-载体间相互作用改善反应稳定性。
Gödde等[51]采用浸渍、焙烧和还原的方法将质量分数为10%~50% 的Ni纳米粒子负载在掺氮碳纳米管上。由于N掺杂碳纳米管的锚定作用,尽管Ni负载量很高,但Ni粒子粒径仍然小于10 nm。同时,该催化剂在Ni质量分数为10%~50% 的负载量具有相似的催化性能,但负载质量分数为30% 的Ni催化剂在100 h反应时间内表现出较高的稳定性。Sun等[52]采用水热法制备了以钇修饰的CeO2为载体的负载型Ni(质量分数为5%)催化剂。钇掺杂促进了CeO2粒径的减小和CeO2纳米棒的形成,增加了CeO2载体的比表面积和氧空位数,增强了金属-载体的相互作用。结果表明,与其他催化剂相比,当钇质量分数为2% 时催化剂中能够活化CO2的氧空位数量最多,并且具有最强的金属-载体间相互作用,从而能够抑制Ni活性中心烧结,使催化剂具有较高的CO2甲烷化反应性能。
利用限域效应是另一种避免金属粒子烧结的方法。例如Vrijburg等[53]将胶体Ni纳米粒子包覆在介孔二氧化硅载体中,发现Ni的烧结受到很大的抑制。经过70 h CO2甲烷化反应后,金属Ni粒子的粒径基本不变。Lin等[54]以MOF为前驱体制备了Ni@C材料。MOF衍生的Ni@C粒子具有独特的空心和多孔结构,可以为CO2吸附/活化和氧化还原过程提供高的比表面积和丰富的活性位点。因此,该Ni@C催化剂在低温、常压的CO2甲烷化反应条件下,具有较高的活性、选择性和良好的反应稳定性。
综合以上研究报道可以发现,通过对载体的修饰(例如:添加CeO2、掺氮等)以形成新的晶相(例如:形成Ce2O2S晶相以限制NiS形成)或增强金属-载体间相互作用是提高CO2甲烷化催化剂抗硫中毒性、抗烧结能力的有效方法。除此以外,还可通过限域结构为金属活性中心提供物理屏障,以抑制金属粒子长大,这也是提高CO2甲烷化催化剂抗烧结性能的重要途径。
5 结论和展望通过CO2甲烷化反应能够大量回收利用二氧化碳,对于实现“碳达峰,碳中和”具有重要的意义。围绕适用于CO2甲烷化反应的催化剂的研究进展,本综述主要介绍了催化剂活性中心、粒子尺寸和载体效应对CO2甲烷化反应性能的影响规律,以及影响Ni基CO2甲烷化催化剂反应稳定性的2个主要因素和相应的改善方法。虽然已经积累了一定的研究成果,但是CO2甲烷化反应过程涉及众多反应,CO2甲烷化的反应机理尚未完全明确,须结合多种原位表征技术、瞬态动力学和理论计算等研究手段,以揭示和明晰CO2甲烷化的反应机理,为高性能催化剂的开发提供理论指导。
此外,大量研究已经表明,高分散的金属粒子往往具有较高的CO2甲烷化反应活性和CH4选择性。因此,如何进一步提高金属粒子分散度、还原度以及在反应过程中的稳定性是提高Ni基催化剂低温反应活性和改善反应稳定性的关键。相较于传统负载型Ni基催化剂,高熵合金和溶出型金属催化剂由于独特的多种金属间、金属-载体间相互作用而在热催化以及电催化CO2甲烷化领域具有优异的反应性能,是未来CO2甲烷化催化剂研究开发中值得关注的方向之一。除了金属活性中心,催化剂载体表面的酸碱性以及氧空位浓度对CO2吸附能力具有重要影响,也是影响Ni基催化剂低温反应活性的关键因素。因此,在高效CO2甲烷化催化剂研究开发工作中,尚需综合考虑金属活性中心和载体的性质,进一步揭示催化剂金属活性中心的表界面性质、电子结构、金属-载体相互作用、载体表面性质(例如:酸碱性、氧空位浓度)对CO2甲烷化反应性能的影响规律以及催化剂构效关系,为开发具有较高低温反应活性、CH4选择性和稳定性的新型催化剂提供理论指导,进而为CO2甲烷化反应的商业化应用奠定基础。
| [1] |
HUSSAIN I, JALIL A A, HASSAN N S, et al. Recent advances in catalytic systems for CO2 conversion to substitute natural gas(SNG): Perspective and challenges[J]. Journal of Energy Chemistry, 2021, 62: 377-407. DOI:10.1016/j.jechem.2021.03.040 |
| [2] |
ALI N, BILAL M, NAZIR M S, et al. Thermochemical and electrochemical aspects of carbon dioxide methanation: A sustainable approach to generate fuel via waste to energy theme[J]. Science of the Total Environment, 2020, 712: 136482. DOI:10.1016/j.scitotenv.2019.136482 |
| [3] |
AHN Y H, LIM D, MIN J, et al. Clathrate nanocage reactor for the decomposition of greenhouse gas[J]. Chemical Engineering Journal, 2019, 359: 1629-1634. DOI:10.1016/j.cej.2018.10.238 |
| [4] |
PARK J H. , YANG J, KIM D, et al. Review of recent technologies for transforming carbon dioxide to carbon materials[J]. Chemical Engineering Journal, 2022, 427: 1629-1634. |
| [5] |
QUINDIMIL A, DE-LA-TORRE U, PEREDA-AYO B, et al. Effect of metal loading on the CO2 methanation: A comparison between alumina supported Ni and Ru catalysts[J]. Catalysis Today, 2020, 356: 419-432. DOI:10.1016/j.cattod.2019.06.027 |
| [6] |
ZHANG Z, PAN S Y, LI H, et al. Recent advances in carbon dioxide utilization[J]. Renewable and Sustainable Energy Reviews, 2020, 125: 109799. DOI:10.1016/j.rser.2020.109799 |
| [7] |
RA E C, KIM K Y, KIM E H, et al. Recycling carbon dioxide through catalytic hydrogenation: Recent key developments and perspectives[J]. ACS Catalysis, 2020, 10(19): 11318-11345. DOI:10.1021/acscatal.0c02930 |
| [8] |
LI L, ZENG W Q, SONG M X, et al. Research progress and reaction mechanism of CO2 methanation over Ni-based catalysts at low temperature: A review[J]. Catalyst, 2022, 12: 224. DOI:10.3390/catal12020224 |
| [9] |
ASHOK J, PATI S, HONGMANOROM P, et al. A review of recent catalyst advances in CO2 methanation processes[J]. Catalysis Today, 2020, 356: 471-489. DOI:10.1016/j.cattod.2020.07.023 |
| [10] |
TADA S, IKEDA S, SHIMODA N, et al. Sponge Ni catalyst with high activity in CO2 methanation[J]. International Journal of Hydrogen Energy, 2017, 42(51): 30126-30134. DOI:10.1016/j.ijhydene.2017.10.138 |
| [11] |
RöNSCH S, SCHNEIDER J, MATTHISCHKE S, et al. Review on methanation¬From fundamentals to current projects[J]. Fuel, 2016, 166: 276-296. DOI:10.1016/j.fuel.2015.10.111 |
| [12] |
KARELOVIC A, RUIZ P. Mechanistic study of low temperature CO2 methanation over Rh/TiO2 catalysts[J]. Journal of Catalysis, 2013, 301: 141-153. DOI:10.1016/j.jcat.2013.02.009 |
| [13] |
WANG X, HONG Y, SHI H, et al. Kinetic modeling and transient DRIFTS¬MS studies of CO2 methanation over Ru/Al2O3 catalysts[J]. Journal of Catalysis, 2016, 343: 185-195. DOI:10.1016/j.jcat.2016.02.001 |
| [14] |
HUSSAIN I, JALIL A A. , IZAN S M, et al. Thermodynamic and experimental explorations of CO2 methanation over highly active metal-free fibrous silica-beta zeolite (FS@SiO2-BEA) of innovative morphology[J]. Chemical Engineering Science, 2021, 229: 116015. DOI:10.1016/j.ces.2020.116015 |
| [15] |
GAO J, WANG Y, PING Y, et al. A thermodynamic analysis of methanation reactions of carbon oxides for the production of synthetic natural gas[J]. RSC Advances, 2012, 2(6): 2358-2368. DOI:10.1039/c2ra00632d |
| [16] |
MIGUEL C V, SORIA M A, MENDES A, et al. Direct CO2 hydrogenation to methane or methanol from post-combustion exhaust streams¬A thermodynamic study[J]. Journal of Natural Gas Science and Engineering, 2015, 22: 1-8. DOI:10.1016/j.jngse.2014.11.010 |
| [17] |
GAO J, LIU Q, GU F, et al. Recent advances in methanation catalysts for the production of synthetic natural gas[J]. RSC Advances, 2015, 5(29): 22759-22776. DOI:10.1039/C4RA16114A |
| [18] |
ROLDAN L, MARCO Y, GARCIA-BORDEJE E, et al. Origin of the excellent performance of Ru on nitrogen-doped carbon nanofibers for CO2 hydrogenation to CH4[J]. ChemSusChem, 2017, 10(6): 1139-1144. DOI:10.1002/cssc.201601217 |
| [19] |
SUN S Z, SUN H M, GUAN S L, et al. Integrated CO2 capture and methanation on Ru/CeO2-MgO combined materials: Morphology effect from CeO2 support[J]. Fuel, 2022, 317: 123420. DOI:10.1016/j.fuel.2022.123420 |
| [20] |
CAO F H, GONG N N, MA Z X, et al. Controlling CO2 hydrogenation selectivity by Rh-based catalysts with different crystalline phases of TiO2[J]. ChemComm, 2022, 58: 4219-4222. |
| [21] |
FRANKEN T, HEEL A. Are Fe based catalysts an upcoming alternative to Ni in CO2 methanation at elevated pressure?[J]. Journal of CO2 Utilization, 2020, 39: 101175. DOI:10.1016/j.jcou.2020.101175 |
| [22] |
NGUYEN T H, KIM H B, PARK E D. CO and CO2 methanation over CeO2-supported Cobalt catalysts[J]. Catalyst, 2022, 12: 212. DOI:10.3390/catal12020212 |
| [23] |
LEE W J, LI C, PRAJITNO H, et al. Recent trend in thermal catalytic low temperature CO2 methanation: A critical review[J]. Catalysis Today, 2021, 368: 2-19. DOI:10.1016/j.cattod.2020.02.017 |
| [24] |
SHAFIEE P, ALAVI S M, REZAEI M, et al. Promoted Ni-Co-Al2O3 nanostructured catalysts for CO2 methanation[J]. International Journal of Hydrogen Energy, 2022, 47(4): 2399-2411. DOI:10.1016/j.ijhydene.2021.10.197 |
| [25] |
PIANO G D, GAMBOA J J, CONDó A M, et al. Bimetallic Ni-Fe catalysts for methanation of CO2: Effect of the support nature and reducibility[J]. Applied Catalysis A, General, 2022, 634: 118540. DOI:10.1016/j.apcata.2022.118540 |
| [26] |
PANDEY D, DEO G. Promotional effects in alumina and silica supported bimetallic Ni-Fe catalysts during CO2 hydrogenation[J]. Journal of Molecular Catalysis A: Chemical, 2014, 382: 23-30. DOI:10.1016/j.molcata.2013.10.022 |
| [27] |
GUO M, LU G. The regulating effects of cobalt addition on the catalytic properties of silica-supported Ni-Co bimetallic catalysts for CO2 methanation[J]. Reaction Kinetics, Mechanisms and Catalysis, 2014, 113(1): 101-113. DOI:10.1007/s11144-014-0732-0 |
| [28] |
LIU Q, BIAN B, FA J, et al. Cobalt doped Ni based ordered mesoporous catalysts for CO2 methanation with enhanced catalytic performance[J]. International Journal of Hydrogen Energy, 2018, 43(10): 4893-4901. DOI:10.1016/j.ijhydene.2018.01.132 |
| [29] |
LE T A, KIM J, KANG J K, et al. CO and CO2 methanation over M (M = Mn, Ce, Zr, Mg, K, Zn, or V)-promoted Ni/Al@Al2O3 catalysts[J]. Catalysis Today, 2020, 348: 80-88. DOI:10.1016/j.cattod.2019.08.058 |
| [30] |
POLANSKI J, LACH D, KAPKOWSKI M, et al. Ru and Ni-Privileged metal combination for environmental nanocatalysis[J]. Catalysts, 2020, 10(9): 992. DOI:10.3390/catal10090992 |
| [31] |
BUSTINZA A, FRíAS M, LIU Y, et al. Mono-and bimetallic metal catalysts based on Ni and Ru supported on alumina-coated monoliths for CO2 methanation[J]. Catalysis Science & Technology, 2020, 10: 4061-4071. |
| [32] |
SWALUS C, JACQUEMIN M, POLEUNIS C, et al. CO2 methanation on Rh/γ-Al2O3 catalyst at low temperature: "In situ" supply of hydrogen by Ni/activated carbon catalyst[J]. Applied Catalysis B: Environmental, 2012, 125: 41-50. DOI:10.1016/j.apcatb.2012.05.019 |
| [33] |
YEH J W, CHEN S K, LIN S J, et al. Nanostructured high-entropy alloys with multiple principal elements: Novel alloy design concepts and outcomes[J]. Advanced Engineering Materials, 2004, 6: 299-303. DOI:10.1002/adem.200300567 |
| [34] |
MORI K, HASHIMOTO N, KAMIUCHI N, et al. Hydrogen spillover-driven synthesis of high-entropy alloy nanoparticles as a robust catalyst for CO2 hydrogenation[J]. Nature Communications, 2021, 12(1): 3884. DOI:10.1038/s41467-021-24228-z |
| [35] |
NELLAIAPPAN S, KATIYAR N K, KUMAR R, et al. High-Entropy alloys as catalysts for the CO2 and CO reduction reactions: Experimental realization[J]. ACS Catalysis, 2020, 10(6): 3658-3663. DOI:10.1021/acscatal.9b04302 |
| [36] |
ARANDIYAN H, WANG Y, SCOTT J, et al. In situ exsolution of bimetallic Rh-Ni nanoalloys: A highly efficient catalyst for CO2 methanation[J]. ACS Applied Material Interfaces, 2018, 10(19): 16352-16357. DOI:10.1021/acsami.8b00889 |
| [37] |
THALINGER R, GOCYLA M, HEGGEN M, et al. Ni-perovskite interaction and its structural and catalytic consequences in methane steam reforming and methanation reactions[J]. Journal of Catalysis, 2016, 337: 26-35. DOI:10.1016/j.jcat.2016.01.020 |
| [38] |
LIU L, CORMA A. Metal catalysts for heterogeneous catalysis: From single atoms to nanoclusters and nanoparticles[J]. Chemical Reviews, 2018, 118(10): 4981-5079. DOI:10.1021/acs.chemrev.7b00776 |
| [39] |
WANG K, MEN Y, LIU S, et al. Decoupling the size and support/metal loadings effect of Ni/SiO2 catalysts for CO2 methanation[J]. Fuel, 2021, 304: 121388. DOI:10.1016/j.fuel.2021.121388 |
| [40] |
LIU J, WU X R, C Y Q, et al. Why Ni/CeO2 is more active than Ni/SiO2 for CO2 methanation? Identifying effect of Ni particle size and oxygen vacancy[J]. International Journal of Hydrogen Energy, 2022, 47: 6089-6096. DOI:10.1016/j.ijhydene.2021.11.214 |
| [41] |
SHEN L, XU J, ZHU M, et al. Essential role of the support for Nickel-based CO2 methanation catalysts[J]. ACS Catalysis, 2020, 10(24): 14581-14591. DOI:10.1021/acscatal.0c03471 |
| [42] |
RIANI P, VALSAMAKIS I, CAVATTONI T, et al. Ni/SiO2-Al2O3 catalysts for CO2 methanation: Effect of La2O3 addition[J]. Applied Catalysis B: Environmental, 2021, 284: 119697. DOI:10.1016/j.apcatb.2020.119697 |
| [43] |
PANDEY D, DEO G. Effect of support on the catalytic activity of supported Ni–Fe catalysts for the CO2 methanation reaction[J]. Journal of Industrial and Engineering Chemistry, 2016, 33: 99-107. DOI:10.1016/j.jiec.2015.09.019 |
| [44] |
ESPINO O E E, ZONETTI P C, CELIN R R, et al. The tendency of supports to generate oxygen vacancies and the catalytic performance of Ni/ZrO2 and Ni/Mg(Al)O in CO2 methanation[J]. Catalysis Science & Technology, 2022, 6(12): 1324-1338. |
| [45] |
LIU Z H, GAO X H, LIU B, et al. Recent advances in thermal catalytic CO2 methanation on hydrotalcite-derived catalysts[J]. Fuel, 2022, 321: 124115. DOI:10.1016/j.fuel.2022.124115 |
| [46] |
AGRAWAL P K. Catalyst deactivation[M]. Netherland: Elsevier Scientific Publishing Company, 1980.
|
| [47] |
WOLF M, SCHüLER C, HINRICHSEN O. Sulfur poisoning of co-precipitated Ni-Al catalysts for the methanation of CO2[J]. Journal of CO2 Utilization, 2019, 32: 80-91. DOI:10.1016/j.jcou.2019.03.003 |
| [48] |
CZEKAJ I, STRUIS R, WAMBACH J, et al. Sulphur poisoning of Ni catalysts used in the SNG production from biomass: Computational studies[J]. Catalysis Today, 2011, 176(1): 429-432. DOI:10.1016/j.cattod.2010.10.078 |
| [49] |
ALARCóN A, GUILERA J, SOTO R, et al. Higher tolerance to sulfur poisoning in CO2 methanation by the presence of CeO2[J]. Applied Catalysis B: Environmental, 2020, 263: 118346. DOI:10.1016/j.apcatb.2019.118346 |
| [50] |
RENDA S, DI STASI C, MANYà J J, et al. Biochar as support in catalytic CO2 methanation: Enhancing effect of CeO2 addition[J]. Journal of CO2 Utilization, 2021, 53: 101740. DOI:10.1016/j.jcou.2021.101740 |
| [51] |
GöDDE J, MERKO M, XIA W, et al. Nickel nanoparticles supported on nitrogen-doped carbon nanotubes are a highly active, selective and stable CO2 methanation catalyst[J]. Journal of Energy Chemistry, 2021, 54: 323-331. DOI:10.1016/j.jechem.2020.06.007 |
| [52] |
SUN C, BEAUNIER P, PAROLA V L, et al. Ni/CeO2 nanoparticles promoted by Yttrium doping as catalysts for CO2 methanation[J]. ACS Applied Nano Materials, 2020, 3: 12355-12368. DOI:10.1021/acsanm.0c02841 |
| [53] |
VRIJBURG W L, VAN HELDEN J W A, VAN HOOF A J F, et al. Tunable colloidal Ni nanoparticles confined and redistributed in mesoporous silica for CO2 methanation[J]. Catalysis Science & Technology, 2019, 9(10): 2578-2591. |
| [54] |
LIN X, WANG S, TU W, et al. MOF-derived hierarchical hollow spheres composed of carbon-confined Ni nanoparticles for efficient CO2 methanation[J]. Catalysis Science & Technology, 2019, 9(3): 731-738. |