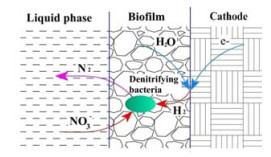
随着社会工业化、城市化进程的推进,人类对化石燃料的使用逐年增加,由此产生的氮氧化物(NOx)成为全球主要的污染物之一,引发酸雨、光化学烟雾、臭氧层破坏等环境问题,同时也是人类慢性支气管炎、哮喘、肺癌等呼吸道疾病的诱因之一[1]。《2015年中国环境公报》数据表明,2015年,我国NOx排放总量为1851.8万吨,比2014年下降10.9%,比2010年下降18.6%。虽然NOx排放总量逐年下降,但仍为环保领域关注的焦点。
目前脱硝技术主要为选择性催化还原法(selective catalytic reduction,SCR)和选择性非催化还原法(selective non-catalytic reduction,SNCR)[2],但存在氨逃逸二次污染、设备条件苛刻等问题[2-4]。生物法源自于微生物净化有机废气和微生物废水反硝化的理论[3],利用脱氮菌还原NOx,具有污染小、工艺简单、运行成本低的特点,因此成为烟气脱硝的研究热点方向之一。Barnes及Apel等[4-5]利用堆肥生物滤塔反硝化作用脱除NO,实验发现模拟烟气中O2含量>5%时,NO去除率只有40%~45%,表明O2的含量对反硝化脱除NO效果影响显著。蒋文举等[6]利用活性污泥中的反硝化细菌进行脱硝处理,当NO浓度低于500 mg·m-3时,可保证其90%的脱除率,但随着处理负荷增加,NO去除率下降迅速。
生物过滤器和生物滴滤塔等虽然对NOx有较高的脱除效率,但去除效率易被氧气含量和气体流量影响,反应器也存在填料堵塞、管理复杂等问题。基于此,Yang等[7]提出生物转鼓反应器(rotating drum biofilter,RDB)的方法,较好地解决了污染物分布不均和填料堵塞的问题。陈建孟等[8]利用生物转鼓技术脱除NO,在高气量(20 g·m-3·h-1)条件下,NO去除率仅为75%。NO难溶于水,气液传质速率慢的问题仍未得到解决。为强化气液传质,Buisman等[9]首先提出络合吸收结合生物法处理NO,以此来强化NO的传质效率和解决传统络合吸收剂的再生问题,并设计了相应的生物过滤净化装置。
络合吸收-生物还原(chemical absorption-biological reduction,CABR)法脱除NOx,是指利用络合吸收剂络合吸收烟气中的NO,随后络合吸收物在脱氮菌的作用下转化为N2排出,同时络合吸收剂在微生物还原作用下再生[10-11]的过程。络合吸收-生物还原法结合了生物法投资运行成本低、无二次污染的特点[12],且改进了生物法中传质效率低、气体停留时间长的缺陷,操作简便,脱硝效率高,成为生物脱硝方面研究的热点。
本文综述络合吸收-生物还原法的研究进展:首先概述络合吸收-生物还原法脱除NOx的工艺过程,然后探讨生物还原过程的反应机理及强化机制,并综合讨论络合吸收-生物还原反应器的结构优化,最后对脱硝技术的发展方向进行展望。
2 络合吸收-生物还原法脱除NOx的工艺过程 2.1 络合吸收-生物还原法脱除NOx的工艺原理络合吸收-生物还原工艺的原理是:在湿法脱硫后约50℃的中温条件下,利用络合吸收剂Fe(Ⅱ)EDTA,络合吸收烟气中的NO,随后在脱氮菌的作用下将其还原为N2,同时铁还原菌还原再生吸收剂,实现络合吸收剂循环利用。该技术基本原理如下:
(1) NO的络合吸收及吸收剂的氧化:
| $ {\rm{Fe(II)EDT}}{{\rm{A}}^{2-}} + {\rm{NO}} \Leftrightarrow {\rm{Fe(II)EDTA-N}}{{\rm{O}}^{2-}} $ | (1) |
| $ {\rm{4Fe(II)EDT}}{{\rm{A}}^{2-}} + {\rm{O}}_2 + {\rm{4H}}^+ \to {\rm{4Fe(III)EDT}}{{\rm{A}}^-} + 2{\rm{H}}_2{\rm{O}} $ | (2) |
(2) NO的还原及吸收剂再生:
| $ 2\text{Fe(II)EDTA-N}{{\text{O}}^{2-}}+{\rm{electron\ donor}}\ \xrightarrow{\text{Microorganism}}\ \text{2Fe(II)EDT}{{\text{A}}^{2-}}+\ {\rm{N}}_2 $ | (3) |
| $ \text{Fe(III)EDT}{{\text{A}}^{-}}+\ {\rm{electron\ donor}}\ +\ \text{O}{{\text{H}}^{-}}\ \xrightarrow{\text{Microorganism}}\ \text{Fe(II)EDT}{{\text{A}}^{2-}}+\ \text{H}_2\text{O} $ | (4) |
近年来,基于不同的吸收体系和生物反应装置,建立了不同的CABR集成系统。荆国华等[13]使用生物填料塔,在进气量1 L·min-1,NO浓度100 mg·m-3,3 %的O2浓度下,NO脱除率在95%以上,但气体处理负荷较小。Li等[14]构建络合吸收-生物还原一体式反应系统,在进气量2 L·min-1,NO浓度670 mg·m-3,O2含量3%时,NO去除率达90%以上,极大地增加了体系的处理负荷,其工艺流程如图 1所示。
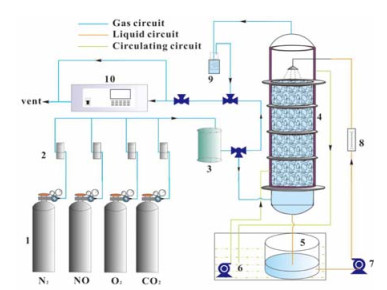
|
图 1 一体式CABR处理烟气中NOx的装置流程[14] Fig.1 Schematic diagram of the integrated one-stage chemical absorption-biological reduction system[14] 1. gas cylinder 2. mass flow controller 3. mixing chamber 4. biopacking tower 5. absorbent storage tank 6. thermostatic water bath 7. absorbent recycle pump 8.rotameter 9. cold trap 10. NOx analyzer |
络合吸收-生物还原一体式反应系统优点在于,占地面积较小,装置简单,易于操作。然而,体系中微生物与烟气中的O2、NO直接接触,两者对微生物的毒害作用[15],限制了脱硝体系的抗氧冲击能力与NO处理负荷。针对此缺陷,李梅芳等[16]将络合吸收与生物还原过程分开,重新构建了两段式络合吸收-生物还原系统,在进气量1 L·min-1,NO浓度400 mg·m-3,O2含量9%的实验件下,仍可保持95%以上的NO脱除率,其基本原理如图 2所示。两段式CABR系统的高处理负荷及其运行的稳定性,更利于实现体系放大与工业应用,将成为脱硝技术研究的重点。
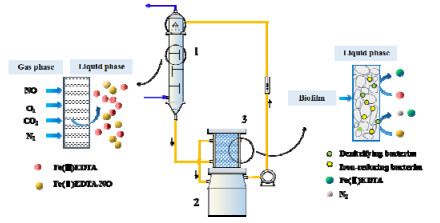
|
图 2 两段式CABR处理烟气中NOx的基本原理 Fig.2 Principle of the integrated two-stage chemical absorption-biological reduction system 1. absorption tower 2. reservoir 3. bio-reduction reactor |
在稳态运行的络合吸收-生物还原脱硝体系中,考察脱除NOx的关键步骤,利于CABR技术处理NOx的工艺研究及后期反应设备的开发。针对这一目的,学者们开展了不同层次的研究。Liu等[17]在生物填料塔中研究络合吸收-生物还原体系脱除NO的传质反应过程,首次通过实验证明了O2浓度增加的过程中,Fe(Ⅱ)EDTA与NO的络合和Fe(Ⅱ)EDTA的氧化过程成竞争性反应,极大地影响生物反应脱除NO的效果。
Zhao等[18]建立CABR体系中NO的传质-反应模型,定量地确定了氧气浓度和NO脱除效率之间的关系。实验结果拟合反应模型表明氧气浓度和NO脱除效率成反比关系:具体而言,氧气浓度由0%升至8%时,NO脱除效率由92.26%降至69.96%,并且随着氧气浓度的增加,NO去除效率下降速度加快。该模型验证了NO与O2同时和Fe(Ⅱ)EDTA反应的竞争机制,在高氧气浓度下为达到较好的NO去除效率,需强化微生物再生络合吸收剂Fe(Ⅱ)EDTA的能力。
于此同时,Xia等[19]结合化学反应动力学,计算NO吸收和微生物还原两个过程中的反应速率常数,确定Fe(Ⅲ)EDTA还原过程为速率限制步骤。
目前这些研究表明,为了适应大气量的工业环境,如何控制氧气含量,高效还原Fe(Ⅲ)EDTA,实现吸收剂再生,才是保证络合吸收生物还原体系脱硝效率的关键。
3 生物还原机理及强化机制络合吸收剂Fe(Ⅱ)EDTA强化了气液传质过程,并且可以在微生物的作用下将络合物中的NO还原为N2。在此过程中,Fe(Ⅱ)EDTA的消耗主要来源于络合产物Fe(Ⅱ)EDTA-NO的生成,以及烟气中的O2的氧化。而上述吸收与氧化产物均可在微生物的作用下再生Fe(Ⅱ)EDTA。探明其中生物还原机理,将有利于优化反应进程与体系结构,推进络合吸收-生物还原法的工业化进程。
3.1 Fe(Ⅱ)EDTA-NO的生物还原机理学者们首先对Fe(Ⅱ)EDTA-NO在生物还原过程中的电子供体来源展开了不同的研究。Kumaraswamy等[20]在研究中发现有机物甲醇、乙醇可以作为电子供体将NO络合物还原为N2,但没有考察包括Fe(Ⅱ)EDTA在内的其他电子供体的作用。于此同时,van der Maas等[21]却发现,Fe(Ⅱ)EDTA-NO的生物还原过程,无论有机电子供体存在与否,Fe(Ⅱ)EDTA均是优先被利用的电子供体。在此基础上,Zhang等[11]以异养反硝化菌进行实验,同时考察了有机物和Fe(Ⅱ)EDTA的作用,发现络合产物的微生物还原过程中,葡萄糖和Fe(Ⅱ)EDTA可同时作为电子供体,且以葡萄糖为主,占比84%,其余16%的络合态NO的还原是以Fe(Ⅱ)EDTA为电子供体;同时葡萄糖作为主要电子供体时Fe(Ⅱ)EDTA-NO还原速率更高。
关于Fe(Ⅱ)EDTA-NO的还原途径,van der Maas等[21]检测气相中NO、N2、N2O的浓度,发现在NO还原为N2的反硝化过程中,以N2O为中间产物。该实验缺点在于络合态NO是由添加NO2-同Fe(Ⅱ)EDTA反应生成,与烟气中NO同Fe(Ⅱ)EDTA络合吸收产物存在一定差异,无法排除引入物质的影响。Zhang等[22]以元素守恒为基础,计算生物还原过程的化学计量数,对正常NO吸收的CABR体系中的Fe(Ⅱ)EDTA-NO还原途径进行深入分析,在仪器检测限范围内液相中均未检出NH4+、NO2-以及NO3-,因此证实了络合态NO的还原以N2O为中间产物,其反应途径如下:
| $ \text{Fe(II)EDTA-NO}\ \xrightarrow{{\rm{electron}}\text{ }}\ {\rm{N}}_2{\rm{O}}\ \ \xrightarrow{{\rm{electron}}\text{ }}\ {\rm{N}}_2 $ |
以上学者通过对NO络合物还原机理的探索,为CABR系统的优化进程提供了方向。
3.2 Fe(Ⅲ)EDTA的生物还原机理以及影响因素Fe(Ⅲ)EDTA的还原是保证生物还原-化学吸收体系稳态运行的又一关键因素。由于烟气中氧气含量占比3%~8%,部分吸收剂(Fe(Ⅱ)EDTA)被氧化为Fe(Ⅲ)EDTA,失去络合吸收能力。
目前关于Fe(Ⅲ)EDTA的还原机理主要存在两种争论,一种观点认为Fe(Ⅲ)EDTA是由铁还原菌直接还原的生化过程;另一种观点认为存在中间电子传输体,能将电子从铁还原菌传输到Fe(Ⅲ)EDTA,如图 3所示。van der Maas等[23-24]发现体系中加入0.25 mmol·L-1硫化物能使Fe(Ⅲ)EDTA还原速率加快3倍,从而推断硫化物可作为电子传输体参与Fe(Ⅲ)EDTA的还原过程;除此之外,研究认为维生素B12、半胱氨酸等也可以作为电子传输体加快Fe(Ⅲ)还原速率。然而Manconi等[25]研究却发现游离态的硫化物存在会导致中间产物N2O的积累,影响NO还原过程,硫化物的使用并没有定论。另一方面,根据Jing等[26]实验中不添加电子传输体,与van der Maas的研究结果相比,Fe(Ⅲ)EDTA仍能保持极高的还原效率。因此,Fe(Ⅲ)EDTA的还原仍然是一个生物还原过程,酶促反应在微生物还原中起主要作用。
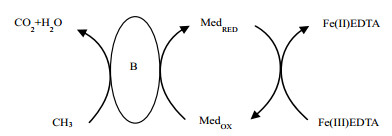
|
图 3 中间电子传输体存在的Fe(Ⅲ)EDTA还原过程 Fig.3 Schematic diagram of indirect reduction of Fe(Ⅲ)EDTA with intermediate electronic transfer B: bacterium/bacterial consortium, Med: electron mediator, RED: reduction state, OX: oxidation state |
考虑到Fe(Ⅲ)EDTA生物还原过程为CABR系统中速率的决定步骤,学者们对其影响因素进行了探索。李伟等[27]探究体系中络合吸收产物Fe(Ⅱ)EDTA-NO、吸收剂Fe(Ⅱ)EDTA以及Fe(Ⅲ)EDTA三者的关系,发现高浓度的Fe(Ⅱ)EDTA-NO (>3.7 mmol·L-1)和Fe(Ⅱ)EDTA (>5.7 mmol·L-1)均会发生细胞生长抑制现象,导致Fe(Ⅲ)EDTA还原速率下降迅速,表明Fe(Ⅲ)EDTA的生物还原反应可能为产物抑制。因此,体系要保证稳定的NOx去除效率,需要适宜的吸收剂浓度,三者之间的动态平衡过程有待学者的后续研究。另一方面,由于烟气中含有NO和O2等组分,使得吸收液中存在NO3-、NO2-等多种阴离子,Zhang等[11]对NO2-、NO3-在Fe(Ⅲ)EDTA生物还原中的作用展开了研究,发现逐渐增加NO3-、NO2-浓度(0~10 mmol·L-1),Fe(Ⅲ)EDTA还原速率与微生物总量均随之下降。说明NO3-、NO2-会作为竞争性电子受体,影响微生物还原Fe(Ⅲ)的速率。其次,吸收液中的NO2-会与Fe(Ⅱ)EDTA反应,生成Fe(Ⅱ)EDTA-NO,结合李伟等[27]前期研究,Fe(Ⅱ)EDTA-NO在一定浓度下对铁还原菌生长具有抑制作用,因此NO3-、NO2-存在会影响Fe(Ⅲ)微生物还原能力。
3.3 生物电化学强化机制电极-生物膜反应器(biofilm electrode reactor,BER)原是指将电化学技术与生物膜技术相耦合,以阴极电子为电子供体,被微生物高效利用进行反硝化脱氮的污水处理技术,其基本原理如图 4所示,因其清洁、无二次污染,且脱硝效率高的特点,逐渐成为一种经济高效的脱氮新技术[28-31]。BER过程对脱硝过程的强化机理是:一方面阴极电解水产生的H2可以作为电子供体被附着在电极上的微生物利用[32],同时,碳阳极电解产生的CO2可作为碳源被异养反硝化菌利用[29-30, 33];另外,也有部分学者认为反硝化脱氮的强化是电化学过程与生物膜共同作用的结果[34],汤兵等[35]比较了普通生物反应器和电极生物反应器除氮效果的差别,认为电解过程与生物过程之间的协同效应强化了还原过程。
受此启发,Mi等[37]发现CABR中的脱氮菌Pseudomonassp.DN-2和铁还原菌Escherichia coli FR-2可以经过微电流驯化,适应BER中的微电流环境,并成功将络合态NO还原N2,为BER与络合吸收-生物还原技术的结合提供了可能。Gao等[38]将BER与络合吸收-生物还原法结合,发现在30 mA电流的作用下,Fe(Ⅱ)EDTA-NO和Fe(Ⅲ)EDTA的还原效率分别可以达到85%和78%,证明了BER对烟气脱硝强化作用的可行性。从此,生物电还原过程作为化学吸收-生物电还原(CABER)系统中处理烟气中NOx的关键环节,应用于强化Fe(Ⅲ)EDTA的还原过程,成为保证体系中Fe(Ⅱ)EDTA含量的重要切入点。
4 络合吸收-生物还原集成系统(CABR)工艺优化 4.1 反应器构型优化建立高效、稳定的络合吸收-生物还原系统对于实际工业生产至关重要,为获得络合吸收最优体系,反应器经历了光生物反应器、生物转鼓反应器以及填料塔等构型的转变,表 1为不同反应器条件下的研究结果。其中生物填料塔(bio-packing tower)由于强化了NO络合吸收的传质过程,在较大的NO浓度(500 ppm)下,仍可保持较高的脱除速率(>90%)。
|
|
表 1 不同反应器的运行参数及脱硝性能对比 Table 1 Operation parameters and performance of different denitrification reactors |
加强对菌种分离、纯化的研究,寻找高效脱氮菌,可以极大地提升脱硝效率。现有研究主要针对不同菌种的生长特性进行优化,在中温条件下分离出高效脱硝菌种。Kumaraswamy等[20]从反硝化反应器中分离出脱氮菌Bacillus aztoformans KT-1与Paracoccus ferrooxidans;荆国华等[43]分离得到假单孢菌Pseudomonas sp.DN-1用于还原吸收液中的Fe(Ⅱ)(EDTA)-NO;李伟等[44]分离纯化得到了Fe(Ⅲ)还原菌Escherichia coli FR-2和脱氮菌Pseudomonas sp.DN-2,实验表明在高浓度NO条件下,体系稳定性较强:逐渐增大NO浓度至670 mg·m-3时,稳态运行下NO脱除率能维持在95%以上;而当NO浓度达到800 mg·m-3时,NO的脱除效率虽有下降但最后仍稳定在90%左右。然而,纯种培养局限性在于对实验条件和操作要求较高,尚不具备工业化的条件。
与此相比,混合培养可以提升微生物群落稳定性,并且混合底物利用率高、培养条件易于控制。张蕾等[45]采用混合培养的方式驯化培养高效还原菌,重新建立一体式CABR集成系统(One-stage CABR system),挂膜过程时间为53 d,比纯种培养挂膜缩短了25 d;当进气量增大到2.5 L·min-1时NO脱除效率可以保持在90%左右;在O2浓度由0%增大到12%的过程中,体系抗氧化冲击能力也有很大提高。混合培养的优势在于生物多样性及种类的提高,因此,对环境变化的抗冲击力也有了很大改善。
然而络合吸收-生物还原一体式反应系统进行烟气脱硝时,微生物会直接与烟气中的氧气、NO接触,产生对微生物的毒害作用。李梅芳[16]建立两段式络合吸收-生物还原系统(Two-stage CABR system),采用混合菌挂膜,相较于铁还原菌和脱氮菌相继挂膜,时间缩短了50 d,实验中挂膜时间和生物量对比如表 2所示。体系中络合吸收与生物还原作为两个独立的过程,避免了微生物与烟气直接接触,提升了体系的抗氧气冲击能力,有利于提高NO处理负荷:烟气量达到5 L·min-1时,NO脱除率仍在90%以上。
以上学者对CABR系统中的菌种选育与培养方式的优化,为提升脱硝效率与实现吸收剂再生提供了保证;但由于技术手段较为单一,目前研究局限于微生物群落结构,在体系挂膜以及还原过程中生物膜尺度上的研究较少。
5 络合吸收-电极生物膜反应器集成系统(CABER)工艺优化鉴于CABR系统在抗氧化性以及Fe(Ⅱ)EDTA-NO还原速率慢的缺陷,学者们通过电化学强化生物还原过程建立络合吸收-电极生物膜反应器集成系统(CABER)以获得更好的脱硝性能。如表 3所示,CABER集成系统在NOx的最大去除负荷、最大耐氧度以及Fe(Ⅲ)EDTA的还原速率方面均有大幅度提升[46]。针对CABER系统中的电化学强化机理和反应器构型优化,学者们展开了如下的研究。
5.1 CABER中的微生物电化学强化机理Xia等[47]在稳态运行的BER中考察Fe(Ⅲ)EDTA还原过程,结果表明阴极电子是优势电子供体,并定义了如图 5所示的阴极电子的四种利用途径:Fe(Ⅲ)EDTA的直接电化学还原;以H2为电子供体的间接生物还原,以及H2的储存和释放过程。其中,直接还原和间接还原是BER强化Fe(Ⅲ)EDTA还原过程的关键途径。其缺陷在于实验未监测生物阴极电势,H2的储存与释放过程缺乏说服力。葡萄糖可作为有机碳源供微生物新陈代谢,阴极电子产生的H2作为电子供体还原Fe(Ⅲ)EDTA,二者表现为协同关系,且0.06 A外加电源和200 mg·L-1的葡萄糖为最佳电子供体组合。
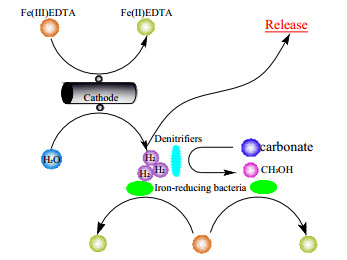
|
图 5 电极生物膜反应器中阴极电子的利用途径[47] Fig.5 Schematic diagram of pathway of cathode electron utilization in BER[47] |
Zhao等[48]在BER稳态运行过程中,分别控制工作电极的电势或电流,考察Fe(Ⅲ)EDTA还原过程中的生物阴极上的电子转移途径。发现不同的电流密度下,阴极电势均未达到析氢电位,生物阴极上的电子传递途径以电子直接传递为主。另一方面,Zhao等[48]在恒电压条件下,对生物阴极电子进行定量考察,对比生物膜电极反应器与非生物电极反应器的法拉第效率,如图 6所示,在无外加碳源情况下,体系运行12 h内,BER中电子利用效率约为非生物电极反应器的2-3倍,从电子传递层面明确了BER强化Fe(Ⅲ)EDTA还原的内因。
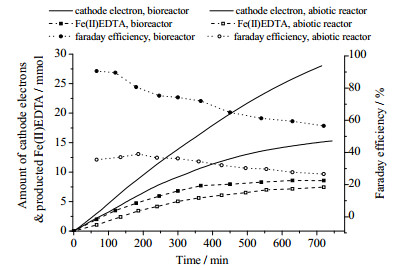
|
图 6 恒电压(-300 mV vs. SHE)条件下电极生物膜反应器与非生物电极反应器中的法拉第效率[48] Fig.6 Faraday efficiency comparison between biocathodes and abiotic electrodes (-300 mV vs. SHE)[48] |
针对Fe(Ⅱ)EDTA-NO的还原过程,Zhao等[48]在无外加碳源、不同恒电压情况下,考察生物阴极对Fe(Ⅱ)EDTA-NO的还原强化作用,发现其还原速率相较于非生物电极提升了2倍,还原机制为铁自养反硝化过程。Xia等[49]在外加电流0.06 A,初始葡萄糖浓度200 mg·L-1的条件下,通过电子供体衡算,定量计算发现,87%的Fe(Ⅱ)EDTA-NO还原主要来自无机电子供体Fe(Ⅱ)EDTA,并将强化过程归因于微电流体系中铁物种丰富度的提升。
这些对于探明Fe(Ⅲ)EDTA还原过程中的电子转移途径与电极生物膜(BER)反应器还原机理的研究,为进一步提升生物还原速率,优化体系的操作参数提供了可能。
5.2 CABER系统反应器构型优化CABER强化脱氮的关键在于提高反应器中的生物量和电流效率,反应器的结构和形式上逐步向高效能的方向发展。Sakakibara等[50]使用网状阴极,并在表面环绕聚亚胺酯泡沫塑料,反硝化微生物更易于附着生长,游离电解质迁移增强,形成了高效的氧化还原区域,脱氮效率更加稳定。Zhou等[51]利用新型三维电极生物膜(3 dimensional biofilm-electrode reactor,3D-BER)反应器去除微污染地下水中的硝酸盐和有机污染物,与二维电极生物膜反应器性能相比效果显著。Zhou等[52]将3D-BER应用于烟气脱硝中,扩大了阴极还原面积,更有利于微生物附着还原,改善了脱硝性能。
近年来,学者们在活性炭介质[51, 53]、无烟煤颗粒[52-54]等作为CABER系统阴极填充粒子方面也做过不同尝试,发现其脱硝效率较高,但也出现了微生物附着生长缓慢,反应器内气路不畅等问题。Prosnansky等[29]以活性炭颗粒填充在反应器阴极网层内,增加了工作电极阴极表面积,在地下水处理试验中获得了更高的电流密度,脱氮速率是普通电极生物膜反应器的3~60倍。高琳[36]分别在填充活性炭颗粒与石墨颗粒的反应器内挂膜,比较生物膜生长情况、微生物还原效率和体系的运行情况,研究表明石墨颗粒为填料时,Fe(Ⅲ)EDTA具有更高、更稳定的还原效率,由图 7挂膜后的阴极填料环境扫描电镜图可知,活性炭颗粒表面有较多污染物吸附沉积,堵塞粒子层,使得活性炭比表面积减小,石墨颗粒表面生物附着量及均匀度明显高于活性炭表面。

|
图 7 5000倍下阴极颗粒表面[36] Fig.7 ESEM micrographs (×5000) of cathodic surface after 3 months of cultivation[36] |
这些研究在加强生物电极还原的性能的同时,使得电极生物膜反应器实现了二维式向三维式结构的跨越,为进一步提高反应效率提供了可能。不足之处是,关于生物阴极材料的研究较少,学者们更多采用传统的碳基底材料,而缺乏新型材料的引入与发展;这也会成为今后研究的重点之一。
6 结语络合吸收-生物还原脱硝系统由于处理负荷高、抗氧化性能优越、运行成本低且无二次污染,是较为理想的烟气脱硝技术,具有广阔的工业应用前景。目前研究者针对现有反应原理,提出了两段式的CABR系统,并找出了反应的关键限速步骤;同时对其生物还原的机理和影响因素作了系统的研究;针对现有的CABR系统以及生物电化学强化方法,学者们在反应器构型优化以及菌种选育等多个方面开展了大量工作,但该系统目前仍有以下方面需要开展研究:
(1) 当前实验应用的液气比与实际工业生产仍有较大差距,开发吸收容量大、传质效率高、价格低廉的新型络合吸收剂成为突破此瓶颈的方向之一;
(2) 驯化培养具有高效脱氮以及铁还原菌种,注重保存优势菌种,可以尝试结合现代生物工程技术培养高效工程菌,并从分子生物学角度,全面分析微生物还原机理,进而提高脱硝效率;
(3) BER的引入强化了生物还原过程,具有巨大潜力。寻找新型电极材料以提升阴极产氢效率,增大阴极区表面积,从而增加微生物附着量等都具有很大的研究价值;
目前关于CABR体系的经济核算较少,可以运用数学模型确定系统中添加剂等成本费用之间的影响,削减运行成本,优化参数,为装置的中试提供基础研究数据,早日实现脱硝体系进入工业生产阶段。
| [1] | Neuffer B, Laney M. Alternative control techniques document update-NOx emissions from new cement kilns[R]. U.S. Environmental Protection Agency, https://www3.epa.gov/ttn/catc/dir1/cement_updt_1107.pdf,2007. |
| [2] | Muzio L J, Quartucy G C, Cichanowicz J E. Overview and status of post-combustion NOx control:SNCR, SCR and hybrid technologies[J]. International Journal of Environment and Pollution, 2002, 17(1/2): 4-30. DOI:10.1504/IJEP.2002.000655. |
| [3] | Mateju V, Cizinska S, Krejci J, et al. Biological water denitrification-a review[J]. Enzyme and Microbial Technology, 1992, 14(3): 170-183. DOI:10.1016/0141-0229(92)90062-S. |
| [4] | Chou M S, Lin J H. Biotrickling filtration of nitric oxide[J]. Journal of the Air and Waste Management Association, 2000, 50(4): 502-508. DOI:10.1080/10473289.2000.10464033. |
| [5] | Apel W A, Turick C E. The use of denitrifying bacteria for the removal of nitrogen-oxides from combustion gases[J]. Fuel, 1993, 72(12): 1715-1718. DOI:10.1016/0016-2361(93)90360-E. |
| [6] | JIANG Wen-ju(蒋文举), BI Lie-feng(毕列锋), LI Xu-dong(李旭东). Study on removal of NOx from waste gas by biological method(生物法废气脱硝研究)[J]. Environmental Science(环境科学), 1999, 30(3): 35-38. |
| [7] | Yang C, Suidan M T, Zhu X, et al. Biomass accumulation patterns for removing volatile organic compounds in rotating drum biofilters[J]. Water Science and Technology, 2003, 48(8): 89-96. DOI:10.2166/wst.2003.0456. |
| [8] | Chen J, Jiang Y, Chen J, et al. Dynamic model for nitric oxide removal by a rotating drum biofilter[J]. Journal of Hazardous Materials, 2009, 168(2/3): 1047-1052. |
| [9] | Buisman C J N, Dijkman H, Verbraak P L, et al. Process for purifying flue gas containing nitrogen oxides: US 5891408[P], 1999-04-06. |
| [10] | Li W, Wu C Z, Shi Y. Metal chelate absorption coupled with microbial reduction for the removal of NOx from flue gas[J]. Journal of Chemical Technology and Biotechnology, 2006, 81(3): 306-311. DOI:10.1002/(ISSN)1097-4660. |
| [11] | Zhang S H, Mi X H, Cai L L, et al. Evaluation of complexed NO reduction mechanism in a chemical absorption-biological reduction integrated NO(x) removal system[J]. Applied Microbiology and Biotechnology, 2008, 79(4): 537-544. DOI:10.1007/s00253-008-1469-3. |
| [12] | Kennes C, Thalasso F. Waste gas biotreatment technology[J]. Journal of Chemical Technology and Biotechnology, 1998, 72(4): 303-319. DOI:10.1002/(ISSN)1097-4660. |
| [13] | Jing G H, Li W, Shi Y, et al. Regeneration of nitric oxide chelate absorption solution by two heterotrophic bacterial strains[J]. Journal of Zhejiang University-Science A, 2004, 5(4): 432-5. DOI:10.1631/jzus.2004.0432. |
| [14] | Li W, Zhang L, Liu N, et al. Evaluation of NO removal from flue gas by a chemical absorption-biological reduction integrated system:complexed NO conversion pathways and nitrogen equilibrium analysis[J]. Energy Fuels, 2014, 28(7): 4725-4730. DOI:10.1021/ef500652g. |
| [15] | Bradshaw D J, Marsh P D, Allison C, et al. Effect of oxygen, inoculum composition and flow rate on development of mixed-culture oral biofilms[J]. Microbiology, 1996, 142: 623-629. DOI:10.1099/13500872-142-3-623. |
| [16] | LI Mei-fang (李梅芳). Development of chemical absorption-biological reduction two-stage system for NOx removal from flue gas: performance research and process optimization (络合吸收-生物还原两段式烟气脱硝系统的性能研究与参数优化)[D]. Hangzhou (杭州): Zhejiang University (浙江大学), 2017. http://cdmd.cnki.com.cn/Article/CDMD-10335-1017035141.htm |
| [17] | Liu N, Lu B H, Zhang S H, et al. Evaluation of nitric oxide removal from simulated flue gas by Fe(Ⅱ)EDTA/Fe(Ⅱ)citrate mixed absorbents[J]. Energy Fuels, 2012, 26(8): 4910-4916. DOI:10.1021/ef300538x. |
| [18] | Zhao J, Xia Y, Li M, et al. A Biophysicochemical model for NO removal by the chemical absorption-biological reduction integrated process[J]. Environmental Science & Technology, 2016, 50(16): 8705-8712. |
| [19] | Xia Y F, Lu B H, Liu N, et al. NOx removal in chemical absorption-biological reduction integrated system:process rate and rate-limiting step[J]. Bioresource Technology, 2013, 149: 184-190. DOI:10.1016/j.biortech.2013.09.056. |
| [20] | Kumaraswamy R, van Dongen U, Kuenen J G, et al. Characterization of microbial communities removing nitrogen oxides from flue gas:the BioDeNOx process[J]. Applied and Environmental Microbiology, 2005, 71(10): 6345-6352. DOI:10.1128/AEM.71.10.6345-6352.2005. |
| [21] | van der Maas P, van de Sandt T, Klapwijk B, et al. Biological reduction of nitric oxide in aqueous Fe(Ⅱ)EDTA solutions[J]. Biotechnology Progress, 2003, 19(4): 1323-1328. |
| [22] | Zhang S H, Li W, Wu C Z, et al. Reduction of Fe(Ⅱ)EDTA-NO by a newly isolated Pseudomonas sp strain DN-2 in NOx scrubber solution[J]. Applied Microbiology and Biotechnology, 2007, 76(5): 1181-1187. DOI:10.1007/s00253-007-1078-6. |
| [23] | van der Maas P, Peng S, Klapwijk B, et al. Enzymatic versus nonenzymatic conversions during the reduction of EDTA-chelated Fe(Ⅲ) in BioDeNOx reactors[J]. Environmental Science and Technology, 2005, 39(8): 2616-2623. DOI:10.1021/es049222d. |
| [24] | van der Maas P, van den Brink P, Klapwijk B, et al. Acceleration of the Fe(Ⅲ)EDTA-reduction rate in BioDeNOx reactors by dosing electron mediating compounds[J]. Chemosphere, 2009, 75(2): 243-249. |
| [25] | Manconi I, van der Maas P, Lens P N L. Effect of sulfur compounds on biological reduction of nitric oxide in aqueous Fe(Ⅱ)EDTA2-solutions[J]. Nitric Oxide-Biology and Chemistry, 2006, 15(1): 40-49. DOI:10.1016/j.niox.2005.11.012. |
| [26] | Jing G, Zhou J, Zhou Z, et al. Reduction of Fe(Ⅲ)EDTA-in a NOx scrubbing solution by magnetic Fe3O4-chitosan microspheres immobilized mixed culture of iron-reducing bacteria[J]. Bioresource Technology, 2012, 108: 169-175. DOI:10.1016/j.biortech.2011.12.112. |
| [27] | Li W, Wu C Z, Zhang S H, et al. Evaluation of microbial reduction of Fe(Ⅲ)EDTA in a chemical absorption-biological reduction integrated NOx removal system[J]. Environmental Science and Technology, 2007, 41(2): 639-644. DOI:10.1021/es061757e. |
| [28] | Sakakibara Y, Kuroda M. Electric prompting and control of denitrification[J]. Biotechnology and Bioengineering, 1993, 42(4): 535-537. DOI:10.1002/(ISSN)1097-0290. |
| [29] | Prosnansky M, Sakakibara Y, Kuroda M. High-rate denitrification and SS rejection by biofilm-electrode reactor (BER) combined with microfiltration[J]. Water Research, 2002, 36(19): 4801-4810. DOI:10.1016/S0043-1354(02)00206-3. |
| [30] | Zhang X, Huang W, Wang X, et al. Feasibility and advantage of biofilm-electrode reactor for phenol degradation[J]. Journal of Environmental Sciences, 2009, 21(9): 1181-1185. DOI:10.1016/S1001-0742(08)62401-8. |
| [31] | Hao R, Li S, Li J, et al. Denitrification of simulated municipal wastewater treatment plant effluent using a three-dimensional biofilm-electrode reactor:operating performance and bacterial community[J]. Bioresource Technology, 2013, 143: 178-186. DOI:10.1016/j.biortech.2013.06.001. |
| [32] | Sakakibara Y, Araki K, Tanaka T, et al. Denitrification and neutralization with an electrochemical and biological reactor[J]. Water Science and Technology, 1994, 30(6): 151-155. DOI:10.2166/wst.1994.0262. |
| [33] | Zhou M, Wang W, Chi M. Enhancement on the simultaneous removal of nitrate and organic pollutants from groundwater by a three-dimensional bio-electrochemical reactor[J]. Bioresource Technology, 2009, 100(20): 4662-4668. DOI:10.1016/j.biortech.2009.05.002. |
| [34] | FENG Yu-jie(冯玉杰), SHEN Hong(沈宏), YANG Jing-ming(杨靖明), et al. Echnological conditions and process analysis on denitrification of biofilm-electrode system(电极生物膜法反硝化工艺条件及过程)[J]. Journal of Harbin Institute of Technology(哈尔滨工业大学学报), 2008(12): 1956-1961. DOI:10.3321/j.issn:0367-6234.2008.12.022. |
| [35] | TANG Bing(汤兵), ZHU You-chun(朱又春), XU Yan-bin(许燕滨), et al. Experimental study on nitrogen removal by electrode-biology process(电极-生物过程除氮的实验研究)[J]. Environmental Engineering(环境工程), 2003, 21(5): 19-20, 23. |
| [36] | GAO Lin (高琳). Reduction of chelate complexes in NOx scrubber solution using three-dimensional bio-electrode reactor (三维电极生物膜法还原NOx络合吸收产物)[D]. Hangzhou (杭州): Zhejiang University (浙江大学), 2011. http://cdmd.cnki.com.cn/Article/CDMD-10335-1011052431.htm |
| [37] | Mi X H, Gao L, Zhang S H, et al. A new approach for Fe(Ⅲ)EDTA reduction in NOx scrubber solution using bio-electro reactor[J]. Bioresource Technology, 2009, 100(12): 2940-2944. DOI:10.1016/j.biortech.2009.01.046. |
| [38] | Gao L, Mi X H, Zhou Y, et al. A pilot study on the regeneration of ferrous chelate complex in NOx scrubber solution by a biofilm electrode reactor[J]. Bioresource Technology, 2011, 102(3): 2605-2609. DOI:10.1016/j.biortech.2010.10.012. |
| [39] | van der Maas P, van den Bosch P, Klapwijk B, et al. NOx removal from flue gas by an integrated physicochernical absorption and biological denitrification process[J]. Biotechnology and Bioengineering, 2005, 90(4): 433-441. DOI:10.1002/(ISSN)1097-0290. |
| [40] | Jin H F, Santiago D E O, Park J, et al. Enhancement of nitric oxide solubility using Fe(Ⅱ)EDTA and its removal by green algae Scenedesmus sp.[J]. Biotechnology and Bioprocess Engineering, 2008, 13(1): 48-52. DOI:10.1007/s12257-007-0164-z. |
| [41] | Lu B H, Jiang Y, Cai L L, et al. Enhanced biological removal of NOx from flue gas in a biofilter by Fe(Ⅱ)Cit/Fe(Ⅱ)EDTA absorption[J]. Bioresource Technology, 2011, 102(17): 7707-7712. DOI:10.1016/j.biortech.2011.05.086. |
| [42] | CHEN Jun(陈浚), YANG Xuan(杨宣), YU Jian-ming(於建明), et al. Investigation of effect and process of nitric oxide removal in rotating drum biofilter coupled with absorption by FeⅡ(EDTA)(FeⅡ(EDTA)络合协同RDB去除NO废气效能及过程分析)[J]. Environmental Science(环境科学), 2012, 33(2): 539-544. |
| [43] | JING Guo-hua(荆国华), LI Wei(李伟), SHI Yao(施耀), et al. Properties of pesudomonas sp. DN-1 in reduction of nitric oxide chelate absorption solution(假单胞菌DN-1再生NO络合吸收液的特性)[J]. Environmental Science(环境科学), 2004, 25(4): 163-166. DOI:10.3321/j.issn:0250-3301.2004.04.034. |
| [44] | JING Guo-hua(荆国华), LI Wei(李伟), SHI Yao(施耀), et al. Microbial reduction of FeⅢ(EDTA) in the system of nitric oxide removal by metal chelate absorption(络合吸收脱除NO体系中Fe(Ⅲ)EDTA的生物还原)[J]. Environmental Science.(环境科学), 2005, 26(6): 21-25. DOI:10.3969/j.issn.1673-1212.2005.06.007. |
| [45] | ZHANG Lei (张蕾). Development of chemical absorption-biological reduction integrated system for NOx removal from flue gas: microbial communities feature and solvent degredation (生物还原耦合化学吸收处理烟气中NOx-微生物群落特征和吸收剂损耗规律)[D]. Hangzhou (杭州): Zhejiang University (浙江大学), 2015. http://cdmd.cnki.com.cn/Article/CDMD-10335-1015320449.htm |
| [46] | Xia Y, Shi Y, Zhou Y, et al. A new approach for NOx removal from flue gas using a biofilm electrode reactor coupled with chemical absorption[J]. Energy Fuels, 2014, 28(5): 3332-3338. DOI:10.1021/ef500604d. |
| [47] | Li W, Xia Y, Zhao J, et al. Generation, utilization, and transformation of cathode electrons for bioreduction of Fe(Ⅲ)EDTA in a biofilm electrode reactor related to NOx removal from flue gas[J]. Environmental Science and Technology, 2015, 49(7): 4530-4535. DOI:10.1021/es5058488. |
| [48] | Zhao J K, Zhang C Y, Sun C, et al. Electron transfer mechanism of biocathode in a bioelectrochemical system coupled with chemical absorption for NO removal[J]. Bioresource Technology, 2018, 254: 16-22. DOI:10.1016/j.biortech.2018.01.066. |
| [49] | Xia Y, Zhao J, Li M, et al. Bioelectrochemical reduction of Fe(Ⅱ)EDTA-NO in a biofilm electrode reactor:performance, mechanism, and kinetics[J]. Environmental Science and Technology, 2016, 50(7): 3846-3851. DOI:10.1021/acs.est.5b05861. |
| [50] | Sakakibara Y, Nakayama T. A novel multi-electrode system for electrolytic and biological water treatments:electric charge transfer and application to denitrification[J]. Water Research, 2001, 35(3): 768-778. DOI:10.1016/S0043-1354(00)00327-4. |
| [51] | Zhou M, Fu W, Gu H, et al. Nitrate removal from groundwater by a novel three-dimensional electrode biofilm reactor[J]. Electrochimica Acta, 2007, 52(19): 6052-6059. DOI:10.1016/j.electacta.2007.03.064. |
| [52] | Zhou Y, Gao L, Xia Y F, et al. Enhanced reduction of Fe(Ⅱ)EDTA-NO/Fe(Ⅲ)EDTA in NOx scrubber solution using a three-dimensional biofilm-electrode reactor[J]. Environmental Science and Technology, 2012, 46(22): 12640-12647. DOI:10.1021/es3025726. |
| [53] | FAN Bin(范彬), QU Jiu-hui(曲久辉), LIU Suo-xiang(刘锁祥), et al. Nitrate removal from drinking water by three-dimension electrode electrochemical-biofilm reactors(复三维电极生物膜反应器脱除饮用水中的硝酸盐)[J]. Acta Scientiae Circumstantiae(环境科学学报), 2001, 21(1): 39-43. DOI:10.3321/j.issn:0253-2468.2001.01.008. |
| [54] | WANG Hai-yan(王海燕), QU Jiu-hui(曲久辉), LEI Peng-ju(雷鹏举). The influence of anthracite granule size on the denitrification of three-demension-electrode biofilm reactor(介质粒径对复三维电极-生物膜脱硝反应器的影响)[J]. Acta Scientiae Circumstantiae(环境科学学报), 2003, 23(1): 64-68. |