2. 国家非粮生物质能源工程技术研究中心, 广西 南宁 530004
2. National non grain Biomass Energy Engineering Technology Research Center Guangxi University, Nanning 530004, China
乙酸乙酯是一种性能很好的工业试剂,应用前景广泛。在制备乙酸乙酯的传统工艺中,传统的均相催化剂浓硫酸价格低廉、工艺成熟,但存在腐蚀性强、设备的维护成本高等问题。离子液体又称为室温离子液体(room temperature ionic liquids),是一种在常温下呈现液态的盐[1],它拥有不易挥发、催化反应活性高、不易失活、可重复利用、化学稳定性和热稳定性好等特殊的理化性质。对离子液体阳离子引入─COOH、─OH、─SO3H、─CN等功能基团[2-4],可制备出具有专一应用性能的功能化离子液体(TSILs)[5],而根据反应需要选择特定的TSILs,才能够取得更为理想的反应效果。在1986年出现了以离子液体为催化剂的报道[6],此后离子液体逐渐应用于各种有机反应当中。反应动力学数据作为基础数据在化工模拟和设计过程中至关重要,同时建立合适的动力学模型,有助于找出反应条件与催化性能之间的相互影响及量化关系[7]。目前酯化反应动力学模型普遍是在溶液理想均相机理(IH模型)的基础上构建的,如蓝丽红等[8]开发出用于合成乙酸丁酯的阳离子交换膜催化剂,并建立了酯化反应动力学的IH模型方程,之后廖安平等[9]探索了用D072型强酸性离子交换树脂催化合成乙酸正丁酯动力学,同样用IH模型在实验范围内回归得到的动力学方程与实际符合程度较好,模型的置信度较高,为催化精馏技术合成乙酸正丁酯过程设计提供了良好基础。
酯化体系非理想性影响较大,为此也有学者引入溶液的非理想均相机理(NIH)模型以校正非理想效应。其中溶液理论中非随机双液体模型方程(NRTL方程[10])可以用二元数据推算多元气液平衡和溶液平衡的性质,可用于部分互溶体系,如田君等[11]用HCJ-10型强酸性离子交换树脂催化合成乙酸乙酯,采用NRTL方程对液相非理想性进行修正;Cui等[12-14]报道了离子液体催化乙酸甲酯与异戊醇酯交换的动力学研究及过程模拟,并为该方法开发了NIH动力学模型;董颜箔等[15]采用1-丁基-3-甲基咪唑硫酸氢盐离子液体作为乙酸乙酯酯化反应催化剂,采用NIH模型构建反应的动力学方程,并应用于反应精馏工艺流程的模拟优化;He等[16]在探索新型离子催化剂在乙酸乙酯合成反应的研究中,将IH和NIH这2种模型结果进行对比,发现NIH模型明显优于IH模型。
吡啶类离子液体具有结构稳定和酸性较强等特点,是一种有应用前景的酸性催化剂。如张文林等[17]合成出磺酸丁基吡啶硫酸氢盐类离子液体;程新炎等[18]合成了多种2-甲基吡啶类离子液体,考察癸酸和三聚甘油的酯化反应的催化性能,获得了较好的效果。目前针对该吡啶类离子液体催化剂用于乙酸乙酯合成的反应动力学研究尚未有报道。
本研究以1-磺酸丁基-2-甲基吡啶硫酸氢盐离子液体作为催化剂,用动力学实验考察了温度、催化剂、乙酸和乙醇的量比等因素对乙酸和乙醇酯化反应转化率的影响。根据二级可逆反应机理建立酯化反应动力学的NIH模型,选用NRTL活度方程修正混合液体的非理想性质。通过最小二乘法拟合回归动力学实验数据获得反应活化能和反应速率常数,并求解反应动力学非线性方程预测催化反应性能。
2 实验(材料与方法) 2.1 实验材料与仪器99.7% 纯度冰醋酸和99.8% 纯度无水乙醇、分析纯酚酞指示剂和氢氧化钠均购自广东光华科技股份有限公司;99% 纯度离子液体1-磺酸丁基-2-甲基吡啶硫酸氢盐购自上海成捷化学有限公司。MP-501A恒温水浴锅购自上海恒一科学仪器有限公司;DHG-9070A电热恒温鼓风干燥箱购自上海齐欣科学仪器有限公司;LQ-A2003电子天平购自瑞安市安特称重设备有限公司;1306型精密水银温度计购自冀州市耀华器械仪表厂;LQ-A2003型电子天平由瑞安市安特称重设备有限公司生产。
2.2 实验步骤 2.2.1 酯化反应动力学实验实验采用500 mL四口烧瓶为反应器,装有冷凝器、温度计、机械搅拌装置和取样器。先将一定量的冰醋酸和催化剂1-磺酸丁基-2-甲基吡啶硫酸氢盐置于四口烧瓶中加热,向冷凝器通冷凝水冷凝,同时无水乙醇置于烧杯中预热。当体系温度达到313.15~333.15 K后,将无水乙醇转移到四口烧瓶中,开启搅拌装置并维持恒温,使催化剂与反应液充分接触,此时作为反应初始时间并开始计时。每隔一段时间进行取样,将样品及时放置到冰浴冷却,防止反应继续发生。分别设置不同反应温度、催化剂浓度和初始乙酸和乙醇的量比的实验条件,考察各因素对反应效果的影响。
2.2.2 样品组成分析方法用注射器取样并测量该样品的质量和体积。采用酸碱滴定法分析样品中乙酸的质量分数,配制0.05 mol⋅L−1的NaOH溶液作为滴定液,用邻苯二甲酸氢钾标定,指示剂为酚酞。由于酸性离子液体也会消耗一定量NaOH,采用空白实验扣除消耗量,即在配制乙酸、乙醇和离子液体初始反应混合物系时,同时配制等量的乙酸和离子液体的空白混合溶液,根据式(1)可以计算出反应转化率。
| $ X=\frac{\frac{V_{1} \times m_{\mathrm{tot} 1}}{m_{1}}-\frac{V_{2} \times m_{\mathrm{tot} 2}}{m_{2}}}{\frac{n_{\mathrm{HAc}}}{n_{\mathrm{HAc}}+n_{\mathrm{cat}}} \times \frac{V_{1} \times m_{\mathrm{tot} 1}}{m_{1}}} $ | (1) |
式中:X为该反应体系的转化率,m1(g)和V1(mL)分别为空白溶液取样称取的质量和滴定该样品消耗的NaOH体积,m2 (g)和V2(mL)分别为混合物反应t(min)时刻后取样称取的质量和滴定消耗的体积,mtot1和mtot2分别为反应体系前后的总质量(g),nHAc和ncat分别为乙酸和催化剂的初始物质的量(mol)。
3 反应动力学模型 3.1 模型建立Brønsted理论的反应机理[19-20]认为反应分3个步骤,第1步离子液体催化剂提供的质子与乙酸的羰基进行结合;第2步是亲核取代反应形成中间体;第3步是中间体脱水生成乙酸乙酯。其中第1步和第3步是快速反应,第2步反应速度较慢,通常认为第2步是该反应的速率控制步骤,所以该反应机理可以简化为2级可逆反应,因为1 mol离子液体催化剂可以提供1 mol的质子,质子的浓度
| $ r = {k_ + }{c_{{{\text{H}}^ + }}}{c_{{\text{HAc}}}}{c_{{\text{EtOH}}}} - {k_ - }{c_{{{\text{H}}^ - }}}{c_{{\text{EtAc}}}}{c_{{{\text{H}}_2}{\text{O}}}} = {c_{{{\text{H}}^ + }}}{\left( {\frac{n}{V}} \right)^2}\left( {{k_ + }{x_{{\text{HAc}}}}{x_{{\text{EtOH}}}} - {k_ - }{x_{{\text{EtAc}}}}{x_{{{\text{H}}_2}{\text{O}}}}} \right) $ | (2) |
式中:r为反应速率,mol⋅L−1⋅min−1;c为i组分(H+、HAc、EtOH、H−、EtAc、H2O)的浓度,mol⋅L−1;n为反应溶液的总物质的量,mol;V为反应溶液的总体积,L;x为i组分(HAc、EtOH、EtAc、H2O)的摩尔分数;
| $ r=c_{\mathrm{cat}}\left(\frac{n}{V}\right)^{2}\left(k_{+} a_{\mathrm{HAc}} a_{\mathrm{EtOH}}-k_{-} a_{\mathrm{EtAc}} a_{\mathrm{H}_{2} \mathrm{O}}\right) $ | (3) |
其中正反应速率常数k+和逆反应速率常数k_可以用Arrhenius方程来表示,见式(4)、(5):
| $ {k_ + } = k_ + ^0{\exp _{}}\frac{{ - {E_{{\rm{A}} + }}}}{{RT}} $ | (4) |
| $ {k_ - } = k_ - ^0{\exp _{}}\frac{{ - {E_{{\rm{A}} - }}}}{{RT}} $ | (5) |
式中:k+0和k-0分别为正逆反应的指前因子,L2·mol−2·min−1;
| $ {\text{l}}{{\text{n}}_{}}{\gamma _i} = \frac{{\mathop \sum \nolimits_j {\tau _{ji}}{G_{ji}}{x_j}}}{{\mathop \sum \nolimits_k {G_{ki}}{x_k}}} + \mathop \sum \limits_j \frac{{{x_j}{G_{ij}}}}{{\mathop \sum \nolimits_k {x_k}{G_{kj}}}}\left( {{\tau _{ij}} - \frac{{\mathop \sum \nolimits_k {x_k}{\tau _{kj}}{G_{kj}}}}{{\mathop \sum \nolimits_k {x_k}{G_{kj}}}}} \right) $ | (6) |
式中:xj和xk分别为j组分和k组分的摩尔分数;τji=Bji/ T、τij=Bij/ T、τkj=Bkj/ T均为NRTL方程参数;其中Bji、Bij、Bkj为溶液的特征函数;Gji =exp (−Bijτij)、Gki =exp (−Bikτik)、Gij =exp (−Bjiτji) Gkj=exp (−Bjkτjk)、为溶液的相互作用能;γi为组分i在液相的活度系数。方程参数和有序特性参数的数据从Aspen Plus数据库中获得。如表 1所示。
|
|
表 1 反应体系的NRTL模型的二元交互参数和非随机性参数 Table 1 Binary interaction parameters and nonrandom parameters of NRTL model |
在初始条件下,逆反应速率、产物酯和水的活度均为0,由式(3)推导出式(7):
| $ r_{0}=\left(\frac{n}{V}\right)^{2} c_{\mathrm{cat}} k_{0} \exp \left(-\frac{E_{\mathrm{a}}}{R T}\right) a_{\mathrm{HAc}} a_{\mathrm{EtOH}}=\left(\frac{n}{V}\right)^{2} f(x) k_{0} \exp \left(-\frac{E_{\mathrm{a}}}{R T}\right) a_{\mathrm{HAc}} a_{\mathrm{EtOH}} $ | (7) |
式中:
| $ \frac{{{\text{d}}{X_{{\text{HAc}}}}}}{{{\text{d}}t}} = \frac{r}{{(\frac{n}{V}){x^0}_{{\text{HAc}}}}} $ | (8) |
式中:XHAc为乙酸的反应转化率;xHAc0为乙酸的初始摩尔分数。
使用龙格库塔法编辑Matlab程序求解该动力学微分方程,可以算出乙酸转化率计算值。再将计算值与实验值的平均绝对方差(MASE)作为目标函数,采用非线性最小二乘法对全时刻范围动力学实验数据进行拟合,获取正逆反应速率常数和正逆反应活化能。目标函数见式(9):
| $ {\rm{MASE}} = \frac{1}{N}\mathop \sum \limits_{i = 1}^N {\left( {{X_{{\text{HAc}}, {\text{cal}}}} - {X_{{\text{HAc}}, {\text{exp}}}}} \right)^2} $ | (9) |
式中:N为数据点的个数,XHAc, cal和XHAc, exp分别为乙酸转化率的计算值和实验值。
4 结果与讨论 4.1 反应动力学模型参数不同催化剂浓度和不同温度的初始反应速率与浓度的拟合曲线分别见图 1和2。从图 1中可以看出,随着催化剂浓度的上升,初始反应速率加快并且呈线性关系;图 2中随着温度的上升,r0/(cHAc, 0·cEtOH, 0)呈非线性上升,其中cHAc, 0和cEtOH, 0分别为乙酸和乙醇的初始浓度。以上拟合结果作为初值,用Matlab进行编程得出相关动力学参数。如表 2所示为线性拟合得到的指前因子、反应初始活化能、拟合结果以及误差。表中R2表示平均绝对方差系数。
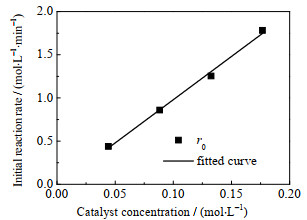
|
图 1 温度为323.15 K和初始乙酸和乙醇的量比为1时催化剂浓度对反应初始速率的拟合曲线 Fig.1 The fitting curve of catalyst concentration as a function of initial reaction rate at 323.15 K and initial ethyl alcohol to acetic acid molar ratio = 1 |
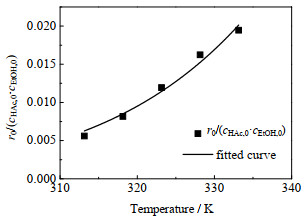
|
图 2 催化剂浓度为0.137 3 mol·L−1和初始乙酸和乙醇的量比为1时温度对r0/(cHAc, 0·cEtOH, 0)的拟合曲线 Fig.2 The fitting curve of temperature as a function of r0 / (cHAc, 0·cEtOH, 0) at catalyst concentration of 0.137 3 mol·L−1 and initial ethyl alcohol to acetic acid molar ratio = 1 |
|
|
表 2 动力学模型的参数和误差 Table 2 Parameters and errors of the dynamic model |
用NIH模型关联实验数据得到动力学方程如式(10):
| $ r = (0.099x + 0.003)(n/V)2[{725_{}}096{\exp _{}}( - {5_{}}952/T){a_{{\rm{HAc}}}}{a_{{\rm{EtOH}}}} - {387_{}}491{\exp _{}}( - {6_{}}467/T){a_{{\rm{EtOH}}}}{a_{\rm{H{_2}O}}}$ | (10) |
据文献报道离子交换树脂Amberlyst 15[21]作为一种酸性催化剂在酯化反应体系中效果较好。在相同条件下用Amberlyst 15(乙酸与催化剂的质量比为100 g: 5 g)和离子液体催化剂的催化效果分析如图 3所示。在相同条件下离子液体(ILS)催化下的乙酸转化率在100 min左右几乎达到平衡,而Amberlyst 15催化下的乙酸转化率在300 min后才达到平衡,说明了该离子液体的酯化反应催化效果更好;该吡啶类离子液体催化剂与He等[16]的咪唑类离子液体催化剂进行了比较,发现同样在NIH模型条件下,吡啶类离子液体催化下的乙酸转化率达到的平衡时间更短,说明其在性能方面更加优越,催化效果更好。
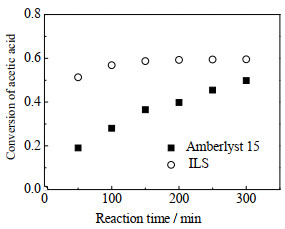
|
图 3 初始乙酸和乙醇的量比为1的条件下催化效果比较 Fig.3 Comparison of catalytic performance at initial ethyl alcohol to acetic acid molar ratio = 1 |
在Matlab中,用编程的方式将非理想模型和理想模型进行了拟合对比,发现非理想模型平衡转化率比实验值偏低,但反应初期数据基本吻合;而理想模型在转化初期和达到平衡后理论值均明显高于实验值,数据吻合度没有非理想模型高,证明了NIH模型优于IH模型。
4.2 温度对酯化反应的影响在催化剂浓度为0.137 3 mol·L−1、初始乙酸和乙醇的量比nHAc: nEtOH=1时,温度对乙酸转化率的影响如图 4所示,反应开始阶段,曲线斜率最大,说明此时反应速率最大,因为体系反应物浓度在0时刻最大,产物浓度为0,为正反应方向进行。后续酯的质量分数增加,逆反应速率增加,导致乙酸转化率的增长趋势变缓,最后趋于平衡。在20 min左右即可达到平衡转化率的一半,当反应温度为333.15 K时,在50 min左右反应达到平衡。随反应温度313.15升高到333.15 K,乙酸的转化速度逐渐变快,说明升高温度促进酯化反应速率增大。该体系的标准反应焓为–3.2 kJ·mol−1[22],属于微放热反应,因此温度变化对平衡转化率几乎没有影响。
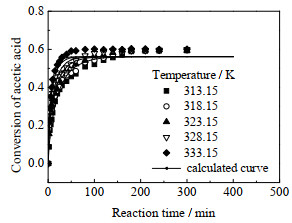
|
图 4 温度对乙酸转化率的影响 Fig.4 Effects of reaction temperature on acetic acid conversion |
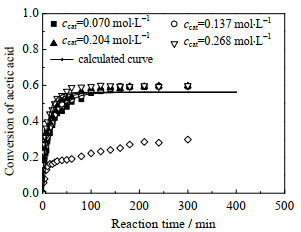
当温度为323.15 K,nHAc: nEtOH=1时,离子液体催化剂浓度对乙酸转化率的影响见图 5。随着离子液体浓度从0.070增加到0.268 mol·L−1时,乙酸的转化速率增大,说明催化剂浓度提高对酯化反应正向进行具有促进作用,但不能改变平衡转化率。在30 min时转化率达到平衡转化率一半,60 min后接近平衡转化率,而做空白实验时发现反应缓慢,转化率在300 min内乙酸转化率均低于0.3,转化率处于较低状态,说明离子液体催化剂对乙酸乙酯合成作用显著。
|
图 5 催化剂浓度对乙酸转化率的影响Fig. 7 Effects of initial reactant molar ratio on ethyl acetate concentrationEthyl acetate concentration / (mol·L−1) Fig.5 Effects of catalyst concentration on acetic acid conversion |
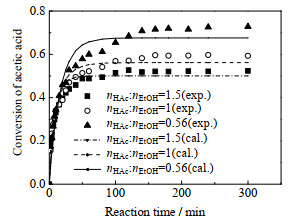
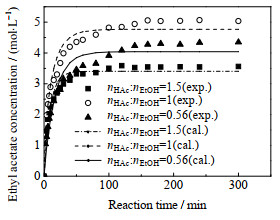
如图 6和7所示分别在温度为323.15 K、催化剂浓度为0.140 mol·L−1的条件下,初始乙酸和乙醇的量比对乙酸转化率和乙酸乙酯浓度的影响结果(nHAc: nEtOH为0.56~1.5)。在nHAc: nEtOH=0.56时乙酸的平衡转化率最高,在nHAc: nEtOH=1时乙酸的平衡转化率明显降低,在nHAc: nEtOH=1.5时乙酸的平衡转化率最低,说明过量的乙醇有利于提高乙酸的转化率。但在乙酸过量的情况下,反应达到平衡的速度更快,可能是过量的乙酸对反应有一定的自催化作用[23],提高了反应速率,使反应更快达到了平衡。从图 7可以看出,在nHAc: nEtOH=1.5时乙酸乙酯的浓度最低,在nHAc: nEtOH=0.56时,平衡产物中的乙酸乙酯的浓度升高,在nHAc: nEtOH=1时乙酸乙酯的浓度最高,所以在相同条件下为了使得到的产物量最多,应该保持初始乙酸和乙醇的量比接近1。
|
图 6 初始乙酸和乙醇的量比对乙酸转化率的影响 Fig.6 Effects of initial reactant molar ratio on acetic acid conversion |
|
图 7 初始乙酸和乙醇的量比对乙酸乙酯浓度的影响 Fig.7 Effects of initial reactant molar ratio on ethyl acetate concentration |
由此可见,催化剂浓度不影响乙酸的平衡转化率,但对乙酸的转化率有一定影响,而且该反应下温度对其平衡转化率影响不大,但初始乙酸和乙醇的量比对乙酸平衡转化率有较大影响,且在该情况下平衡转化率越大,初始乙酸转化率越高。所以,平衡转化率是制约乙酸转化率的关键。
5 结论(1) 反应动力学计算值与实验值吻合较好,但是在达到平衡时计算值略低于实验值,原因可能是反应初期测定的动力学实验数据点较多,但后期达到平衡时的数据点相对较少,因此拟合回归的模型结果更贴近反应初期数据,此外NRTL模型的引入也在一定程度上影响预测结果。
(2) 1-磺酸丁基-2-甲基吡啶硫酸氢盐离子液体催化剂在乙酸乙酯反应中,效果比Amberlyst 15离子交换树脂催化剂更好,随着温度和离子液体催化剂浓度升高,反应速率增大,转化率逐渐变快,但平衡转化率几乎不变;随着乙酸和乙醇的量比增大,乙酸的转化率增大,乙醇过量有利于乙酸转化率的提高,当乙酸和乙醇的量比等于1时,乙酸乙酯浓度达到最大。
(3) 利用实验数据获得反应温度、催化剂浓度与反应初始速率的关系,使用龙格库塔法编辑Matlab程序求解该动力学微分方程,采用非线性最小二乘法对全时刻范围动力学实验数据进行拟合获取正逆反应速率常数和正逆反应活化能。结果表明NIH模型建立的反应动力学方程计算值与实验值基本吻合,说明该模型适用于离子液体催化乙酸乙酯反应体系。
| [1] |
WELTON T. Room-temperature ionic liquids. Solvents for synthesis and catalysis[J]. Cheminform, 2011, 111(8): 2071-2084. |
| [2] |
GENG W G, LI X H, WANG L F, et al. Synthesis of Multiester-appended and multicarboxylic-appended imidazolium ionic liquids[J]. Chinese Chemical Letters, 2006, 17(2): 169-172. |
| [3] |
王国华, 解从霞, 张春华, 等. 酸功能化离子液体催化合成马来酸二异辛酯[J]. 精细化工, 2008, 25(4): 354-357. WANG G H, XIE C X, ZHANG C H, et al. Synthesis of diisooctyl maleate catalyzed by acidic functionalized ionic liquids[J]. Fine Chemicals, 2008, 25(4): 354-357. DOI:10.3321/j.issn:1003-5214.2008.04.011 |
| [4] |
DAVIS J H. Task-specific ionic liquids[J]. Chemistry Letters, 2004, 33(9): 1072-1077. DOI:10.1246/cl.2004.1072 |
| [5] |
梁金花, 徐玥, 李振江, 等. Brϕnsted酸功能化双核离子液体制备及催化合成醋酸丁酯的研究[J]. 高校化学工程学报, 2011, 25(3): 519-523. LIANG J H, XU Y, LI Z J, et al. Synthesis and application of functional Brϕnsted acid binuclear ionic liquid[J]. Journal of Chemical Engineering of Chinese Universities, 2011, 25(3): 519-523. DOI:10.3969/j.issn.1003-9015.2011.03.028 |
| [6] |
BOON J A, LEVISKY J A, PFLUG J L, et al. Friedel-Crafts reactions in ambient-temperature molten salts[J]. Journal of Organic Chemistry, 1985, 51(4): 480-483. |
| [7] |
孙晓波, 黄强, 刘国际, 等. 以磷钨酸为催化剂的丁二酸二丁酯的合成及其动力学研究[J]. 高校化学工程学报, 2007, 21(4): 627-632. SUN X B, HUANG Q, LIU G J, et al. Study on synthesis of dibutyl succinate catalyzed by phosphtungstic acid and its reaction kinetic[J]. Journal of Chemical Engineering of Chinese Universities, 2007, 21(4): 627-632. DOI:10.3321/j.issn:1003-9015.2007.04.015 |
| [8] |
蓝丽红, 闫瑞一, 廖安平, 等. 阳离子交换膜催化合成乙酸丁酯动力学研究[J]. 离子交换与吸附, 2006, 22(2): 168-174. LAN L H, YAN R Y, LIAO A P, et al. Kinetics of synthesis of butyl acetate catalyzed by cation exchange membrane[J]. Ion Exchange and Adsorption, 2006, 22(2): 168-174. DOI:10.3321/j.issn:1001-5493.2006.02.011 |
| [9] |
廖安平, 左卫元, 童张法, 等. 强酸性离子交换树脂催化合成乙酸正丁酯动力学[J]. 高校化学工程学报, 2012, 26(2): 254-258. LIAO A P, ZUO W Y, TONG Z F, et al. Kinetics of synthesis of n-butyl acetate catalyzed by strong acid ion exchange resin[J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(2): 254-258. |
| [10] |
赵瑾. 含离子液体体系汽液相平衡的测定级模型化研究[D]. 北京: 北京化工大学, 2007. ZHAO J. Stage modeling of vapor-liquid equilibrium in ionic liquid systems [D]. Beijing: Beijing University of Chemical Technology, 2007. |
| [11] |
田君, 廖安平, 童张法. 新松弛法用于流化催化反应精馏过程的计算[J]. 化工科技, 2014, 22(5): 1-4. TIAN J, LIAO A P, TONG Z F. The new relaxation method is used to calculate the distillation process of fluidized catalytic reaction[J]. Technology In Chemical Industry, 2014, 22(5): 1-4. DOI:10.3969/j.issn.1008-0511.2014.05.001 |
| [12] |
CUI X, CAI J, ZHANG Y, et al. Kinetics of transesterification of methyl acetate and n-Butanol catalyzed by ionic liquid[J]. Industrial & Engineering Chemistry Research, 2011, 50(20): 11521-11527. |
| [13] |
ZHEN Y, CUI X, JIE H, et al. Kinetic study and process simulation of transesterification of methyl acetate and isoamyl alcohol catalyzed by ionic liquid[J]. Industrial & Engineering Chemistry Research, 2015, 54(4): 1204-1215. |
| [14] |
JIE H, CUI X, ZHANG Y, et al. Transesterification of methyl acetate with isobutanol in a reactive and extractive distillation column with ionic liquid as catalyst and molecular liquid as entrainer[J]. Industrial & Engineering Chemistry Research, 2016, 55(2): 404-419. |
| [15] |
董颜箔, 何瑞宁, 童张法, 等. 离子液体催化反应精馏合成乙酸乙酯工艺模拟[J]. 化工进展, 2018, 37(2): 468-474. DONG Y B, HE R N, TONG Z F, et al. Simulation of distillation process of ethyl acetate by ionic liquid catalysis[J]. Chemical Industry and Engineering Progress, 2018, 37(2): 468-474. |
| [16] |
HE R N, ZOU Y, TONG Z F, et al. Kinetic study and process simulation of esterification of acetic acid and ethanol catalyzed by [HSO3-bmim][HSO4][J]. Chemical Engineering Research and Design, 2018, 137: 235-245. DOI:10.1016/j.cherd.2018.07.020 |
| [17] |
张文林, 钱智浩, 李春利, 等. N-(4-磺酸丁基)吡啶硫酸氢盐离子液体的结构分析[J]. 河北工业大学学报, 2016, 45(4): 45-52. ZHANG W L, QIAN Z H, LI C L, et al. Structural analysis of N-(4- butyl sulfonate) pyridine bisulfate ionic liquid[J]. Journal of Hebei University of Technology, 2016, 45(4): 45-52. |
| [18] |
程新炎, 王志远, 王敏伟, 等. 2-甲基吡啶类离子液体结构与酸性关联及其酯化催化活性[J]. 南昌大学学报, 2017, 41(3): 236-240. CHENG X Y, WANG Z Y, WANG M W, et al. The association of 2-methylpyrudinium ionic liquids structures, acidities and esterification catalytic performance[J]. Journal of Nanchang University, 2017, 41(3): 236-240. |
| [19] |
RÖNNBACK R, SALMI T, VUORI A, et al. Development of a kinetic model for the esterification of acetic acid with methanol in the presence of a homogeneous acid catalyst[J]. Chemical Engineering Science, 1997, 52(19): 3369-3381. DOI:10.1016/S0009-2509(97)00139-5 |
| [20] |
XU F, ZHOU X, ZHANG G, et al. Novel Bronsted acidic ionic liquid as efficient and reusable catalyst system for esterification[J]. Catalysis Communications, 2007, 9(11): 1208-1211. |
| [21] |
HASANOĞLU A, SALT Y, KELEŞER S, et al. The esterification of acetic acid with ethanol in a pervaporation membrane reactor[J]. Desalination, 2009, 245(1): 662-669. |
| [22] |
TURNER G. CRC handbook of chemistry and physics-A ready-reference book of chemical and physical data, 70th edition-WEAST, RC, LIDE, DR[J]. Annals of Science, 1991, 48(5): 496-497. |
| [23] |
彭宝祥, 舒庆, 王光润, 等. 酸催化酯化法制备生物柴油动力学研究[J]. 化学反应工程与工艺, 2009, 25(3): 250-255. PENG B X, SHU Q, WANG G R, et al. Kinetic study on preparation of biodiesel by acid-catalyzed esterification[J]. Chemical Reaction Engineering and Technology, 2009, 25(3): 250-255. |




