2. 中国科学院 微观界面物理与探测重点实验室, 上海 201800;
3. 中国科学院 重庆绿色智能技术研究院 跨尺度制造技术重庆市重点实验室, 重庆 400714
2. Key Laboratory of Interfacial Physics and Technology, Chinese Academy of Sciences, Shanghai 201800, China;
3. Chongqing Key Laboratory of Multi-Scale Manufacturing Technology, Chongqing Institute of Green and Intelligent Technology, Chinese Academy of Sciences, Chongqing 400714, China
细胞是生命体结构和功能的基本单位,对生命相关问题的深入认识与细胞密切相关,目前对于细胞的研究已经从细胞群体和组织层次深入到单细胞水平。细胞由细胞核、细胞质、细胞骨架以及细胞膜等构成。细胞膜表面存在许多生物大分子,比如膜蛋白、糖蛋白、糖脂和由质膜特化形成的结构(微绒毛、细胞内辙、纤毛和鞭毛等)。细胞膜上存在许多体现细胞膜功能的生物大分子,比如快速转运水分子的孔道水通道蛋白,影响细胞和细胞间粘附作用的E-钙黏蛋白[1]以及与细胞信号识别关系密切的糖蛋白。细胞骨架是真核细胞中与维持细胞形态和细胞运动有关的蛋白纤维网络结构。细胞形态可以体现细胞表面分子和细胞骨架及细胞器等信息,反映细胞的生理状态[2]。研究表明,细胞形态在细胞的生长、分化、发育、死亡和肿瘤生长等诸多生理过程中与细胞功能密切相关[3~6],比如在癌症的侵袭过程中,癌细胞需要不断地修改自身的形状和硬度来与其周围的组织结构进行反应[7];再比如细胞的力学性质会随着细胞的性质或其所处环境的不同而发生改变,能反映细胞的生理学特性[8]。因此研究单个细胞包括形态和力学在内的物化特性对于揭示生命的奥秘具有重要意义。
自1986年发明以来,原子力显微镜(AFM)在研究生物样品方面显现出强大的活力[9~11]。它能够以超高的成像分辨率(埃级,10-10 米)和力学分辨率(皮牛级,10-12 牛顿)在近生理环境下和纳米尺度下观察细胞形态和测量细胞力学性质[12, 13]。相比较于扫描电子显微镜(scanning electron microscope,SEM)和透射电镜(transmission electron microscope,TEM),AFM在研究细胞方面最大的两个优点是:(1) 可以在生理条件下进行活体实验,从而可以获得生理活性下关于细胞的实验数据;(2) 可以对样品进行力学性质测量,因此可以获得细胞的机械性质,如黏附性、弹性和塑性等。目前,已有不少关于利用传统AFM成像和力学技术研究细胞物化特性的综述文章[14]。然而,近年来一些新的AFM成像技术和应用不断涌现出来,并在细胞的物化性质测量方面展现出巨大应用前景。为了加快这些新技术的应用,本综述在对AFM基本原理和传统应用扼要介绍的基础上,着重介绍新型AFM测量技术[比如峰值力模式(PeakForce)、快扫模式(FastScan)以及将AFM与超高分辨率光学显微镜联用]对包括细胞成像和力学测量在内的物化性质方面的最新研究进展。
2 AFM基本工作原理及传统工作模式介绍AFM是一种具有极高成像分辨率和力学分辨率的先进设备。它的成像扫描范围可以从几个 nm × nm到约100 m × 100 m,并且可以在生理溶液环境下工作,是研究细胞体系的理想工具[15]。利用AFM的成像和力学测量功能对细胞样品进行检测,可以获得细胞表面的结构信息和细胞的力学信息(如:黏附力和弹性)[16]。
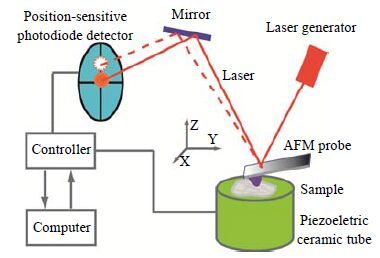
2.1 AFM基本成像原理及工作模式AFM基本成像原理:如图 1所示,当AFM工作时,一个预设定的作用力通过AFM探针作用在样品上,这个作用力使得AFM探针的微悬臂发生一定量的偏折(预先设定偏折量)。此偏折量决定了从微悬臂背面反射的激光束(红色实线)到达光电四象限探测器的位置(实心红斑)。当样品在压电陶瓷扫描管的带动下在X-Y平面(水平面)做光栅模式扫描(raster scan)时,AFM探针的微悬臂的偏折量会随所测样品表面形貌变化而瞬时相应偏离设定偏折量,从而引起到达光电四象限探测器的激光斑(空心虚斑)位置发生瞬时变化。光电四象限探测器会将检测的光信号变化以电信号的形式传送给AFM电子控制箱,控制箱将会控制压电陶瓷扫描管在Z-方向做相应的伸缩变化使微悬臂的偏折恢复到其预设值。在这个过程中,将压电陶瓷扫描管在Z-方向和X-Y平面的位置变化重新构建便可以得到扫描区域样品的形貌图。AFM基本的成像模式主要包括:接触模式(contact mode)和轻敲模式(tapping mode)。在接触模式中,AFM的针尖始终和样品表面保持轻微接触,并且保持恒定的作用力。一般来讲,对于硬样品通过接触模式成像可以获得稳定、高分辨率的样品表面形貌图。但是,如果样品表面和针尖存在黏附力,使用接触模式成像则容易使样品变形甚至发生损伤而使图像失真。在轻敲模式中,探针的微悬臂在其共振频率附近作受迫运动,探针与样品间歇时接触,它们之间的作用力大小可以通过控制探针接触样品时微悬臂的振幅/偏折量来保持恒定。由于轻敲模式中的针尖和样品的接触非常短暂且作用力与样品表面几乎垂直,因此,可以避免样品粘附到针尖上和几乎完全消除剪切力对样品的破坏。轻敲模式可以对柔软、易变形和黏度较大的样品进行很好地成像观测[17]。
|
图 1 AFM基本工作原理示意图 Fig.1 Schematic diagram of AFM working principles AFM is composed of a piezoelectric ceramic tube, a laser generator, a position-sensitive photodiode detector, a controller and an AFM probe. The AFM probe is a micro-cantilever with a sharp tip attached at its end. The sharp tip ensures the nanometer resolution in imaging and the micro-cantilever is a force sensor that can detect even tiny deformation of a sample, which ensures the high sensitivity of AFM in force measurements |
在理解AFM基本成像原理的基础上,很容易理解AFM力学测量原理。在利用AFM进行力学测量时,首先将AFM探针移动到待测样品上方,保持压电陶瓷扫描管在X-Y平面不动,控制压电陶瓷扫描管在Z-方向做伸缩运动;这样AFM探针就可以趋近样品表面,进而压入样品,然后趋离样品。在此过程中,AFM微悬臂偏折引起的光电四象限探测器探测到的由激光斑位置变化引起的电压值会发生变化。在标定光电四象限探测器的敏感系数后(探针接触硬衬底后,压电陶瓷扫描管在Z-方向上的位移与该运动引起的探针微悬臂偏折导致的光电四象限探测器的电压值变化量的比值),可将电压值的变化转化为微悬臂的实际偏折量d;再通过热扰的方法标定微悬臂的弹性系数k,这样就可以通过胡克定律计算样品的受力,F=k×d。实验上直接得到的力学曲线是探针趋近和离开样品过程中微悬臂偏折量与压电陶瓷扫描管在Z-方向上位置变化的曲线。为了分析被测样品性质,我们需要从压电陶瓷扫描管在Z-方向上的位置变化中去除探针微悬臂本身的偏折量,得到探针针尖与样品之间的实际距离。样品受力与探针针尖与样品之间的实际距离曲线被称之为力-距离曲线(force-distance curve)[18],包括趋近力-距离曲线和回撤力-距离曲线,对力-距离曲线进行深入分析,可以得到样品弹性、黏附性和塑性等性质[19]。
3 传统AFM工作模式在细胞物化性质(成像和力学)研究中的应用AFM可以在保持细胞生理活性的溶液中(缓冲液和细胞培养液)对细胞进行观测研究。早在20世纪90年代初,研究人员就开始利用AFM对活细胞进行成像方面的研究。主要可以概括为三个方面的研究:(1) 观测正常细胞和非正常细胞的形态变化,如Hsieh等人[20]的研究显示正常软骨组织细胞和患有骨节炎的组织的细胞形态(铺展面积、高度和表面粗糙度等)不同;(2) 观测由于物理、化学和生物因素(如药物和环境污染物)引起的细胞形态变化[21];(3) 对细胞进行动态观察[22]。这些研究成果可以检测药物的有效性,有利于帮助寻找疾病治疗的新方法[23]。
AFM还可以对细胞进行力学测量,获得细胞力学性质。基于趋近力-距离曲线分析,可以得到与细胞压缩相关的机械性能(如压弹性)。Li等人[8]用AFM在37℃下对恶性肿瘤细胞(MCF-7) 与良性肿瘤细胞(MCF-10A)进行成像和细胞弹性测量比较,经对AFM力曲线分析的结果显示癌细胞的硬度是正常细胞硬度的30%,这个指标可以被用来帮助区分正常细胞和肿瘤细胞。从分析回退力-距离曲线,可以得到与细胞拉伸相关的机械性质(如细胞表面的黏附性及细胞表面生物大分子与其它分子的特异性反应)。Yang等人[24]通过将ICAM-1修饰在针尖上,研究了细胞表面黏附分子整合素Mac-1和ICAM-1(inter cellular adhesion molecule-1) 细胞间黏附分子的相互作用。结果表明Mac-1在静息状态下与ICAM-1有一定的结合,被活化后对ICAM-1的结合力增大,结合几率也增加。通过比较Mn2+活化的Mac-1或Mac-1几个突变体与ICAM-1相互作用的力谱,推断出Mac-1活化后与ICAM-1亲和力增高是由Mac-1的α亚基I结构域的α7螺旋下移控制的,这为研究Mac-1激活的机制和构象的变化提供新的依据。由于许多生物过程,如受体信号转导(受体-配体)和免疫系统(抗原-抗体)等都是通过生物分子间的相互作用来实现的,通过将探针用特异生物大分子功能化,可以通过回退力-距离曲线检测和鉴别细胞表面的靶分子,这为细胞信号通路的研究和药物设计提供了有效的物理手段。
总之,AFM成像技术和力学测量技术已经被广泛的用于细胞物理化学领域,使得人们能从单分子和单细胞水平认识细胞的结构与功能及其相互关系[25]、从单细胞水平区分病变细胞和正常细胞[26]和可视化研究药物的作用机理[27]。
4 新型AFM技术在细胞物化特性(成像和力学)研究中的应用 4.1 单细胞力谱技术在生命体中,细胞与细胞之间的作用在细胞存活、基因表达、细胞迁移和分化等相关信号通路方面都有重要的作用[28, 29]。前面提到可以在传统AFM回退力曲线测量技术中使用生物单分子修饰的AFM探针来检测细胞表面的受体、抗原和其它大分子的分布特性[30]。但是,由于经生物单分子修饰的探针在同一时间仅能对细胞表面的某一位点进行测量,并不能反应细胞与细胞的实际作用,因此将细胞连接在探针上来研究细胞与基底上的细胞或生物大分子相互作用的技术应运而生[31~33],这种技术被称之为单细胞力谱技术(single-cell force spectroscopy,SCFS)。
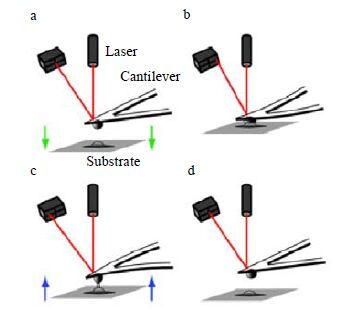
SCFS是通过将细胞修饰在探针上,在基底上粘附细胞或者生物大分子来检测细胞与细胞或者细胞与生物单分子间的相互作用力[34]。在SCFS测量细胞间的黏弹性测量实验中(图 2)[35],首先需要将活细胞连接在无针尖的AFM探针的微悬臂末端。为了使细胞更容易连接在AFM探针的微悬臂上,通常是在AFM探针的悬臂上修饰基底蛋白[32, 33],比如层黏蛋白、纤维连接蛋白或糖结合凝集素,通过基底蛋白和细胞表面的糖基化蛋白作用把细胞连接到悬臂上。驱动连接有细胞的AFM探针逐渐靠近基底上的细胞,在预设力的作用下使细胞与细胞接触一定时间,然后将连有细胞的AFM微悬臂驱离基底细胞。Kashef等人[33]在单细胞力谱技术方面做了尝试,用伴刀豆蛋白将CNCC细胞(颅神经嵴细胞)修饰在AFM探针的微悬臂上,用层黏蛋白将CNCC细胞粘附在基底上,然后检测了两个细胞间的作用力。这个实验为研究细胞间的相互作用力奠定了方法学基础。
|
图 2 基于AFM 的单细胞力谱技术 Fig.2 Schematic diagram of AFM-based single-cell force spectroscopy (a) A single cell immobilized on a functionalized cantilever is positioned above a second cell adhering to a protein substrate. (b) Both cells are then brought into contact for a defined contact time and with a preset contact force. (c) The cells are subsequently separated, and the maximal separation force and the detachment work can be extracted from a simultaneously recorded force–distance curve. (d) The cantilever is retracted until the cells separate |
在人的红细胞中,cAMP(环磷酸腺苷)是由腺苷酸环化酶(AC)分解ATP得到的产物,它可以通过蛋白激酶A(protein kinase A,PKA)激活相应的信号通路;cAMP依赖性的PKA可以调节细胞粘附分子和层黏蛋白之间的相互作用。毛喉素是一种疏水性激活剂,可以通过激活AC而影响PKA,从而影响细胞粘附分子。Maciaszek等人[36]将健康人血红细胞和用毛喉素处理过的人血红细胞分别修饰在探针的微悬臂上,用SCFS技术研究了这两种细胞与层粘蛋白的相互作用。研究结果显示:健康红细胞和层黏蛋白间的解离力是594.5 pN,毛喉素处理过的红细胞和层黏蛋白间的解离力是837.9 pN。本实验说明,基于AFM的单细胞力谱技术可以研究药物对细胞黏附性的影响。
4.2 峰值力(Peak Force)模式虽然传统的AFM成像和力学技术已得到了广泛的应用,但是仍然有很明显的技术缺点。从成像技术方面来讲,在传统接触模式成像过程中探针与样品之间存在剪切作用,容易造成样品的损坏;在传统轻敲成像模式中,由于是基于对快速振动的探针的微悬臂振幅值监测来对探针针尖与样品作用力进行反馈控制,因而探针针尖与样品间的作用力难以精确控制,仍有可能导致待测样品严重变形或破坏[37]。从力学测量方面来讲,基于力曲线的测量方法[单个力曲线测量方法和力体积(Force Volume)模式]存在测量速度慢的问题,既耗时又不利于生物样品活性保持[37]。考虑到这些不足,Bruker公司近年来成功开发了商业化的峰值力(PeakForce)模式。与传统AFM测量技术相比,在峰值力技术中形貌成像和力学测量可以同时进行,针尖与样品的作用力可以得到精确控制,力学测量速度与成像速度一样快,可以有效地避免样品的损坏和针尖的污染,也可以在很大程度上避免传统力学测量技术中对细胞进行化学固定的要求,因而可以同时得到高质量的样品形貌图像和力学性质。
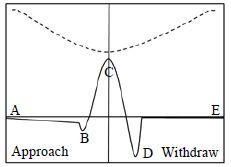
如图 3所示[38],峰值力模式是用正弦波(图中虚黑线)代替传统三角波的方式来驱动压电陶瓷扫描管Z方向上的运动;在该模式中,探针受压电陶瓷扫描管在Z方向上的作用而受迫振动[38]。该操作模式的优点是:越接近样品表面,探针相对样品的运动速度越慢,因此避免了因系统响应的延迟而导致探针的不必要的移动,可以更精确的控制探针和样品之间的相互作用力。利用峰值力[图 3中C点,即趋近(approach)力曲线(蓝色曲线)与回退(withdraw)力曲线(红色曲线)的转折点]进行反馈,可以对样品在微小作用力下稳定成像(~10 pN),从而可以获得更为精确的样品的AFM形貌图像。在峰值力模式中,探针本身不振动,通过驱动压电陶瓷扫描管Z方向上快速运动来实现样品与探针的相互作用。由于压电陶瓷扫描管的运动频率(0.25~2 kHz)远低于探针悬臂共振的频率(几十到几百 kHz),因而AFM系统可以及时检测样品和探针之间的作用;同时,在峰值力模式中,压电陶瓷扫描管Z方向上的运动频率(0.25~2 kHz)远远高于传统力学测量模式中的频率(0.1~10 Hz),因而可以比较快速地对样品进行力学测量[38]。峰值力技术能够在保证侧向分辨率不变的条件下测量小到1 MPa的软物质和大到20 GPa的硬物质。其测量速度比传统力体积模式快近两个数量级,可以在较短时间内完成力学测量,有利于保持细胞的生物活性[39]。
|
图 3 峰值力测量模式 Fig.3 Schematic diagram of the peak force mode Plot of force and piezo Z position as a function of time,including (B) jump-to-contact,(C) peak force,(D) adhesion.[38] |
Bruker公司采用峰值力技术对鼠的黑色素瘤细胞在HEPES溶液中薄片状伪足进行成像[38],在256 ×256像素点的分辨率下用时仅8.5 min;而采用传统的力体积模式以2 Hz的测量速率获得同样分辨率的图像需耗时9 h。图 4a是利用峰值力模式在250 Hz的力学测量速率下得到的黑色素瘤细胞的图像,图 4b和4c分别是利用力体积模式在1 Hz(图 4b)和5 Hz(图 4c)的力学测量速率下得到的黑色素瘤细胞的图像。从图像可以看出,相比于峰值力模式,利用力体积模式难以清晰地分辨出细胞骨架的肌动蛋白。

|
图 4 峰值力模式和力体积模式下得到的Sneddon 模量图的比较 Fig.4 Comparison of force mapping images obtained with peak force quantitative nanomechanical measurements (Peak Force QNM) and force volume (FV). Scale bar: 2 μm (a) a peak force QNM image with 256 × 256 pixels collected at a ramp rate of 250 Hz. (b) a FV image with 16 × 16 pixels collected at a ramp rate of 1 Hz. (c) a FV image with 16 × 16 pixels collected at a ramp rate of 5 Hz. It takes 4.4 minutes, 4.3 minutes and 51.2 seconds to collect images (a), (b) and (c), respectively. Scale bar: 2 μm. |
Heu等人[40]用峰值力模式在生理环境中观察了除草剂草甘膦作用于Hacat细胞(人永生化表皮细胞)前后的AFM图像,经过AFM分析软件的Derjaguin-Muller-Toporov(DMT)模型拟合得到细胞弹性模量图和细胞形变图。结果显示:草甘膦处理6 h后细胞呈现扁平状并且有不同分布的突起,同时表现出复杂的丝状网络与众多的细胞膜之间的接合点。采用峰值力模式获得的高分辨率AFM图像和力曲线数据很好地描述了草甘膦能对Hacat细胞引起的细胞形貌和机械性质的变化以及Hacat细胞会对草甘膦产生氧化应激反应。另外,Tomankova等人[41]采用峰值力模式对没有固定和未经化学处理的Hela细胞(人宫颈癌细胞)成像得到其形貌图、黏滞力分布图以及DMT模量图(与细胞弹性相关),并且得到Hela细胞的细胞核附近的杨氏模量大约为35 kPa。
目前,越来越多的人用峰值力模式来测量生物样品的生物物理化学性质,比如活细胞或者固定的细胞[42]、Hacat表皮细胞[40]和微生物细胞[43]等。根据峰值力模式工作过程中对样品剪切力小、与样品间歇接触和力学测量速度快的特点,可以确信该工作模式在细胞的力学性质测量方面将具有极大的应用潜力。
4.3 快扫(FastScan)模式对生物分子功能发挥和细胞生理活动的动态过程观测一直是生物学家、化学家和物理学家所关心的问题。虽然峰值力模式可以对样品进行精确成像,但是它在成像速度上和传统AFM一样,通常得到一副图像的时间为分钟量级[44]。因此,虽然利用峰值力模式和传统的AFM工作模式可以直接观察到DNA、蛋白质和活细胞,但是由于成像速度受限而难以观察生物分子相互作用和细胞生理活动的动态变化过程。为了解决AFM成像速度过慢的问题,从90年代初,国际上几个著名课题组,如Quate课题组、Hansma课题组和Ando课题组开始致力于快扫(Fast Scan)模式AFM的研究,直到近年来才真正实现了商业化的快扫模式AFM[45]。目前的快扫模式AFM是基于传统轻敲模式AFM发展起来的。快扫模式AFM的技术关键是要能够快速稳定地对样品成像,即要有较高的成像速度。为了简化起见,假设样品表面在X-Z平面是一个具有波长为λ和振幅为h0/2的呈正弦波形的周期结构,则最大成像速度Rmax可以用公式(1) 表示[46],
| $R\max =2\theta \max \lambda fB/(\pi WN)$ | (1) |
在该公式中,θmax是探针作用于样品上的最大可能相位延迟角度(弧度),取决于样品的易碎性,对蛋白质而言典型值为~π/9;fB为AFM系统带宽(压电陶瓷扫描管在Z方向的最大允许振动频率);W为所扫描样品在X方向宽度;N为扫描线条数。带宽fB是AFM系统反馈速度的特征量,是限制扫描速度的一个决定性因素,定义为输出信号与输入信号产生45°相位延迟的系统反馈频率。对于一个特定样品,带宽fB可以由公式(2) 表示[46]:
| ${{f}_{B}}=1/(8\tau 0)$ | (2) |
在该公式中τ0为整个闭环AFM系统中的相位延迟时间,主要包括探针微悬臂振动响应时间、探测微悬臂振幅所需时间、反馈控制箱对错误信号积分所需时间、Z-压电驱动器响应时间和探针从非稳态到与样品稳定接触所需时间(parachutiing time)[44]。
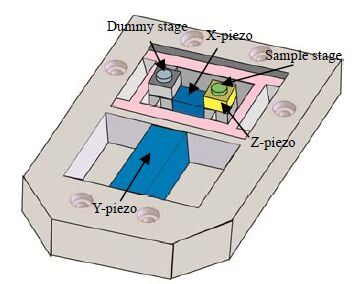
从上述公式看出,提高反馈回路带宽是实现快扫的关键所在。为了提高带宽fB,τ0需要最小化,这也就是要求构成AFM闭环系统的各个部件产生的时间延迟最小化。为了实现这个目的,在实际的快扫模式AFM中采用了比常规AFM探针微悬臂更小的AFM探针、更为灵敏的光电探测器、结构更为稳定和防震性能更好的扫描器、新的更为灵敏的PID(proportional-intergral-derivative)反馈控制技术以及漂移(drift)补偿技术[47]。2011年,Ando课题组利用这些技术发展的快扫模式AFM在观测马达蛋白时实现了每秒采集12.5副图的速度[45]。扫描器是快扫模式AFM的关键部件,图 5是一个典型的用于快扫模式AFM的扫描器[47]。在该扫描器中,X-、Y- 和Z- 压电驱动器是独立的,有效避免它们之间的相互干扰;另外,为了保证Z-压电驱动器的快速振动和降低在液体中成像时由快速振动而导致的样品台表面与探针之间的流体压力干扰,快扫模式AFM中的样品台直径很小(毫米量级)[47]。
|
图 5 一个高速扫描器示意图 Fig.5 Sketch of the high-speed scanner currently used for imaging studies A sample stage is attached on the top of the upper z-piezoelectric actuator (the lower Z-piezo electric actuator used for counterbalancing is hidden). The dimensions (W × L × H) of the z-actuators are (3 × 3 × 2) mm3. The gaps are filled with an elastomer for passive damping[45] |
Suzuki等人[48]利用快扫模式AFM,对Hela细胞的丝状伪足进行动态观察,采用的扫描速率为0.2 fps,即每隔5 s可以获取一幅细胞伪足的AFM图像,实现了对Hela细胞的丝状伪足的动态变化实时观察。图 6为选取的每隔10 s的细胞伪足的AFM图像。从20 s和130 s的两幅AFM图像可以明显看到细胞伪足位置不同(如第130 s的AFM图中黄线所示)。Watanabe等人[49]利用用快扫模式AFM实时观察了Hela细胞内陷成纳米级小囊到小囊完全进入细胞内部的整个内吞过程。内吞是指通过细胞膜将细胞外分子或物质运输到细胞内,是细胞获取细胞外物质重要的途径之一。快扫技术可以像录制电影一样实时记录细胞生理过程的动态变化过程,为观察很多动态生理过程提供了新方法。总之,快扫模式AFM在细胞表面蛋白识别、信号转导、胞吞胞吐等动态生物过程中有着巨大应用潜力。

|
图 6 Hela 细胞表面动力学的快扫AFM 图像 Fig.6 Dynamics of living Hela cell surface revealed by high-speed AFM. Scan rate 0.2 fps, image size: 4480 nm × 3360 nm, scale bar: 1 μm High-speed AFM images show dynamic features of the cell surface, reflecting the motion of filopodia. Images were recorded at a scan rate of 0.2 fps. Image size: 4480 nm × 3360 nm. Scale bar: 1 μm. |
AFM可以获得细胞的形貌和细胞力学信息,但是无法对细胞内部结构进行观测和定位,因此难以全面评估细胞的生物物理化学性质。用超分辨率光学显微镜对荧光标记的细胞进行观察可以得到细胞的内部结构信息,该技术主要是通过选择性标记细胞内的特异分子,以特异分子的分布显示细胞的结构特性;经过光学断层成像技术结合计算机三维重建技术可以得到细胞三维空间的立体结构,获取细胞内部结构信息。因此将超分辨率显微镜和AFM联用可以获取更丰富的细胞信息。目前,有研究者将超分辨率显微镜的典型代表受激发射损耗显微技术(stimulated emission depletion,STED)和随机光学重构显微技术(stochastic optical reconstruction microscopy,STORM)分别与AFM联用对生物分子和细胞进行探测,利用各自的优点同时获得样品表面信息和三维结构信息[50, 51]。Benjamin等人[52]将AFM和STED联用,在PBS缓冲溶液中观测了对微管放射性(放射性示踪元素ATTO647N)标记的cos7(非洲绿猴肾成纤维细胞)细胞,并将所得图像与由共聚焦显微镜成像得到的图像作对比。结果显示,从共聚焦显微镜得到的图像难以清晰地观察细胞中的纤丝结构,而从STED图像则可以观察到纤丝结构的细节;将由AFM力学测量得到杨氏模量分布图与对应区域的STED图像叠加,就可以获得细胞内部微管分布信息和细胞表面形貌以及细胞的弹性信息。
JPK公司利用联用的STORM与AFM联用技术对Hela细胞进行成像实验,在实验中,工作人员用鼠抗α-tubulin的抗体做一抗,Alexa647标记的抗鼠抗体做为二抗。 图 7是STORM与AFM联用的对Hela测试的结果: STORM图像清晰地显示了单个微管和微管的分布;AFM图像清晰地显示了细胞表面形貌;将AFM图像和STORM图像叠加可以得到细胞内部结构和表面形貌信息。Chacko等人[53]将STED和STORM分别与AFM联用,对用荧光染料标记过α-微管蛋白抗体的Hela细胞和成纤维细胞进行成像检测,同样获取了细胞的内部结构信息和丰富的表面信息。

|
图 7 STORM 和AFM 联用在Hela 细胞上应用 Fig.7 Combination of STORM and AFM on Hela cell studies (a) The microtubules were labeled with Alexa647 via immuno-fluorescence staining and measured with STORM. Individual microtubules and their distribution can be clearly resolved. (b) AFM image on the same position was taken to get further information about the cell membrane surface texture (z-range: 400 nm). (c) Overlay of AFM and STORM to get information about possible correlations of the optical and mechanical data. Scale bar: 2 μm. |
AFM与超分辨光学显微镜联用技术的快速发展将推进认识细胞形貌、细胞结构以及细胞力学性质与细胞生理功能的深层次机理。
4.5 不同AFM成像技术及力学测量技术比较上面对不同AFM成像技术和力学测量技术做了介绍,下面我们将不同成像技术(表 1)和力学测量技术(表 2)的参数特点和优缺点进行一个总结,以便读者对这些技术有一个清晰的了解。从表 1可以看出,相比于接触模式、轻敲模式和峰值力模式,快扫模式AFM成像速度明显提高,并且可以看出接触模式、轻敲模式、峰值力模式和快扫模式AFM对样品的损伤逐步减小;另外,将峰值力模式和快扫模式AFM测量技术与荧光显微镜、激光共聚焦显微镜和超光学分辨显微镜的结合还有待发展。从表 2可以看出AFM,目前最快的力学测量模式是峰值力模式,该模式相对与力体积模式具有明显的优势;单细胞力谱技术还有待进一步完善和发展,需要进一步发展将细胞牢固固定于AFM微悬臂的便捷方法和解决系统漂移问题。
| 表 1 AFM成像技术性能比较 Table 1 Comparison of AFM imaging techniques |
| 表 2 AFM力学测量技术比较 Table 2 Comparison of AFM force measurement techniques |
经过近30年的发展,AFM在细胞成像和力学性质的研究中发挥着越来越重要的作用。从最初的成像模式(如接触和轻敲两种成像模式)以及基于力曲线的力学测量模式发展到今天的具有高速成像能力的模式(如快扫模式),具有高速、高分辨率的力学测量模式(如峰值力模式),使得AFM在细胞物理化学特性研究中的应用越来越深入;与此同时,随着AFM与超分辨光学显微镜的联合使用,可以实现在获取细胞表面和整体形貌以及力学性质的同时还可以对细胞内部成分及结构进行定位和三维成像,大大提升了AFM在细胞物理化学特性研究中获取有用信息的能力。但是,AFM技术的发展仍然有很大空间,比如:目前的快扫模式AFM仍然基于轻敲模式,在成像中探针与样品仍有正压力,仍然存在对样品和生物反应过程破坏的可能性,发展基于非接触式的快扫模式AFM将具有广阔应用前景;另外,目前峰值力模式AFM技术以及快扫模式AFM技术与先进光学成像技术(如激光共聚焦显微镜技术、STED和STORM)联用还是一片空白,这些联用技术的发展将可以为得到更为丰富的细胞物理化学特性信息提供有效手段。可以预测,随着新的AFM技术的发展和应用,它将在细胞物理化学特性的研究中发挥越来越重要的功能。
符号说明:
| d | — 微悬臂的偏折量,m | Rmax | — 最大成像速度,frame⋅s-1(幅/秒) |
| F | — 样品的受力,N | W | — 所扫描样品在X方向宽度,nm |
| fB | — AFM系统带宽,Hz | θmax | — 探针作用于样品上的最大可能相位延迟角度(弧度),rad |
| k | — 微悬臂的弹性系数,N⋅m-1 | λ | — 波长,nm |
| N | — 扫描线条数,line | τ0 | — 闭环AFM系统中的相位延迟时间,s |
| [1] | Shih I-M, Hsu M-Y, Oldt R J . The role of E-cadherin in the motility and invasion of implantation site intermediate trophoblast[J]. Placenta , 2002, 23 (10) : 706-715 DOI:10.1016/S0143-4004(02)90864-7 |
| [2] | Keren K, Pincus Z, Allen G M . Mechanism of shape determination in motile cells[J]. Nature , 2008, 453 (7194) : 475-480 DOI:10.1038/nature06952 |
| [3] | LI Xiang-qin(李香琴), LIU Tian-qing(刘天庆), SONG Ke-dong(宋克东) . Effects of Bone Marrow Mesenchymal stem cells on the proliferation and differentiation of neural stem cells growing in calcium alginate beads(骨髓间充质干细胞对海藻酸钙胶珠内神经干细胞增殖与分化的作用)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2013, 27 (2) : 228-235 |
| [4] | Mogilner A, Keren K . The shape of motile cells[J]. Current Biology:CB , 2009, 19 (17) : R762-771 DOI:10.1016/j.cub.2009.06.053 |
| [5] | Kilian K A, Bugarija B, Lahn B T . Geometric cues for directing the differentiation of mesenchymal stem cells[J]. Proceedings of the National Academy of Sciences of the United States of America , 2010, 107 (11) : 4872-4877 DOI:10.1073/pnas.0903269107 |
| [6] | LI Xiang-qin(李香琴), LIU Tian-qing(刘天庆), ZHU Lei-lei(朱蕾蕾) . Effect of neural stem cells on apoptosis of PC12 cells induced by serum deprivation(神经干细胞对去血清诱导PC12细胞凋亡的作用)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2007, 12 (6) : 964-970 |
| [7] | Friedl P, Wolf K . Tumour-cell invasion and migration:diversity and escape mechanisms[J]. Nature Reviews Cancer , 2003, 3 (5) : 362-374 DOI:10.1038/nrc1075 |
| [8] | Li Q S, Lee G Y, Ong C N . AFM indentation study of breast cancer cells[J]. Biochemical and biophysical Research Communications , 2008, 374 (4) : 609-613 DOI:10.1016/j.bbrc.2008.07.078 |
| [9] | Wang H, Wang X, Li H . Molecular expansion of an individual coiled DNA on a graphite surface[J]. Langmuir:the ACS Journal of Surfaces and Colloids , 2011, 27 (6) : 2405-2410 DOI:10.1021/la104776n |
| [10] | Wang H, Wilksch J J, Lithgow T . Nanomechanics measurements of live bacteria reveal a mechanism for bacterial cell protection:the polysaccharide capsule in Klebsiella is a responsive polymer hydrogel that adapts to osmotic stress[J]. Soft Matter , 2013, 9 (31) : 7560 DOI:10.1039/c3sm51325d |
| [11] | Wang H, Wilksch J J, Strugnell R A . Role of capsular polysaccharides in biofilm formation:an AFM nanomechanics study[J]. ACS applied Materials & Interfaces , 2015, 7 (23) : 13007-13013 |
| [12] | Zhao W, Cai M, Xu H . A single-molecule force spectroscopy study of the interactions between lectins and carbohydrates on cancer and normal cells[J]. Nanoscale , 2013, 5 (8) : 3226-3229 DOI:10.1039/c3nr00553d |
| [13] | Li M, Liu L, Xi N . Progress in measuring biophysical properties of membrane proteins with AFM single-molecule force spectroscopy[J]. Chinese Science Bulletin , 2014, 59 (22) : 2717-2725 DOI:10.1007/s11434-014-0290-x |
| [14] | Lamontagne C A, Cuerrier C M, Grandbois M . AFM as a tool to probe and manipulate cellular processes[J]. Pflugers Archiv:European Journal of Physiology , 2008, 456 (1) : 61-70 DOI:10.1007/s00424-007-0414-0 |
| [15] | Shi X L, Zhang X J, Xia T . Living cell study at the single-molecule and single-cell levels by atomic force microscopy[J]. Nanomedicine , 2012, 7 (10) : 1625-1637 DOI:10.2217/nnm.12.130 |
| [16] | Green N H, Allen S, Davies M C . Force sensing and mapping by atomic force microscopy[J]. Trac-Trend Analytical Chemistry , 2002, 21 (1) : 64-73 |
| [17] | ZHANG Xiao-qing(张晓清), BU Qing-zhen(卜庆珍), PEI Xiao-qin(裴晓琴) . The application of atomic force microscope in biological field(原子力显微镜在生物领域中的应用)[J]. Microbiology(微生物学通报) , 2008, 35 (4) : 595-601 |
| [18] | Dufrene Y F, Pelling A E . Force nanoscopy of cell mechanics and cell adhesion[J]. Nanoscale , 2013, 5 (10) : 4094-4104 DOI:10.1039/c3nr00340j |
| [19] | Puech P H, Taubenberger A, Ulrich F . Measuring cell adhesion forces of primary gastrulating cells from zebrafish using atomic force microscopy[J]. Journal of Cell Science , 2005, 118 (18) : 4199-4206 DOI:10.1242/jcs.02547 |
| [20] | Hsieh C H, Lin Y H, Lin S . Surface ultrastructure and mechanical property of human chondrocyte revealed by atomic force microscopy[J]. Osteoarthritis and Cartilage , 2008, 16 (4) : 480-488 DOI:10.1016/j.joca.2007.08.004 |
| [21] | Cross S E, Jin Y S, Lu Q Y . Green tea extract selectively targets nanomechanics of live metastatic cancer cells[J]. Nanotechnology , 2011, 22 (21) : 215101 DOI:10.1088/0957-4484/22/21/215101 |
| [22] | Braet F, Vermijlen D, Bossuyt V . Early detection of cytotoxic events between hepatic natural killer cells and colon carcinoma cells as probed with the atomic force microscope[J]. Ultramicroscopy , 2001, 89 (4) : 265-273 DOI:10.1016/S0304-3991(01)00092-4 |
| [23] | Balint Z, Krizbai I A, Wilhelm I . Changes induced by hyperosmotic mannitol in cerebral endothelial cells:an atomic force microscopic study[J]. European Biophysics Journal , 2007, 36 (2) : 113-120 DOI:10.1007/s00249-006-0112-4 |
| [24] | Yang H, Yu J, Fu G . Interaction between single molecules of Mac-1 and ICAM-1 in living cells:an atomic force microscopy study[J]. Experimental Cell Research , 2007, 313 (16) : 3497-3504 DOI:10.1016/j.yexcr.2007.08.001 |
| [25] | Lehenkari P P, Charras G T, Nykanen A . Adapting atomic force microscopy for cell biology[J]. Ultramicroscopy , 2000, 82 (1-4) : 289-295 DOI:10.1016/S0304-3991(99)00138-2 |
| [26] | Cross S E, Jin Y S, Rao J . Nanomechanical analysis of cells from cancer patients[J]. Nature Nanotechnology , 2007, 2 (12) : 780-783 DOI:10.1038/nnano.2007.388 |
| [27] | Sharma S, Santiskulvong C, Rao J . The role of Rho GTPase in cell stiffness and cisplatin resistance in ovarian cancer cells[J]. Integrative Biology:Quantitative Biosciences from Nano to Macro , 2014, 6 (6) : 611-617 DOI:10.1039/c3ib40246k |
| [28] | Friedl P, Gilmour D . Collective cell migration in morphogenesis, regeneration and cancer[J]. Nature Reviews Molecular Cell Biology , 2009, 10 (7) : 445-457 DOI:10.1038/nrm2720 |
| [29] | Legate K R, Wickstrom S A, Fassler R . Genetic and cell biological analysis of integrin outside-in signaling[J]. Genes & Development , 2009, 23 (4) : 397-418 |
| [30] | O'donoghue M B, Shi X, Fang X . Single-molecule atomic force microscopy on live cells compares aptamer and antibody rupture forces[J]. Analytical and Bioanalytical Chemistry , 2012, 402 (10) : 3205-3209 DOI:10.1007/s00216-011-5667-y |
| [31] | Friedrichs J, Legate K R, Schubert R . A practical guide to quantify cell adhesion using single-cell force spectroscopy[J]. Methods , 2013, 60 (2) : 169-178 DOI:10.1016/j.ymeth.2013.01.006 |
| [32] | Puech P H, Poole K, Knebel D . A new technical approach to quantify cell-cell adhesion forces by AFM[J]. Ultramicroscopy , 2006, 106 (8-9) : 637-644 DOI:10.1016/j.ultramic.2005.08.003 |
| [33] | Benoit M, Gabriel D, Gerisch G . Discrete interactions in cell adhesion measured by single-molecule force spectroscopy[J]. Nature Cell Biology , 2000, 2 (6) : 313-317 DOI:10.1038/35014000 |
| [34] | Helenius J, Heisenberg C P, Gaub H E . Single-cell force spectroscopy[J]. Journal of Cell Science , 2008, 121 (11) : 1785-1791 DOI:10.1242/jcs.030999 |
| [35] | Kashef J, Franz C M . Quantitative methods for analyzing cell-cell adhesion in development[J]. Developmental biology , 2015, 401 (1) : 165-174 DOI:10.1016/j.ydbio.2014.11.002 |
| [36] | Maciaszek J L, Partola K, Zhang J . Single-cell force spectroscopy as a technique to quantify human red blood cell adhesion to subendothelial laminin[J]. Journal of Biomechanics , 2014, 47 (16) : 3855-3861 DOI:10.1016/j.jbiomech.2014.10.016 |
| [37] | Pittenger B. Toward quantitative nanomechanical measurements on live cells with peakforce QNM. Bruker Application Note AN141 RevA0, 1-10.(2013). |
| [38] | Pittenger B. Quantitative mechanical property mapping at the nanoscale with peakforce. Bruker Application Note AN128 RevA0, 1-12.(2013). |
| [39] | Adamcik J, Berquand A, Mezzenga R . Single-step direct measurement of amyloid fibrils stiffness by peak force quantitative nanomechanical atomic force microscopy[J]. Applied Physics Letters , 2011, 98 (19) : 193701 DOI:10.1063/1.3589369 |
| [40] | Heu C, Berquand A, Elie-Caille C . Glyphosate-induced stiffening of HaCaT keratinocytes, a Peak Force Tapping study on living cells[J]. Journal of Structural Biology , 2012, 178 (1) : 1-7 DOI:10.1016/j.jsb.2012.02.007 |
| [41] | Tomankova K, Kolar P, Malohlava J, et al. Mechanical characterisation of HeLa cells using atomic force microscopy[J]. In:Méndez-Vilas, A, Ed. Current microscopy contributions to advances in science and technology. Badajoz:Formatex Research Center, 2012, 549-554. |
| [42] | Berquand A, Roduit C, Kasas S . Atomic force microscopy imaging of living cells[J]. Microscopy Today , 2010, 18 (6) : 8-14 DOI:10.1017/S1551929510000957 |
| [43] | Wang Y, Subbiahdoss , G , et al Swartjes J . Length-scale mediated differential adhesion of mammalian cells and microbes[J]. Advanced Functional Materials , 2011, 21 (20) : 3916-3923 DOI:10.1002/adfm.v21.20 |
| [44] | Ando T . High-speed atomic force microscopy coming of age[J]. Nanotechnology , 2012, 23 (6) : 062001 DOI:10.1088/0957-4484/23/6/062001 |
| [45] | Uchihashi T, Ryota I, Ando T . High-speed atomic force microscopy reveals rotary catalysis of rotorless F1-ATPase[J]. Science , 2011, 333 (6043) : 755-758 DOI:10.1126/science.1205510 |
| [46] | Ando T . High-speed AFM imaging[J]. Current Opinion in Structural Biology , 2014, 28 : 63-68 DOI:10.1016/j.sbi.2014.07.011 |
| [47] | Ando T, Uchihashi T, Fukuma T . High-speed atomic force microscopy for nano-visualization of dynamic biomolecular processes[J]. Progress in Surface Science , 2008 (83) : 337-437 |
| [48] | Suzuki Y, Sakai N, Yoshida A, et al. High-speed atomic force microscopy combined with inverted optical microscopy for studying cellular events[J]. Scientific Reports, 2013, 3, 2131:1-7. |
| [49] | Watanabe H, Uchihashi T, Kobashi T . Wide-area scanner for high-speed atomic force microscopy[J]. Review of Scientific Instruments , 2013, 84 (5) : 1-10 |
| [50] | Hermsdorfer A, et al. Combination of high-resolution AFM with super-resolution stochastic optical reconstruction microscopy. JPK Technical Note, 2014:1-9. |
| [51] | Eifert A, Kranz C . Hyphenating atomic force microscopy[J]. Analytical Chemistry , 2014, 86 (11) : 5190-5200 DOI:10.1021/ac5008128 |
| [52] | Harke B, Chacko J V, Haschke H . A novel nanoscopic tool by combining AFM with STED microscopy[J]. Optical Nanoscopy , 2012 DOI:10.1186/2192-2853-1-3 |
| [53] | Chacko J V, Zanacchi F C, Diaspro A . Probing cytoskeletal structures by coupling optical superresolution and AFM techniques for a correlative approach[J]. Cytoskeleton , 2013, 70 (11) : 729-740 DOI:10.1002/cm.v70.11 |
| [54] | Heinisch J, N. Lipke P, Beaussart A . Atomic force microscopy-looking at mechanosensors on the cell surface[J]. Journal of Cell Science , 2012, 125 (18) : 4189-4195 DOI:10.1242/jcs.106005 |
| [55] | Kindt J, Phan N, Pittenger B, et al. Survey, screening, dynamics:a no-compromise approach to high-speed atomic force microscopy. Bruker Application Note AN134 RevA0, 2013, 1-10. |
| [56] | Muller D, Dufrene Y . Atomic force microscopy:a nanoscopic window on the cell surface[J]. Trends in cell biology , 2011, 21 (8) : 461-469 DOI:10.1016/j.tcb.2011.04.008 |
| [57] | Slade A, Pittenger B, Milani P . Investigating cell mechanics with atomic force microscopy[J]. Microscopy and Analysis , 2014, 28 (3) : S6-S9 |
| [58] | Yamashita H, Taoka A, Uchihashi T . Single-molecule imaging on living bacterial cell surface by high-speed AFM[J]. Journal of Molecular Biology , 2012, 422 (2) : 300-309 DOI:10.1016/j.jmb.2012.05.018 |
| [59] | Sharma A, Anderson K, Muller D . Actin microridges characterized by laser scanning confocal and atomic force microscopy[J]. FEBS Letter , 2005, 579 (9) : 2001-2008 DOI:10.1016/j.febslet.2005.02.049 |
| [60] | Park A, Chae Y, Lee S . Presynaptic structure of aplysia single live neuron by atomic force and confocal laser scanning microscope[J]. The Journal of Physical Chemistry , 2013, 117 (17) : 4779-4788 DOI:10.1021/jp3115308 |
| [61] | Gramlich M, Bae J, Hayward R . Fluorescence imaging of nanoscale domains in polymer blends using stochastic optical reconstruction microscopy[J]. Optics Express , 2014, 22 (7) : 8438-8450 DOI:10.1364/OE.22.008438 |
| [62] | Helenius J, Heisenberg C, Gaub C . Single-cell force spectroscopy[J]. Journal of Cell Science , 2008, 121 (11) : 1785-1791 DOI:10.1242/jcs.030999 |




