共晶是由2种或多种分子以特定化学计量比组成的结晶单相材料,通过氢键、卤键、π…π堆积作用、C─H…π相互作用和范德华相互作用结合在一起,它既不是溶剂化物,也不是简单的盐[1-2]。近年来,共晶被应用于不同领域,尤其在制药领域,共晶发挥了重要作用[3-10]。共晶拆分法是一种新的拆分技术,被用于分离难以采用其他拆分方法分离的外消旋化合物[11-13]。共晶拆分剂与外消旋体能否形成共晶是共晶拆分的关键。
左乙拉西坦(levetiracetam,LEV)是吡咯烷酮类化合物,化学命名为(S)-ɑ-乙基-2-氧-1-吡咯烷乙酰胺,是一种新型抗癫痫药物[14-16]。LEV可以与很多化合物形成共晶,它既能用于共晶法分离外消旋化合物对映体,也能通过共晶法被共晶拆分剂拆分。如Machado等[17]得到了较为稳定的LEV与(S)-布洛芬的共晶。Springuel等[18]通过研磨法成功制备了LEV与吡拉西坦的共晶,表明可以通过结构相似准则寻找合适的共晶形成物。Harmsen等[19]使用与LEV形成对映体特异性共晶法拆分了外消旋布洛芬。Springuel等[20-21]报道以(S)-扁桃酸为共晶拆分剂,成功拆分乙拉西坦对映体。
扁桃酸及卤代扁桃酸是重要的药物及药物中间体、手性拆分剂和手性配体,同时扁桃酸及其衍生物分子中同时具有羟基和羧基,容易与其他化合物形成盐或共晶。本研究以LEV为共晶前体,研究LEV与几种卤代扁桃酸对映体形成共晶的规律,为建立共晶拆分分离和阐明共晶形成机理提供基础。
2 实验部分 2.1 药品与仪器左乙拉西坦(质量分数≥99%,杭州泽泉生物科技有限公司);3-氯扁桃酸(3-chloromandelic acid)、4-氯扁桃酸(4-chloromandelic acid)、4-溴扁桃酸(4-bromomandelic acid)(质量分数≥98%,上海泰坦科技股份有限公司);4-氟扁桃酸(质量分数为98%,九鼎化学科技有限公司);(S)-2-氯扁桃酸((S)-2-chloromandelic acid,(S)-2-ClMA)(质量分数≥99.8%,上海东岳药业有限公司);(R)-2-氯扁桃酸((R)-2-chloromandelic acid,(R)-2-ClMA)(质量分数≥99.8%,巴斯夫);(S)-3-氯扁桃酸((S)-3-chloromandelic acid,(S)-3-ClMA)、(R)-3-氯扁桃酸((R)-3-chloromandelic acid,(R)-3-ClMA)、(S)-4-氯扁桃酸((S)-4-chloromandelic acid,(S)-4-ClMA)、(R)-4-氯扁桃酸((R)-4-chloromandelic acid,(R)-4-ClMA)、(S)-4-溴扁桃酸((S)-4-bromomandelic acid,(S)-4-BrMA)、(R)-4-溴扁桃酸((R)-4-bromomandelic acid,(R)-4-BrMA)、(S)-4-氟扁桃酸((S)-4-fluoromandelic acid,(S)-4-FMA)、(R)-4-氟扁桃酸((R)-4-fluoromandelic acid,(R)-4-FMA)自制得到[22-23],质量分数≥99.8%;甲醇(色谱纯,质量分数≥99.9%,上海泰坦科技股份有限公司);乙腈(分析纯,质量分数≥99%,上海泰坦科技股份有限公司)。
D8 Focus X射线粉末衍射仪(Bruker公司);STA 6000同步热分析仪(美国Perkin Elmer公司);NEXUS红外光谱仪(美国尼高力仪器公司);500MHz/AVANCEIII核磁共振波谱仪(瑞士Bruker公司);C、H、N、S ⅱ/VARIO EL III元素分析仪(德国Elementar公司)。
2.2 共晶的制备 2.2.1 液体辅助研磨法准确称取(S)-2-ClMA 0.062 8 g(0.336 mmol)和LEV 0.057 2 g(0.336 mmol),以物质的量比1:1投入玛瑙研钵中,滴加40 μL甲醇充分研磨1.5 h,室温干燥,得到LEV与(S)-2-ClMA的共晶,标记为LEV-(S)-2-ClMA(G)(G代表液体辅助研磨法);准确称取(R)-2-ClMA 0.062 8 g(0.336 mmol)和LEV 0.057 2 g (0.336 mmol),以物质的量比1:1投入玛瑙研钵中,滴加40 μL甲醇充分研磨1.5 h,未得到LEV与(R)-2-ClMA的共晶。将(S)-2-ClMA换成同样质量的(S)-3-ClMA或(S)-4-ClMA,将(R)-2-ClMA换成同样质量的(R)-3-ClMA或(R)-4-ClMA,以相同的方法得到共晶LEV-(S)-3-ClMA(G),未得到LEV与(R)-3-ClMA的共晶;得到共晶LEV-(S)-4-ClMA(G),未得到LEV与(R)-4-ClMA的共晶。
准确称取(S)-4-BrMA 0.155 3 g(0.672 mmol)和LEV 0.057 2 g(0.336 mmol),以物质的量比2:1投入玛瑙研钵中,滴加80 μL甲醇充分研磨1.5 h,室温干燥,得到LEV与(S)-4-BrMA的共晶,标记为LEV-(S)-4-BrMA(G);准确称取(R)-4-BrMA 0.155 3 g(0.672 mmol)和LEV 0.0572 g(0.336 mmol),以物质的量比2:1投入玛瑙研钵中,滴加80 μL甲醇充分研磨1.5 h,未得到LEV与(R)-4-ClBrMA的共晶。以相同的方法得到共晶LEV-(R)-4-FMA(G),未得到LEV与(S)-4-FMA的共晶。
2.2.2 冷却结晶法准确称取(S)-2-ClMA 0.267 4 g(1.433 mmol)和LEV 0.243 9 g(1.433 mmol),以物质的量比1:1投入20 mL直型螺口瓶中,并在其中加入0.833 mL(摩尔分数为85%)乙腈,在60 ℃下搅拌30 min,室温下静置后,加入一粒共晶LEV-(S)-2-ClMA(G)作为晶种,在−15 ℃下放置14 d,得到LEV-(S)-2-ClMA共晶,标记为LEV-(S)-2-ClMA(C)(C代表冷却结晶法)。以相同的方法得到共晶LEV-(S)-3-ClMA(C)、LEV-(S)-4-ClMA(C)。
准确称取(S)-4-BrMA 0.662 2 g(2.866 mmol)和LEV 0.243 9 g(1.433 mmol),以物质的量比2:1投入20 mL直型螺口瓶中,并在其中加入1.250 mL(摩尔分数为85%)乙腈,在60 ℃下搅拌30 min,室温下静置后,加入一粒共晶LEV-(S)-4-BrMA(G)作为晶种,在−15 ℃下放置14 d,得到LEV-(S)-4-BrMA共晶,标记为LEV-(S)-4-BrMA (C)。以相同的方法得到共晶LEV-(R)-4-FMA(C)。
2.3 表征方法 2.3.1 X射线粉末衍射(XRPD)采用D8 Focus型X射线衍射仪进行测试,检测条件:Cu靶Kα射线(波长λ = 0.154 06 nm),管电流为10 m A,管压为40 k V,扫描速度为5 (°)⋅min−1,扫描范围2θ=5°~50°。
2.3.2 差示扫描量热法(DSC)采用STA 6000型同步热分析仪进行DSC测试,氮气气氛,气体流速为20 cm3⋅min−1,温度范围为30~180 ℃,升温速率为5 ℃⋅min−1。
2.3.3 红外光谱法(IR)在NEXUS型红外光谱仪上采用KBr压片法进行测试,测试波段为4 000~400 cm−1,分辨率为4 cm−1。
2.3.4 固体核磁法(13C-NMR)在11.7 T磁场环境下,采用带有固体高分辨魔角旋转探头的AVANCE III型500 MHz核磁共振波谱仪进行测试。
2.3.5 元素分析法(EA)采用VARIOEL Ⅲ型元素分析仪进行测试,测定C、H、N元素的质量分数。
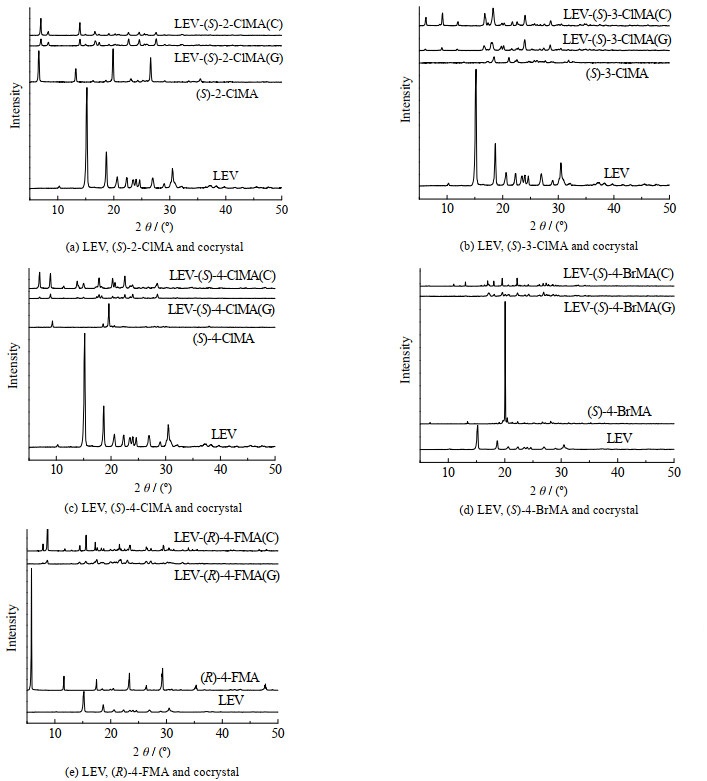
3 结果与讨论 3.1 XRPD分析XRPD是一种根据不同物质衍射峰出峰位置不同、判断新相产生的重要方法。本实验制备的LEV-(S)-2-ClMA样品及其原料的XRPD图谱如图 1(a)所示,LEV在10.29°、15.20°、18.67°、26.93°、30.46°处有特征峰,(S)-2-ClMA在6.62°、13.22°、19.86°、26.59°处有特征峰。在LEV-(S)-2-ClMA(G)样品的XRPD图谱上,2种原料的特征峰完全消失,并在7.02°、13.94°、16.73°、22.66°、24.57°、27.59°处出现了新的特征峰,表明LEV-(S)-2-ClMA(G)是一种不同于原料的新物质,即LEV-(S)-2-ClMA共晶。如图 1(b)所示,在LEV-(S)-3-ClMA(G)样品的XRPD图谱上,2种原料的特征峰已经消失,并在9.07°、16.65°、17.95°、20.19°、23.96°处出现了新的特征峰,表明产生了新物质,即LEV-(S)-3-ClMA共晶。如图 1(c)所示,在LEV-(S)-4-ClMA(G)样品的XRPD图谱上,2种原料的特征峰已经消失,并在8.93°、17.41°、17.81°、20.32°、22.52°、28.50°处出现了新的特征峰,表明产生了新物质,即LEV-(S)-4-ClMA共晶。如图 1(d)所示,在LEV-(S)-4-BrMA(G)样品的XRPD图谱上,2种原料的特征峰完全消失,并在17.18°、18.12°、28.62°、29.14°、29.54°、34.20°处出现了新的特征峰,表明有新物质生成,即LEV-(S)-4-BrMA共晶。如图 1(e)所示,在LEV-(R)-4-FMA(G)样品的XRPD图谱上,2种原料的特征峰完全消失,并在8.66°、14.42°、15.54°、23.00°、27.22°处出现了新的特征峰,表明有新物质生成,即LEV-(R)-4-FMA共晶。与液体辅助研磨法所得产物XRPD图谱相比,冷却结晶法所得产物具有相同的特征峰,表明2种方法得到的产物相同,为同种物质。而液体辅助研磨法所得产物的衍射峰强度均不如冷却结晶法所得产物,且衍射峰峰形不如冷却结晶法所得产物尖锐,表明冷却结晶法所得产物结晶度更高。
|
图 1 LEV、卤代扁桃酸及共晶的X射线衍射图 Fig.1 XRPD patterns of LEV, halogenated mandelic acids and cocrystals |
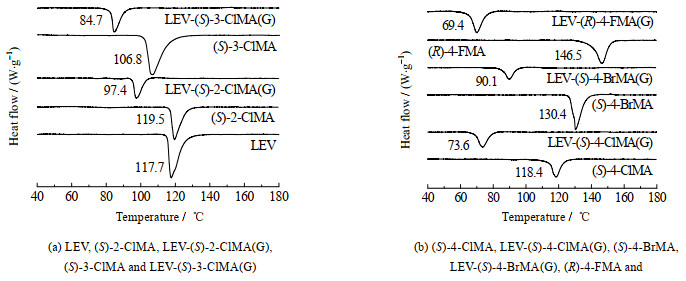
热力学分析是表征新物质产生的一种重要手段,不同的固体物质熔点不同,因此根据熔点的变化可判别是否产生新相。如表 1所示为LEV、卤代扁桃酸及5种共晶样品的熔点和熔融焓,表明5种共晶样品的熔点和熔融焓与2种原料均不相同。如图 2所示为5种共晶样品的DSC曲线,并在图上标记了熔点。在5个体系中,液体辅助研磨法所得产物的DSC曲线中原料的吸热峰完全消失,在不同于2种原料的位置出现了新的吸热峰,且熔点均低于2种原料。考虑研磨产物可能是2种原料的低共熔物,根据XRPD图得到研磨产物并不是单纯2种原料谱图的叠加,判断研磨产物不是低共熔物,因此可以证明研磨产物是不同于原料的新物质,这是共晶形成的热力学标志。研磨产物中完全未出现原料的吸热峰,同时加热温度范围内未出现其他吸热峰,进一步判断研磨产物是热力学测试的一个纯相。但无论是熔点还是熔融焓,研磨产物均低于2种原料,LEV-(R)-4-FMA(G)的熔点最低,表明LEV与(R)-4-FMA(G)形成的共晶在5种研磨产物中2个共晶形成物之间的相互作用最弱。
|
|
表 1 LEV、卤代扁桃酸及共晶的热力学性质 Table 1 Thermodynamic properties of LEV, halogenated mandelic acids and cocrystals |
|
图 2 LEV、卤代扁桃酸及共晶的DSC曲线图 Fig.2 DSC curves of LEV, halogenated mandelic acids and cocrystals |
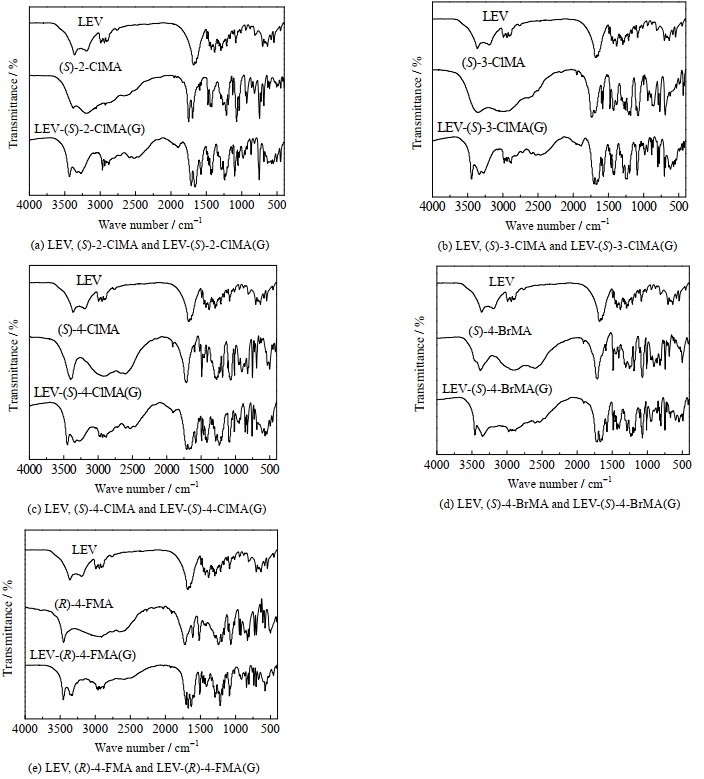
当手性化合物形成共晶时,晶体结构中分子间作用力的改变会影响红外吸收光谱中官能团的峰形以及吸收峰的位置,因此IR作为结构分析的重要手段,可用来判断共晶的形成。如图 3所示为LEV和卤代扁桃酸的碳原子编号。如图 4(a)所示为LEV、(S)-2-ClMA和LEV-(S)-2-ClMA(G)的IR图谱。LEV在3 361.8和3 194.0 cm−1处的吸收峰归属于酰胺基的2个─NH的伸缩振动,在LEV-(S)-2-ClMA(G)的红外图谱中,2个吸收峰分别蓝移至3 434.7和3 271.4 cm−1处;LEV在1 678.3和1 650.8 cm−1处的吸收峰归属于C1═O和C6═O的伸缩振动,均红移至1 493.2 cm−1处;(S)-2-ClMA在3 380.3和1 750.9 cm−1处的吸收峰分别归属于羟基和羧基的伸缩振动,在LEV-(S)-2-ClMA(G)中分别红移至3 332.4和1 660.5 cm−1处。如图 4(b)所示,在LEV-(S)-3-ClMA(G)的红外图谱中,LEV分子中酰胺基的2个─NH的伸缩振动峰分别蓝移至3 444.2和3 274.5 cm−1处,C1═O和C6═O的伸缩振动峰分别红移至1 673.9和1 641.1 cm−1处;(S)-3-ClMA分子中的羟基、羧基的伸缩振动峰分别由3 353.6和1 733.7 cm−1处红移至3 334.3和1 704.8 cm−1处。如图 4(c)所示,在LEV-(S)-4-ClMA(G)的红外图谱中,LEV分子中酰胺基的2个─NH的伸缩振动峰分别蓝移至3 448.1和3 274.5 cm−1处,C1═O和C6═O的伸缩振动峰分别红移至1 672.0和1 577.5 cm−1处;(S)-4-ClMA分子中的羟基、羧基的伸缩振动峰分别由3 399.9和1 712.5 cm−1处红移至3 340.2和1 708.6 cm−1处。如图 4(d)所示,在LEV-(S)- 4-BrMA(G)的红外图谱中,LEV分子中酰胺基的2个─NH的伸缩振动峰分别蓝移至3 357.7和3 349.7 cm−1处,C1═O和C6═O的伸缩振动峰分别红移至1 672.0和1 643.0 cm−1处;(S)-4-BrMA分子中的羟基的伸缩振动峰由3 380.6 cm−1处红移至3 349.7 cm−1处。如图 4(e)所示,在LEV-(S)-4-FMA(G)的红外图谱中,LEV分子中酰胺基的2个─NH的伸缩振动峰分别蓝移至3 455.8和3 332.4 cm−1处,C1═O和C6═O的伸缩振动峰分别红移至1 673.9和1 631.5 cm−1处;(S)-4-FMA分子中的羟基和羧基的伸缩振动峰分别由3 452.0和1 722.1 cm−1处红移至3 357.5和1 704.8 cm−1处。从图 4(a)到4(e)的IR分析结果可以发现,这些基团伸缩振动峰发生了迁移现象,这是由于在共晶形成过程中,官能团间形成氢键,基团的化学环境发生变化,可以判断共晶的形成。
|
图 3 LEV和卤代扁桃酸的碳原子编号 Fig.3 Carbon numbers on LEV and halogenated mandelic acid |
|
图 4 LEV、卤代扁桃酸及共晶的红外光谱图 Fig.4 IR spectra of LEV, halogenated mandelic acids |
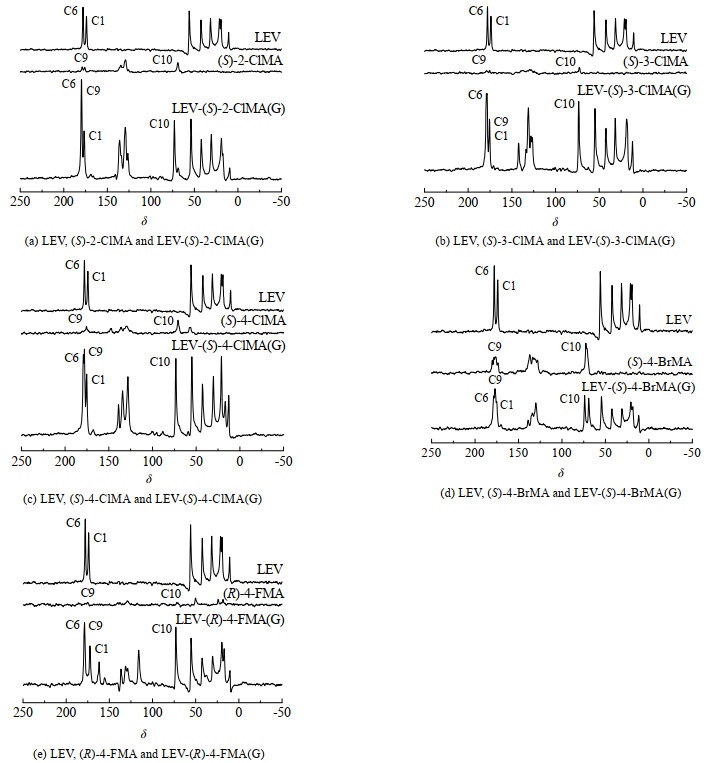
通过比较原料和产物在13C-NMR谱图上化学位移的差异,可判断新物质的生成,因此,13C-NMR也常被用于判断共晶的形成。原料LEV、卤代扁桃酸及5种共晶样品的13C-NMR数据如表 2所示,C1、C6、C9、C10的化学位移δ均发生了迁移,表明共晶形成过程中官能团之间形成了氢键,且与形成共晶时化学位移迁移不超过5是一致的,进一步证明共晶的形成。如图 5所示,在LEV-(S)-2-ClMA(G)、LEV-(S)-3-ClMA(G)和LEV-(S)-4-ClMA(G) 3种共晶的13C-NMR图谱中,碳原子的峰均没有发生裂分,表明形成的共晶为1:1共晶(物质的量比)。在LEV-(S)-4-BrMA(G)、LEV-(R)-4-FMA(G) 2种共晶的13C-NMR图谱中,碳原子的峰发生裂分,表明形成的共晶为1:2共晶(物质的量比)。
|
|
表 2 LEV、卤代扁桃酸及共晶的13C-NMR数据 Table 2 13C-NMR data of LEV, halogenated mandelic acids and cocrystals |
|
图 5 LEV、卤代扁桃酸及共晶的13C固体核磁图 Fig.5 13C-NMR spectra of LEV, halogenated mandelic acids and cocrystals |
元素分析(EA)可以定量测定有机物中元素的质量分数,因此可以用来确定共晶中2种固体的比例。对冷却结晶法得到的5种共晶进行元素分析测试,得到C、H和N元素的质量分数分别为w(C)、w(H)和w(N);5种共晶分别以物质的量比为n(LEV) : n ((S)-2-ClMA)=1:1、n(LEV) : n((S)-3-ClMA)=1:1、n(LEV): n((S)-4-ClMA)=1:1、n(LEV) : n((S)-4-BrMA)=1:2、n(LEV) : n((R)-4-FMA)=1:2进行计算,得到C、H和N元素的理论质量分数。C、H和N元素的实测值与理论值如表 3所示,表明实测值与理论值基本一致,且相对误差均在5%以内。
|
|
表 3 5种共晶的元素分析结果 Table 3 Elemental analysis results of five cocrystals |
以LEV为拆分剂,乙腈为溶剂,考察了2-氯扁桃酸、3-氯扁桃酸、4-氯扁桃酸、4-溴扁桃酸以及4-氟扁桃酸5种卤代扁桃酸的共晶拆分结果,从析出的固相中可以分别得到LEV和(S)-2-ClMA、(S)-3-ClMA、(S)-4-ClMA、(S)-4-BrMA和(R)-4-FMA形成的共晶,其中卤代扁桃酸的光学纯度分别为:78%、83%、88%、71%和90%,详细内容见文献[24]。
4 结论(1) 通过液体辅助研磨法和冷却结晶法研究了LEV与5种卤代扁桃酸的2个对映体形成共晶的规律,得到的5种共晶为:LEV-(S)-2-ClMA、LEV-(S)-3-ClMA、LEV-(S)-4-ClMA、LEV-(S)-4-BrMA和LEV-(R)-4-FMA,而LEV不与(R)-2-ClMA、(R)-3-ClMA、(R)-4-ClMA、(R)-4-BrMA、(S)-4-FMA形成共晶,表明LEV只与其中一种卤代扁桃酸对映体形成共晶,同时发现卤素基团的类型会影响所得共晶的构型。
(2) 通过XRPD、DSC、IR、13C-NMR和EA 5种测试手段分析了共晶LEV-(S)-2-ClMA、LEV-(S)-3-ClMA、LEV-(S)-4-ClMA、LEV-(S)-4-BrMA和LEV-(R)-4-FMA。结果表明,通过液体辅助研磨法得到的产物明显不是原料衍射峰的叠加,判断生成了共晶,通过冷却结晶法得到的产物衍射峰位置与研磨法得到的一致,为同一种共晶;所得共晶只有一个吸热峰,且与2种原料的吸热峰位置不同,同时共晶的熔点小于2种原料的熔点,共晶的IR出峰位置和13C-NMR出峰位置的变化,进一步证明了共晶的形成。LEV-(S)-2-ClMA、LEV-(S)-3-ClMA和LEV-(S)-4-ClMA为1:1共晶(物质的量比),而LEV-(S)-4-BrMA和LEV-(R)-4-FMA为1:2共晶(物质的量比),说明取代基卤数的不同会影响所得的共晶。本研究可为建立共晶拆分分离方法和阐明共晶形成机理提供支持。
| [1] |
AITIPAMULA S, BANERIEE R, BANSAL A K, et al. Polymorphs, salts, and cocrystals: What's in a name?[J]. Crystal Growth & Design, 2012, 12(5): 2147-2152. |
| [2] |
HE X T, HONG D L, CHEN C, et al. Comparison between the acidification of acidic and alkalic groups[J]. Crystal Growth & Design, 2019, 19(1): 437-443. |
| [3] |
NING Q, LI M, SCHLINDWEIN W, et al. Pharmaceutical cocrystals: An overview[J]. International Journal of Pharmaceutics, 2011, 419(1/2): 1-11. |
| [4] |
王义成, 冯成亮, 杨素勤, 等. 药物共晶的最新研究进展[J]. 药学进展, 2013(3): 120-130. WANG Y C, FENG C L, YANG S Q, et al. The latest research progress of drug cocrystals[J]. Pharmaceutical Progress, 2013(3): 120-130. |
| [5] |
SCHULTHEISS N, BETHUNE S, HENCK J O. Nutraceutical cocrystals: Utilizing pterostilbene as a cocrystal former[J]. Crystengcomm, 2010, 12(8): 2436-2442. DOI:10.1039/c002045a |
| [6] |
GAGNIERE E, MANGIN D, PUEL F, et al. Formation of co-crystals: Kinetic and thermodynamic aspects[J]. Journal of Crystal Growth, 2009, 311(9): 2689-2695. DOI:10.1016/j.jcrysgro.2009.02.040 |
| [7] |
BRAGA D, SHEMCHUK O, GREPIONI F. Organic–inorganic ionic co-crystals: A new class of multipurpose compounds[J]. Crystengcomm, 2018, 20(16): 2212-2220. DOI:10.1039/C8CE00304A |
| [8] |
KAVANAGH O N, CROKER D M, WALKER G M, et al. Pharmaceutical cocrystals: From serendipity to design to application[J]. Drug Discovery Today, 2019, 24(3): 796-804. DOI:10.1016/j.drudis.2018.11.023 |
| [9] |
JUNG M S, KIM J S, KIM M S, et al. Bioavailability of indomethacin-saccharin cocrystals[J]. Journal of Pharmacy & Pharmacology, 2010, 62(11): 1560-1568. |
| [10] |
WOUTERS J, GREPIONI F, BRAGA D, et al. Novel pharmaceutical compositions through co-crystallization of racetams and Li+ salts[J]. Crystengcomm, 2013, 15(44): 8898-8902. DOI:10.1039/c3ce41539b |
| [11] |
HARMSEN B, LEVSSENS T. Enabling enantiopurity: Combining racemization and dual-drug co-crystal resolution[J]. CrystalGrowth & Design, 2018, 18(6): 3654-3660. |
| [12] |
HE L, LIANG Z R, YU G J, et al. Green and efficient resolution of racemic ofloxacin using tartaric acid derivatives via forming cocrystal in aqueous solution[J]. Crystal Growth & Design, 2018, 18(9): 5008-5020. |
| [13] |
SANCHEZ-GUADARRAMA O, MENDOZA-NAVARRO F, CEDILLO-CRUZ A, et al. Chiral resolution of RS-praziquan-tel via diastereomeric co-crystal pair formation with l-malic acid[J]. Crystal Growth & Design, 2016, 16(1): 307-314. |
| [14] |
WEIJENBERG A, BROUWER O F, CALLENBACH P. Levetiracetam monotherapy in children with epilepsy: A systematic review[J]. CNS Drugs, 2015, 29(5): 371-382. DOI:10.1007/s40263-015-0248-9 |
| [15] |
丁小莉. 抗癫痫药物左乙拉西坦的合成与工艺研究[D]. 南京: 南京理工大学, 2012. DING X L. Study on synthesis and technology of antiepileptic drug levetiracetam [D]. Nanjing: Nanjing University of Science and Technology, 2012. |
| [16] |
张轶群, 李吉, 胡玉, 等. 抗癫痫药物左乙拉西坦[J]. 中国神经免疫学和神经病学杂志, 2010, 17(2): 145-147. ZHANG Y Q, LI J, HU Y, et al. The antiepileptic drug levetiracetam[J]. Chinese Journal of Neuroimmunology and Neurology, 2010, 17(2): 145-147. |
| [17] |
MACHADO S, CASTRO R, MARIA T, et al. Levetiracetam+nonsteroidal anti-inflammatory drug binary systems: A contribution to the development of new solid dosage forms[J]. International Journal of Pharmaceutics, 2017, 533(1): 1-13. DOI:10.1016/j.ijpharm.2017.09.012 |
| [18] |
SPRINGUEL G, NORBER B, ROBEVNS K, et al. Advances in pharmaceutical co-crystal screening: Effective co-crystal screening through structural resemblance[J]. Crystal Growth & Design, 2012, 12(1): 475-484. |
| [19] |
HARMSEN B, LEVSSENS T. Dual-drug chiral resolution: Enantiospecific cocrystallization of (S)-ibuprofen using levetiracetam[J]. Crystal Growth & Design, 2017, 18(1): 441-448. |
| [20] |
SPRINGUEL G, COLLARD L, LEVSSENS T. Ternary and quaternary phase diagrams: Key tools for chiral resolution through solution cocrystallization[J]. Crystengcomm, 2013, 15(39): 7951-7958. DOI:10.1039/c3ce41141a |
| [21] |
SPRINGUEL G, LEVSSENS T. Innovative chiral resolution using enantiospecific cocrystallization in solution[J]. Crystal Growth & Design, 2012, 12(7): 3374-3378. |
| [22] |
冯彩. 两种氯代扁桃酸的拆分及相关机理研究[D]. 上海: 华东理工大学, 2016. FENG C. Study on the resolution of two kinds of chloromandelic acid and its related mechanism [D]. Shanghai: East China University of Science and Technology, 2016. |
| [23] |
胡海燕. 形成非对映体盐法拆分两种卤代扁桃酸及其机理研究[D]. 上海: 华东理工大学, 2019. HU H Y. Resolution of two halomandelic acids by diastereomeric salt formation and its mechanism [D]. Shanghai: East China University of Science and Technology, 2019. |
| [24] |
WANG J, PENG Y F. Resolution of halogenated mandelicacids through enantiospecific co-crystallization with levetiracetam[J]. Molecules, 2021, 26: 5536. DOI:10.3390/molecules26185536 |




