六甲氧基甲基三聚氰胺(HMMM)具有六官能度单分子结构,有很高的反应活性及交联性[1],与醇酸树脂[1]、聚酯树脂[2]丙烯酸树脂[3]、环氧树脂[4, 5]、酚醛树脂[3]等都具有良好的混溶性,且水溶性良好[6, 7],适于用作低VOC涂料交联剂。
虽然有关HMMM的制备和应用[8~12]已有不少,但六羟甲基三聚氰胺(HMM)与甲醇醚化反应机理及动力学尚未报道,这不利于其生产工艺参数的优化。特别是需要进行规模化和连续化生产装置的工程设计和放大时,掌握合成反应动力学规律具有重要意义。醚化反应为HMM活性羟甲基末端羟基与醇羟基在酸催化作用下脱水醚化,酸做催化剂时活化甲醇形成碳正离子,进攻亲核体羟甲基基团[14~16]。类似于三聚氰胺与甲醛进行羟甲基化的反应网络[13],HMM也具有六个反应位的醚化缩合反应。HMMM的前驱体为HMM,由三聚氰胺与甲醛水溶液反应而得,生成产物HMM不溶解于水。在HMM与甲醇醚化反应过程中,水是醚化反应产物之一,水的存在会影响醚化反应平衡,导致反应平衡逆向移动,阻碍醚化产物的生成。为得到高醚化产品,采用干燥HMM与甲醇反应可得到高甲醚化产品。
在实际生产反应中,甲醇与HMM反应,甲醇既是溶剂,也是反应物。但HMM不溶解于甲醇,反应体系开始为非均相体系,反应过程在HMM颗粒表面进行,反应速率受到颗粒大小、聚集态的影响。随着醚化反应的进行,体系逐渐呈均相。为了揭示醚化反应机理,掌握反应的动力学规律,本研究通过引入二甲亚砜(DMSO)做溶剂,使醚化反应一开始就处于均相。
温度对醚化反应也有较大影响,低温是防止醚化反应过程发生缩聚副反应的关键。通常,在50℃以下,反应主要表现为甲醚化反应,缩聚很少发生,HPLC检测也证明了这一点,反应产物为不同醚化度单核(三嗪环)醚化物。超过50℃时,缩聚副反应明显增加,且温度越高,缩聚及交联凝胶程度越严重。此外,酸是醚化反应催化剂,过低pH易引发羟甲基之间的缩聚及交联;pH过高,则反应速率过慢且醚化进行不完全。当反应体系pH=3.5时,醚化反应进行完全,且缩聚副反应极少发生[17]。
本研究在55℃以下,pH值为3.5,以少量DMSO为溶剂进行了HMM的甲醚化反应,提出了HMM甲醚化的反应机理及相应的动力学方程,根据实验数据拟合了HMM甲醚化动力学参数,分析了反应条件对醚化反应的影响及醚化度变化规律,为工业设计与放大提供参考。
2 实验部分 2.1 原料及处理HMM:自制,以氢氧化钠为催化剂,pH=9.0,T=70℃下,将37%甲醛水溶液与三聚氰胺按摩尔比9:1投入四口烧瓶中反应20 min后,将反应产物过滤、洗涤,置于70℃真空烘干至恒重,粉碎得粉末状产品,其13C-NMR与1H-NMR核磁谱图如图 1所示。依文献[18]确定的各特征官能团原子与对应的出峰位置,可见核磁谱图中只显示HMM所对应的各个特征峰信号,未见-NH2、-NHCH2OH及缩聚物-CH2-、-CH2OCH2-出峰,表明三聚氰胺氨基氢已完全转化为羟甲基。

|
图 1 HMM的核磁[a)碳谱与b)氢谱]分析结果 Fig.1 NMR [13C spectrum (a) and the 1H spectrum (b)] spectra of HMM |
甲醇(99.5%):国药集团化学试剂有限公司,AR。硝酸(65%):AR,国药集团化学试剂有限公司。乙醇(99.5%):国药集团化学试剂有限公司,AR。二甲亚砜:国药集团化学试剂有限公司,AR。DMSO-d6:Sigma Aldrich, 色谱级,纯度99.9%。pH计:杭州东星仪器设备厂,PHS-3型。甲醇、乙醇及DMSO使用前经4A分子筛除微量水。
2.2 甲醚化反应先将粉末状的HMM加入到装有冷凝管的500 mL四口烧瓶中,加入300 mL二甲亚砜,油浴加热升温,待HMM溶解完全,混合物变为澄清透明状,且温度稳定在设定温度后,快速加入已称量好的甲醇,用硝酸调节pH值至3.5,反应过程中维持体系温度恒定及pH=3.5±0.1。待到取样时间时,用吸管快速吸取适量溶液于已装有定量内标(乙醇)的取样管中,在液氮中冷冻后,置于冰箱中冷冻保存待测。
2.3 分析与表征方法HMM的核磁分析,1H-NMR谱及13C-NMR谱均采用Bruker公司AVANCE Ⅲ400型核磁共振仪(400MHZ),TMS为内标,DMSO-d6为溶剂。甲醇浓度的测定使用Agilent 6890气相色谱仪,使用HP-5型号色谱柱,氢火焰离子检测器(FID)。HMM甲醚化产物的分析采用高效液相色谱-质谱(HPLC-MS)联用。使用Agilent technologies 1200series液相色谱仪与Finigan LCQ Deca XP MAX质谱仪。
3 结果与讨论 3.1 反应机理与动力学模型HMM分子中有6个-CH2OH基团。由于位阻及电子效应,作者认为甲醇与这些-CH2OH的反应并非瞬间同时进行,醚化过程中会形成如图 2所示9种醚化同系物,经HPLC-MS分析证实了这些醚化产物的存在。在pH=3.5,摩尔配比(甲醇/HMM)为15,50℃反应1 h取样,产物中存在不同醚化度产物,但主要以高醚化度产物为主,缩聚物量很少,如图 3所示。

|
图 2 HMM醚化机理 Fig.2 Mechanism of HMM etherification |

|
图 3 醚化产物HPLC分析 Fig.3 HPLC analysis of the etherified product |
HMM的醚化过程中由于存在一系列不同醚化度同系物,由于缺乏标样,不易分别将不同产物定量分析得到。但该醚化反应从官能团角度看,HMM分子结构对称,分子中每两个羟甲基连接在同一氮原子上,此两个羟甲基醚化反应时非同时进行,当同一个氮原子上连接的两个羟甲基之一经醚化后,先醚化基团会对尚未醚化羟甲基具有位阻效应及电子效应,第二级醚化过程与第一级醚化过程有区别,每个HMM分子三嗪环外三个氮原子所连接羟甲基基团情况相同。因此HMM醚化反应本质上可分为氮原子连接的两个羟甲基的顺序醚化反应。根据反应官能团归纳,今将醚化反应机理模型简化如图 4所示。
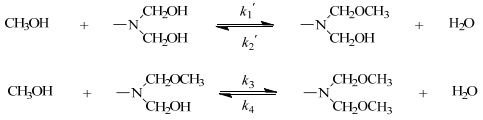
|
图 4 HMM官能团醚化机理 Fig.4 Etherification mechanism of HMM functional groups |
反应过程中甲醇过量,且均相条件下甲醇与羟甲基之间醚化较快,使中间产物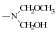
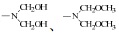
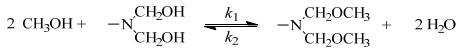
|
(1) |
考虑时间t=0及t时刻物料的浓度,有:
| ${\operatorname{CH} _3}OH +-{\operatorname{CH} _2}OH\mathop \rightleftharpoons \limits_{{k_2}}^{{k_1}}-{\operatorname{CH} _2}OC{H_3} + {\operatorname{H} _2}O$ | (2) |
t=0:
t时:
则醚化反应速率方程为:
| $\frac{{d\left[{{{\operatorname{CH} }_3}OH} \right]}}{{dt}} = - {k_1}\left[{{{\operatorname{CH} }_3}OH} \right]\left[{-{{\operatorname{CH} }_2}OH} \right] + {k_2}\left[{-{{\operatorname{CH} }_2}OC{H_3}} \right]\left[{{\operatorname{H} _2}O} \right]\\ = - {k_1}{C_t}\left[{\left( {\frac{6}{\operatorname{B} }-1} \right){C_0} + {C_t}} \right] + {k_2}{({C_0} - {C_t})^2}$ | (3) |
反应达平衡时,甲醇含量将不再变化,由
| $\frac{{d[{{\operatorname{CH} }_3}OH]}}{{dt}} = 0$ | (4) |
得到
| $ - {k_1}\left[{C{H_3}OH} \right]\left[{-{{\operatorname{CH} }_2}OH} \right] + {k_2}\left[{-{{\operatorname{CH} }_2}OC{H_3}} \right]\left[{{\operatorname{H} _2}O} \right] = 0$ | (5) |
将反应平衡时各反应物浓度代入式(5),反应平衡常数为
| $K = \frac{{{k_1}}}{{{k_2}}} = \frac{{{{({C_0} - {C_e})}^2}}}{{{C_e}[(\frac{6}{B}-1){C_0} + {C_e}]}}$ | (6) |
整理式(6)得反应平衡方程如下:
| $K\left\{ {\left( {\frac{6}{B} - 1} \right)} \right. + \left. {\frac{{{C_e}}}{{{C_0}}}} \right\} - \left[{\frac{{{C_0}}}{{{C_e}}}-\frac{{{C_e}}}{{{C_0}}}-2} \right] = 0$ | (7) |
其中B为甲醇与HMM的摩尔比,k1为甲醚化正反应速率常数,k2为甲醚化逆反应速率常数,C0为反应初始体系中甲醇的摩尔浓度,Ct为t时刻反应体系中甲醇的摩尔浓度,Ce为反应平衡时体系中甲醇的摩尔浓度,平衡常数为:K=k1/k2。
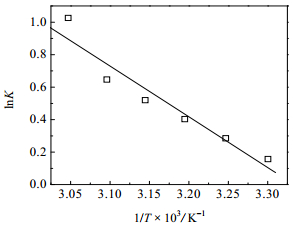
3.2 甲醚化平衡常数与表观反应焓van’t Hoff方程反映了化学反应的标准焓变与平衡常数随着温度的变化规律的关系。若反应焓不为零,且将其近似看成与温度无关的常数,由van’t Hoff方程:
| $\ln K = - \frac{{{\Delta _r}H_m^\theta }}{{RT}} + \frac{{{\Delta _r}{S^\theta }}}{R}$ | (8) |
以实验值lnK对1 /T作图,由图 5得该拟合直线方程为
|
图 5 van’t Hoff方程曲线 Fig.5 van't Hoff plot of equilibrium data |
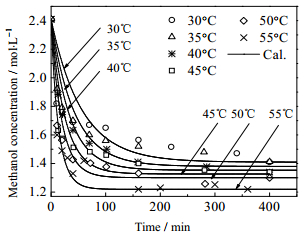
在摩尔配比B=9下,分别改变反应温度(30℃~55℃),进行甲醚化反应,采用四阶Runge-Kutta法求解微分方程,并利用上述得到的平衡常数K计算得k1,k2,拟合结果如图 6所示,反应速率常数列于表 1。
|
图 6 甲醇/HMM=9,pH=3.5反应条件下温度对反应的影响 Fig.6 Effects of temperature on reaction. Methanol/HMM=9, pH=3.5 |
| 表 1 pH=3.5, 甲醇/HMM=9时,不同温度下的反应速率 Table 1 Reaction rate constants under different temperatures when pH=3.5 and MA/HMM=9 |
可以看到,温度对反应速率有较大影响,提高温度,反应速率加快,温度每提高10℃,速率常数约提高一倍。
反应从动力学的角度考虑,甲醇与HMM的配比不应影响动力学参数。但提高甲醇/HMM的摩尔比有利于提高产物的醚化度(DoE),见表 2。为验证模型及参数的准确性,采用摩尔配比B=15时的实验数据与已求得模型参数计算值进行验证,由图 7可知,实验值与计算值符合良好。
| 表 2 40℃下不同配比的醚化度 Table 2 Degree of etherification under different component ratios at 40℃ |

|
图 7 T=40℃,B=15实验值与模型计算验证 Fig.7 Verification of experimental results with model calculation. T=40℃, B=15 |
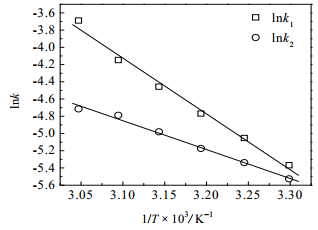
将表 1中的速率常数与阿伦尼乌斯方程
|
图 8 速率常数k1与k2的Arrhenius方程曲线 Fig.8 Arrhenius plots of rate constants k1 and k2 |
得出下面关系式,经由Arrhenius方程计算,其表观反应活化能和指前因子分别为表 3所示:
| $\ln {k_1} = - 6478.48\frac{1}{T} + 15.96$ | (9) |
| $\ln {k_2} = - 3355.25\frac{1}{T} + 5.55$ | (10) |
其中,R为摩尔气体常量,J×(mol×K)-1;Ea1为醚化反应正反应活化能,J×mol-1;Ea2为醚化反应逆反应活化能,J×mol-1;A1和A2为对应的指前因子,J×(mol×min)-1。可以看出正反应的活化能Ea1=53.9 kJ×mol-1大于逆反应的活化能Ea2=27.9 kJ×mol-1,说明温度对醚化正反应的影响程度大于逆反应,在一定温度范围内,升高温度有利于提高醚化程度。
| 表 3 醚化反应活化能与指前因子 Table 3 Reaction activation energy and pre-exponential factor of etherification reaction |
醚化度是评价HMM醚化程度及HMMM产品质量的重要指标,醚化度根据甲醇反应量与羟甲基总量的比值计算,公式如下:
| ${\mathop{\rm DoE}\nolimits} = \frac{{n( - {{{\mathop{\rm CH}\nolimits} }_2}OC{H_3})}}{{n( - {{{\mathop{\rm CH}\nolimits} }_2} - )}} \times \frac{1}{6} = \frac{{n( - {{{\mathop{\rm CH}\nolimits} }_2}OC{H_3})}}{{n({\mathop{\rm HMM}\nolimits} )}} = \frac{{{{\mathop{\rm C}\nolimits} _0} - {{\mathop{\rm C}\nolimits} _t}}}{{{{\mathop{\rm C}\nolimits} _0}/{\mathop{\rm B}\nolimits} }}$ | (11) |
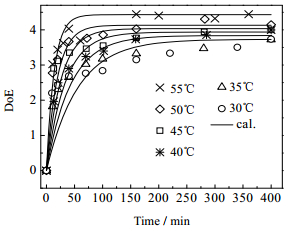
当pH=3.5,摩尔配比(甲醇/HMM) B=9时,不同温度下HMM甲醚化度随时间变化如图 9所示。由图 9可知醚化度于30~55℃,随反应温度升高而增加,提高反应温度,有利于提高醚化度。温度越高,反应达平衡时间越短。需要指出的是,DMSO的引入虽然为研究带来方便,但与实际生产的全甲醇醚化结果有一定偏差,核磁表明,醚化度偏差约比实际生产体系偏小0.2~0.3。
|
图 9 pH=3.5, B=9, 不同温度下醚化度与反应时间关系 Fig.9 DoE vs time under different temperatures with pH = 3.5, B = 9 |
本文开展了过量甲醇和均相反应情况下,HMM甲醚化反应合成HMMM动力学研究,提出了HMM醚化反应机理,得到了简化动力学模型,并以实验数据进行了拟合分析,发现与实验结果符合良好,并获得了相关动力学参数。
在30~55℃,该醚化反应平衡常数为1.17~2.79,是一个典型的可逆平衡反应。甲醚化反应的活化能为53.9 kJ×mol-1,逆反应活化能为27.9 kJ×mol-1。在上述温度范围内,适当提高反应温度,有利于加快甲醚化反应速率,提高甲醚化程度。
符号说明:
A --对应的指前因子,L×(mol×min)-1
K --醚化反应平衡常数
B --甲醇与HMM摩尔配比
k1 --平均醚化正反应速率常数,L×(mol×min)-1
C0 --反应初始时甲醇浓度,mol×L-1
k1' --第一级醚化正反应速率常数,L×(mol×min)-1
Ce --反应平衡时甲醇浓度,mol×L-1
k2 --平均醚化逆反应速率常数,L×(mol×min)-1
Ct --反应至t时刻甲醇浓度,mol×L-1
k2' --第一级醚化逆反应速率常数,L×(mol×min)-1
cal. --根据模型方程计算得到的值
k3 --第二级醚化正反应速率常数,L×(mol×min)-1
DoE --醚化度
k4 --第二级醚化逆反应速率常数,L×(mol×min)-1
Ea --反应活化能,kJ×mol-1
R --摩尔气体常量,J×(mol×K)-1
| [1] | Wang H, Wang Q, He N , et al. Waterborne Alkyd-Amino insulation paint modified by tung Oil[J]. Polymer Materials Science and Engineering , 2011, 27 (2) : 133-136. |
| [2] | Verma G, Dhoke S K, Khanna A S . Polyester based-siloxane modified waterborne anticorrosive hydrophobic coating on copper[J]. Surface and Coatings Technology , 2012, 212 (2012) : 101-108. |
| [3] | English A D, Chase D B, Spinelli H J . Structure and degradation of an intractable polymeric system:Melamine formaldehyde Cross-Linked acrylic coatings[J]. Macromolecule , 1983, 16 (9) : 1422-1427. DOI:10.1021/ma00243a004. |
| [4] | Zhang X, Zhou B, Sun X , et al. Preparation and Properties of epoxy/Phenol formaldehyde novolac/hexakis (methoxymethyl) melamine Hybrid resins from in situ polymerization[J]. Journal of Applied Polymer Science , 2008, 110 (6) : 4084-4092. DOI:10.1002/app.v110:6. |
| [5] | Liu Y, Chang G, Wu C . Halogen-free flame retardant epoxy resins from hybrids of phosphorus-or silicon-containing epoxies with an amine resin[J]. Journal of Applied Polymer Science , 2006, 102 (2) : 1071-1077. DOI:10.1002/(ISSN)1097-4628. |
| [6] | Rahman M M, Kim E, Kwon J Y , et al. Cross-linking reaction of waterborne polyurethane adhesives containing different amount of ionic groups with hexamethoxymethyl melamine[J]. International Journal of Adhesion and Adhesives , 2008, 28 (1-2) : 47-54. DOI:10.1016/j.ijadhadh.2007.03.004. |
| [7] | Pathak S S, Khanna A S, Sinha U M . HMMM cured corrosion resistance waterborne ormosil coating for aluminum alloy[J]. Progress in Organic Coatings , 2007, 60 (3) : 211-218. DOI:10.1016/j.porgcoat.2007.07.014. |
| [8] | Kandelbauer A, Wuzella G, Mahendran A , et al. Model-free kinetic analysis of melamine-formaldehyde resin cure[J]. Chemical Engineering Journal , 2009, 152 (2-3) : 556-565. DOI:10.1016/j.cej.2009.05.027. |
| [9] | Bauer D R, Budde G F . Crosslinking kinetics and network formation in organic coatings containinghexamethoxymethylmelamine[J]. Journal of Applied Polymer Science , 1983, 28 (1) : 253-266. DOI:10.1002/app.1983.070280122. |
| [10] | Meijer E W . A model study for coatings containing hexamethoxymethylmelamine[J]. Journal of Polymer Science Part A:Polymer Chemistry , 1986, 24 (9) : 2199-2208. DOI:10.1002/pola.1986.080240914. |
| [11] | Ratzsch M, Bucka H, Ivanchev S , et al. The reaction mechanism of the transetherification and crosslinking of melamine resins[J]. Macromolecular Symposia , 2004, 217 (1) : 431-443. DOI:10.1002/masy.200451339. |
| [12] | Kroeger A, Hiltrop K, Bremser W . Phase behavior of aqueous hexamethoxymethyl melamine systems[J]. Progress in Organic Coatings , 2013, 76 (2-3) : 335-340. DOI:10.1016/j.porgcoat.2012.09.015. |
| [13] | Tomita B . Melamine-Formaldehyde Resins-Molecular-Species distributions of methylolmelamines and some kinetics of Methylolation[J]. Journal of Polymer Science Part A-Polymer Chemistry , 1977, 15 (10) : 2347-2365. DOI:10.1002/pol.1977.170151005. |
| [14] | AN Wei-zhong(安维中), DOND Feng-lei(董凤蕾), LIU Zhao-bin(刘兆滨) , et al. Kinetics of n-butanol ethoxylation(正丁醇乙氧基化反应动力学研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2008, 22 (04) : 611-617. |
| [15] | ZHANG Dong(张栋), LI Gang-sen(李刚森), ZHANG Ya-dong(章亚东) . Synthesizing ethylene glycol monoethyl ether directly from ethanoland ethylene glycol(由乙醇和乙二醇直接法合成乙二醇单乙醚)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28 (5) : 1091-1096. |
| [16] | SUN Shuai(孙帅), LIANG Ning(粱宁), AN Hua-liang(安华良) , et al. Synthesis of dimethyl toluene-2, 4-dicarbamate from 2, 4-toluene diamine, Urea, and methanol by reaction distillation(2, 4-二氨基甲苯、尿素和甲醇合成甲苯-2, 4-二氨基甲酸甲酯反应精馏过程研究)[J]. Journal of Chemical Engineering of Chinese Universities(高校化学工程学报) , 2014, 28 (6) : 1236-1242. |
| [17] | SUN Qiao-lu (孙巧路).Synthesis and characterization of highly etherified melamine formaldehyde resin (高甲醚化三聚氰胺甲醛树脂的合成与表征)[D].Hangzhou (杭州):Zhejiang University (浙江大学), 2015. |
| [18] | Nicolau V V, Martinelli M, Strumia M C , et al. Methylolation of melamine with incipient condensation.I.Synthesis and Characterization[J]. Journal of Applied Polymer Science , 2009, 113 (2) : 1030-1041. DOI:10.1002/app.v113:2. |




